¿ INTRODUCCIÓN
La presencia de una masa pélvica es uno de los hallazgos más frecuentes en la práctica clínica ginecológica. Debiás frecuentes en la práctica clínica ginecológica. Debis frecuentes en la práctica clínica ginecológica. Debido a la gran variedad histológica de estas tumoraciones y a su presencia en cualquier etapa de la vida, se dificulta el diagnóstico de benignidad o malignidad. La elevación del marcador tumoral CA125 en presencia de alguna masa pélvica, es altamente sospechosa de carcinoma de ovario. Sin embargo, existen diversas condiciones benignas que pueden confundir estos hallazgos, especialmente en mujeres premenopáusicas.1,2 Los tumores benignos de ovario, pueden presentar ligera elevación del CA125, pero los valores por arriba de 200 U/mL hacen sospechar malignidad, con una sensibilidad del 79% y especificidad del 7%.3,4 Presentamos el caso de una mujer de 30 años con tumor pélvico asociado a incremento del CA125 por neoplasia benigna, el cual fue resuelto por vía laparoscópica. Se analizan la importancia del CA125 en la evaluación de neoplasias pélvicas, así como la utilidad del abordaje laparoscópico en tumores de ovario benignos.
¿PRESENTACIÓN DEL CASO
Mujer de 30 años de edad, eumenorreica, nuligesta, vida sexual activa desde los 20 años, utilizando preservativo como método de planificación familiar, último Papanicolaou y colposcopia a los 29 años, negativos para cáncer. o refiere ningún otro antecedente de importancia. Acude a nuestra unidad por cuadro de seis meses de evolución, caracterizado por la presencia de dolor pélvico de mediana intensidad, dismenorrea, sin otros síntomas ginecológicos o urinarios asociados. En la exploración ginecológica bimanual se encontró una masa pélvica dependiente de anexo derecho. El ultrasonido demostró una lesión quística en
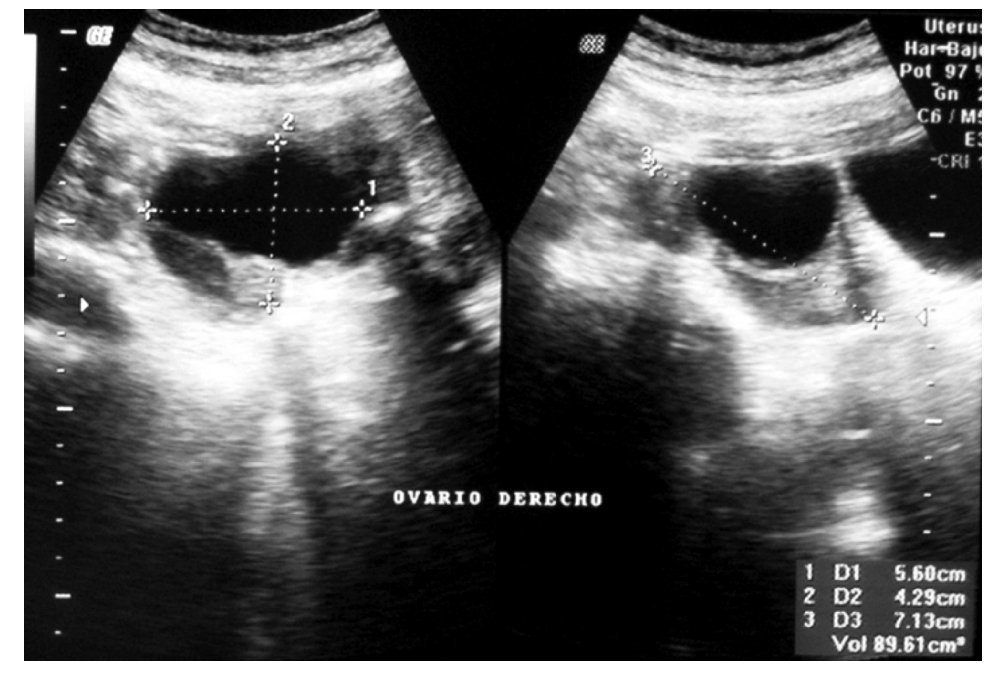
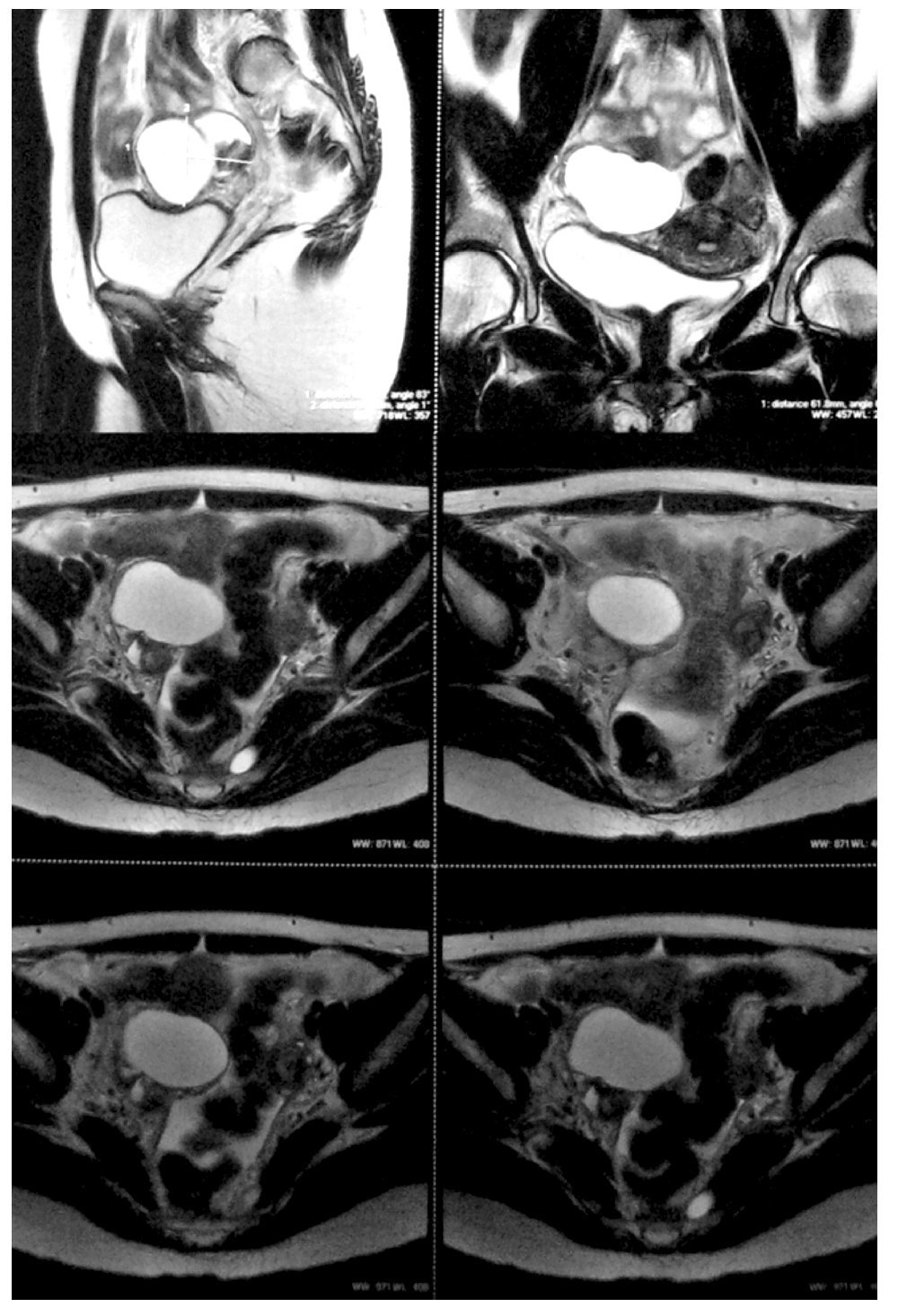
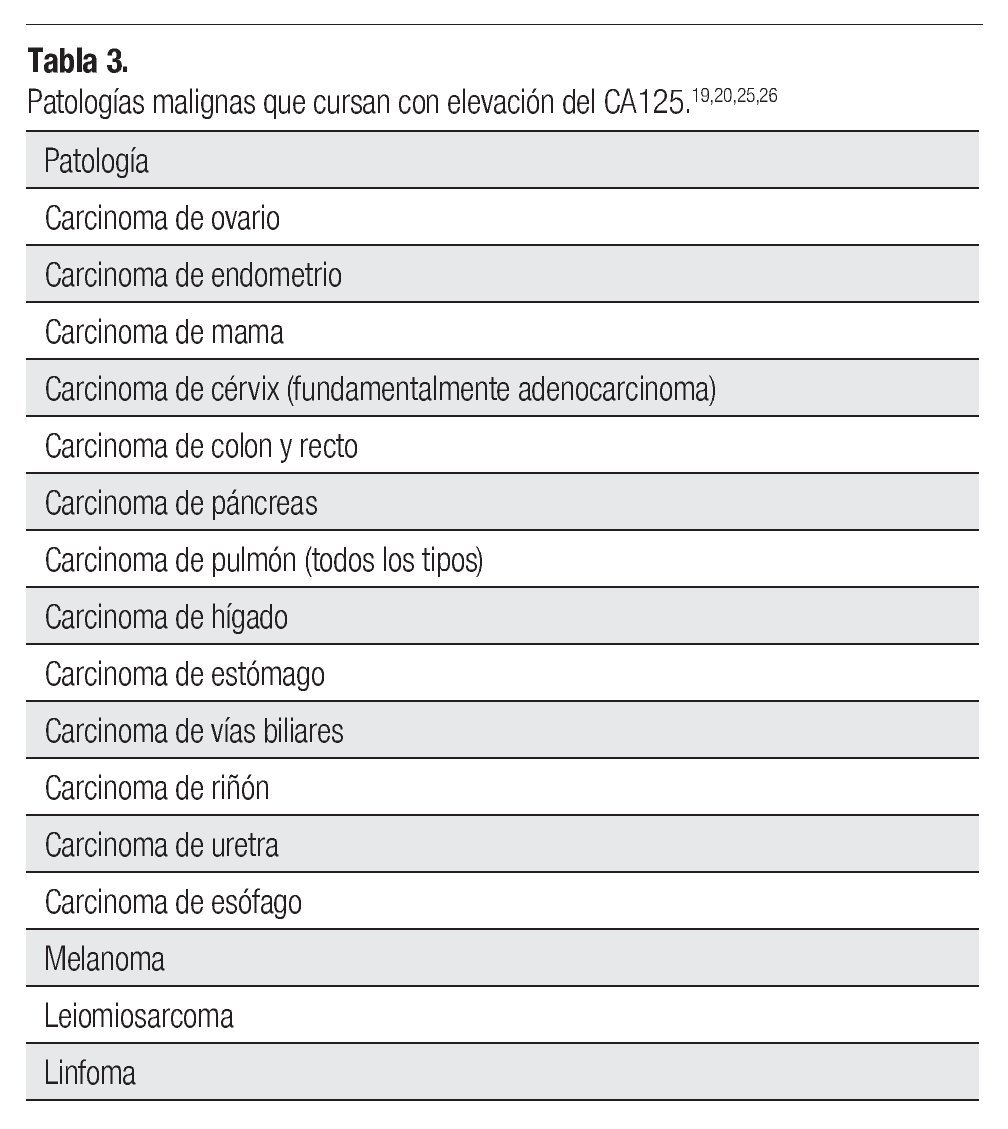
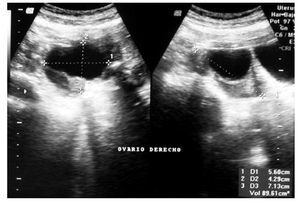
ovario derecho, diámetro máximo de 7.5 cm, con paredes finas y regulares, de contenido anecoico (Figura 1). El CA125 se encontró elevado en 525 U/mL (normal <35 U/mL), los restantes marcadores tumorales fueron normales (antígeno carcinoembrionario [ACE], alfa fetoproteína [AFP], gonadotropina coriónica humana [HCG]). La resonancia magnética (RM) reveló una lesión quística de 8 cm de pared lisa y regular en anexo derecho, sin implantes peritoneales, ascitis, adenopatías ni metástasis hepáticas (Figura 2). La paciente fue valorada por el servicio de Cirugía Oncológica y se programó para cirugía por tumor de anexo, a descartar cáncer de ovario en etapa temprana.
Figura 1. -Ultrasonido pélvico. Quiste de ovario derecho.
Figura 2. Resonancia magnética. Lesión quística de anexo derecho.
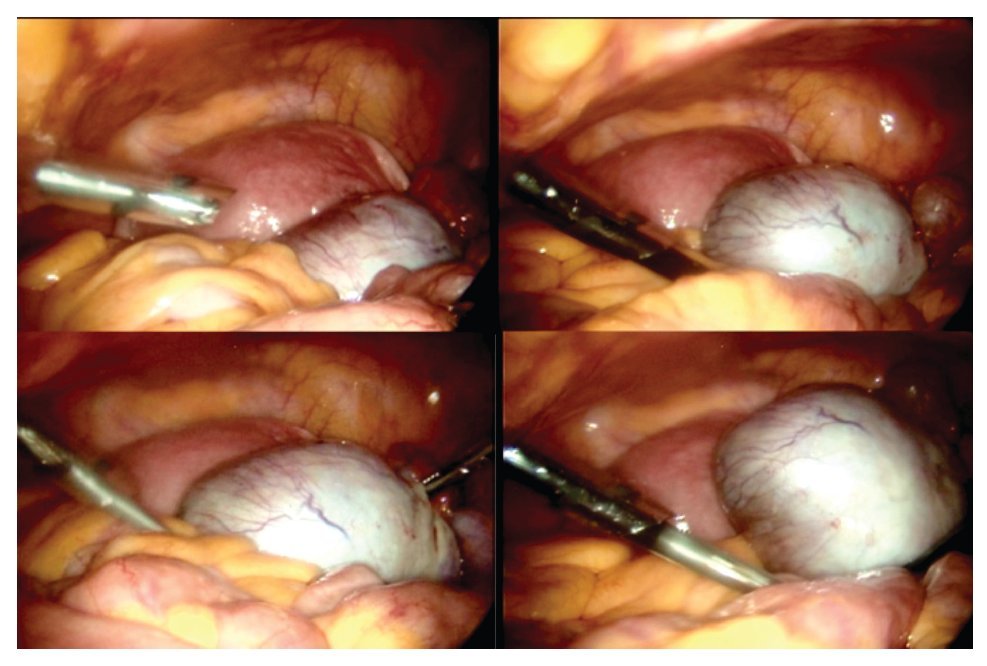
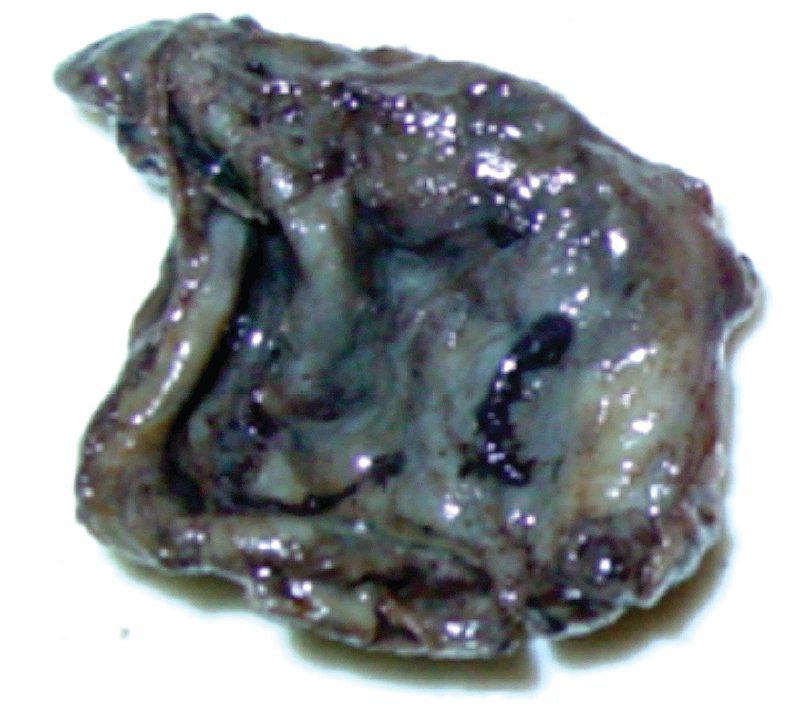
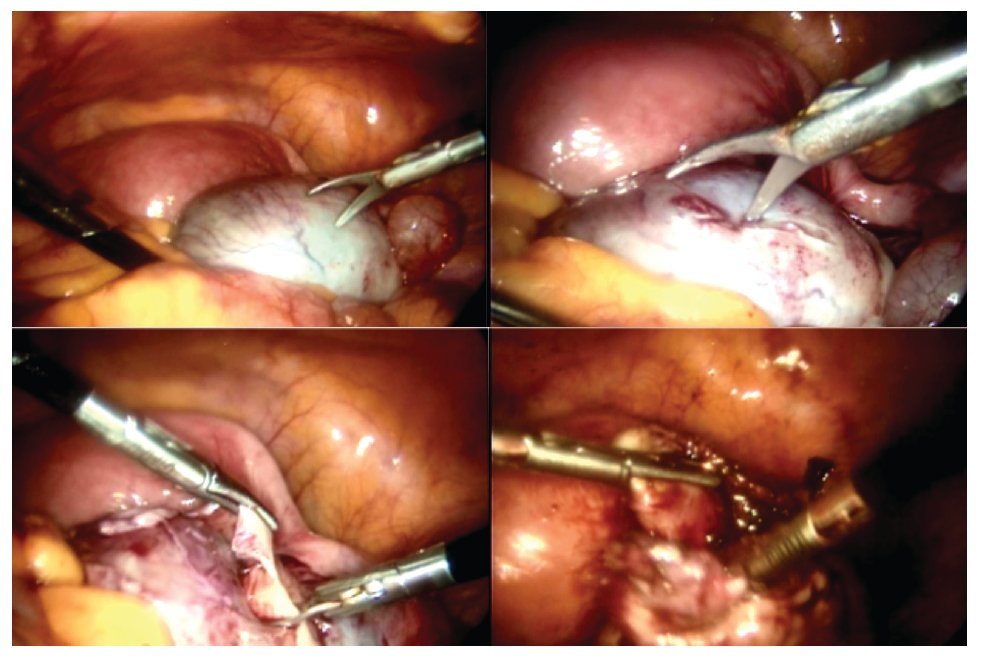
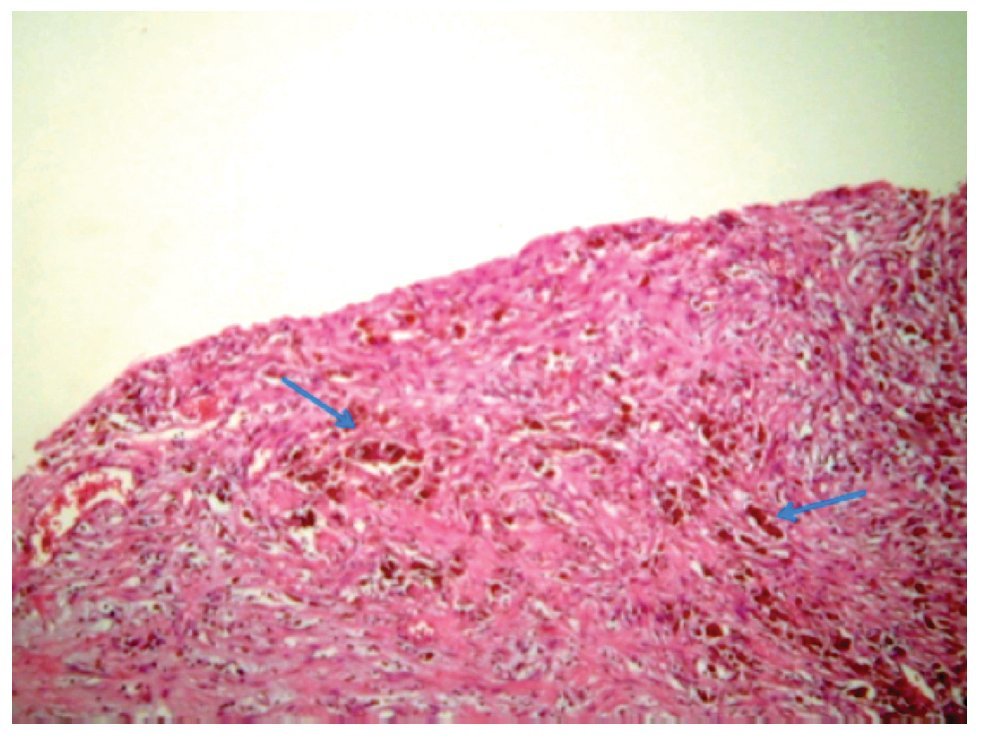
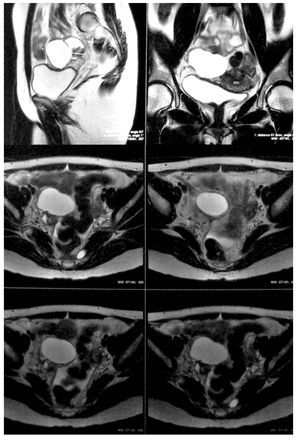
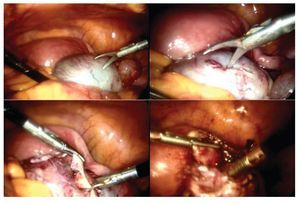
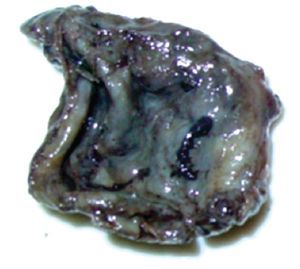
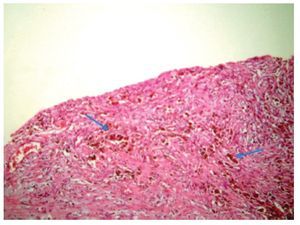
La paciente se sometió a cirugía laparoscópica, utilizando dos puertos de 5 mm y un puerto umbilical de 10 mm, con lente óptico de 5 mm de cero grados, manteóptico de 5 mm de cero grados, manteniendo una presión intraabdominal de 12 mmHg, con monitorización con capnógrafo. Se encontró un tumor en anexo derecho, de 8 cm de diámetro mayor, con cápsula intacta, sin papilas superficiales, implantes peritoneales o ascitis; asimismo un quiste paratubario derecho de aproximadamente 2 cm. El ovario izquierdo y resto de órganos pélvicos se encontraron dentro de la normalidad (Figura 3). Se realizó cistectomía de quiste de ovario derecho por laparoscopia con preservación de parénquima ovárico, utilizando pinza bipolar para el control hemostático del sitio quirúrgico, se aspiró el contenido del quiste obteniendo material "achocolatado", se retiró la pieza quirúrgica con endobolsa (Figura 4). El estudio transoperatorio fue de quiste endometriósico (benigno). El procedimiento quirúrgico se completó sin ningún incidente o accidente. La paciente presentó disminución del CA125 en el posoperatorio y fue egresada 24 horas después de la cirugía, en buenas condiciones generales. El reporte de patología descartó malignidad, correspondió a un tumor de ovario, con la cápsula rota y vacía de un quiste uniloculado, de aspecto fibroso, color gris, dimensión de 7 x 7 x 0.4 cm, el interior con áreas herrumbrosas adheridas y fácilmente desprendibles, sin áreas papilares o sólidas (Figura 5). Los hallazgos microscópicos reportaron una pared formada por densas fibras, epitelio endometrial en la cara interna rodeada de escaso estroma endometrial, con material heterogéneo eosinofílico con eritrocitos y hemosiderina adherida, sin presencia de atipias. El diagnóstico de patología definitivo fue quiste endometrioide (endometriósico) benigno (Figura 6).
Figura 3. Hallazgos laparoscópicos. Tumor de anexo derecho.
Figura 4. Cistectomía de quiste de ovario derecho por laparoscopia.
Figura 5. Hallazgo macroscópico. Quiste de ovario uniloculado, capsula rota y vacía.
Figura 6. Pared de endometrioma, se observan abundantes hemosiderófagos.
¿DISCUSIÓN
El antígeno CA125, descrito por primera vez en 1981, es una glucoproteína de alto peso molecular (200 kDA), codificada por el gen MUC16 ubicado en el brazo largo del cromosoma 19 en la posición 13.2, con un valor de referencia de 35-60 U/mL.4,5 Es sintetizada en los epitelios derivados de la cavidad celómica y por tanto no es un antígeno tumoral específico, ya que se puede encontrar elevado tanto en procesos benignos como malignos del tejido donde se origina.2,6,7 El CA125 puede ser detectado y cuantificado en sangre así como fluidos biológicos gracias a su capacidad antigénica con técnicas de inmunoensayo, con la utilización de anticuerpos monoclonales.8 El CA125 se sintetiza en el epitelio celómico y por tanto se puede encontrar en estructuras tan variadas como el mesotelio de la pleura y del peritoneo, el miocardio, el pericardio o el epitelio mulleriano como son el de la trompa de Falopio, endocérvix, ovario y fondo vaginal.3, 9,10
El CA125 es un marcador excelente para las neoplasias epiteliales ováricas, se encuentra elevado en más del 85% de las pacientes con carcinomas activos. Estudios comparativos de los marcadores CA125, CA19-9 y ACE han indicado la clara superioridad del CA125, como el mejor marcador tumoral para los tumores epiteliales.11,12 El CA125, un marcador que también se eleva en la mayoría de los adenocarcinomas, es de gran utilidad en la evaluación y tratamiento de enfermos con carcinoma de ovario. Actualmente su mayor utilidad radica en el seguimiento de las pacientes con carcinoma de ovario, tras haber remitido clínicamente la neoplasia posterior a recibir quimioterapia. ambién es útil en el diagnóstico diferencial de otros tipos de cáncer del tracóstico diferencial de otros tipos de cáncer del tracto digestivo.3,6,13 Sin embargo, sin otros procedimientos diagnósticos, la utilización exclusiva del CA125 en el screening del carcinoma de ovario es poco útil.2 La causa que origina la elevación del CA125 como marcador, es la lesión difusa de las células mesoteliales.14 La elevación en la valoración de una paciente con cáncer de ovario difiere según el momento en que se haya tomado: a) screening; b) diagnóstico diferencial; c) monitorización de la resóstico diferencial; c) monitorización de la resstico diferencial; c) monitorización de la respuesta, y d) seguimiento.15
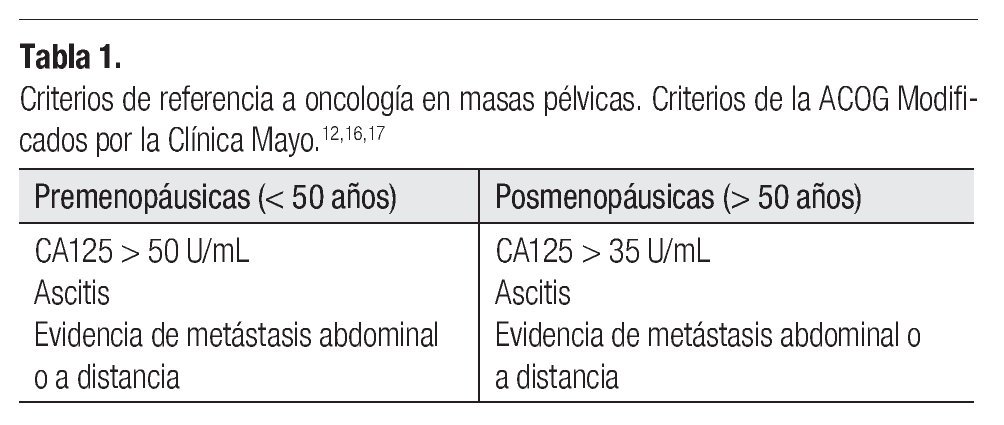
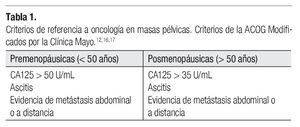
El evento clínico-patológico que se quiere evidenciar con la determinación del CA125 en el screening del cáncer de ovario, es diagnosticar un tumor en mujeres que desconocen tener la enfermedad. Existen ciertos parámetros de sospecha de malignidad para referencia a un centro oncológico (Tabla 1).12,16,17
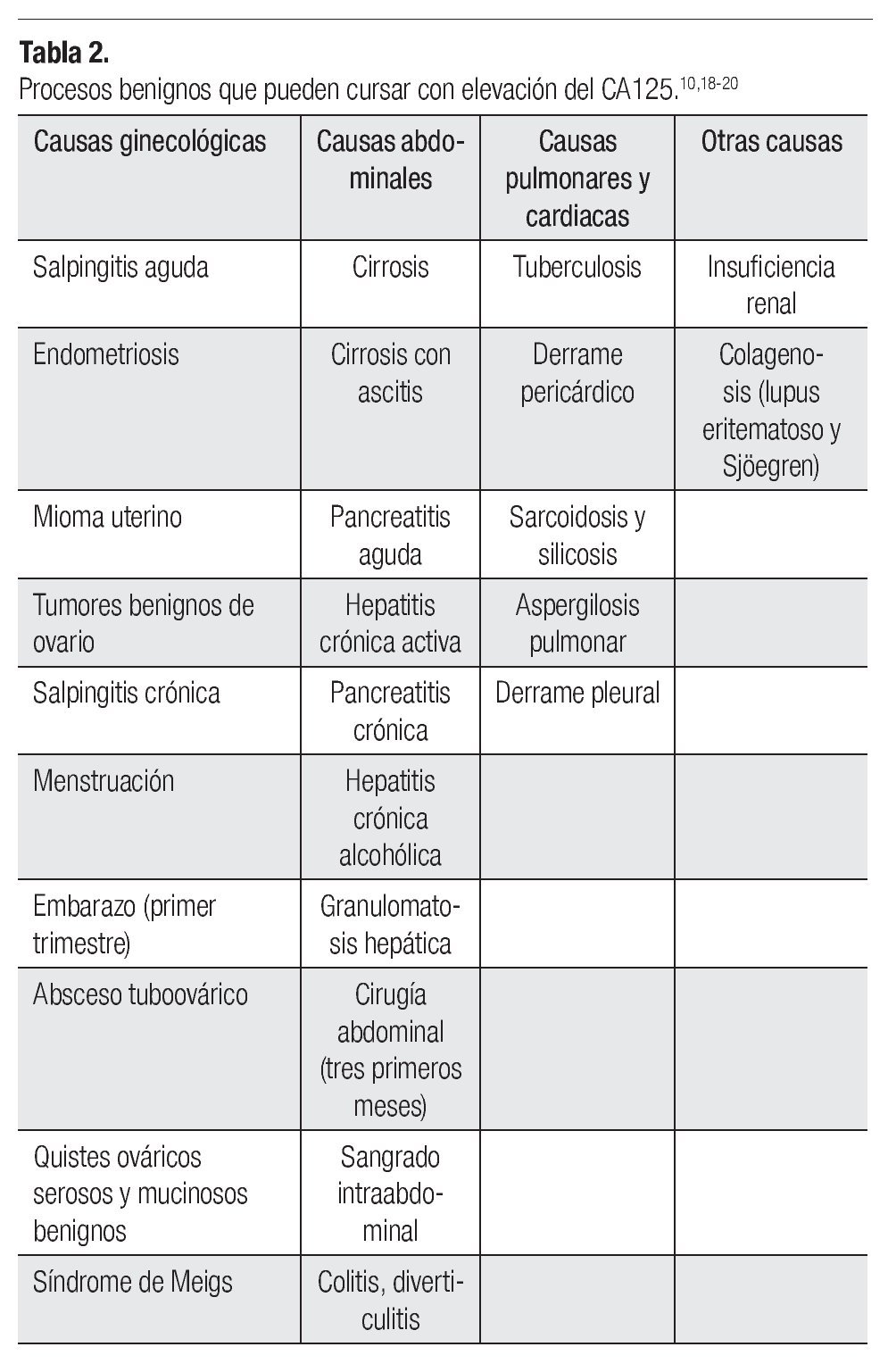
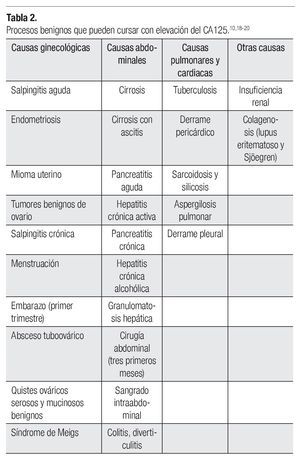
Por otro lado, existen múltiples patologías benignas que condicionan elevación del CA125 (Tabla 2).10,18-20 Se debe considerar que en ciertos procesos fisiológicos del endometrio, como ocurre en el primer trimestre del embarazo y en el posparto, incluso la menstruación y la endometriosis, puede existir elevación del CA125. La menopausia es otro factor importante asociado con incremento de las concentraciones de CA125.21,22 Desde el punto de vista práctico, parece que la diferencia entre premenopáusicas y menopáusicas mejora la interpretación de las concentraciones aumentadas de CA125. odas las pacientes premenopáusicas con concentraciones de hasta 35 U/mL presentan tumoraciones benignas, mientras que más del 80% de las pacientes menopáusicas con valores por encima de 35 U/mL presentan tumoraciones malignas. Por otro lado, existe un número importante de pacientes que cursan con cáncer de ovario en estadio I, en quienes las cifras de este marcador pueden encontrarse normales.3,22
Los procesos patológicos del hígado incluyen diversas enfermedades que cursan con gran elevación del CA125; tal es el caso de enfermos con cirrosis sin ascitis, hepatitis vírica, granulomatosis hepática y hepatitis crónica alcohólica. En presencia de cirrosis con ascitis, el CA125 se encuentra más elevado que en el resto de las patologías mencionadas.10,18-23
La frecuencia de falsos positivos y falsos negativos limita el uso de este marcador como método único de screening para el carcinoma de ovario, pero su especificidad aumenta cuando se asocia con otras pruebas diagnósticas como la ecografía, sobre todo en pacientes de alto riesgo. Existen otras situaciones que originan falsos positivos y falsos negativos del marcador CA125 en cáncer de ovario. Por ejemplo en las primeras semanas tras la laparotomía, este marcador puede estar elevado sin presencia de enfermedad neoplásica. también puede haber una elevación en las cifras de este marcador en pacientes con tumor residual mínimo, debido a un incremento de ciertos factores (como factor de crecimiento transformante [TGF] beta, factor de crecimiento epidérmico [EGF] y factor estimulante de colonias de macrófagos [M-CSF]), ya que algunos de ellos -al igual que los corticoides- inhiben cierto paso de la ruta bioquímica de la síntesis del CA125. Otros factores y citocinas (TGF-alfa, factor de necrosis tumoral [TF] alfa, interleucina [IL] 1) pueden elevar la expresión de este marcador.22-24
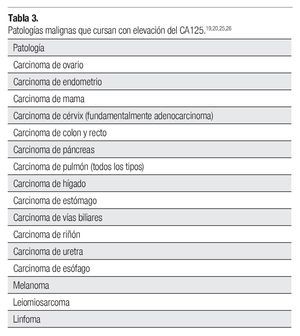
La determinación del CA125 podría ser útil en el diagnóstico diferencial de los tumores con diseminación peritoneal o abdominal de primario desconocido, ya que su elevación podría inclinar la balanza hacia el diagnóstico de un carcinoma de ovario. Sin embargo, existen muchas neoplasias malignas que cursan con la elevación del CA12519 ,20,25,26 (Tabla 3). Es demasiado raro que en estadios avanzados de cáncer de ovario se obtengan rangos bajos del CA125.27
Otra utilidad potencial del CA125 es la monitorización de la respuesta al tratamiento con quimioterapia en pacientes con cáncer de ovario en estadios avanzados (IIB-IV). Si el nivel del marcador CA125 está por encima de 70 U/mL antes del tercer ciclo, el pronóstico es malo, mientras que la reducción de éste por debajo de 35 U/mL durante el mismo ciclo es de buen pronóstico para la paciente.22,28
Existen otras condiciones donde también puede haber elevación del CA125, como es el uso de ciertos medicamentos (Taxol). Otras condiciones asociadas son la ruptura traumática o quirúrgica del peritoneo como ocurre en la diálisis o procedimientos quirúrgicos abdominales donde se ha visto elevación de este marcador sin la presencia de una neoplasia.22,2 ,30
La determinación del CA125 en el seguimiento de una paciente con carcinoma de ovario es detectar precozmente una recurrencia, bien tras el tratamiento adyuvante en aquellas con carcinoma de ovario en estadios iniciales o tras la remisión completa en pacientes con enfermedad avanzada. La elevación del CA125 en el seguimiento de pacientes con cáncer de ovario, establece el diagnóstico de recurrencia.15,1 ,28,31
La clasificación preoperatoria de las pacientes con tumoraciones ováricas y en particular la discriminación entre lesiones malignas y benignas, es importante para el óptimo manejo de estos casos. La mayoría es de naturaleza benigna. Una minoría corresponde a tumores limítrofes o borderline y lesiones malignas invasivas.15,31
Cuando en la evaluación clínica, el marcador CA125 y el estudio ultrasonográfico resultan negativos para lesión maligna, el referente estándar es la vía laparoscópica, incluso para los quistes de gran tamaño.32 En mujeres en edad reproductiva, el procedimiento es la enucleación del quiste y extracción en endobolsa. En mujeres premenopáusicas y menopáusicas -dado que existe mayor riesgo para lesiones malignas- es preferible realizar una ooforectomía o anexectomía y extracción en endobolsa con la finalidad de evitar el escape de células a la cavidad peritoneal.33
Muchos tumores benignos por el hecho de medir más de 10 cm de diámetro son intervenidos por laparotomía, pero actualmente el procedimiento se puede realizar por abordaje laparoscópico. En algunas ocasiones, cuando se emplea la vía laparoscópica puede haber ruptura de la cápsula y salida de material a la cavidad abdominal, con el riesgo de peritonitis química; se debe evitar el escape intraperitoneal del contenido del quiste.34 Otra opción para el manejo de tumores benignos de ovario entre 7 y 15 cm de diámetro, es la minilaparotomía guiada laparoscópica.35
Cuando se evalúa la tumoración por la vía laparoscópica, se puede optar por la colocación de un trócar accesorio para colapsar la tumoración mediante una aguja por aspiración, evitando el escape del contenido. A continuación, se amplía la incisión de la fascia o la aponeurosis de una de las entradas laterales, completando a 3 cm, introduciendo una pinza de anillos o de Kocher de cirugía convencional; a través de la incisión ampliada, se pinza la pared del quiste por el punto de menor resistencia y se extrae fuera del abdomen. Se abre el quiste, terminando de retirar todo el contenido intraquístico, se procede a retirar la cápsula, se realiza hemostasia, afrontamiento y finalmente se retorna el ovario al interior del abdomen.35,36
Las tumoraciones limítrofes o malignas en estadio I son diagnosticadas principalmente en pacientes jóvenes, siendo a menudo descubiertas durante el intraoperatorio o en la histología definitiva.37 Las principales preocupaciones en el abordaje laparoscópico del tumor limítrofe y del tumor de ovario en estadio inicial son: 1) el riesgo de un estadio inicial inadecuado, 2) diseminación intraperitoneal por escape de células, y 3) metástasis en el sitio del trócar.38 La recurrencia se asocia a la rotura intraoperatoria del quiste. Con respecto a la diseminación peritoneal, el principal factor de riesgo parece ser el diagnóstico oculto de una lesión maligna o la realización de procedimientos inadecuados.32,3
En mujeres menores de 40 años que desean preservar la fertilidad con un tumor limítrofe o en estadio inicial de cáncer de ovario, es aceptable realizar lavado peritoneal, anexectomía del lado afectado, biopsia del ovario contra-lateral (en caso de lesión sospechosa), biopsia peritoneal múltiple, omentectomía, agregándose linfadenectomía pélvica y paraaórtica infrarrenal. Además se realizaparaaórtica infrarrenal. Además se realizará apendicetomía en los casos de tumores mucinosos.40 En mujeres de 4 años además se realizará histerectomía total y anexectomía bilateral. El desarrollo de la cirugía mínimamente invasiva hace posible tratar los tumores limítrofes y malignos de ovario en estadio inicial, cumpliendo las guías y principios oncológicos establecidos en pacientes seleccionadas y con cirujanos experimentados, con conocimientos oncológicos y habilidades en laparoscopia avanzada.41
El presente caso corresponde a una mujer joven con un tumor pélvico (tumor de anexo) con hallazgos radio-gráficos de benignidad pero con elevación del CA125. El diagnóstico preoperatorio era de sospecha de malignidad, aunque el marcador podría haber estado elevado por otras patologías, incluyendo las benignas. El grupo oncológico decidió hacer una abordaje inicial por vía laparoscópica porque existía la posibilidad de una neoplasia benigna, la cual se confirmó mediante los hallazgos laparoscópicos y el estudio histopatológico transoperatorio. El resultado quirúrgico fue aceptable con cicatrización mínima, menor dolor posoperatorio y estancia intrahospitalaria reducida.
Hasta el momento de la publicación se contraindica la cirugía laparoscópica en cáncer de ovario avanzado, debido a que debe realizarse una cirugía de citorreducción óptima que incluye: histerectomía total con salpingoo- que incluye: histerectomía total con salpingooforectomía bilateral, omentectomía, disección ganglionar pélvica y retroperitoneal, lavado peritoneal, además de resección de todos los implantes metastásicos, con el fin de dejar menos de 1 cm de residuo tumoral. Lo anterior es una situación compleja que es difícil realizar por vía laparoscópica. Sin embargo, es posible la cirugía laparoscópica en etapas I, como parte de un protocolo de estudio en centros oncológicos con amplia experiencia en cirugía de mínima invasión aplicada a la Oncología Ginecológica ( CC ).42
¿ CONCLUSIÓN
El CA125 tiene una moderada sensibilidad diagnóstica como predictor de malignidad en tumores pélvicos. Un diagnóstico preoperatorio preciso de las tumoraciones pélvicas permitirá que las pacientes con estas neoplasias puedan ser referidas a un centro oncológico donde obtengan una correcta estadificación y se beneficien de cirugías citorreductoras óptimas que mejoren la suóptimas que mejoren la su- que mejoren la supervivencia. En el caso de cualquier tumor de anexo, se deben solicitar los marcadores tumorales incluyendo CA125, AFP, GCH fracción beta (b-HCG), con el fin de descartar malignidad. En caso de tumor benigno las pacientes se pueden beneficiar de los abordaje por vía laparoscópica. Sin embargo, algunos datos sugieren que aunque varios parámetros clínicos y de laboratorio son tiles en la evaluación de las tumoraciones pélvicas, ninguna de las combinaciones de factores puede ser considerada cien por ciento precisa en la predicción de neoplasias malignas. Se concluye por lo tanto que el CA125 tiene una moderada eficacia diagnóstica como predictor de neoplasias benignas o malignas, cuando no se acompaña de otros métodos diagnósticos.
Correspondencia: Dr. Efraín A. Medina Villaseñor.
Hospital Ángeles Metropolitano. Tlacotalpan No. 59, Torre Diamante, Consultorio 735. Col. Roma Sur, 06760, México, DF.
Teléfonos: 5858 403 /5855 5533.
Página web: www.oncologiabetania.com
Correo electrónico:efra73@hotmail.com