El carcinoma hepatocelular (CHC) es el sexto cáncer más común en el mundo y su incidencia está aumentando en países occidentales. La resección hepática es el tratamiento quirúrgico ideal en pacientes no cirróticos y en cirróticos, con la función hepática preservada y sin hipertensión portal. La sobrevivencia a 5 años después de la resección se encuentra entre el 41% y 74%. Los predictores de recurrencia incluyen el grado del tumor, la invasión vascular, el tamaño del tumor, número de tumores, presencia de lesiones satélites, niveles de alfa fetoproteína, transfusión y márgenes de la resección positivos para tumor. Alrededor del 15% de los pacientes se les puede realizar una segunda resección tras la recurrencia. El trasplante hepático se ha convertido en una útil herramienta terapéutica en los pacientes con CHC, con resultados excelentes aplicando los criterios de Milán, obteniendo sobrevivencia a 5 años de 70% con bajas tasas de recurrencia.
Hepatocellular carcinoma is the 6th most common cancer worldwide and its incidence is increasing in the west. Liver resection remains the treatment of choice in non-cirrhotic and cirrhotic with preserved liver function and normal portal pressure. Careful patient selection is paramount. Five year survival after resection is somewhere between 41%-74%. Predictors of recurrence include vascular invasion, tumor size, and presence of satellite lesions among others. About 15% of patients can receive a second resection after recurrence. Liver transplant has become a very valuable tool in the management of hepatocellular carcinoma with very good results when within the Milan criteria, with 70% 5-years survival and low recurrence rates.
Generalidades
El carcinoma hepatocelular (CHC) es el cáncer primario del hígado más común y su origen es el hepatocito. Es el sexto cáncer más común en el mundo y su incidencia está aumentando en el occidente1. La mayoría de los casos, el CHC se desarrollan en hígados cirróticos, más comúnmente a causa de hepatitis virales tipo B y tipo C, pero también puede suceder por cirrosis alcohólica e incluso por esteatohepatitis no alcohólica (NASH, por sus siglas en inglés). El cáncer de hígado ocurre en menor nivel en hígados no cirróticos. Estos tumores suelen ser silenciosos y no producir síntoma alguno hasta etapas avanzados cuando el tumor obstruye conductos biliares, invade vasos u otros órganos vecinos. Por este motivo hay métodos de vigilancia y detección temprana para pacientes con alto riesgo de padecer estos tumores y, así otorgarles tratamiento quirúrgico temprano y una mejor oportunidad de curación. Tanto el estadio del tumor como la reserva hepática deben de tomarse en cuenta como parte de la estrategia terapéutica2. Las opciones terapéuticas no son mutuamente excluyentes y su uso debe individualizarse según las necesidades de cada paciente. Entre las opciones no quirúrgicas de tratamiento se encuentran la ablación por radiofrecuencia (ARF), quimioembolización transarterial (QETA) y con menos sustento científico, el uso de radioembolización Itrio radioactivo (Y-90) y la radiación externa3. La evaluación completa de un paciente con sospecha de CHC debe incluir tomografía o resonancia magnética contrastada, estudios de extensión para descartar la posibilidad de metástasis pulmonares o intraabdominales y estudios de función hepática, además de la evaluación cardiopulmonar realizada para evaluar riesgo quirúrgico. Cuando el tumor cumple con ciertas características por tomografía o resonancia es posible hacer el diagnóstico sin biopsia, y así se evita el riesgo de implantar tumor en el trayecto de la aguja, al igual que otras potenciales complicaciones4. La clave está en hacer una evaluación completa y posteriormente escoger el mejor tratamiento inicial. Debido a lo extenso del tema, la intención primaria de este capítulo será enfocarse en el manejo quirúrgico del CHC.
Criterios de selección para la resección hepática
La resección hepática es el tratamiento más apropiado para aquellos pacientes con hepatocarcinoma, en la ausencia de cirrosis. Dichos pacientes pueden ser sometidos a una operación con baja morbilidad y mortalidad (< 5%)5. La mayoría de pacientes cirróticos tienen alteraciones en la función de su hígado y estos no son candidatos a resección hepática6. Empero, pacientes altamente seleccionados con cirrosis y función hepática normal con bilirrubina total menor a 1.0 mg/dL, pueden ser tratados exitosamente con resección hepática, sin embargo la decisión de tratamiento en estos pacientes sigue siendo un reto7. En pacientes con cirrosis, una cuidadosa evaluación de la función hepática debe llevarse a cabo de forma preoperatoria para evitar la falla hepática postoperatoria2,8.
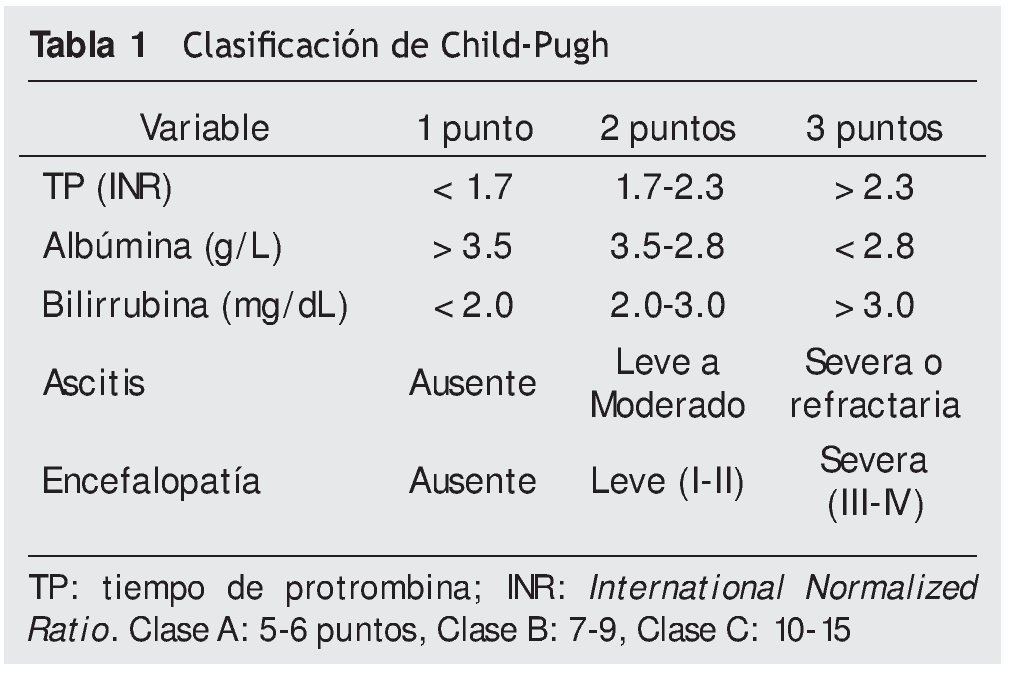
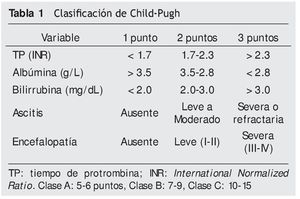
El éxito de la resección del CHC yace en identificar adecuadamente el grado de cirrosis y, valorar el riesgo de complicaciones y mortalidad de forma cuidadosa. Han surgido varios estudios con la intención de medir la función hepática, pero ninguno ha probado ser más efectivo que la clasificación de Child-Pugh (tabla 1)9. Ha sido ampliamente demostrado que en pacientes con clasificación de Child-Pugh B o C, el insulto quirúrgico constituye un riesgo inaceptable. Otros estudios sugieren que en pacientes con hipertensión portal o un Child-Pugh B, el tratamiento quirúrgico no ofrece ventajas sobre el tratamiento no quirúrgico (ARF, QETA, etc.)10. Makuuchi y Miyagawa reportaron también que algunos pacientes con Child-Pugh A no eran buenos candidatos a tratamiento quirúrgico, basado en un algoritmo de 3 variables: ascitis, bilirrubinas y porcentaje de retención de indiocianina a los 15 minutos11. Aquellos pacientes con retención de más de 20% de indiocianina a los 15 minutos, no deben ser sometidos a una resección12. El grupo del Clínico de Barcelona identificó la ausencia de hipertensión portal clínicamente relevante y la bilirrubina < 1 mg/dL, como los mejores factores para determinar a los candidatos para hepatectomía en caso de CHC. En este estudio los pacientes con un Child-Pugh A y mínima hipertensión portal (ausencia de várices por imagen, plaquetas > 100,000/mm3 o gradientes de presión venosa hepática < 10 mmHg), tenían una sobrevivencia a 5 años de 70% vs. 50% en aquellos pacientes Child-Pugh A con presencia de hipertensión portal13.
En cuanto al estadio del tumor, la presencia de metástasis extrahepáticas o invasión a la vena porta o a la vena cava inferior, son contraindicación para cirugía. El tamaño del tumor como parámetro aislado no ha demostrado ser un buen criterio de irresecabilidad14. Algunos autores consideran que las lesiones < 2 cm, deben ser tratadas con resección hepática y otros con ARF15,16. Los pacientes con múltiples tumores hepáticos no son candidatos ideales, ya que en la mayoría de los casos son un reflejo de invasión vascular y metástasis intrahepáticas17. Sin embargo, si hay una pequeña lesión contralateral ésta puede ser tratada con ARF o con una resección hepática no anatómica o en cuña. En general, la invasión portal es contraindicación para la cirugía. En casos resecables donde la invasión portal es unilateral, los pacientes pueden en un 25%-30% de los casos, rebasar la expectativa de vida por varios meses al compararse con un paciente que no se opera18.
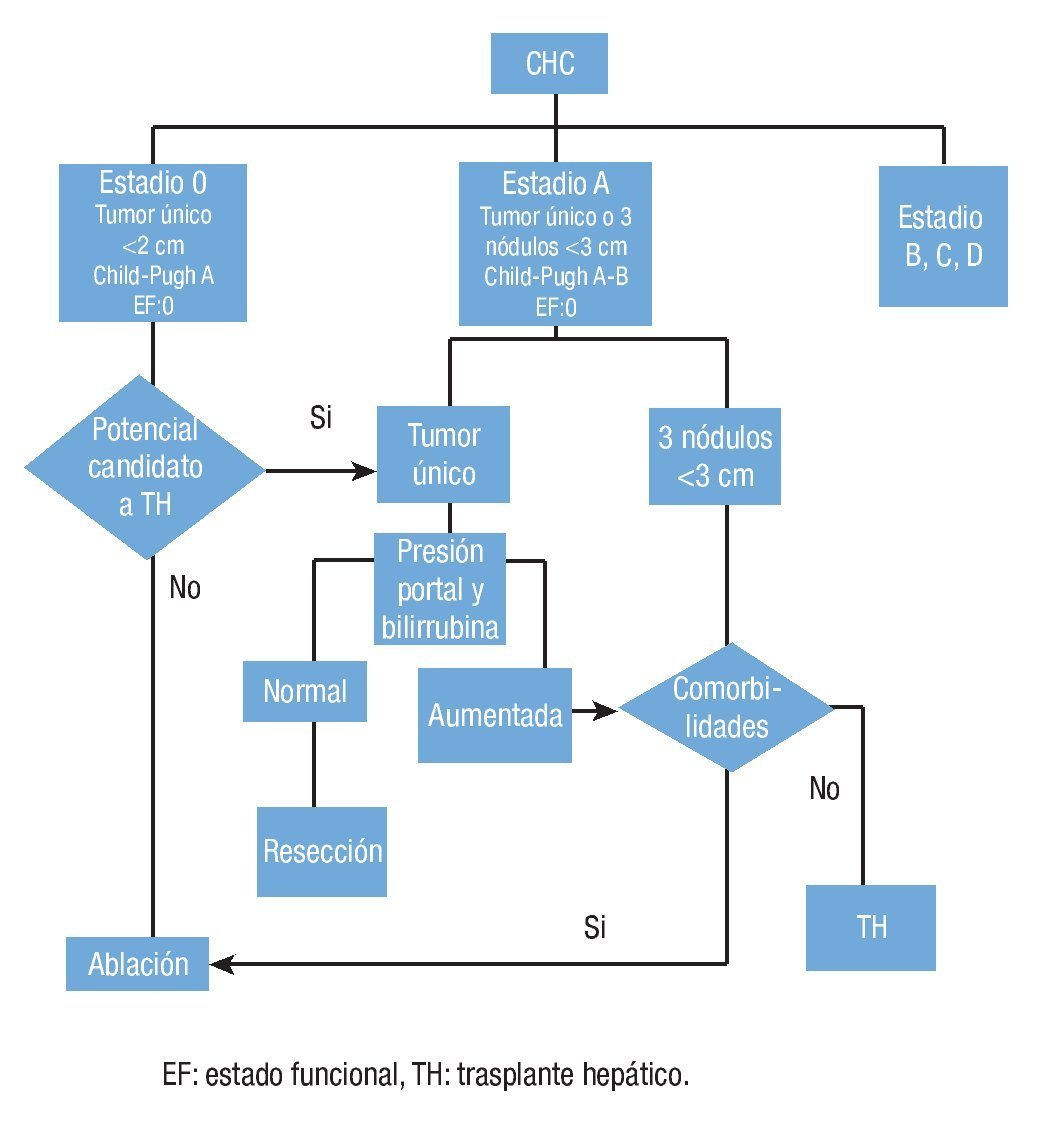
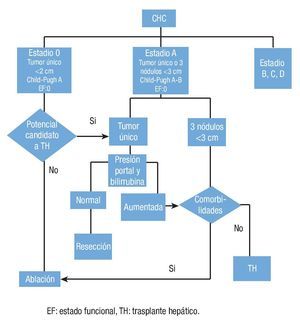
La clasificación de estadiaje del Cáncer de Hígado del Clínico de Barcelona (BCLC, por sus siglas en inglés), permite estratificar a los pacientes y agruparlos según en tipo de terapia que más les favorece19. La figura 1 contiene la parte de la clasificación relevante a la resección, los estadios 0 y A. Dicha clasificación engloba varios de los conceptos que se mencionaron en los párrafos previos.
Figura 1. Adaptado de la clasificación de BCLC con enfoque al estadio 0 y A.
Embolización de la vena porta
La embolización de la vena porta (EVP) puede ser utilizada para inducir crecimiento del remanente hepático de forma preoperatoria, cuando la reserva hepática es limítrofe o cuando se planea una resección muy extensa. En un estudio de 112 pacientes que fueron sometidos a EVP se notó que aquellos pacientes no cirróticos con remanentes de menos de 40% del volumen total o aquellos cirróticos con remanentes menores al 60% tenían considerablemente más complicaciones, insuficiencia hepática, estancia intrahospitalaria, y mortalidad a 90 días del postoperatorio20. La ausencia de hipertrofia en respuesta a EVP refleja una mala capacidad de regeneración y es por ende, una contraindicación para una hepatectomía mayor.
Manejo intraoperatorio
Los factores clave durante una resección hepática incluyen el uso del ultrasonido intraoperatorio, la resección segmentaria, la oclusión del flujo vascular, mantener una presión venosa central baja y la técnica de transección del parénquima.
El ultrasonido usado por el cirujano de forma transoperatoria facilita la resección, permitiendo la visualización de los vasos intrahepáticos y su relación con el tumor, también puede detectar tumores pequeños no identificados previo a la cirugía con otros estudios de imagen.
El conocimiento preciso y familiaridad con la anatomía del hígado incluyendo todas sus variantes es fundamental para la cirugía hepática segura. Los avances de la cirugía hepática en los últimos 30 años son en gran medida gracias al conocimiento de la anatomía segmentaria según Couinaud21. La resección respetando las divisiones hepáticas segmentarias tiene ventajas oncológicas, debido a la tendencia de los tumores a invadir las ramas segmentarias de la porta y debe realizarse siempre que sea posible. Por otro lado en individuos con pobre reserva hepática, sobretodo en pacientes cirróticos, el imperativo es preservar la mayor cantidad de parénquima y evitar resecciones mayores y por ende, es mejor realizar resecciones limitadas aunque no se respete la anatomía segmentaria. Independientemente del tipo de resección no debe perderse de vista la importancia de obtener márgenes libres de tumor22. Las definiciones pertinentes a diferentes tipos de resección fueron estandarizadas en Brisbane, Australia en el 200023.
Debido a que el sangrado transoperatorio y la transfusión sanguínea en el transoperatorio son predictores independientes de mal pronóstico tras una hepatectomía por CHC, el control de la hemorragia durante la cirugía es de suma importancia24. Por esta razón hay muchos estudios comparando variaciones en la técnica de oclusión del flujo sanguíneo hepático (o maniobra de Pringle). Por ejemplo, utilizar oclusión intermitente 15 minutos y liberarla 5 minutos, comparada con oclusión continua con la meta de obtener control del sangrado y al mismo tiempo evitar daño hepático por isquemia/reperfusión y por tanto, disminuir la morbimortalidad25. La oclusión intermitente se ha vuelto la forma más común de controlar el sangrado transoperatorio durante una resección hepática26. La exclusión vascular hepática total, es decir el cortar el flujo entrante (vena porta y arteria hepática) y el flujo de salida (de las venas hepáticas) del hígado, ha sido descrito para la resección de ciertos CHC en pacientes no cirróticos, pero rara vez se utiliza en pacientes cirróticos27. Un ensayo clínico controlado demostró también la viabilidad y seguridad de realizar resecciones hepáticas sin oclusión vascular inclusive en hígados cirróticos, siendo un método utilizado en varios centros especializados28. La necesidad de control vascular de entrada o maniobra de Pringle puede obviarse con varias de las nuevas técnicas de transección hepática que se mencionarán a continuación. La fuente de sangrado transoperatorio más importante en estos casos, son ramas de las venas hepáticas. Una de las mejores formas de evitar el sangrado profuso de estas venas es por medio de un manejo con baja presión venosa central (PVC), por parte de anestesiolología. Manteniendo la PVC por debajo de 5 mmHg por medio de cambios posturales (Trendelenburg de 15°), restricción de volumen intravascular, diuréticos, vasodilatadores, y agentes anestésicos como el isoflurano que produce vasodilatación29.
Hay varias técnicas descritas para realizar la transección del parénquima hepático. La forma tradicional se lleva a cabo con la fractura del parénquima hepático y la ligadura sistemática de los pequeños vasos, mientras se van haciendo evidentes con ligadura o con clips quirúrgicos. Dicha técnica se lleva a cabo más comúnmente con el pinzamiento del parénquima, con una pinza hemostática de Kelly o con la punta cerrada de una tijera de Metzenbaum. Hoy en día, existen muchos instrumentos como el disector ultrasónico (CUSA), engrapadoras vasculares, Ligasure, Waterjet, bisturí armónico, la transección asistida por radiofrecuencia, entre otros. Estas han demostrado su utilidad sobre todo durante procedimientos mínimamente invasivos y en general, permiten una transección segura y con escaso sangrado. Sin embargo, son costosos y su superioridad con el método clásico de fractura del parénquima y ligadura no se ha probado en estudios. Actualmente, los métodos más utilizados son la técnica de fractura del parénquima-ligadura y el disector ultrasónico (CUSA), pero el uso de la amplia gama de instrumentos depende más de la preferencia del cirujano y de la experiencia que este tiene con ellos. Idealmente todo cirujano hepático debe de estar familiarizado y tener disponible varios métodos de transección29.
Resultados y recurrencia
La sobrevivencia de pacientes con CHC posresección es de 80%-92% al año, 61%-86% a los 3 años y 41%-74% a los 5 años, dependiendo de la serie que se revise30,31. Los predictores de mortalidad en el postoperatorio inmediato se relacionan sobre todo con la función hepática e incluyen la clasificación de Child-Pugh, el grado de fibrosis, el nivel de bilirrubina total, la presencia de hipertensión portal y el número de plaquetas. Aún en estadios tempranos, el CHC recurre en 20%, 50% y 75% de los pacientes a uno, 3 y 5 años, respectivamente32. En el caso específico de pacientes infectados con el virus de la hepatitis C y cirrosis, la recurrencia puede ser de hasta el 80% a 5 años13. Los predictores de recurrencia incluyen el grado tumoral, invasión vascular microscópica y macroscópica, el tamaño del tumor, número de tumores, presencia de tumores satélite, nivel de alfa fetoproteína, transfusión intraoperatoria y margen quirúrgico positivo33. Con técnicas moleculares se pueden detectar micrometástasis hasta en el 88% de pacientes y probablemente son la causa de la recurrencia. Alrededor de 80% de las recurrencias ocurren en el hígado, sin embargo por factores tanto del tumor recurrente como de la función hepática sólo en el 15% de los casos los pacientes pueden ser sometidos a una segunda resección34. La recurrencia se puede deber a metástasis del tumor primario o desarrollo de novo de otro tumor primario. La gran mayoría de metástasis intrahepáticas se manifiesta en los primeros 2 años tras la resección, en cambio, el riesgo de padecer un nuevo tumor aumenta con el paso del tiempo y está más relacionado a la carcinogénesis inherente al hígado cirrótico, que al tumor previamente resecado34,35.
El tratamiento ideal en pacientes que desarrollan recurrencia después de la resección hepática y que preservan una función hepática adecuada sigue siendo incierto. Entre los tratamientos potencialmente curativos se encuentran; la segunda resección, el trasplante hepático, y la ARF. De los casos con recurrencia, la segunda resección es posible en el 15%. Roayaie et al. reportó el seguimiento de 487 pacientes que recibieron una resección hepática por CHC entre 1994 y 2009. De éstos, 221 desarrollaron recurrencia y sólo 35 fueron sometidos a una segunda resección. La sobrevivencia tras la segunda resección fue de 67% a 5 años. Sin embargo sobrevivieron el 81%, los pacientes que recurrieron más de un año después de la resección primaria y que no tenían invasión vascular tras la segunda resección. El trasplante hepático "de rescate" tras la resección o posterior a una descompensación hepática, es considerado como una segunda estrategia de tratamiento para los tumores recurrentes. Majno et al. concluyó que la expectativa de vida tras un trasplante hepático de rescate en comparación con el trasplante primario no eran significativamente diferentes36. Belghiti et al. también describió una morbilidad y supervivencia a largo plazo similar a la del trasplante primario37. Sin embargo, Adam et al. si reportó peores resultados en el trasplante de rescate en comparación con el trasplante primario en pacientes cirróticos38. En este último trabajo, al comparar trasplante de rescate con el trasplante hepático primario se encontró una mortalidad operatoria de 28% vs. 2%, riesgo de recurrencia de 54% vs. 18% y una menor sobrevivencia de 41% vs. 61%.
Por el momento, no hay evidencia sólida de que haya terapia adyuvante útil para prevenir la recurrencia posterior al tratamiento quirúrgico, sin embargo hay algunos estudios al respecto39. El sorafenib utilizado actualmente para estadios avanzados de CHC está siendo estudiado en ensayos clínicos controlados como terapia adyuvante, pero aún no hay resultados disponibles. El tratamiento de la hepatitis C con inhibidores de proteasa e interferón pegilado ha logrado eliminar al virus de la sangre en hasta el 75% de los pacientes tratados40. El tratamiento con antivirales de la hepatitis B, a su vez, reduce la replicación viral aunque no la elimina41. El tratamiento de la hepatitis B y C ha demostrado reducir de forma significativa la incidencia de CHC de novo, y debe implementarse antes y/o después de la resección hepática.
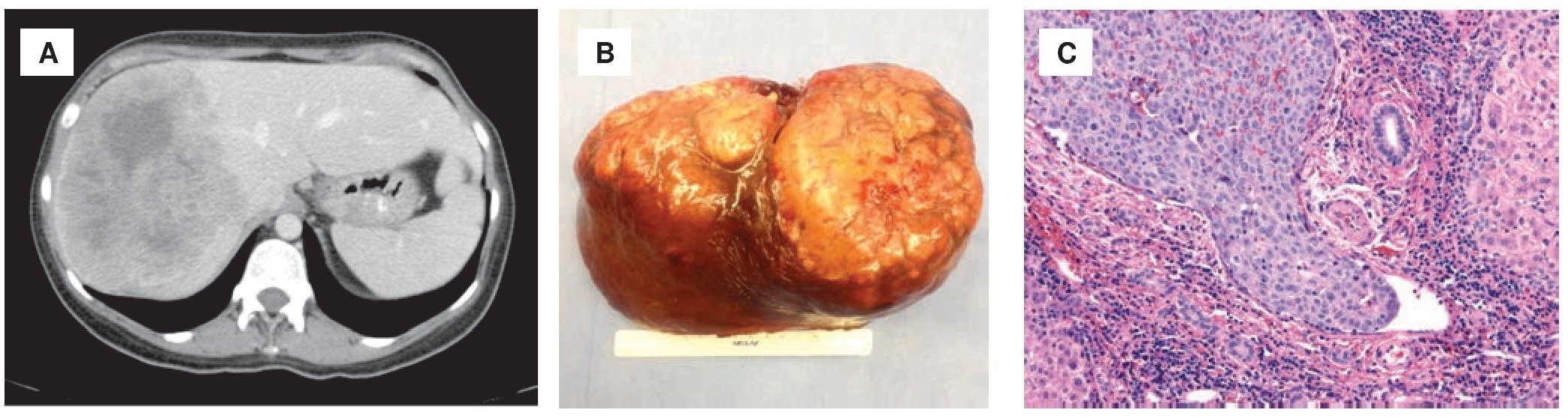
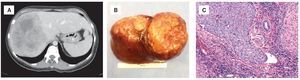
En la figura 2 puede verse caso clínico como ejemplo (paciente femenino joven, sin historia de enfermedad hepática con tumor en lóbulo derecho del hígado sin invasión a grandes vasos, sin enfermedad extrahepática y con función hepática normal).
Figura 2. A) Tomografía axial computada en fase venosa con gran tumoración hipodensa en el lóbulo derecho del hígado. B) Hepatectomía derecha por hepatocarcinoma mayor a 10 cm. C) Carcinoma hepato-celular con presencia de invasión vascular microscópica con tinción de hematoxilina & eosina.
Resección hepática laparoscópica
La cirugía laparoscópica del hígado ha crecido rápidamente debido a la mayor experiencia de los cirujanos y de los avances tecnológicos, es ahora razonable para una gran cantidad de pacientes con cáncer hepático incluyendo el CHC candidatos a resección. Según los "estatutos de Louisville" son indicaciones de cirugía laparoscópica los casos con: lesiones solitarias, de 5 cm o menos, localizadas en los segmentos 2 a 6 del hígado. La resección laparoscópica de la sección lateral izquierda del hígado debe ser considerada el estándar de tratamiento. Las resecciones mayores (por ejemplo, hepatectomías derecha o izquierda) deben ser realizadas por cirujanos experimentados, ya que son cirugías con un grado de complejidad muy grande42. Las ventajas de la laparoscopía incluyen menor dolor postoperatorio, el rápido retorno de la función digestiva, menor estancia hospitalaria y menor tiempo total de recuperación43. Un meta-análisis comparó 165 resecciones hepáticas laparoscópicas con 244 resecciones abiertas. Tras ser pareados los casos según la extensión de la resección, no se demostraron diferencias relacionadas con la viabilidad oncológica (márgenes tumorales, recurrencia, sobrevivencia a 5 años)44.
Trasplante hepático
El trasplante hepático se ha convertido en un elemento muy importante en el tratamiento del hepatocarcinoma en aquellos países en donde se logra integrar todos los factores necesarios para un programa de trasplante hepático exitoso, incluyendo más no limitado a la educación de la población, organización detallada, coordinación gubernamental, adecuada preparación técnica y asignación de recursos. En Estados Unidos, el CHC es la primera indicación de trasplante hepático. El razonamiento de esta terapia es que además de tratar el cáncer con el borde más amplio posible y extraer también sitios no reconocidos de micrometástasis, cura también la cirrosis (presente en más del 80% de los CHC) y por ende, disminuye sustancialmente la posibilidad de que se generen tumores de novo. Cuando se usan criterios limitantes para el trasplante (como los criterios de Milán), la recurrencia es de 10% a 15%.
Criterios de Milán
Las series iniciales de trasplante hepático para CHC en la década de los 90, incluían casos avanzados de estos tumores y por consecuencia, la sobrevivencia a 5 años fluctuaba entre el 20% y 50%, lo cual era inaceptable al compararse con otras causas de trasplante que estaban alrededor de 70%-75% de sobrevivencia a 5 años. Sin embargo, Mazzaferro et al. demostró que los pacientes con hepatocarcinoma podían sobrevivir prácticamente lo mismo que pacientes trasplantados por otras causas siempre y cuando se limitaran los candidatos a tumores tempranos (tumores solitarios menores o iguales a 5 cm; hasta 3 tumores menores de 3 cm; sin invasión macrovascular y sin enfermedad extrahepática)45. Estos criterios han sido aceptados extensamente y son los criterios utilizados por UNOS (por sus siglas en inglés, United Network for Organ Sharing) para asignar órganos a pacientes con CHC en los Estados Unidos.
Conclusión
La cirugía es el tratamiento de elección para el CHC, sin embargo sólo la minoría de pacientes son candidatos a una resección y el acceso al trasplante hepático es limitado. Los pacientes con cirrosis Child-Pugh A y sin hipertensión portal con una lesión única, deben ser sometidos a resección. Los pacientes con tumores irresecables pero que se encuentren dentro de los criterios de Milán, deben de enlistarse para un trasplante hepático. Los tratamientos no quirúrgicos deben ser considerados para limitar la progresión de la enfermedad. La recurrencia de estos tumores sigue siendo elevada y el tratamiento óptimo en estos casos es un reto para los especialistas.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Hospital Ángeles Metropolitano.
Tlacotalpan N° 59, Torre Diamante, Consultorio N° 735, Colonia Roma Sur, C.P. 06760, México D.F., México.
Teléfono: (55) 5858 4039.
Correo electrónico: efra73@hotmail.com (Efraín A. Medina-Villaseñor).