INTRODUCCIÓN
El mesotelioma pleural maligno (MPM) es una neoplasia poco frecuente y agresiva en la cual las células mesoteliales sufren transformación maligna, se dividen y crecen sin control. La incidencia de estos tumores se ha incrementado en los últimos 20 años. Se considera que el 80% de los casos son ocasionados por exposición laboral a fibras de asbesto, específicamente crocidolita, amosita y crisotila.1 El 20% restante se debe a otras causas, como la exposición al virus simiano 40 (SV40).2
Se ha indicado que los siguientes factores de crecimiento son cruciales para el desarrollo de esta enfermedad: factor de crecimiento epidérmico, factor de necrosis tumoral, factor de crecimiento derivado de plaquetas y factor de crecimiento derivado de queratinocitos.3
Los grupos CALGB (Cancer and Leukemia Group B) y EORTC (European Organization for Research and Treatment of Cancer) han cooperado en el estudio e identificación de algunos factores pronósticos de la reducida mediana de supervivencia en este grupo de pacientes, como: género masculino, edad mayor de 75 años, dolor torácico o disnea, plaquetas > 400,000 por μL, DHL (deshidrogenasa láctica) > 500 UI/L, baja concentración de hemoglobina, mal estado general, leucocitos > 8,300 por μL e histología sarcomatoide.4,5
En 80% de los casos, se diagnostica el tumor cuando ya está en etapa clínica III o IV y ya no se tiene la opción de tratarlo con resección quirúrgica. La mediana de supervivencia en este grupo es inferior a 12 meses. Aunque se han logrado mejoras en los procedimientos diagnósticos y los esquemas de tratamiento, el pronóstico para este grupo de pacientes aún es desalentador. En este artículo se informa de la experiencia clínica con doce pacientes que tenían mesotelioma y fueron tratados en dos instituciones públicas mexicanas con un esquema de pemetrexed combinado con cisplatino, como tratamiento de primera línea.
PACIENTES Y MÉTODOS
Se revisaron expedientes clínicos de pacientes con diagnóstico de MPM en etapa clínica III o IV para los que era adecuado el tratamiento paliativo con quimioterapia de primera línea. Los expedientes provinieron de dos instituciones: el Centro Oncológico Estatal ISSEMyM (Toluca, Estado de México) y el Hospital de Oncología del Centro Médico Nacional Siglo XXI (México, D.F.). La selección de pacientes dependió de que se contara con información suficiente sobre la vigilancia de su evolución; los que cumplieron este criterio recibieron en 2006 tratamiento inicial de quimioterapia con pemetrexed (500 mg/m2) y cisplatino (75 mg/m2).
Todos los pacientes firmaron una forma de consentimiento informado para recibir la quimioterapia.
Se llevó a cabo un estudio observacional retrospectivo de las características que tenían los pacientes, el tipo de tratamiento administrado, los resultados obtenidos y la toxicidad informada.
RESULTADOS
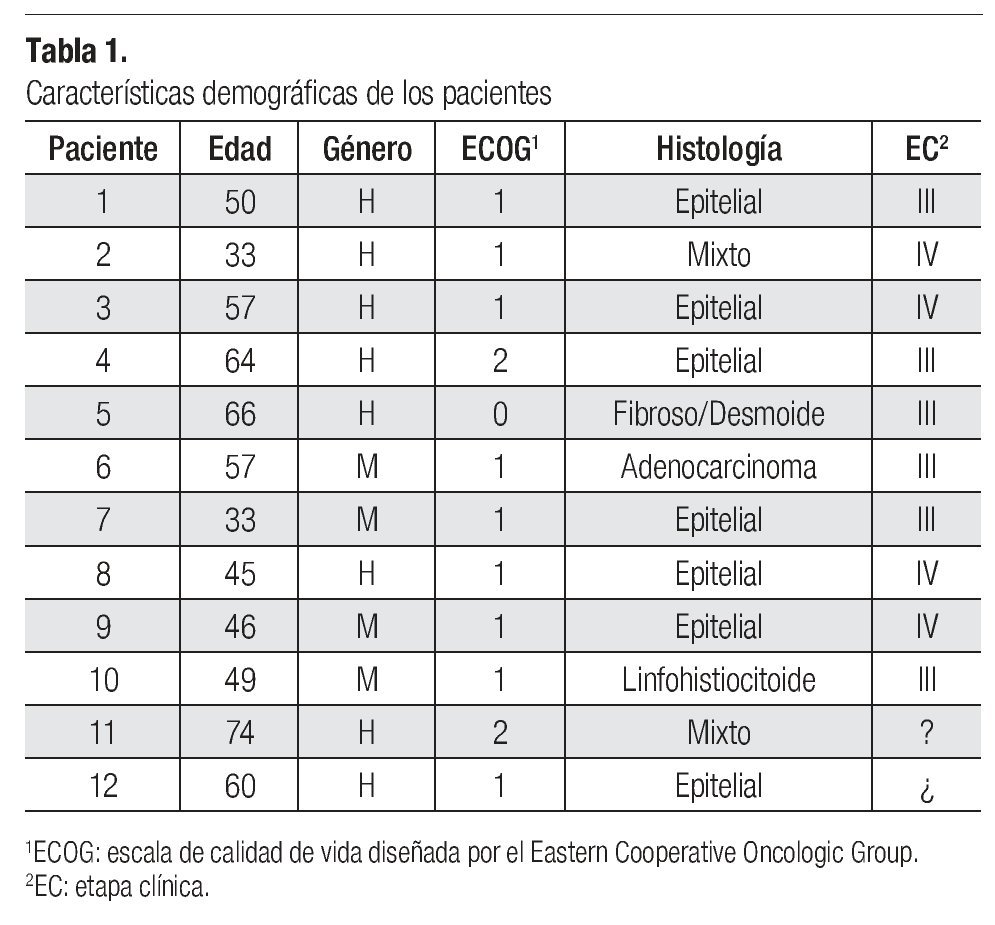
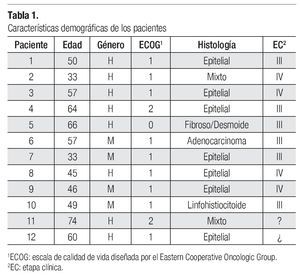
En los expedientes de las dos instituciones participantes se hallaron doce casos de pacientes a los que se diagnosticó mesotelioma y cuyo tratamiento inició en el año 2006. Ocho de ellos eran de género masculino (67%) y cuatro de género femenino (33%). El rango de edades fue de 33 a 74 años y la edad promedio de 52 años (Tabla 1). Seis de los doce pacientes (50%) diagnosticados estaban en etapa clínica (EC) III y cuatro en EC IV (34%); sólo uno de los expedientes contenía comentarios específicos sobre el sitio de metástasis, que eran hepáticas. Al revisar los expedientes se halló que en dos casos no había indicación de la etapa clínica, pero se dedujo que se trataba de una etapa clínica avanzada, ya que recibieron tratamiento paliativo con quimioterapia. Los diagnósticos histológicos fueron los siguientes: siete pacientes con mesotelioma epitelial (58%), dos con mesotelioma mixto (17%) y uno con adenocarcinoma e histología fibrosa (Tabla 1).
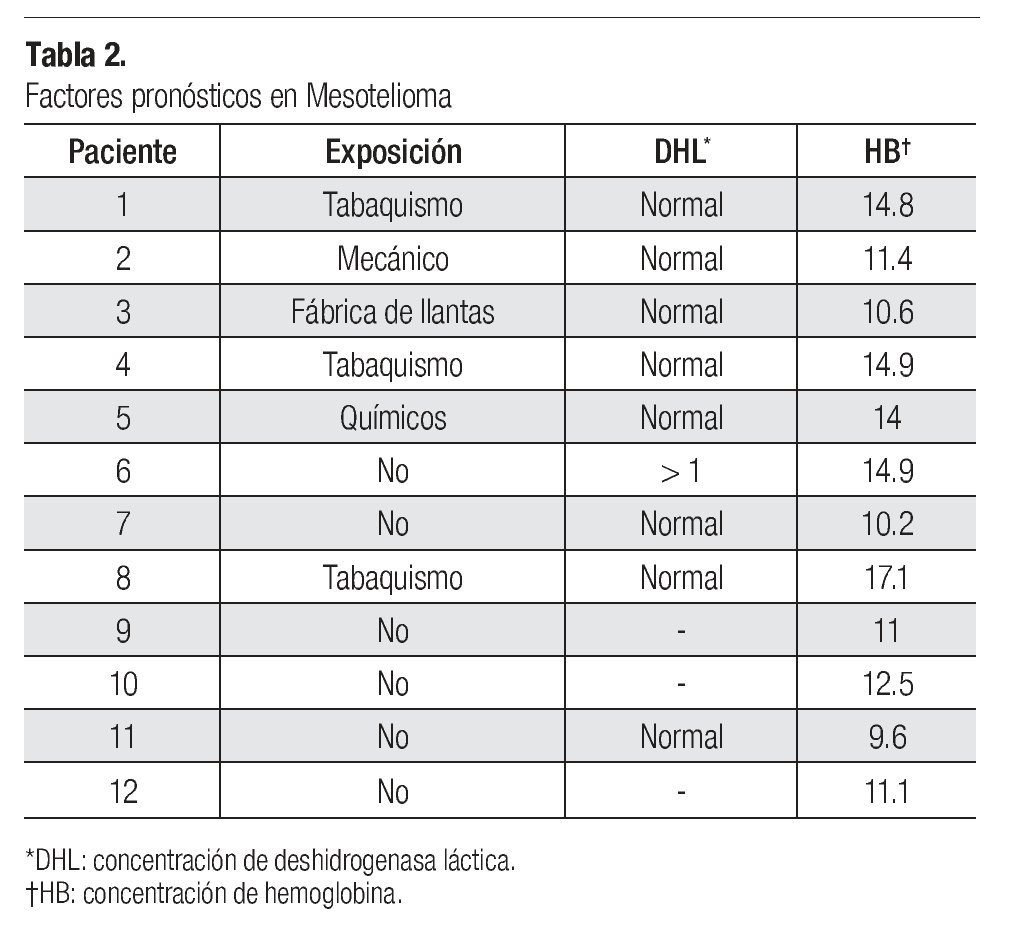
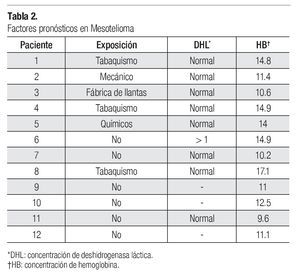
Se identificaron factores de riesgo de desarrollar mesotelioma en seis de los pacientes (50%). Dichos factores fueron: tabaquismo en tres pacientes, uno con profesión de mecánico automotriz, uno que trabajó en la fabricación de llantas y otro más que laboraba en la fabricación de productos químicos.
En cuanto a los factores pronósticos del desarrollo de mesotelioma, se halló que, al diagnóstico, la concentración de deshidrogenasa láctica (DHL) era normal en ocho casos (67%), en tres no se obtuvo el dato (25%) y en otros dos (8%) no fue posible recuperar la información respectiva. En la escala ECOG, el estado funcional de uno de los pacientes era de 0, el de otros nueve (75%) fue de 1 y el de otros dos (17%) fue de 2. La concentración de hemoglobina fue mayor de 17 en un paciente, en cuatro se hallaba dentro de parámetros normales y en siete pacientes (58%) estaba a niveles bajos, entre 9.6 y 12.5. En cuanto a características demográficas, como ya se dijo en párrafos anteriores, 67% de los pacientes eran de género masculino y ninguno era mayor de 75 años de edad. Tampoco se encontraron casos con histología sarcomatosa (Tabla 2).
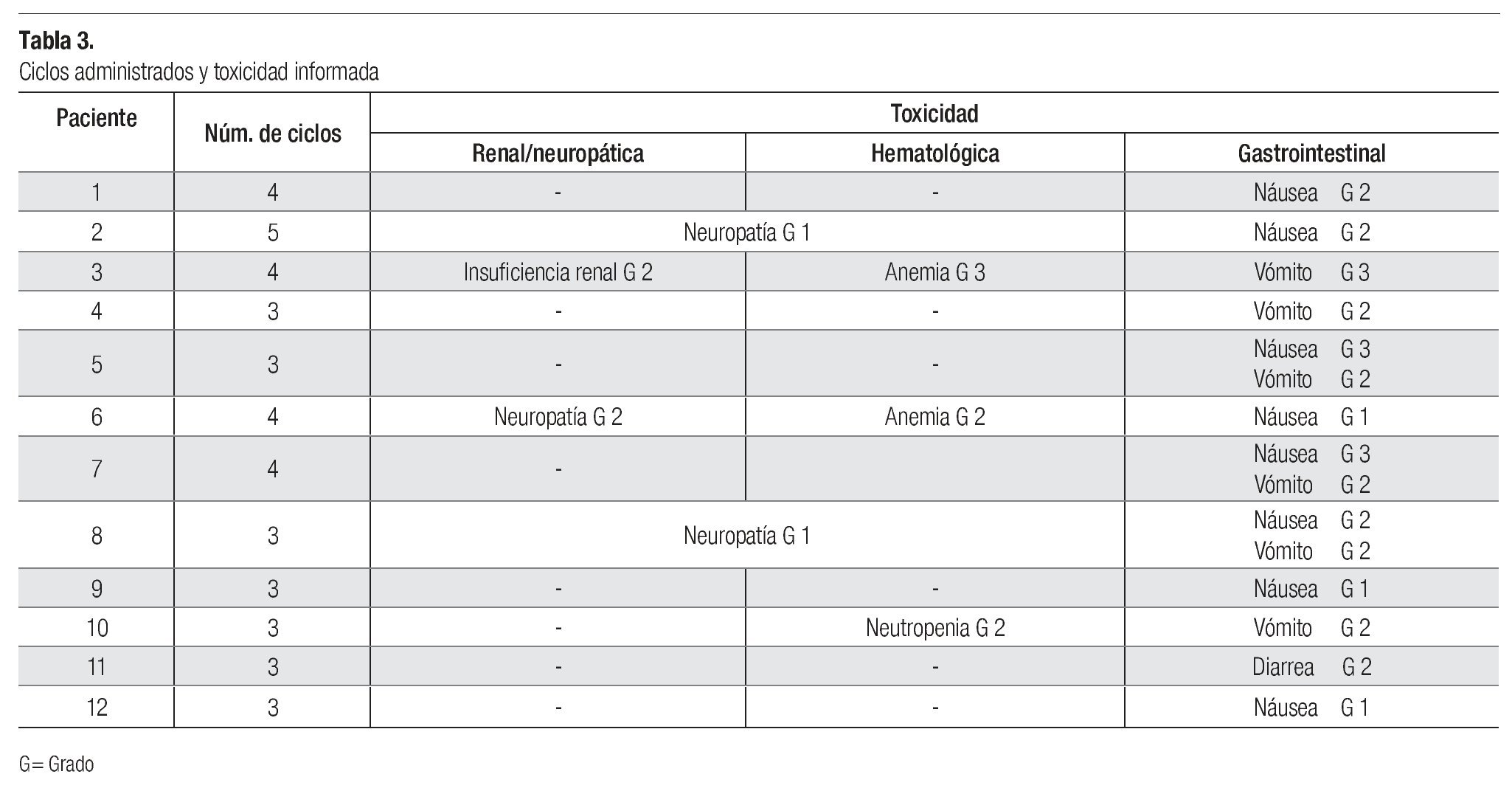
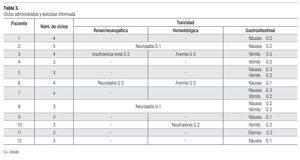
El rango de ciclos de tratamiento de primera línea con pemetrexed y algún agente platinado fue de tres a cinco; siete (58%) pacientes recibieron tres ciclos, cuatro (33%) recibieron cuatro ciclos y una recibió 5 ciclos. Las respuestas al tratamiento de primera línea fueron: cuatro parciales (33.3%), cuatro con enfermedad estable (33.3%) y cuatro con progresión de la enfermedad (33.3%); dos de estos pacientes tenían histología epidermoide y otro tuvo histología adenocarcinomatosa. En un caso no se observó reacción valorable. En general, el rango de tiempo a la progresión de uno a 11 meses, con promedio de 5.9. Los sujetos con menor tiempo a la progresión fueron los que padecían enfermedad progresiva y que recibieron el tratamiento de primera línea, pero no el de segunda línea. El rango de supervivencia en este grupo de pacientes fue dos a cinco meses; un paciente se perdió a la vigilancia, por lo que no se contó con información específica respecto de su evolución. El promedio de supervivencia desde el diagnóstico hasta la última consulta de revisión o la defunción fue de nueve meses.
Los efectos tóxicos informados fueron: anemia y neutropenia grado dos (por separado y en distintos pacientes) y anemia grado tres (en un mismo sujeto). Todos los pacientes (100%) experimentaron toxicidad gastrointestinal con la siguiente distribución: seis padecieron náusea, dos de ellos sufrieron intoxicación de grado 1 y los demás la tuvieron de grado 2. Cinco de los sujetos padecieron vómito de grado 2. Se informó de un paciente con diarrea de grado 2 y otro con intolerancia a la vía oral. En tres sujetos (25%) se detectó neuropatía de grado 1 a 2 y uno padecía insuficiencia renal de grado 2. Por desgracia, no se incluyó el detalle de las comorbilidades y, por tanto, no fue posible vincular dicha toxicidad con alguna enfermedad de base (Tabla 3).
Ocho pacientes recibieron tratamiento de segunda línea. El rango fue entre tres a seis ciclos. El esquema más utilizado fue gemcitabina más carboplatino (en cinco pacientes), seguidos de epirrubicina en un paciente y de pemetrexed en otro. Se informó que hubo dos reacciones parciales y dos con enfermedad estable, todas en el grupo de pacientes que recibieron gemcitabina y carboplatino como tratamiento de segunda línea. En dos casos se administró radioterapia como tratamiento de tercera línea.
DISCUSIÓN
El mesotelioma pleural maligno es un tumor relativamente raro. En estudios epidemiológicos se demostró que la incidencia de este tumor se ha incrementado a partir del decenio de 1970; antes de 1990 no se disponía de muchas opciones terapéuticas y únicamente se había experimentado con algunos agentes en esquemas de un solo medicamento para el tratamiento. Los fármacos utilizados eran: antraciclinas, alcaloides de la vinca, agentes alquilantes y algunos antimetabolitos, específicamente antifolatos. Hasta ese momento, el medicamento más estudiado en combinación era la doxorrubicina, con tasas de respuesta que fluctuaban de 11% a 30%.6
Pemetrexed es un antifolato que llega a múltiples blancos e inhibe a tres enzimas que participan en la síntesis de purinas y pirimidinas: dihidrofolato reductasa, timidilato sintetasa y glicinamida ribonucleótido formiltransferasa. En un estudio de fase II se observó que este medicamento generaba tasas de respuesta de 14.1%.7 Más tarde, en un estudio de fase III que incluyó 243 pacientes, se comparó al pemetrexed con placebo en tratamiento de segunda línea y se demostró que retarda la progresión de la enfermedad;8 en otro estudio de fase III se vio que este fármaco, en combinación con cisplatino, da lugar a incrementos en supervivencia, tiempo a la progresión y tasas de respuesta, comparado con cisplatino como agente único.9
En este artículo se informa sobre la experiencia y presentación de doce pacientes con mesotelioma pleural, tratados con la combinación de pemetrexed y cisplatino.
Una de las similitudes que se hallaron con lo informado en publicaciones médicas de todo el mundo fue que la mayoría de los pacientes era de género masculino. En este pequeño grupo de pacientes no fue posible describir los síntomas iniciales conocidos como "síndrome de cáncer", es decir, pérdida de peso, fatiga, caquexia, diaforesis nocturna y fiebre, así como hipoalbuminemia e incremento en la velocidad de sedimentación globular; esto se debió que los expedientes revisados no contenían dicha información. Sin embargo, se halló que 58% de los sujetos padecía anemia, lo que concuerda con las observaciones de otros estudios publicados.10 Se ha informado que las exposiciones ocupacionales a los asbestos constituyen el principal riesgo carcinógeno relacionado con el mesotelioma. La mitad de los pacientes incluidos en esta investigación presentó un factor de riesgo vinculado a la enfermedad; sin embargo, es probable que, igual a como sucede en otras series, el largo periodo de latencia entre la exposición y el inicio de la enfermedad ocasiona que el paciente no recuerde dicha exposición u omita mencionarla durante el interrogatorio.11
En casos de mesotelioma, la mediana de supervivencia es de 12 meses a partir del momento del diagnóstico. Los factores de peor pronóstico son: género masculino, enfermedad extendida, mal estado general, cuenta de leucocitos incrementada, anemia, trombocitosis e histología sarcomatoide.12,13 Tres pacientes del grupo estudiado por los autores sufrieron progresión de la enfermedad ante la primera línea de tratamiento; a diferencia de lo informado antes, dos de estos casos correspondieron a pacientes de género femenino, ninguna tuvo histología sarcomatoide y sólo una padecía estado funcional deteriorado (ECOG 2).
Durante mucho tiempo se ha considerado que el MPM es una neoplasia quimiorresistente. Entre los quimioterápicos usados para tratarla, los antifolatos son los que han resultado de mayor eficacia, en primer lugar el metotrexato. El pemetrexed es uno de los antifolatos con mayor actividad; esto se demostró en un estudio de fase III. En dicha investigación se comparó en 456 pacientes la combinación de pemetrexed y cisplatino con cisplatino solo. Con el análisis de todos los pacientes incluidos en el estudio se halló que la combinación generaba una mejoría significativa, con mediana de supervivencia de 12.1 meses, en comparación con los 9.3 meses que se obtenían con cisplatino solo (p = .020). Los principales efectos adversos de la combinación fueron mielosupresióin, fatiga, náusea, vómito y disnea. En esta investigación se halló que los resultados de supervivencia y toxicidad con la combinación de pemetrexed y cisplatino son muy similares a las que se logran con cisplatino solo. Sin embargo, el estudio se realizó sin distribución aleatoria, de modo que no fue posible hacer una comparación con pacientes a los que se administró cisplatino solo. Las intoxicaciones informadas en esta investigación también son similares a las obtenidas por otros estudios de fase III.9
En Europa se llevó a cabo un estudio de fase III con 250 pacientes, para comparar cisplatino con la combinación de cisplatino y raltitrexed. La combinación produjo mejores tasas de respuesta y mayor supervivencia.14
CONCLUSIÓN
El MPM es un tumor poco común, pero su frecuencia se ha incrementado en los últimos años. El pronóstico sigue siendo desalentador, pero también ha crecido el número de métodos diagnósticos y tratamientos disponibles. Un meta-análisis de estudios clínicos de 1965 a 2001 demostró que el cisplatino era el fármaco más activo contra MPM. Hoy, es el único agente aprobado por la FDA para tratar el mesotelioma es pemetrexed combinado con cisplatino.
La población del estudio aquí presentado evolucionó de manera muy similar a lo informado en la bibliografía mundial respecto del tratamiento con el esquema de pemetrexed más cisplatino.15
Correspondencia:
Dra. Marcela Martínez-Prieto.
Gerente de Investigación Clínica, Eli Lilly y Cía. Sur 132 No. 108 con 605. Las Américas. C.P. 01120. Álvaro Obregón. México, D.F. Teléfono: 2614 5118.
Correo electrónico:marcelamtzp@hotmail.com