El cáncer de endometrio es la segunda neoplasia ginecológica más frecuente en el ámbito mundial. Su incidencia es 6 veces mayor en países desarrollados. Es la segunda causa de consulta en el servicio de Ginecología Oncológica del CMN Siglo XXI.
ObjetivoReportar resultados de la casuística del cáncer endometrial tratado mediante laparoscopía en el Hospital de Oncología del CMN Siglo XXI.
Material y métodosEntre 2002 y 2012 se registraron 105 casos diagnosticados con cáncer de endometrio y abordados por vía laparoscópica para estadificación.
ResultadosLa media de edad fue de 59 años; el tiempo quirúgico, 203 minutos en promedio; sangrado, 209ml; estancia hospitalaria: 2.8 días como media. Se resecó una mediana total de 11 ganglios en la linfadenectomía pélvica y 3 ganglios para muestreo paraaórtico. Seis casos exhibieron conversión. Se reportaron 7 casos con complicaciones.
DiscusiónLa etapa de la enfermedad es la variable predictiva más significativa. Se sabe que varios factores se relacionan con el pronóstico en pacientes con enfermedad en etapas similares, entre ellos la edad, el tipo histológico y el grado, invasión miometrial, invasión del espacio vascular, tamaño del tumor, citología peritoneal, receptores hormonales, ploidía del ADN y tipo de tratamiento.
ConclusionesEl tratamiento del cáncer de endometrio mediante abordaje laparoscópico en el Hospital de Oncología del CMN Siglo XXI ofrece índices más bajos de morbilidad y una recuperación más rápida. Independientemente de la vía de abordaje, el pronóstico depende de las características histológicas y la etapa de la enfermedad de cada paciente.
Endometrial cancer is the second most common gynecological neoplasm worldwide. Its incidence is six times higher in developed countries. It is the second reason for consultation at the CMN Siglo XXI Gynecologic Oncology Service.
ObjectiveTo report cases of patients with endometrial cancer treated using laparoscopy at the CMN Siglo XXI Oncology Hospital.
Material and MethodsFrom 2002 to 2012, 105 endometrial cancer-diagnosed cases were collected and staged using the laparoscopic approach.
ResultsMean age was 59 years; the mean surgical time was 203minutes; blood loss: 209ml; hospital length of stay: a mean of 2.8 days. The mean of total resected lymph nodes using pelvic lymphadenectomy was 11, with 3 nodes for para-aortic sampling. Six cases showed conversion. Seven cases were reported as having complications.
DiscussionStage of the disease is the most significant predictor. Many other factors are known to be related to the prognosis among patients with disease at the same stage, including age, histological type and grade, myometrium invasion, vascular space invasion, size of tumor, peritoneal cytology, hormone receptors, DNA ploidy, and type of treatment.
ConclusionsThe treatment of endometrial cancer using the laparoscopic approach at the CMN Siglo XXI Oncology Hospital offers less morbidity and faster recovery. Regardless of the approach, the prognosis depends on histological features and stage of the disease of each patient.
El cáncer de endometrio es la segunda neoplasia ginecológica más frecuente en el ámbito mundial. Su incidencia es 6 veces mayor en los países desarrollados que en las naciones en desarrollo, aunque su mortalidad es más baja en los países menos desarrollados1. En los Estados Unidos es el cáncer ginecológico más frecuente, con un estimado de 40,100 casos diagnosticados y 7,740 muertes en 20082,3. En México se ubica en el sexto lugar por frecuencia4,5. Su incidencia es más común después de la sexta década de vida: se estima que el 75% de los casos ocurre en personas mayores de 50 años, hasta un 95% en mayores de 40 años, y es muy raro en menores de 30 años. Es una enfermedad que predomina en mujeres opulentas, obesas, posmenopáusicas y con bajos índices de paridad6.
La mayoría de los adenocarcinomas endometriales son de tipo endometrioide (90%). Un subtipo distinto de carcinoma endometrioide es el carcinoma velloglandular, que es de bajo grado y excelente pronóstico. Aproximadamente el 10% de los carcinomas endometriales corresponden a carcinomas serosos papilares de células claras, indiferenciados, mixtos, epidermoides y neuroendocrinos. Estas variantes histológicas se consideran de alto grado y de riesgo de re-currencia7–9. En 1989, el Comité de Oncología Ginecológica de la Federación Internacional de Ginecología y Obstericia (FIGO) introdujo un sistema de estadificación quirúrgica. Dicho sistema de estadificación fue objeto de modificaciones, la última de ellas en 2009, en la cual se eliminó el estadio IC, se unificó el estadio II, se dividió el estadio clínico (EC) IIIC en IIIC1 y IIIC2 y se estableció la independencia de la citología peritoneal con respecto al estadio clínico6,10,11. Dado que los factores pronósticos más importantes en esta neoplasia son la invasión del miometrio y la afección ganglionar, se requiere de una cirugía adecuada para poder definirlos12. En el caso del EC II (afección del estroma cervicouterino), en el abordaje quirúrgico inicial debe realizarse una histerectomía radical tipo III de Piver-Rutledge, la cual consiste en histerectomía+salpingo-ooforectomía bilateral, extirpando el tejido parametrial adicional hasta la pared pélvica con sección de la arteria uterina en su emergencia, así como preservación de la arteria vesical superior, con disección ganglionar pélvica bilateral y paraaórtica en forma sistemática1,13. Se debe decidir si la paciente presenta enfermedad operable o no: si es candidata a cirugía, habrá que considerar la vía de abordaje dependiendo de las características propias de la paciente y de la institución donde se efectúa el procedimiento, así como de la experiencia y las preferencias del cirujano involucrado. La cirugía solo debe obviarse en casos muy seleccionados de pacientes con un estado funcional muy deteriorado o en caso de comorbilidades que la impidan14–16. No se recomienda realizar en forma rutinaria la epiplectomía en pacientes con histología endometrioide, independientemente del grado histológico o de la presencia de invasión miometrial. En la toma de decisión puede ser útil la palpación previa del epiplón. La frecuencia de metástasis a este nivel es solo de entre el 3 y el 8.3%17,18.
Si bien el abordaje tradicional para la estadificación y tratamiento del cáncer endometrial es la cirugía abierta, el avance del instrumental y las técnicas de la cirugía laparoscópica han permitido su introducción en el manejo de dicha patología19. La introducción de la laparoscopía como opción terapéutica para mujeres con cáncer endometrial comenzó a principios de los noventa y se generaron múltiples reportes de histerectomía vaginal asistida por laparoscopía y linfadenectomía mostrando que este abordaje permitía una recuperación más acelerada en comparación con la laparotomía20–22.
Tozzi et al. reportaron que las complicaciones posoperatorias tempranas y tardías eran más frecuentes en las pacientes sometidas a laparotomía en comparación con aquellas sometidas a laparoscopía. En el análisis univariante identificaron como factores predictivos de complicaciones posoperatorias la obesidad, afecciones médicas de comorbilidad, la edad avanzada y el abordaje quirúrgico (laparoscopía versus laparotomía). En el análisis multivariante, el abordaje con laparotomía fue la única variable predictiva de complicaciones posoperatorias. Finalmente, no se encontraron diferencias significativas en la supervivencia global ni en la supervivencia libre de enfermedad23–25. Nezhat et al. compararon la histerectomía laparoscópica total más linfadenectomía con la histerectomía abierta en 67 y 127 mujeres con cáncer endometrial en estadio I y II, respectivamente. A 2 y a 5 años de seguimiento, la supervivencia libre de recurrencia fue del 93 vs. 91.7% y del 88.5 vs. 85%, respectivamente, con laparoscopía versus laparotomía, en tanto que la supervivencia global a 2 y a 5 años fue del 100 vs. 99.2% y del 100 vs. 97%, respectivamente26. Recientemente, el Grupo Oncológico Ginecológico publicó los resultados de un estudio prospectivo (LAP2) diseñado con el objeto de demostrar la ausencia de inferioridad de la laparoscopía frente a la laparotomía en términos de recurrencia en pacientes en etapas clínicas I y IIA. Dicha investigación dio inicio en 1996, se cerró en 2005 y la mayor parte de las conversiones ocurrieron en los primeros años27–29. En México, el Hospital de Oncología del Centro Médico Nacional (CMN) Siglo XXI es pionero en el tratamiento laparoscópico de neoplasias malignas ginecológicas; sin embargo, son pocos los documentos publicados acerca de esta experiencia y de ahí la importancia de exponer los resultados obtenidos.
2Material y métodosEl presente estudio consta de una serie de casos en los cuales el diagnóstico de cáncer de endometrio se estableció desde los hospitales o unidades oncológicas de envío, en la mayoría de ellos mediante biopsia de endometrio. El diagnóstico se corroboró solicitando una revisión de laminillas o efectuando una nueva biopsia de conformidad con los hallazgos, como parte del protocolo para todas las pacientes de nuevo ingreso en el Hospital de Oncología del CMN Siglo XXI. En un período de 10 años que abarcó de 2002 a 2012, se trató a un total de 105 pacientes que eran atendidas en el servicio de Ginecología Oncológica del CMN Siglo XXI. Todas las pacientes habían sido diagnosticadas con cáncer de endometrio confirmado histológicamente y con enfermedad limitada al útero por clínica e imagen. Por medio del abordaje laparoscópico, se efectuaron los siguientes procedimientos: lavado peritoneal, linfadenectomía pelvica bilateral, muestreo ganglionar paraaórtico, histerectomía total (PIVER I) y salpingooforectomía bilateral; solo en algunas se realizó una epiplectomía infracólica. Las piezas quirúrgicas fueron examinadas por patólogos del Hospital de Oncología del CMN Siglo XXI. Para el análisis estadístico, se utilizaron únicamente porcentajes y pruebas descriptivas con medias y medianas. En todas las pacientes con enfermedades crónico-degenerativas o con alguna otra patología de importancia y en aquellas mayores de 50 años se solicitó una valoración preoperatoria por medicina interna para la corrección de la patología asociada y asignación del riesgo quirúrgico.
Todos los procedimientos quirúrgicos fueron efectuados por cirujanos oncólogos adscritos al servicio de Ginecología Oncológica. El equipo utilizado incluyó una lente de 30° de 3 chips, 2 monitores planos de vídeo, movilizador uterino Clermont Ferrand y un insuflador de alto flujo con dióxido de carbono. La laparoroscopia se inició con la paciente en posición de litotomía para posteriormente agregar Trende-lemburg. Mediante la introducción de CO2, se logró un neumoperitoneo hasta de 14mm de Hg en promedio, utilizando una aguja de Veress o trócar umbilical de 10mm y posteriormente, mediante visión directa, los demás trócares. A continuación se realizó el lavado peritoneal con 150 cc de solución fisiológica en abdomen y pelvis. Posteriormente, se procedió al muestreo paraaórtico y, subsecuentemente, a la linfadenectomía pelvica bilateral, seguida por la salpingooforectomía bilateral (el tejido se extrajo con ayuda de una endobolsa). Después, se procedió a la histerectomía total PIVER I. Todos estos procedimientos se llevaron a cabo con el auxilio de energía monopolar, bipolar y plasmacinética. La pieza quirúrgica se extrajo por la vía vaginal y se cerró la cúpula con sutura Vicryl del #1 en la mayoría de los casos, con puntos separados. Finalmente, una vez retirado todo el equipo, se colocaron puntos de afrontamiento en la aponeurosis con Vicryl del #1 y en la piel con dermalón del 2/0 o 3/0. Para cuantificar el sangrado, el servicio de Anestesiología restó la cantidad irrigada durante la cirugía a lo recolectado en el dispositivo de aspiración; para determinar el tiempo quirúrgico, se inició la contabilización desde la primera incisión hasta el último cierre en piel. A todas las pacientes se les dejó una sonda de Foley por 24h, salvo en caso de alguna complicación. El día posterior a la cirugía se indicó dieta y deambulación y se egresó a la mayoría de las pacientes. En el seguimiento se revisó a la mayoría de las pacientes mediante consulta externa a una semana de la cirugía para retiro de puntos y a 3 semanas de la intervención con el reporte histopatológico para completar la estadificación y determinar la necesidad de adyuvancia o iniciar el período de vigilancia por el servicio de Ginecología Oncológica y algún otro servicio involucrado. En el caso de las pacientes que permanecieron bajo vigilancia, el control por consulta externa se llevó a cabo cada 3 meses durante el primer año, cada 4 meses durante el segundo año y cada 6 meses a partir del tercer año, solicitando además marcador tumoral (CA 125) y, en caso necesario, citología vaginal o algún estudio de imagen (radiografía de tórax o ultrasonido abdominopélvico). Solo se llevó a cabo en los casos en que existió la sospecha de recurrencia y ameritaban algún estudio diferente a los anteriores o fue posible la toma de biopsia. Debido a que en esta serie de casos los primeros reportes datan del año 2002, algunas pacientes ya fueron egresadas y contrarreferidas al cumplir 5 años de seguimiento sin evidencia clínica, radiológica ni bioquímica de la enfermedad, como parte de la política del servicio de Ginecología Oncológica del CMN Siglo XXI. En el resto de las pacientes, por el año en que se realizaron las últimas cirugías de esta serie, el seguimiento mínimo documentado a la fecha es de 18 meses según la última revisión de los expedientes clínicos, con citas subsecuentes dependiendo de la evolución.
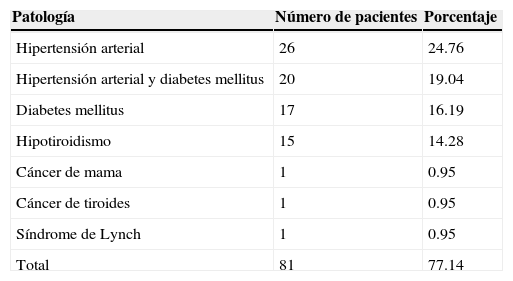
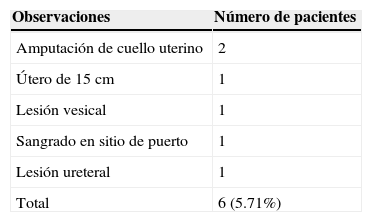
3ResultadosEl promedio de edad en la serie de los 105 casos fue de 59.6 años, con un rango que comprende entre los 40 y los 78 años. En cuanto a enfermedades concomitantes, se encontró que 81 pacientes (77.14%) presentaban alguna, de las cuales la más frecuente fue hipertension arterial en 26 pacientes (24.76%), seguida por esta misma enfermedad pero asociada a diabetes mellitus en 20 pacientes (19.04%); en tercer lugar se ubicó la diabetes mellitus aislada con 17 pacientes (16.19%) y, finalmente, se encontró hipotiroidismo en 15 pacientes (14.28%). En la tabla 1 se aprecian con detalle todas las comorbilidades encontradas. En total, únicamente 6 pacientes (5.71%) presentaron conversión, como se ilustra en la tabla 2. Los 2 primeros casos se debieron a la amputación del cuello uterino durante la disección, lo cual impidió la manipulación del cuerpo uterino para su extracción. Un tercer caso presentaba un útero de 15cm, lo cual impidió la extracción por la vía vaginal. En el cuarto y el quinto caso, la conversión obedeció a la presencia de lesión vesical y ureteral, de manera respectiva. Finalmente, el sexto caso se debió a un sangrado en el sitio de inserción de un puerto que se documentó 6h tras la conclusión de la cirugía inicial.
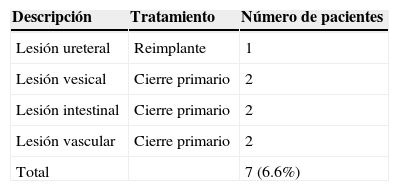
En 7 casos (6.66%) documentaron complicaciones (tabla 3). Una paciente presentó una lesión ureteral derecha que se documentó 72h tras la cirugía con una prueba de fenazopiridina en drenaje cerrado; posteriormente, se sometió a reimplante ureteral. Se registraron 2 pacientes con lesiones vesicales tratadas con cierre primario, 2 pacientes más con lesión mínima en la serosa del colon y 2 pacientes con lesión en la arteria ilíaca derecha y vena ilíaca izquierda, respectivamente, las cuales se repararon sin contratiempos.
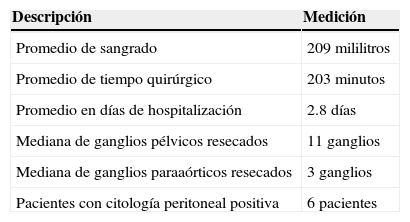
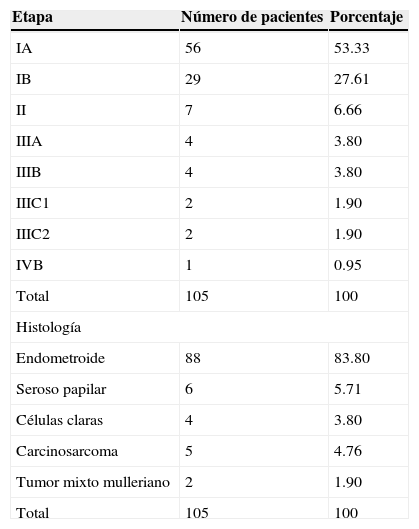
Se reportaron otras variables quirúrgicas (tabla 4), como el volumen del sangrado, del cual se encontró que la media fue de 209ml con un rango de 20 a 600ml. Por lo que respecta al tiempo quirúrgico, el promedio fue de 203 minutos con un rango de 130 a 280 minutos. El número de días de hospitalización que se reportó fue de una media de 2.8 con un mínimo de 2 y un máximo de 6 días. En el rubro de ganglios pélvicos resecados, la mediana fue de 11, con un mínimo de 4 y un máximo de 30. La mediana del muestreo paraaórtico fue de 3 ganglios, con un mínimo de 1 y un máximo de 6 ganglios. En cuanto a la citología peritoneal positiva, solo se reportó en 6 pacientes (8.33%). Conforme a la estadificación de FIGO de 2009, se encontró a 85 (80.95%) pacientes en etapa I, de las cuales 56 se clasificaron como IA y 29 como IB. Únicamente 7 pacientes (6.66%) se clasificaron como etapa II, de modo que, tomadas en su conjunto, suman un total de 92 pacientes (87.61%) en etapa temprana. Cuatro pacientes (3.8%) fueron clasificadas en etapa IIIA, 4 (3.8%) en etapa IIIB, 2 (1.9%) en etapa IIIC1, 2 (1.9%) en etapa IIIC2 y 1 paciente (0.95%) en etapa IVA por actividad tumoral en la mucosa vesical. Por lo que respecta al tipo histológico, 88 pacientes (83.8%) correspondieron a la variedad endometroide, como se observa en la tabla 5. Se registraron 4 reportes (3.8%) de células claras, 6 (5.71%) de histología serosa papilar, 5 carcinosarcomas (4.76%) y 2 reportes de tumor mixto mulleriano (1.9%).
Datos quirúrgicos
| Descripción | Medición |
|---|---|
| Promedio de sangrado | 209 mililitros |
| Promedio de tiempo quirúrgico | 203 minutos |
| Promedio en días de hospitalización | 2.8 días |
| Mediana de ganglios pélvicos resecados | 11 ganglios |
| Mediana de ganglios paraaórticos resecados | 3 ganglios |
| Pacientes con citología peritoneal positiva | 6 pacientes |
Estadificación (FIGO 2009) e histología
| Etapa | Número de pacientes | Porcentaje |
|---|---|---|
| IA | 56 | 53.33 |
| IB | 29 | 27.61 |
| II | 7 | 6.66 |
| IIIA | 4 | 3.80 |
| IIIB | 4 | 3.80 |
| IIIC1 | 2 | 1.90 |
| IIIC2 | 2 | 1.90 |
| IVB | 1 | 0.95 |
| Total | 105 | 100 |
| Histología | ||
| Endometroide | 88 | 83.80 |
| Seroso papilar | 6 | 5.71 |
| Células claras | 4 | 3.80 |
| Carcinosarcoma | 5 | 4.76 |
| Tumor mixto mulleriano | 2 | 1.90 |
| Total | 105 | 100 |
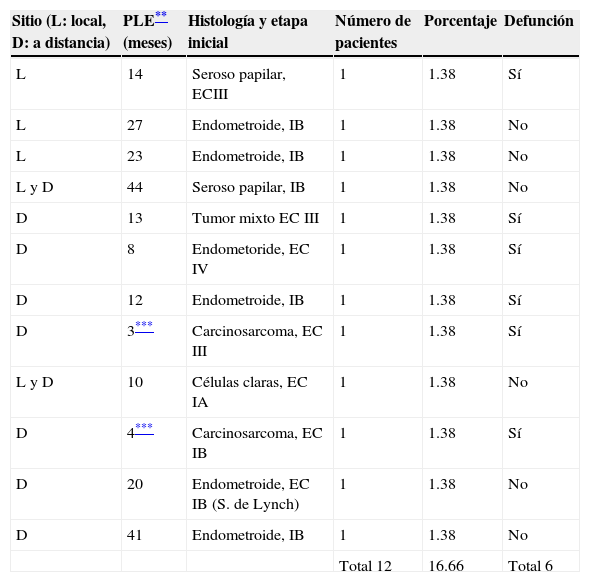
Como se muestra en la tabla 6, en el seguimiento en la consulta externa se encontraron 10 pacientes con recurrencia y 2 con persistencia de la enfermedad. Dentro de las recurrencias, 3 presentaban enfermedad avanzada desde el principio (etapas III y IV e histología desfavorable) y 7 correspondían a etapa I, de las cuales 5 presentaban etapa IB sin factores de mal pronóstico y 2 (IA, IB), histologías desfavorables. Cabe mencionar que los casos en que se determinó recurrencia o persistencia correspondieron a pacientes observadas únicamente entre los años 2007 a 2012 y dieron cuenta de un total de 72 de los 105 casos. Se desconoce el estado actual del resto de las pacientes debido a que fueron egresadas al cumplir su período de seguimiento.
Recurrencias*
| Sitio (L: local, D: a distancia) | PLE** (meses) | Histología y etapa inicial | Número de pacientes | Porcentaje | Defunción |
|---|---|---|---|---|---|
| L | 14 | Seroso papilar, ECIII | 1 | 1.38 | Sí |
| L | 27 | Endometroide, IB | 1 | 1.38 | No |
| L | 23 | Endometroide, IB | 1 | 1.38 | No |
| L y D | 44 | Seroso papilar, IB | 1 | 1.38 | No |
| D | 13 | Tumor mixto EC III | 1 | 1.38 | Sí |
| D | 8 | Endometoride, EC IV | 1 | 1.38 | Sí |
| D | 12 | Endometroide, IB | 1 | 1.38 | Sí |
| D | 3*** | Carcinosarcoma, EC III | 1 | 1.38 | Sí |
| L y D | 10 | Células claras, EC IA | 1 | 1.38 | No |
| D | 4*** | Carcinosarcoma, EC IB | 1 | 1.38 | Sí |
| D | 20 | Endometroide, EC IB (S. de Lynch) | 1 | 1.38 | No |
| D | 41 | Endometroide, IB | 1 | 1.38 | No |
| Total 12 | 16.66 | Total 6 |
Con base en lo anterior, las recurrencias documentadas con etapas incipientes inicialmente (7 casos) corresponderían al 11.4% de un total de 72 pacientes. Las 2 pacientes con persistencia de la enfermedad presentaron histologías de carcinosarcoma en etapas I y III, respectivamente; en ambos casos se documentó la defunción en menos de 8 meses. Las 3 pacientes con recurrencia que inicialmente se encontraban en etapa avanzada fallecieron con un período libre de enfermedad de entre 8 y 14 meses. Dentro de las recurrencias en etapa temprana, solo una paciente falleció con un período libre de enfermedad de 12 meses.
Como se comentó anteriormente, por la fecha de la cirugía, muchas de las pacientes siguen en vigilancia y algunas han sido egresadas para control en su hospital o módulo oncológico local.
4DiscusiónComo se mencionó previamente, varios estudios han reportado resultados favorables a la cirugía laparoscópica con respecto a la herida quirúrgica y la estadificación del cáncer de endometrio, y no se han encontrado diferencias en cuanto a la evolución de la enfermedad, puesto que los factores pronósticos conocidos no guardan ninguna relación con la vía de abordaje en la mayoría de los casos30,31. Si bien la etapa de la enfermedad es la variable predictiva más significativa, se sabe que varios factores se relacionan con el pronóstico en las pacientes con enfermedad en la misma etapa. Dichas variables incluyen la edad, el tipo histológico, el grado histológico, invasión miometrial, invasión del espacio vascular, el tamaño del tumor, citología peritoneal, el estado de los receptores hormonales, ploidía del ADN y el tipo de tratamiento. Lo anterior se refleja fielmente al -analizar a la mayoría de las pacientes que presentaron re-currencia de la enfermedad en esta serie de casos. La presencia de factores de mal pronóstico en muchas de ellas, principalmente la etapa y la histología, determinó la evolución en cada caso e incluso llegó a condicionar el fallecimiento. En el caso de las pacientes en quienes se encontró persistencia de la enfermedad, la evolución de la patología con sus factores pronósticos asociados también determinó el desenlace fatal o muerte.
Por otra parte, llama la atención el hecho de que casi la mitad de las pacientes que presentaron recurrencia correspondían a etapa I con histología favorable (endometroide), todas clasificadas específicamente como EC IB en la nueva clasificación de FIGO; pero si se emplearan los criterios de la clasificación anterior, habrían correspondido a una etapa IC, lo cual muy probablemente les habría conferido un factor de riesgo adicional y seguramente habría implicado un manejo adyuvante inherente, lo cual en etapas inferiores no se contempla. De ahí que habría que reconsiderar qué tan útil o relativa puede estar resultando esta nueva clasificación del cáncer de endometrio, específicamente por las modificaciones efectuadas a la etapa I. Por lo que respecta a la realización de la linfadenectomía pélvica y paraaórtica, esto ha sido tema de discusión, como también lo ha sido el número de ganglios que deben extirparse, mismo que ha variado en número de 10 a 18 o de 14 a 2032–34. La realización de la linfadenectomía conlleva tiempos quirúrgicos y de hospitalización más prolongados en algunas ocasiones, aunque no existe un incremento en la cantidad y la severidad de las complicaciones. Es recomendada por diferentes guías de diagnóstico y tratamiento del cáncer endometrial, entre ellas las de Federación Internacional de Ginecología y Obstetricia (FIGO, en inglés International Federation of Gynecology and Obstetrics), la Sociedad de Oncología Ginecológica (SGO, en inglés Society of Gynecologic Oncology), la Red Nacional Integral del Cáncer (NCCN, en inglés National Comprehensive Cancer Network) y el Colegio Americano de Obstetras y Ginecólogos (ACOG, en inglés American College of Obstetricians and Gynecologists), excepto en pacientes con histología endometrioide, grado 1 y 2, invasión miometrial inferior al 50% y ausencia de evidencia de enfermedad extrauterina1,35–38. Kohler et al. describieron su experiencia con 650 pacientes sometidas a linfadenectomía laparoscópica transperitoneal para el tratamiento de neoplasias malignas ginecológicas. Incluso estos cirujanos con grandes volúmenes quirúrgicos y experiencia reportaron que el número de ganglios obtenidos disminuye a medida que el índice de masa corporal aumenta39–42. Lo anterior cobra mayor importancia si se considera el hecho de que una proporción considerable de las pacientes con cáncer de endometrio presenta obesidad de grados diversos. Dowdy et al. efectuaron procedimientos de linfadenectomía extraperitoneal en pacientes con cáncer endometrial y reportaron que les fue posible extraer incluso más ganglios por laparoscopia que por laparotomía en mujeres con índice de masa corporal ≥ 35kg/m2 (21.6 vs. 17.8)34,43. Ante estas discrepancias, y al contar con estudios que apoyan con evidencia y resultados confiables evitar la linfadenectomía en etapas tempranas, la obtención de un menor número de ganglios por la vía laparoscópica, en especial en la linfadenectomía paraaórtica por las dificultades técnicas que representa, parece carecer de trascendencia y bastaría con efectuar exclusivamente un muestreo ganglionar. Las nuevas técnicas quirúrgicas emergentes, como es el caso de la cirugía robótica, en la cual la laparoscopia sigue siendo la piedra angular, al ser comparadas con la cirugía abierta o con la cirugía laparoscópica convencional, muestran resultados similares en cuanto a la evolución natural de la enfermedad, pero con las ventajas de un riesgo más bajo de infecciones, precisión de movimientos al eliminar el temblor propio del cirujano y accesibilidad virtual en diferentes áreas geográficas para pacientes y cirujanos, agregando un factor o recurso más con que contar en los centros oncológicos44,45. En países del primer mundo esto ya es una realidad y, si bien en nuestro medio aún está en sus inicios el equipamiento y capacitación de los cirujanos, seguramente pasarán a formar parte de los recursos de los principales centros de atención médica para padecimientos oncológicos y no oncológicos en un futuro no muy lejano.
5ConclusionesLa serie presentada de pacientes con cáncer de endometrio atendidas en el Hospital de Oncología del Centro Médico Nacional Siglo XXI confirma los hallazgos de estudios previos, demostrando que el abordaje laparoscópico puede ser considerado efectivo y seguro. Dicha técnica ofrece índices más bajos de morbilidad y una recuperación más acelerada en comparación con el abordaje abierto, aunque también presenta las complicaciones inherentes a este tipo de procedimientos. Dejando a un lado el tiempo quirúrgico, el sangrado transoperatorio y las complicaciones posoperatorias son menores. En cuanto a la linfadenectomía pélvica, la cosecha de ganglios puede llegar a ser incluso mucho mayor; sin embargo, en comparación con el muestreo paraaórtico o la linfadenectomía paraaórtica, el hecho de que represente mayores dificultades técnicas se ve reflejado en un menor número de ganglios resecados, aunque todo esto también estará relacionado con las habilidades del cirujano y la correspondiente curva de aprendizaje. En consecuencia, se estaría dejando a las características histológicas y la etapa de la enfermedad de cada paciente, que son a lo que en realidad obedece la evolución en sí, como factores predictivos independientes de la vía de abordaje. Los resultados del tratamiento y la estadificación laparoscópica mejoran con la experiencia y se ha encontrado que tras una curva de aprendizaje de 9 pacientes se observa una mejora importante, especialmente en cuanto al tiempo quirúrgico. Finalmente, con el advenimiento de la cirugía robótica, el uso de la laparoscopia debe incrementarse progresivamente en todos los centros oncológicos, al grado que se le considere como primera opción de tratamiento quirúrgico al menos en el cáncer ginecológico, específicamente en cuello uterino y endometrio.