El cansancio es uno de los síntomas más frecuentes y contribuye al deterioro de la calidad de vida en el paciente oncológico; en la actualidad no se cuenta con ningún tratamiento de referencia. Nuestro objetivo consistió en investigar la eficacia de un tratamiento multimodal (basado en estrategias no farmacológicas más uso de dexametasona) frente a un tratamiento farmacológico (terapia unimodal) en el tratamiento del cansancio oncológico en el entorno de enfermedad avanzada, planteando como hipótesis alterna que es más beneficioso el uso de una terapia multimodal que unimodal.
Material y métodoSe realizó un estudio prospectivo y doble ciego, con asignación aleatoria 1:1 de 150 pacientes de entre 20 y 80 años de edad con neoplasias avanzadas a un tratamiento multimodal (brazo A) versus terapia unimodal (brazo B). Al mes de tratamiento se evaluaron síntomas de ansiedad y/o depresión, la calidad del sueño y la calidad de vida. Se estableció un nivel de significancia alfa de 0.05 y se utilizó la prueba estadística de la χ2.
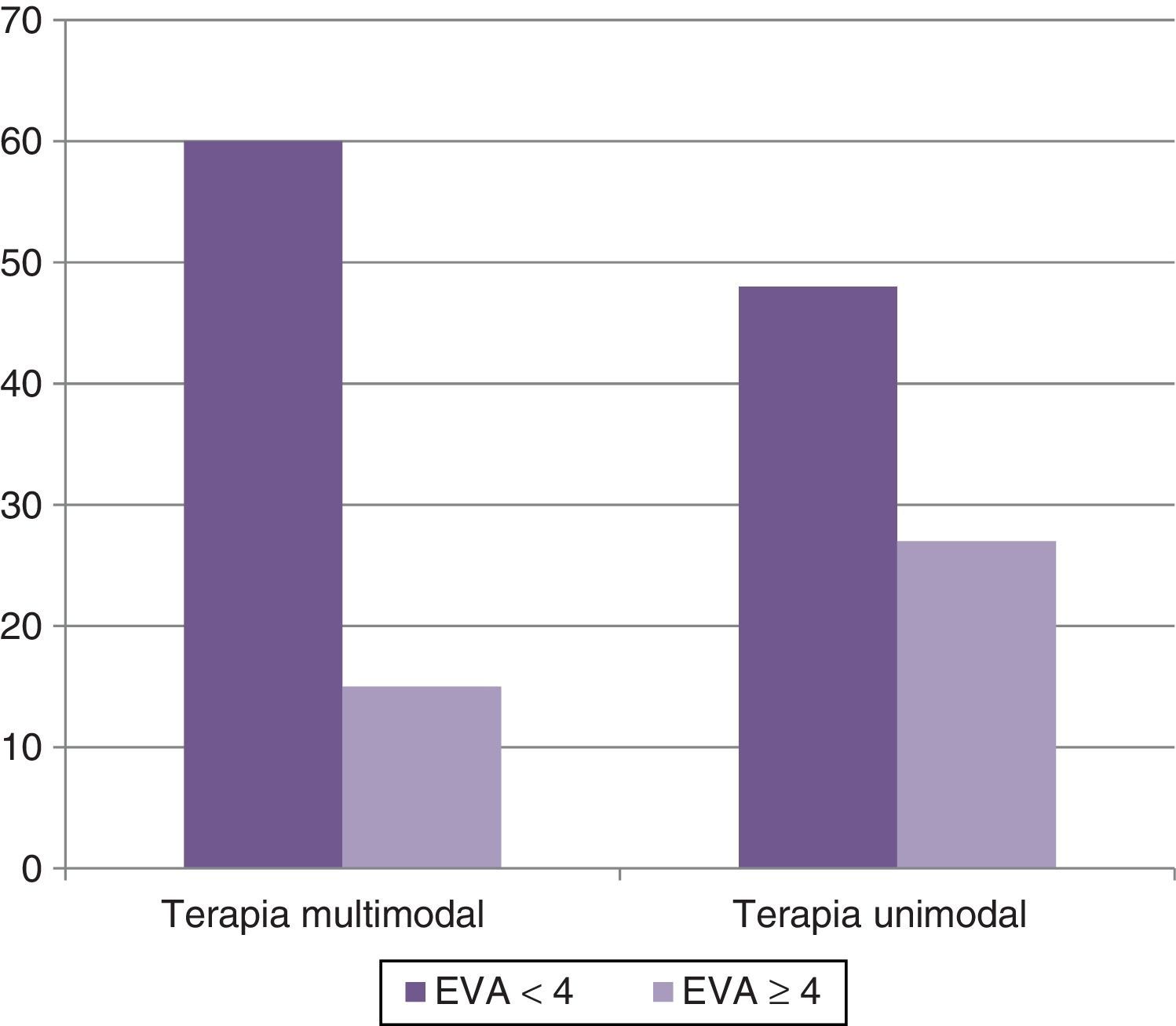
ResultadosLa terapia multimodal mostró una mejoría en la fatiga del 64% al 80% (EVA de menos de 4 a un mes de tratamiento) en relación con la terapia unimodal (p<0.05). Además, se registró un beneficio estadísticamente significativo en los síntomas de ansiedad y depresión, en la calidad del sueño y en la calidad de vida.
DiscusiónEste estudio muestra un avance significativo en el manejo de este síntoma en el entorno de cuidados paliativos.
ConclusiónSe acepta la hipótesis alterna, concluyéndose el beneficio de un plan de tratamiento integral (farmacológico y no farmacológico) sobre un plan terapéutico exclusivamente farmacológico (dexametasona).
Tiredness is one of the most frequent symptoms, and it deteriorates quality of life, in the oncology patient. Currently, there is no standard treatment available. Our aim was to investigate the efficacy of a combined therapy (based on non-pharmacological strategies plus the use of dexamethasone) versus pharmacological treatment alone (single therapy) in cancer-related fatigue, proposing as alternative hypothesis that the use of combined therapy is more beneficial than single therapy.
Material and methodProspective, double blind study with a1:1 randomization of 150 patients with advanced cancer aged between 20 and 80 years to combined treatment (arm A) versus single treatment (arm B). Psychological symptoms of anxiety and/or depression and quality of life were assessed at 1 month of treatment. The alpha level of significance was established at 0.05 and the chi-squared test was used.
ResultsCombined therapy showed an improvement in fatigue (VAS lower than 4 at 1 month of treatment) with regard to single therapy from 64% to 80%; P<.05. In addition, there was a statistically significant improvement in the symptoms of anxiety and depression, in the quality of sleep, and in quality of life.
DiscussionThis study shows a significant advance in the management of this symptom in the palliative care setting.
ConclusionThe alternative hypothesis is accepted, thus concluding the benefit of a comprehensive treatment plan (pharmacological and non-pharmacological) over an exclusively pharmacological (dexamethasone) plan.
El cansancio oncológico ha sido definido por la Red Nacional Integral del Cáncer (NCCN – National Comprehensive Cancer Network) como un sentimiento subjetivo y persistente de fatiga relacionada con el cáncer o su tratamiento, la cual interfiere con la función habitual1. Se mantiene tras un periodo de descanso o sueño, presenta una magnitud y persistencia superior al cansancio normal, es más lesivo para las actividades cotidianas y exhibe un componente afectivo más negativo2. La Clasificación Internacional de Enfermedades en su décima revisión lo definió operacionalmente en J Clin Oncol 20013.
Es el síntoma no tratado más prevalente que se describe en la oncología, con una frecuencia de entre el 70 y el 100% de los pacientes en tratamiento oncológico4, del 17 al 40% en los pacientes que han completado el tratamiento5 y en más del 75% de los pacientes con enfermedad avanzada6.
De etiología compleja y multifactorial, la fatiga puede deberse a la propia neoplasia maligna, al tratamiento oncológico recibido y/o a la anemia asociada a este tipo de enfermedades y su tratamiento. Los factores fisiológicos que contribuyen a la fatiga oncológica son la caquexia, la pérdida de condición física, la anemia y el estado proinflamatorio neoplásico determinado por la concentración elevada de citocinas como la interleucina 1, la interleucina 6 y el factor de necrosis tumoral alfa7. Los factores psicosociales que contribuyen son la ansiedad, la depresión y el insomnio. También se asocia a la sintomatología dolorosa8.
En la actualidad no existe ningún tratamiento farmacológico de referencia. En estudios controlados, los psicoestimulantes no han demostrado ningún beneficio sobre placebo9. Tampoco han mostrado efectividad sobre placebo los inhibidores de colinestarasa de acción central10.
La primera evidencia de beneficio farmacológico en la fatiga oncológica se presentó en la reunión anual de la ASCO en 2012, con el reporte de un pequeño estudio que asignó en forma aleatoria a 84 pacientes con cáncer avanzado a dexametasona frente a placebo. El brazo experimental mostró mejoría del cansancio oncológico (p=0.008) y de la calidad de vida (p=0.03), sin diferencias en la incidencia de síntomas psicológicos (p=0.76) ni en la frecuencia de efectos adversos (p=0.14)11.
Pero en lo que se refiere al tratamiento no farmacológico, ¿qué dicen los estudios más recientes?
- 1)
Medidas dietéticas: la L-carnitina no mostró ningún beneficio frente al placebo12. En cambio, sí se registraron efectos positivos con el ginseng de Wisconsin en comparación con el placebo13.
- 2)
Ejercicio: Varios análisis sustentan los efectos benéficos del ejercicio sobre el cansancio oncológico, observándose en un ensayo aleatorizado una reducción del 35% en el cansancio y una mejoría del 30% en la vitalidad14. Sin embargo, algunos de estos estudios mostraron debilidades metodológicas como sesgo de selección y muestra no representativa, poca constancia en la práctica de ejercicio, evaluaciones poco homogéneas de las variables a investigar y de los criterios de valoración, así como ausencia de un grupo de control adecuado.
No obstante, dentro de los estudios de mejor calidad destaca un ensayo en sobrevivientes de cáncer de mama (n=545), donde el aumento de actividad física recreativa de moderada a vigorosa se relacionó con menos cansancio y dolor, así como con un mejor funcionamiento físico15.
- 3)
Conservación de la energía: Intervención que utiliza el control planificado de los recursos de energía de cada paciente para prevenir su agotamiento. Existe poca literatura al respecto; sin embargo, destaca un estudio aleatorizado con 396 pacientes tratados con quimioterapia, radioterapia o ambas en el cual se compararon actividades centradas en la conservación de energía frente a un grupo de control que recibió un manejo enfocado en la nutrición. En el grupo experimental disminuyeron considerablemente los síntomas de fatiga (p=0.01)16.
- 4)
Manejo del estrés: Las intervenciones psicosociales destinadas a reducir el estrés disminuyen el cansancio. Las intervenciones basadas en grupos de apoyo17, orientación individual18 y entrenamiento contra el estrés19 mejoraron la fatiga oncológica. Se trata de estudios aleatorizados y controlados, con un tamaño de muestra adecuado y que consideraron varias poblaciones oncológicas; sin embargo, se les critica por el hecho de que la fatiga fue un criterio de valoración secundario.
En vista de que la evidencia disponible no es concluyente, la presente investigación tiene como objetivo investigar los resultados de un tratamiento que combine terapias farmacológicas y no farmacológicas frente a una terapia únicamente farmacológica sobre la fatiga oncológica en el entorno de enfermedad avanzada, para lo cual se plantea como hipótesis alternativa un mayor beneficio de una terapia multimodal (farmacológica y no farmacológica) sobre el cansancio oncológico frente a un tratamiento exclusivamente unimodal (farmacológico con dexametasona).
Material y métodoEntre los años 2012 y 2014, en la V Región de Chile, fueron reclutados 150 pacientes con cáncer avanzado bajo tratamiento paliativo con fatiga de 4 puntos ó más sobre 10 conforme al Inventario Breve de Fatiga (una escala visual analógica [EVA] aplicada al cansancio oncológico)20 y al menos otros 2 síntomas relacionados (depresión, ansiedad y/o insomnio).
Los criterios de inclusión fueron un estado funcional ECOG21 inferior o igual a 3, función cognitiva normal evaluada mediante el Mini-Examen Cognoscitivo22, hemoglobina de más de 9g/dl, perfil tiroideo dentro de rangos normales y dolor crónico controlado de menos de 4 evaluado con una EVA.
Los criterios de exclusión incluyeron las infecciones concomitantes (se consideró la evaluación clínica, y si se encontró necesario, de laboratorio), dolor oncológico irruptivo, enfermedad neoplásica encefálica (se consideró evaluación clínica, y de encontrarse alguna sintomatología de focalización neurológica, confirmación por resonancia magnética nuclear de doble contraste con gadolinio) y caquexia asociada a la actividad neoplásica.
Se trató de un estudio prospectivo, doble ciego, con asignación aleatoria 1:1 a dexametasona oral 4mg cada 12 horas por 7 días, seguida por 4mg al día por vía oral por los 23 días posteriores tanto en el brazo de estudio A como en el brazo B. A los pacientes en el brazo A se les administró además un tratamiento no farmacológico estandarizado. Dicho manejo no farmacológico incluyó:
a) Programa domiciliario de ejercicio aeróbico moderado estandarizado y adaptado individualmente. La prescripción inicial consistió en caminar 15 a 20 minutos al día, 5 días cada semana, con intensidad moderada (frecuencia cardíaca de entre el 60% y el 80% de la frecuencia cardíaca máxima entendida como 200 - la edad en años). La pauta se modificó dependiendo de la edad del paciente y su condición física. Cada sesión comenzó y concluyó con 3 a 5 minutos a ritmo lento. Se buscó que los pacientes progresaran en función de su tolerancia hasta paseos de 30 minutos 5 veces a la semana. Si se encontraban muy debilitados o eran de hábitos extremadamente sedentarios se inició con sesiones de 5 a 10 minutos dos veces al día hasta tolerar mayores cargas de ejercicio. Se entró en contacto con los pacientes por vía telefónica cada 2 semanas a fin de documentar su progresión y los efectos secundarios derivados del ejercicio. El programa se ajustó conforme a las indicaciones y se enseñó a los pacientes cómo practicar ejercicio con seguridad, incluyendo medidas como la monitorización del pulso y cuándo contactar al médico tratante para comunicar signos y síntomas (mareos o dolor torácico). Se les animó a caminar con un familiar o un amigo en zonas cercanas a su vecindario o en instalaciones deportivas.
2) Enseñanza estandarizada personalizada y entrega de CD-ROM con técnicas de respiración y relajación en estado hipnótico superficial para reducir el estrés. Se animó a los pacientes a repetir los ejercicios respiratorios y de relajación diariamente y se monitorizaron los avances en este ámbito por vía telefónica cada 2 semanas.
Se seleccionaron estos dos tipos de tratamiento no farmacológico porque se consideró que contaban con mayores evidencias de beneficio en la fatiga oncológica como se expuso previamente.
Las variables aleatorias incluyeron la edad, el sexo, el estado funcional, el índice de masa corporal, comorbilidades de importancia (diabetes mellitus, hipertensión arterial, enfermedad coronaria, enfermedad pulmonar restrictiva u obstructiva crónica), tipo histológico y órgano primario afectado por la actividad neoplásica y tratamiento oncológico recibido previamente.
Al mes de seguimiento se efectuó una nueva evaluación de la fatiga (criterio principal de valoración) mediante el Inventario Breve de la Fatiga. Si el paciente presentó en este instrumento menos de 4 puntos se determinó una mejoría significativa de su fatiga, pero si su puntaje fue superior o igual a 4 se determinó la persistencia de un grado moderado o severo de fatiga.
Al mes de seguimiento también se evaluaron en ambos brazos los siguientes criterios de valoración secundarios:
- a)
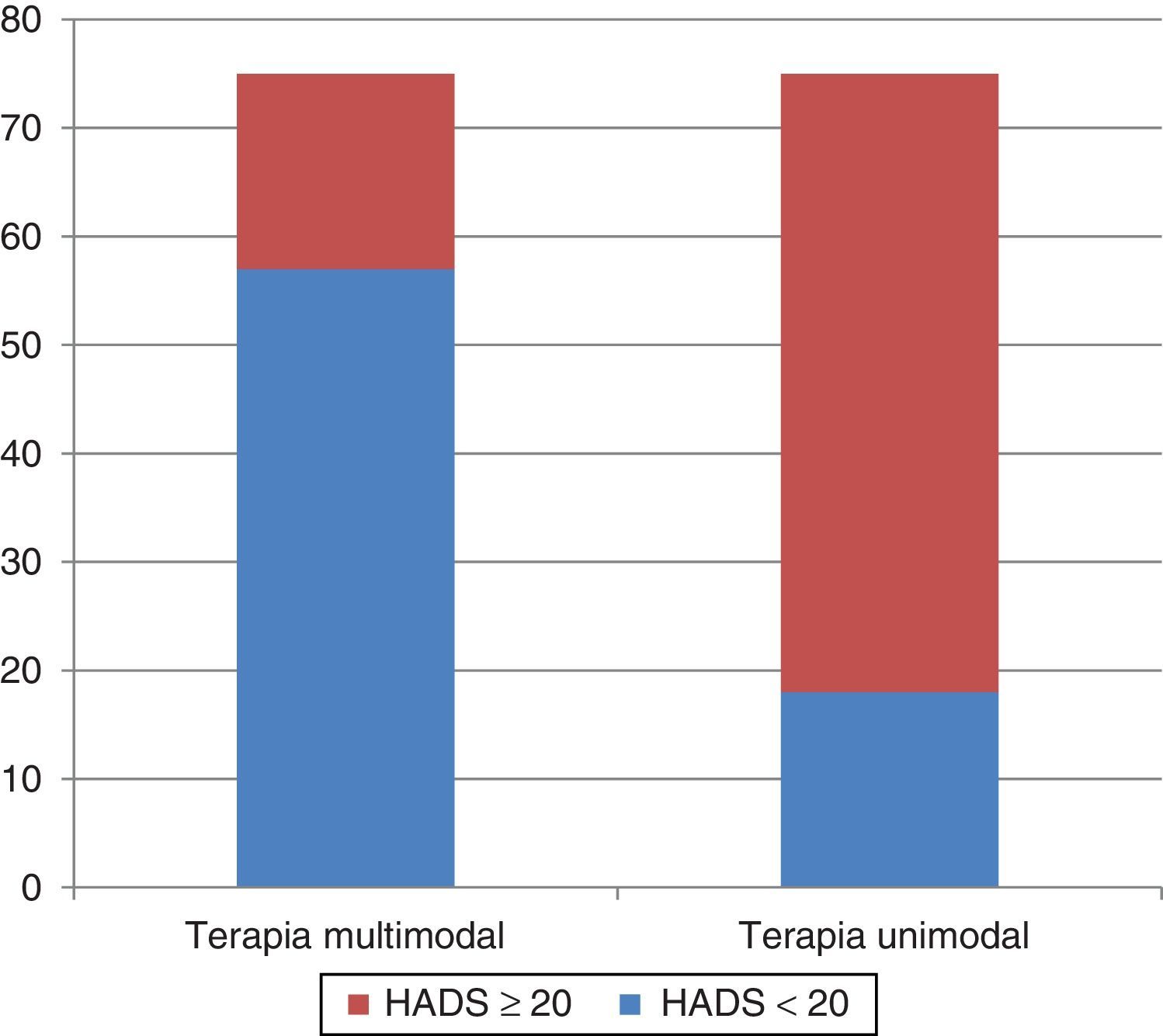
Síntomas de ansiedad/depresión, evaluados mediante el instrumento Escala Hospitalaria de Ansiedad y Depresión (Hospital Anxiety and Depression Scale [HADS]). Para el criterio de valoración de síntomas de ansiedad y depresión se determinó un punto de corte de 20 puntos; por ejemplo, si al mes de evaluación los casos presentaron menos de 20 puntos en el instrumento se consideró que existió mejoría de los síntomas de ansiedad y depresión, pero si presentaron un puntaje superior o igual a 20 puntos se consideró ausencia de mejoría en los síntomas previamente señalados23.
- b)
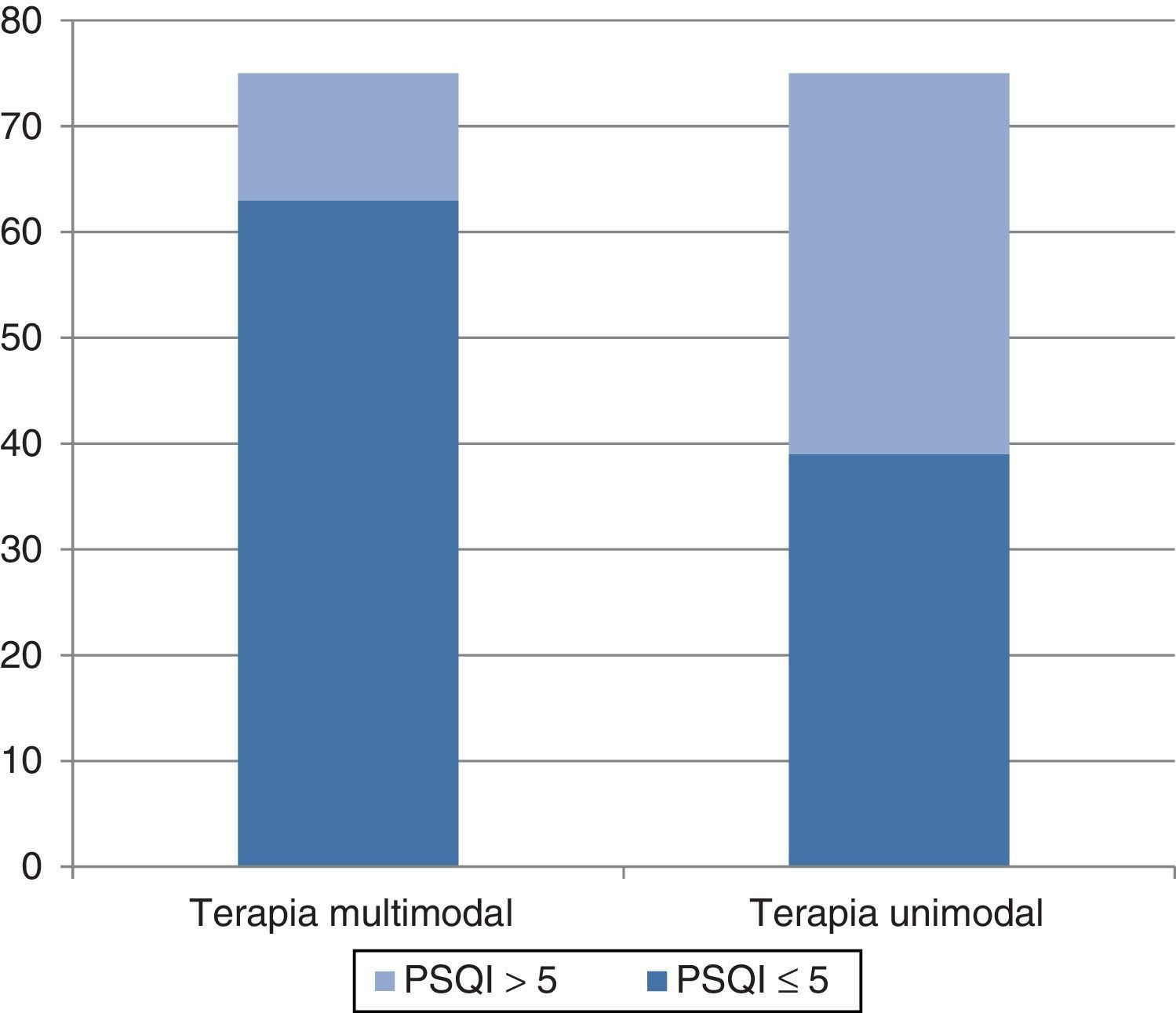
Calidad del sueño. Este criterio se analizó con el cuestionario del Índice de Calidad del Sueño de Pittsburg (Pittsburgh Sleep Quality Index [PSQI]). Si al mes de evaluación los casos presentaron 5 puntos o menos en esta escala, se consideró mejoría de la calidad del sueño, pero si mostraron más de 5 puntos se consideró sueño no reparador24.
- c)
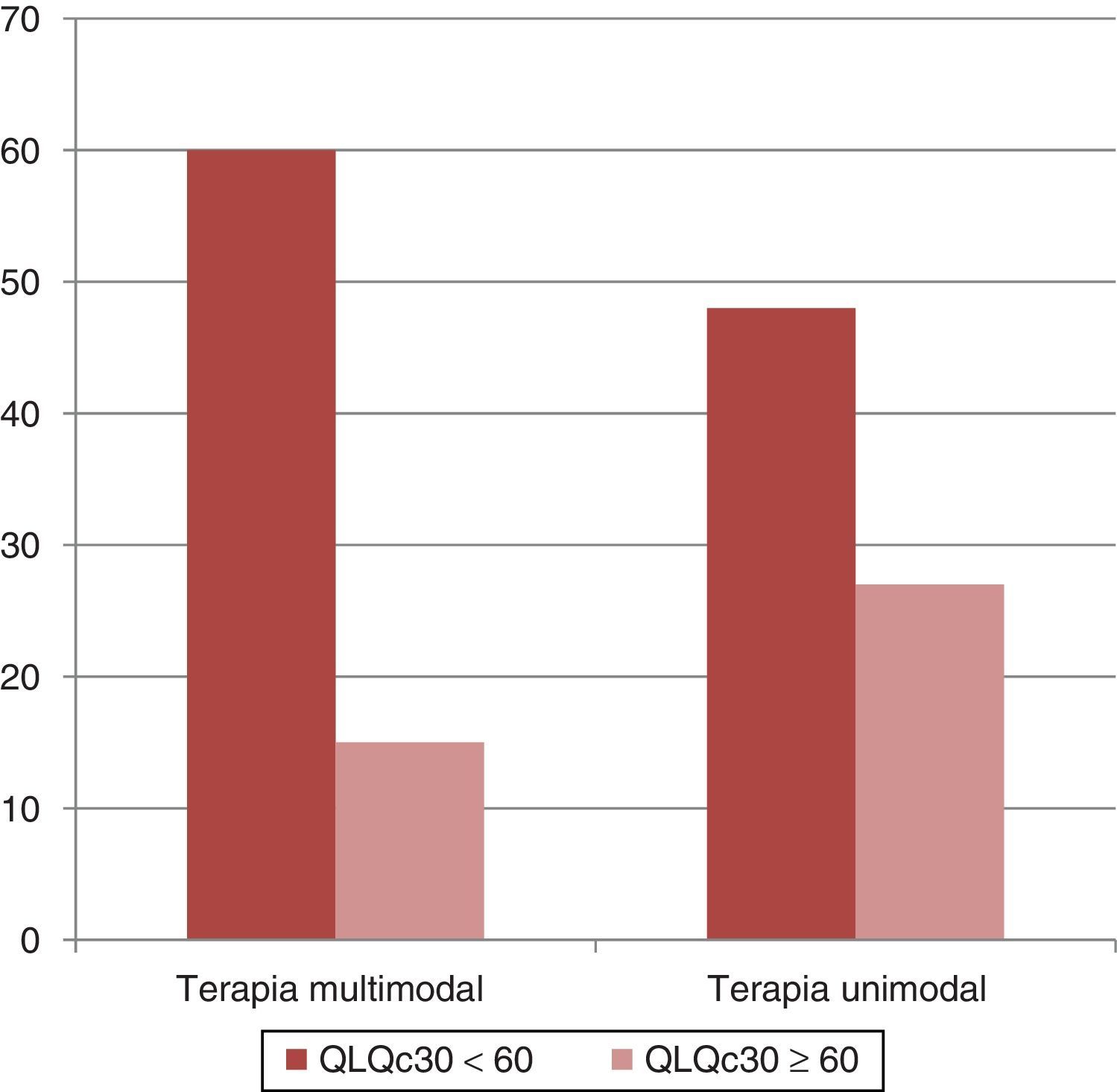
Calidad de vida. Se exploró al mes de seguimiento con el cuestionario QLQc30 (versión 3.0). Si el paciente presentó un puntaje inferior a 60 se concluyó que su calidad de vida era mejor, pero si el puntaje fue superior o igual a 60 se concluyó un deterioro significativo en este aspecto de significancia global25.
Dado que se emplearon variables no paramétricas, para el análisis se utilizó la prueba de la χ2(se consideró la corrección de Yates en caso de que alguna frecuencia prevista resultara inferior a 5). En ambos brazos del estudio se asoció cada criterio de valoración definido como variable operacional, como se estableció en párrafos anteriores. El nivel alfa de significancia se definió en 0.05.
Todos los procedimientos se adhirieron a las normas éticas establecidas en la Declaración de Helsinki (actualizada en el año 2000) y fueron revisados y aprobados por el comité pertinente de la institución en que se controlaron los casos (Centro Médico Integral, Villa Alemana, V Región, Chile).
ResultadosEl estudio contó con la participación de 150 pacientes con una mediana de edad de 60 años; el 52.66% del total de los casos fueron varones y el 47.33% fueron mujeres.
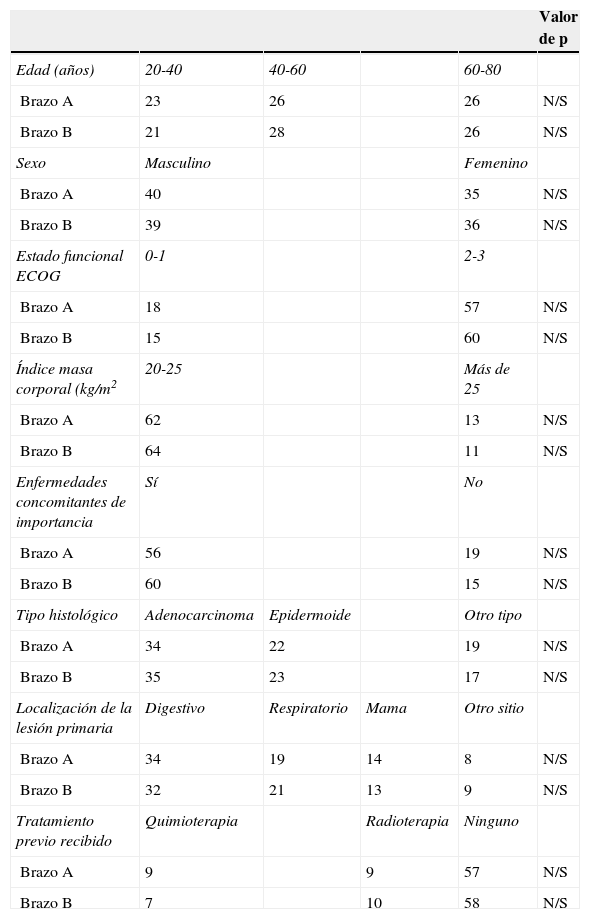
No se registraron diferencias estadísticamente significativas en las distintas variables aleatorias. (tabla 1)
Asignación aleatoria de variables dependientes
| Valor de p | |||||
|---|---|---|---|---|---|
| Edad (años) | 20-40 | 40-60 | 60-80 | ||
| Brazo A | 23 | 26 | 26 | N/S | |
| Brazo B | 21 | 28 | 26 | N/S | |
| Sexo | Masculino | Femenino | |||
| Brazo A | 40 | 35 | N/S | ||
| Brazo B | 39 | 36 | N/S | ||
| Estado funcional ECOG | 0-1 | 2-3 | |||
| Brazo A | 18 | 57 | N/S | ||
| Brazo B | 15 | 60 | N/S | ||
| Índice masa corporal (kg/m2 | 20-25 | Más de 25 | |||
| Brazo A | 62 | 13 | N/S | ||
| Brazo B | 64 | 11 | N/S | ||
| Enfermedades concomitantes de importancia | Sí | No | |||
| Brazo A | 56 | 19 | N/S | ||
| Brazo B | 60 | 15 | N/S | ||
| Tipo histológico | Adenocarcinoma | Epidermoide | Otro tipo | ||
| Brazo A | 34 | 22 | 19 | N/S | |
| Brazo B | 35 | 23 | 17 | N/S | |
| Localización de la lesión primaria | Digestivo | Respiratorio | Mama | Otro sitio | |
| Brazo A | 34 | 19 | 14 | 8 | N/S |
| Brazo B | 32 | 21 | 13 | 9 | N/S |
| Tratamiento previo recibido | Quimioterapia | Radioterapia | Ninguno | ||
| Brazo A | 9 | 9 | 57 | N/S | |
| Brazo B | 7 | 10 | 58 | N/S |
Brazo A: terapia multimodal; brazo B: terapia unimodal; N/S: no significativo.
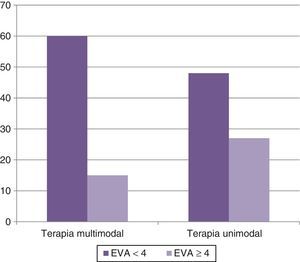
En el brazo A se observó una mejoría de la fatiga (EVA de menos de 4 en la evaluación a un mes) en 60 casos (80%), en tanto que en el brazo B se registró mejoría en 48 casos (64%), siendo la diferencia estadísticamente significativa, con un valor p<0.05 (fig. 1).
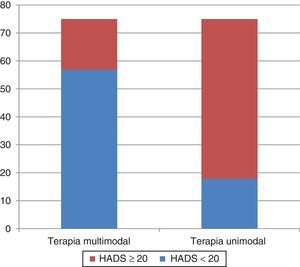
Criterios de valoración secundariosa) El brazo A mostró una mejoría de los síntomas de ansiedad y depresión en la escala HADS, con un puntaje inferior a 20 en la evaluación a un mes en 57 casos (76%) versus 18 casos (24%) en brazo B, con una diferencia estadísticamente significativa (p<0.01) (fig. 2).
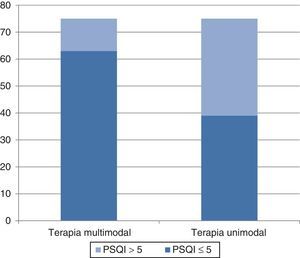
b) En el brazo con manejo multimodal se encontró un beneficio en la calidad del sueño (puntaje ≤ 5 en la evaluación a un mes en el cuestionario del PSQI) en 63 casos (84%) y en 39 casos (52%) con el tratamiento unimodal; la diferencia no se debió al azar (p<0.01) (fig. 3).
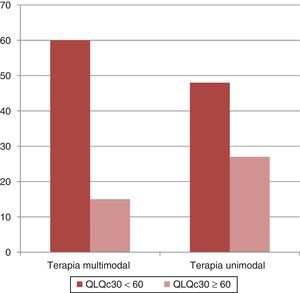
c) En brazo con manejo multimodal se encontró un beneficio en la calidad de vida (puntaje inferior a 60 en la evaluación a un mes en el cuestionario QLQc30 versión 3.0) en 60 casos (84%) y en 48 casos (64%) con el tratamiento unimodal; nuevamente, la diferencia no fue producto del azar (p<0.05 (fig. 4).d) No se registraron diferencias estadísticamente significativas entre ambos brazos de estudio en el reporte de eventos adversos de consideración (grado mayor o igual a 3). En el brazo A se reportaron dos casos (2.66%) y en el brazo B tres casos (4%).
DiscusiónLos resultados del presente estudio son muy interesantes a la luz del conocimiento actual sobre la fatiga oncológica. Si bien no existe un tratamiento farmacológico de referencia para este padecimiento, la mejor evidencia apunta a un beneficio de dexametasona sobre placebo en pacientes con cánceres avanzados, puesto que contrarresta el estado proinflamatorio de la neoplasia de base. Se ha criticado al estudio que demostró lo anterior por el tamaño poco considerable de su muestra, lo cual disminuye la validez estadística de su conclusión, y porque se comparó con placebo.
Con respecto al tratamiento no farmacológico también existen avances, incluido el uso de suplementos alimenticios (ginseng americano), terapia basada en programas de ejercicio, manejo conductual basado en la conservación de la energía y diversas técnicas de manejo del estrés. De toda la evidencia disponible sobre medidas no farmacológicas, la de mayor peso estadístico (por el número de trabajos realizados, varios de ellos con metodología bien planificada y ejecutada) apoya las terapias enfocadas en programas de ejercicio y manejo del estrés.
Sin embargo, no se han desarrollado estudios que combinen terapias farmacológicas y no farmacológicas en busca de mitigar este síntoma de difícil manejo en el entorno paliativo y es por ello que se emprendió este trabajo, pensando en un manejo racional, integral y holístico del cansancio oncológico que incluya un tratamiento multimodal basado en medidas no farmacológicas (un programa de ejercicio aeróbico y técnicas de relajación) y un tratamiento farmacológico (dexametasona).
ConclusiónEl tratamiento de la fatiga oncológica debe empezar a considerar un enfoque multimodal. La presente investigación demuestra que la combinación de terapias es más beneficiosa que dexametasona sola en los síntomas de fatiga y que influye positivamente en síntomas psicológicos, a diferencia del uso del fármaco en forma aislada. Finalmente, la multimodalidad también redunda en beneficios estadísticamente significativos en la calidad de vida global.
Creemos que vamos por buen camino en nuestro concepto de la multimodalidad terapéutica y que nos encontramos en posición de estimular a diferentes grupos de investigación en la materia a nivel mundial a fin de continuar con el desarrollo de este tema.
Conflicto de interesesTodos los autores declaran que este estudio es de índole exclusivamente académico y que no existió ningún tipo de conflicto de intereses.
A la Clínica Ciudad del Mar, Centro Médico Integral y Clínica del Ánimo, donde se reclutaron los casos para esta investigación.