¿ ANTECEDENTES
Los tumores neuroendocrinos (NET) conforman un grupo de diversos tumores sólidos, malignos y de incidencia rara, que se originan en células neuroendocrinas de diferentes partes del organismo; por ejemplo, células neuroendocrinas del epitelio respiratorio, células de islotes pancreáticos, células parafoliculares de la glándula tiroidea y células neuroendocrinas del tracto gastrointestinal (GI). Por su parte, los tumores neuroendocrinos gastroenteropancreáticos (NET-GEP) son aquellos que se originan en células neuroendocrinas del tracto GI y el páncreas. En cualquier caso, en general las neoplasias neuroendocrinas suelen acompañarse de una sintomatología peculiar, grave, debilitante y potencialmente mortal. Aunque la incidencia de NET es baja (~5/100 000), se registra un aumento asociado quizás al mayor conocimiento clínico y la mejor capacidad diagnóstica actuales, así como a la disponibilidad de más y mejores herramientas diagnósticas. Los resultados de la base de datos de supervisión, epidemiología y resultados finales del National Cancer Institute (NCI) de Estados Unidos muestran que en 2004 se diagnosticaron 5.25 nuevos casos de NET por cada 100,000 habitantes (población estándar ajustada por edades) en comparación con sólo 1.09 casos diagnosticados por 100,000 habitantes en ese país en 1973.1
De acuerdo con el sitio donde se originan durante el desarrollo embrionario, los NET se han clasificado tradicionalmente como tumores neuroendocrinos derivados del intestino proximal, del intestino medio y del intestino caudal o distal. El intestino embrionario proximal comprende timo, pulmón, estómago, duodeno proximal y páncreas; el intestino embrionario medio incluye duodeno distal, yeyuno, íleo, ciego, apéndice, colon ascendente, ángulo cólico derecho y colon proximal. Finalmente, el intestino embrionario distal o caudal comprende el colon distal y el recto. En los últimos años se han usado tanto la clasificación de la Organización Mundial de la Salud (OMS) como la propuesta en 2006, conocida como TNM porque toma en consideración el tumor, los nódulos y las metástasis, y analiza la diferenciación tumoral y la diseminación metastásica para estadificar y clasificar los tumores.2 La mayoría de clínicos utiliza la clasificación de la OMS, en la que se advierte que el término tumor neuroendocrino (neuro endocrine tumor) (NET) sólo se aplica a tumores y carcinomas neuroendocrinos bien diferenciados.3 Esta designación de la OMS ha ganado aceptación porque al parecer tiene mayor relevancia pronóstica.
Los NET representan un desafío en la clínica tanto por los disímiles comportamientos biológicos que los subtipos exhiben, como por la diversa sintomatología que son capaces producir. Pueden ser clínicamente sintomáticos (funcionales) o asintomáticos (no funcionales). Aunque tanto los NET funcionales como los no funcionales segregan con frecuencia uno o más péptidos,4 en la mayoría de los casos dichos péptidos no dan lugar a un síndrome clínico específico. Los NET no funcionales suelen diagnosticarse en fases avanzadas de la enfermedad, cuando la masa tumoral o las metástasis producen síntomas y signos clínicos. Los NET funcionales liberan a la circulación sanguínea diversos péptidos y aminas que promueven sintomatología clínica, por ejemplo, de síndrome carcinoide, el cual se caracteriza por rubefacción, diarrea intensa y debilitante, dolor abdominal, trastornos metabólicos, sibilancias y síntomas asmáticos. Sin embargo, ya que la mayoría de estos péptidos y aminas se libera en el sistema de la vena porta, el hígado los depura antes de que entren en la circulación sistémica y los síntomas sólo se manifiestan cuando las metástasis han invadido el hígado. En consecuencia, en la mayoría de estos pacientes el NET funcional se diagnostica también en fases avanzadas de la enfermedad, cuando ya cerca de 50% de ellos muestra metástasis regionales o distantes.1
Las metástasis suelen desarrollarse inicialmente en ganglios linfáticos regionales, después en el hígado y más tarde en localizaciones distantes, como el hueso.5 Hasta 75% de pacientes con NET derivado del intestino embrionario medio o caudal y alrededor de 60% de aquellos con NET pancreáticos (NETp) cursan con metástasis hepáticas.6 La supervivencia se ve afectada por el grado de diseminación metastásica. En pacientes con NET de anatomopatología diferenciada o moderadamente diferenciada, la mediana de supervivencia se ha estimado en ~33 meses en aquellos con metástasis a distancia, en comparación con una mediana de hasta 223 meses en individuos con enfermedad localizada.1
¿ TRATAMIENTO ACTUALIZADO DE NET y NET-GEP
La información sobre estas neoplasias en la bibliografía especializada era mínima hasta hace unos años y sólo en la última década se ha incrementado de manera notable. Esto ocurre a menudo con todas las enfermedades de muy baja incidencia, en especial cuando no se dispone de opciones terapéuticas eficaces. Tal es el caso de los NET y NET-GEP, ya que la introducción de octreotida revolucionó su abordaje clínico e incrementó su detección y atención. Octreotida, un análogo de la hormona natural somatostatina, es un octapéptido sintético de acción prolongada.7 Como la somatostatina endógena, octreotida inhibe la liberación de las hormonas/aminas pituitarias y gastroenteropancreáticas como somatotropina (GH), tirotropina (TSH), insulina, glucagón, colecistocinina (CCc), péptido vasoactivo intestinal (PVI), serotonina y gastrina.
Octreotida también inhibe la producción de ácido gástrico, la secreción de enzimas pancreáticas y el flujo de bilis, prolonga el tiempo de tránsito intestinal y disminuye la contractilidad de la vesícula biliar. Los análogos de la somatostatina han sido la piedra angular en el tratamiento de los síntomas relacionados con NET funcionales. No obstante, aún se requieren terapéuticas que modifiquen la progresión de la enfermedad en pacientes con NET, incluidos aquellos con enfermedad inactiva. Los datos presentados demuestran que, además de controlar los síntomas que acompañan a los tumores neuroendocrinos, Sandostatina LAR también es eficaz para prolongar el tiempo que transcurre hasta la progresión de la enfermedad en los NET funcionales y no funcionales.
Octreotida se ha comercializado desde hace más de dos décadas y hoy está disponible en dos formulaciones, Sandostatina S.C. y Sandostatina LAR. La forma inyectable original de octreotida (Sandostatina S.C.) tenía un régimen posológico de dos o tres inyecciones subcutáneas diarias. En contraste, el preparado de liberación prolongada Sandostatina LAR se administra por vía intramuscular (IM) cada cuatro semanas; esta presentación fue concebida para pacientes que necesitan tratamiento a largo plazo con octreotida.
Sandostatina LAR está indicada para el tratamiento de pacientes con tumores neuroendocrinos avanzados del intestino medio o localización desconocida del tumor primario, así como para aquellos con sintomatología de NET-GEP funcional cuyas manifestaciones se controlan adecuadamente con tratamiento subcutáneo a base de Sandostatina S.C.; tal es el caso de NET con características de síndrome carcinoide, VIPomas, glucagonomas, gastrinomas/síndrome de Zollinger-Ellison, insulinomas y GRFomas. Está indicada también para el control preoperatorio de la hipoglucemia y como terapéutica de mantenimiento, así como en el tratamiento de pacientes con acromegalia adecuadamente controlados con Sandostatina S.C., en quienes la cirugía o la radioterapia son inapropiadas o ineficaces, o bien en el periodo intermedio hasta que la radioterapia alcance la eficacia total.7
¿ MECANISMO DE ACCIÓN DE OCTREOTIDA
Octreotida muestra una elevada afinidad para unirse al subtipo 2 del receptor de somatostatina (sst2) y afinidad moderada por los subtipos 3 (sst3) y 5 (sst5);8 la mayoría de los NET expresa estos subtipos del receptor. La actividad antitumoral de octreotida está mediada por mecanismos de acción directos e indirectos; los primeros incluyen activación de receptores de somatostatina en células tumorales, lo cual da lugar a la modulación de vías intracelulares de transducción de señales.9 Múltiples estudios in vitro que han utilizado estirpes celulares transfectadas con receptores de somatostatina indican que los cinco subtipos del receptor de somatostatina (sst1-5) se encargan de mediar la inhibición de la proliferación celular, mientras que sólo algunos subtipos específicos, como sst2 y sst3, intervienen en la apoptosis o muerte celular programada.10 Al parecer estas acciones están reguladas principalmente por la vía de señalización de la proteína cinasa activada por mitógeno (PAM-cinasa), al activar fosfotirosina fosfatasas. Los mecanismos antiproliferativos indirectos incluyen inhibición de factores de crecimiento mitógenos (factor insulinoide del crecimiento 1 o FIC 1) e inhibición de la angiogénesis tumoral por interacción con receptores de la somatostatina en células endoteliales y monocitos.11
En estudios de NET en modelos animales se ha demostrado que la octreotida inhibe de forma significativa el crecimiento de insulinomas pancreáticos en ratas, y que también inhibe la angiogénesis e induce la apoptosis en carcinomas neuroendocrinos rectales en ratones.12
En su presentación como Sandostatina LAR, octreotida ha demostrado inhibir de manera importante la función basal y el crecimiento de las células enterocromafinoides,13 y prevenir el desarrollo de carcinomas de células enterocromafinoides en ratas Cotton (Sigmodon hispidus) hipergastrinémicas.14 En estos mismos animales, octreotida de acción prolongada indujo un efecto negativo sobre el crecimiento mucoso oxíntico en ratas y un cambio significativo en la expresión génica, trascendental para la regulación del crecimiento, lo que dio lugar a una disminución significativa del número de glándulas gástricas, de células por glándula y de la longitud de las glándulas, con una tendencia al aumento de la apoptosis y a la disminución de la proliferación.15
¿ ESTUDIO PROMID EN NET DEL INTESTINO MEDIO TRATADOS CON OCTREOTIDA
Los estudios clínicos publicados sobre el tratamiento de NET y NET-GEP eran pocos y muy heterogéneos dada la muy escasa casuística disponible de estos tumores. El panorama cambió cuando se comenzó usar octreotida y se observaron resultados no sólo promisorios, sino de una inesperada eficacia; entonces se realizaron más trabajos clínicos. El primero debidamente protocolizado lo llevó a cabo el grupo PROMID (acrónimo de Estudio controlado con placebo, doble-ciego, prospectivo y aleatorizado de los efectos de octreotida LAR en el crecimiento tumoral en pacientes con NET metastáticos) en la Unión Europea.16 Este estudio contó con el apoyo de la Sociedad Europea de Tumores Neuroendocrinos y en él se valoró el efecto antiproliferativo del fármaco en una población de 42 pacientes tratados con octreotida LAR, a los que se comparó con 43 pacientes que recibieron placebo. La media de edad de los pacientes fue 63.5 años (40.5 % con síntomas de síndrome carcinoide, 69% con tumor ya extirpado y 83 % con metástasis hepáticas) y provenían de 18 centros universitarios hospitalarios alemanes.16
Los resultados del estudio PROMID demostraron categóricamente la eficacia de octreotida LAR en el manejo de NET del intestino medio. El tiempo medio para la progresión en el grupo tratado con octreotida fue de 14.3 meses, contra seis meses para placebo, con un valor estadístico significativo (p = 0.000072). Después de seis meses de tratamiento con octreotida, se observó enfermedad estable en 66.7% de los pacientes. El efecto antiproliferativo del fármaco fue evidente. Los tumores funcionales y no funcionales respondieron al tratamiento. El mayor efecto terapéutico se observó en los individuos con carga tumoral baja en hígado y sometidos a resección del tumor primario. Los autores concluyeron que en comparación con placebo, octreotida es un tratamiento que prolonga de modo importante el tiempo para la progresión del tumor en pacientes con NET funcionales, activos o inactivos, del intestino medio.
¿ SEGURIDAD MOSTRADA POR OCTREOTIDA EN EL ESTUDIO PROMID
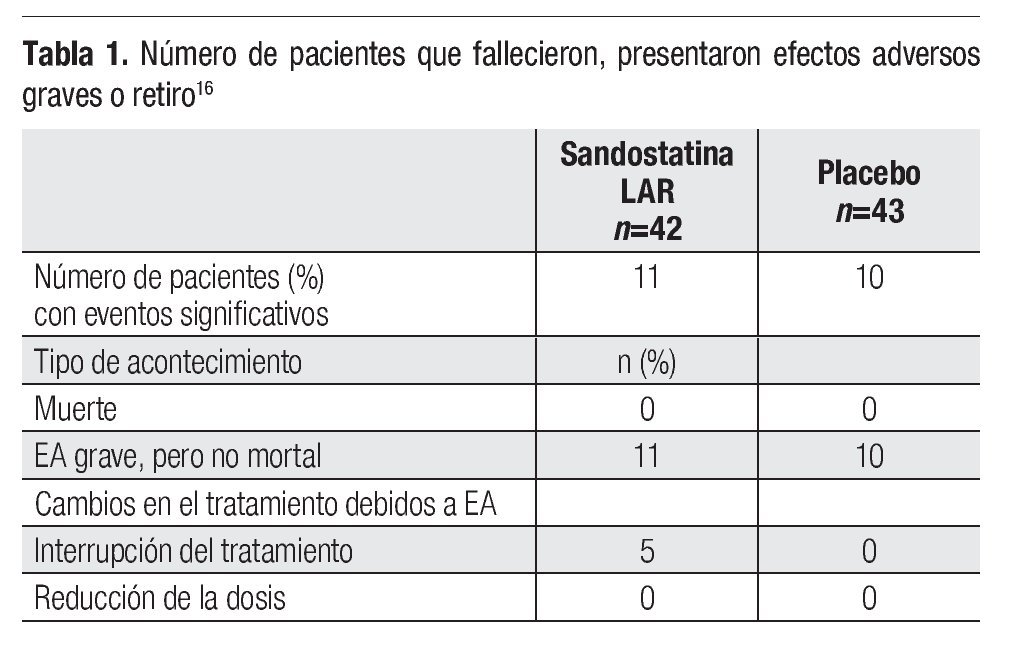
Los datos de eficacia tendrían sólo una importancia marginal si no estuvieran acompañados por un adecuado perfil de seguridad. Octreotida no es un fármaco citotóxico sino el análogo de una hormona endógena, cuyo mecanismo de acción es bastante inocuo en términos de efectos adversos mayores. En el estudio PROMID no ocurrieron muertes relacionadas con el tratamiento. Se observaron eventos adversos (EA) graves en 11 pacientes tratados con octreotida y en 10 de los que recibieron placebo.
Los EA graves documentados con mayor frecuencia en el estudio PROMID afectaron el tracto gastrointestinal (octreotida n=6, placebo n=8), el sistema hematopoyético (octreotida n=5, placebo n=1) y el estado general de la salud (cansancio y fiebre; octreotida n=8, placebo n=2). Los EA de grados 2 a 4 de la OMS, independientemente de su relación causal con la terapéutica, se observaron más a menudo en el grupo tratado con octreotida e incluyeron diarrea y flatulencia. Se detectó litiasis biliar en seis pacientes, cinco de ellos tratados con octreotida. La interrupción del tratamiento.
¿ COMENTARIO
Antes de la publicación de los resultados del estudio PROMID en agosto de 2009,16 las guías para tratamiento de los NET de la Red Nacional Integral del Cáncer (National Comprehensive Cancer Network, NCCN) de Estados Unidos se actualizaron con base en los resultados del PROMID presentados en el simposio ASCO-GI en enero de ese mismo año. Desde la inclusión previamente recomendada en un ensayo clínico, la NCCN recomienda el uso de octreotida de liberación prolongada como terapia de primera línea para tumores carcinoides metastásicos no resecables, asintomáticos, bien diferenciados o moderadamente diferenciados (NET de intestino delgado, colon, recto, apéndice, pulmón, timo, estómago, bronquios).17 Además, sociedades médicas de todo el mundo (Redes Canadiense y Nórdica de NET) han actualizado sus directrices en ese sentido. La Sociedad Norteamericana NET (NANETS) y la Sociedad Europea NET (ENETS) han mostrado su interés con en publicaciones de próxima aparición.
A partir de la introducción de octreotida hace más de 20 años, diversos estudios prospectivos y no comparativos y algunas series retrospectivas habían mostrado que cerca de 50% de los pacientes con NET experimenta una fase prolongada de estabilización de la enfermedad durante el tratamiento. No obstante, faltaban los datos que sólo proporcionaría un estudio prospectivo comparativo con un diseño estadístico robusto. El estudio PROMID es el primer ensayo comparativo aleatorizado y controlado con placebo que ha demostrado un efecto antitumoral estadística y clínicamente significativo de octreotida administrado a dosis de 30 mg cada 28 días a pacientes con tumores neuroendocrinos localmente inoperables o metastásicos (avanzados), bien diferenciados, funcionales o no funcionales del intestino medio o con un tumor primario de origen desconocido. Los pacientes reclutados en el estudio PROMID carecían de opciones terapéuticas curativas, lo cual pone de manifiesto la necesidad médica que afecta a esta población.
La indicación propuesta para octreotida LAR es el tratamiento de NET avanzados del intestino medio o localización desconocida del tumor primario. La dosis recomendada para esta población es 30 mg administrados cada cuatro semanas. El tratamiento con octreotida de liberación prolongada (Sandostatina LAR) para el control del tumor debe proseguir aunque el crecimiento de éste se detenga. Esta recomendación coincide con las directrices terapéuticas de NCCN correspondientes a 2009/2010, que recomiendan octreotida LAR como tratamiento de tumores carcinoides metastásicos no resecables, bien diferenciados o moderadamente diferenciados y asintomáticos (NET del intestino delgado, colon, recto, apéndice, pulmón, timo, estómago, bronquios), la cual se suma a la indicación previa de Sandostatina LAR para el tratamiento de los síntomas del síndrome carcinoide y de los tumores con carga tumoral significativa, progresión o efectos locales.
Correspondencia: Calzada de Tlalpan 1779, San Diego Churubusco, CP 04120, México, D. F.
Tel +(55) 54 84 43 49.
Correo electrónico:cesar.trujillo@novartis.com