¿ DEFINICIÓN
El síndrome de compresión medular por cáncer es un conjunto de manifestaciones de tipo neurológico ocasionadas por metástasis de tumor primario a la médula espinal. La primera descripción de esta entidad fue realizada en 1925 por Spilller en un paciente con una parálisis rápidamente progresiva.
Las lesiones metastásicas en la médula espinal generan compresión extradural en el 97% de los casos, es decir la compresión medular epidural (CME) es la más común en pacientes con enfermedad sistémica. Lesiones intradurales, intramedulares o leptomeníngeas son menos frecuentes (0.3%). Los cánceres más asociados a CME son los de pulmón y mama, seguidos por linfoma, cáncer de próstata, mieloma y sarcoma.1-3
¿ EPIDEMIOLOGÍA
Esta entidad es poco común. Revisiones previas indican que representa sólo el 10% de las causas de muerte por cáncer y actualmente tiene una presentación de 2.5/100 000 por año.4
Entre 2% y 2.5% de los pacientes con cáncer terminal experimentan CME en los primeros dos años de la enfermedad. La incidencia de CME basada en la población adulta de 40 a 60 años es de 7.37% en cáncer de mama, 16.98% en cáncer de próstata y 15.38% en mieloma.
En niños la incidencia es de 4.0% a 5.5%; la manifestación más frecuente es de paraparesia en pacientes de tres meses a 17 años.3
En estudios de autopsia se revela que 5% de los pacientes que fallecen por cáncer tienen compresión medular por metástasis.2
¿ ETIOLOGÍA
En algunas series, los cánceres de próstata, de pulmón y de mama representan cada uno hasta 15% a 20% de casos de CME, en tanto que a linfoma no Hodgkin, mieloma múltiple y cáncer renal corresponden 5% a 10% de los casos. El cáncer colorrectal, sarcomas y tumores de origen desconocido también son causa de CME. En el caso de niños las etiologías más frecuentes son neuroblastoma, sarcoma de Ewing, tumor de Wilms, sarcoma de tejidos blandos y de hueso.1,2
La mayoría de las formas de compresión ocurre por afectación de la columna vertebral (85% a 90% de los casos); generalmente las lesiones son osteolíticas (70%) y se presentan en el cuerpo vertebral, lo cual desarrolla compresión anterior de la médula espinal. Este tipo de compresión es frecuente en cáncer de mama, próstata y mieloma. Otra forma de compresión es la producida por neoplasias paravertebrales (linfoma, sarcoma, neuroblastoma) que generalmente se extienden por el foramen intervertebral sin compromiso vertebral (10% a 15% de los casos) y en estudios de imagen no se evidencia alteración. Este tipo de compresión es más frecuente en niños.1,2
¿ FISOPATOLOGÍA
La compresión de la médula espinal tiene dos fases: uno se produce una compresión de la columna espinal y dos por infiltración en el cuerpo vertebral.
En la primera se presenta diseminación metastásica a través de las válvulas del plexo venoso de Bastón y la embolización arterial directa de células clonogénicas en la médula ósea de la columna como principal mecanismo.
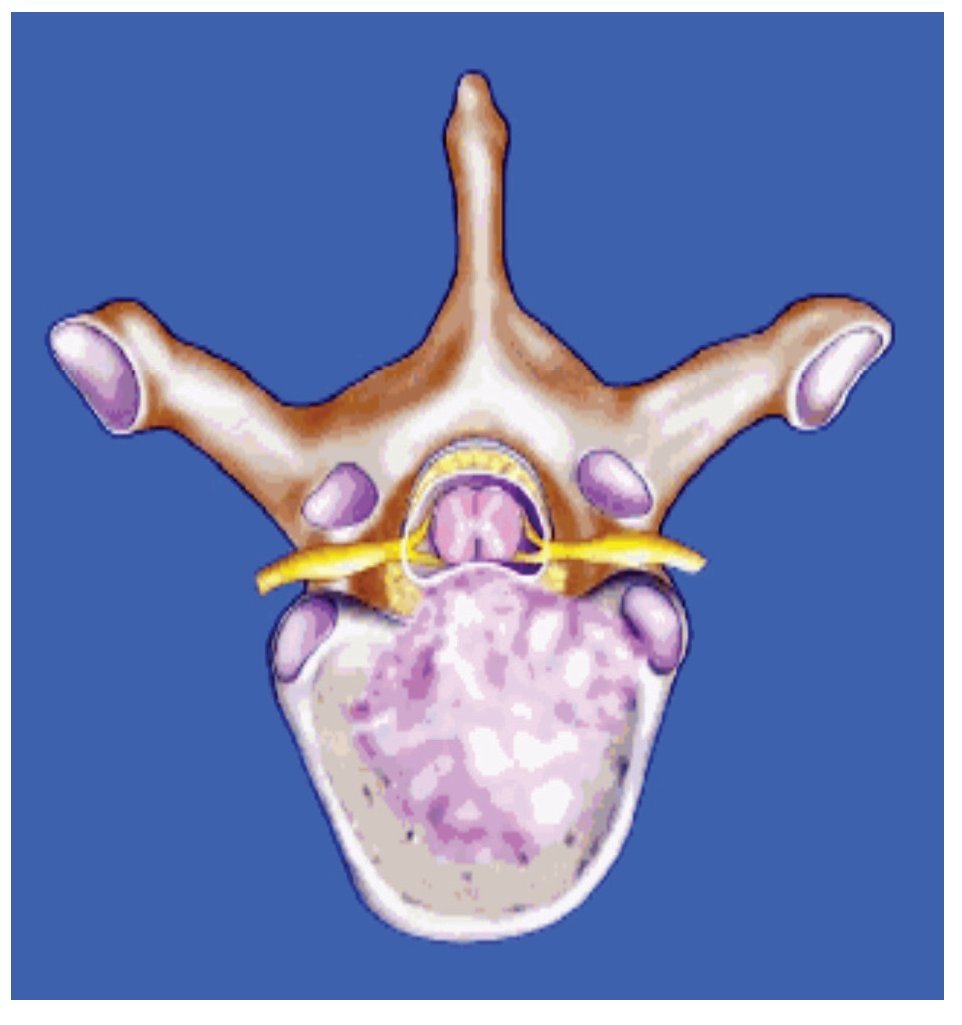
Finalmente la infiltración en el cuerpo vertebral tiene crecimiento que se extiende anteriormente al saco tecal y comprime la médula espinal y el plexo venoso epidural (Figura 1). La destrucción del hueso cortical por el tumor contribuye a la compresión por colapso del cuerpo vertebral y también por fragmentos óseos que entran al espacio epidural. La compresión epidural por metástasis directas en este espacio es rara.
Figura 1. Lesión metastásica en cuerpo vertebral con extensión a la médula espinal (flecha).
El crecimiento tumoral desde la región paraespinal a través del foramen vertebral es poco común como causa de CME, los linfomas son ejemplo de esta vía para la compresión epidural.
La consecuencia de los eventos previos es la obstrucción del flujo venoso y arterial, uno de los principales efectos es la estenosis y obstrucción del plexo venoso epidural que lleva a déficit neurológico. La consecuencia de lo anterior es una hipertensión venosa y edema de la materia blanca, seguidos de disminución del flujo sanguíneo de la médula espinal, por lo que la isquemia sobreviene por el cese del flujo de las arteriolas en la materia blanca y por infarto en la médula espinal. Se ha identificado también que hay vacuolización de la materia blanca y edema de la médula espinal.3
El mecanismo inicial de lesión es el edema vasogénico de la materia blanca en el que intervienen citocinas, mediadores inflamatorios y neurotransmisores. Uno de los más representativos es el factor de crecimiento vascular endotelial (VEGF) que está asociado con la hipoxia de la médula. La prostaglandina E2 es otro mediador expresado que favorece el edema. Finalmente el edema vasogénico es reemplazado por lesión neuronal isquémica-hipóxica que lleva a edema citotóxico y muerte neuronal.3
¿ CUADRO CLÍNICO
La CME se puede presentar en el 8% a 34% de los casos como manifestación inicial de cáncer. Hasta el 30% de los pacientes con tumor de origen desconocido, linfoma no Hodgkin, mieloma o cáncer de pulmón tiene como manifestación inicial de enfermedad sistémica la compresión epidural, lo cual no sucede en los cánceres de mama y próstata.3
La distribución de las metástasis en la región epidural es la siguiente: 60% a 80% en la región torácica, 15% a 30% en región lumbosacra y 10% cervical. En el 50% de los casos los sitios son múltiples.
La sintomatología más frecuente es el dolor en el 83% a 95% de los casos con una duración media de ocho semanas; puede ser local por expansión o radicular por compresión de raíces nerviosas. El dolor empeora por distensión del plexo venoso epidural (maniobras de flexión o de Valsalva). En metástasis intradurales o intramedulares el dolor es menos frecuente. Se reporta déficit motor en el 60% a 85% y en dos tercios de los pacientes se diagnostica estando ya hospitalizados; la CME por arriba del cono medular produce una debilidad de neurona motora superior y generalmente es simétrica (paraplejia). El déficit sensorial es menos común y se presenta en 40% a 90%; los niveles sensoriales afectados son uno a cinco segmentos por debajo del nivel de compresión. En metástasis epidurales a nivel torácico es más frecuente la pérdida sensorial, mientras que a nivel lumbosacro el dolor bajo y la debilidad bilateral de extremidades predominan. El signo de Lhermitte se puede presentar en lesiones a nivel cervical o torácico superior, pero hay que diferenciar de mielopatía por quimioterapia o radioterapia. El síndrome de Horner también se presenta en lesiones cervicales y es de muy mal pronóstico.1,2
La disfunción vesical o intestinal es una manifestación de compresión avanzada y cerca de la mitad de los pacientes la presentan al diagnóstico; la retención urinaria es la manifestación más común en CME.
La ataxia es rara pero se puede presentar debido a que la pérdida sensorial lleva a ésta.
¿ FACTORES PRONÓSTICOS
Una vez que se presenta metástasis en la médula la manifestación inicial puede ser dolor de espalda que dura días o meses; el dolor evoluciona a debilidad y déficit sensorial, y con el tiempo llegan la paraplejia y la disfunción de esfínteres. El tiempo entre la aparición de signos neurológicos y paraplejia oscila entre siete y 10 días (65% de los pacientes) y hasta 48 horas (22%); la progresión rápida puede estar relacionada con los cambios vasculares y el edema. La propia progresión de la paraplejia se debe a la compresión gradual, constituyéndose en una emergencia que debe tratarse eficazmente para evitar el deterioro neurológico.1
Muchos estudios se han realizado para identificar cuáles son los factores relacionados con los resultados de pacientes que reciben tratamiento, pero debido a los diferentes análisis de variables ha sido difícil hacer comparaciones.
En términos generales la expectativa de vida después del diagnóstico de compresión alcanza tres a seis meses. Dentro de los factores pronósticos más importantes de sobrevida se encuentran el tipo de tumor y déficit neurológico al diagnóstico. En muchas revisiones se observa que el tiempo de sobrevida es más corto en pacientes con cáncer de pulmón comparado con cáncer de mama, lo que tiene que ver con la actividad tumoral del primario aún después de la compresión. Se ha observado que pacientes con cáncer de pulmón tienen mayor tendencia a la infiltración de columna torácica, de ahí su mayor progresión.5 Los pacientes con cáncer de próstata tienen una expectativa de vida intermedia. El segundo factor importante es la condición del paciente (si es ambulatorio o no antes del tratamiento, ya que pacientes ambulatorios tienen mayor periodo de sobrevida); la mayoría de pacientes que no son ambulatorios se recupera después del tratamiento, pero un 16% después de radioterapia llegan a ser ambulatorios.1 En estudios de pacientes con parálisis manejados con radioterapia se ha observado mejoría en la función de la marcha después del manejo, y es que se han descrito casos de recuperación tardía lo que se compara con la mayoría de los pacientes.6 Se ha visto que puede haber confusión en los resultados finales en identificar que los pacientes tienen habilidad para caminar, es decir que el éxito del tratamiento en pacientes no ambulatorios deriva en que se reconoce una mejoría en la función de la marcha, comparados con los ambulatorios que permanecieron así después del manejo.5 Pacientes con enfermedad de Hodgkin y no Hodgkin llegan a ser ambulatorios después de radio-quimioterapia si experimentan paraplejia a la presentación. Estudios retrospectivos y prospectivos identifican que el 90% de los pacientes con deterioro lento de la función motora (< 14 días) exhibe mejoría después de radiación, comparado con 10% solamente si el deterioro tiene lugar en uno a 13 días.1,7,8
La función ambulatoria pretratamiento es el mayor determinante de la función de la marcha postratamiento. El tiempo de sobrevida de pacientes no ambulatorios puede mejorar si el tratamiento se indica a la brevedad. Se ha señalado que la histología del primario resulta en una mayor respuesta al tratamiento en pacientes con paresia o paraplejia.5
Otros factores asociados son las disfunciones vesical e intestinal que tienen pronóstico desfavorable. Un factor independiente es la presencia de metástasis múltiples en médula espinal (25% a 40% de los pacientes) que empeoran el pronóstico, lo mismo que las metástasis viscerales.9
Finalmente otro factor propuesto es la respuesta al esquema de radioterapia utilizado. Los resultados con un esquema corto de radiación (dosis única de 8 Gy o cinco sesiones de 4 Gy cada una) o bien un esquema largo (10 sesiones de 3 Gy por sesión/20 sesiones de 2 Gy cada una/15 sesiones de 2.5 Gy por sesión), han indicado que pacientes con expectativa de vida > 6 meses pueden beneficiarse de esquemas largos ya que hay un mayor control de la enfermedad. Cuando la expectativa es < 6 meses es mayor el beneficio con esquemas cortos de radiación. Pacientes con metástasis viscerales, no ambulatorios, con déficit motor (uno a 7 días) antes de la radiación y un estado funcional deteriorado (ECOG 3-4) podrían ser considerados para un esquema corto de radioterapia.10
¿ DIAGNÓSTICO
Si bien el cuadro clínico orienta el diagnóstico, los estudios de imagen son los métodos que ayudan a determinar si existe compresión medular, además de que permiten dirigir la mejor opción de tratamiento. La tomografía computada (TC) y la imagen de resonancia magnética (IRM) son los más utilizados. Hasta en un 46% de los casos el manejo puede cambiar con una resonancia magnética.11
Los rayos X pueden demostrar alteración hasta en el 80% de los casos con metástasis espinales sintomáticas, con un valor predictivo positivo del 98%, pero falsos negativos en el 17%. La mielografía (introducción de medio radiopaco dentro del saco tecal) fue un estudio muy utilizado antes de la TC, pero actualmente no se utiliza.1,3
La TC es un método que identifica compresión espinal y lesiones paraespinales, la desventaja es que no contrasta bien en tejidos blandos. Este método es utilizado para planear la instrumentación en caso que el paciente sea quirúrgico o en la planeación de radioterapia en caso de que se maneje con ésta.3,11
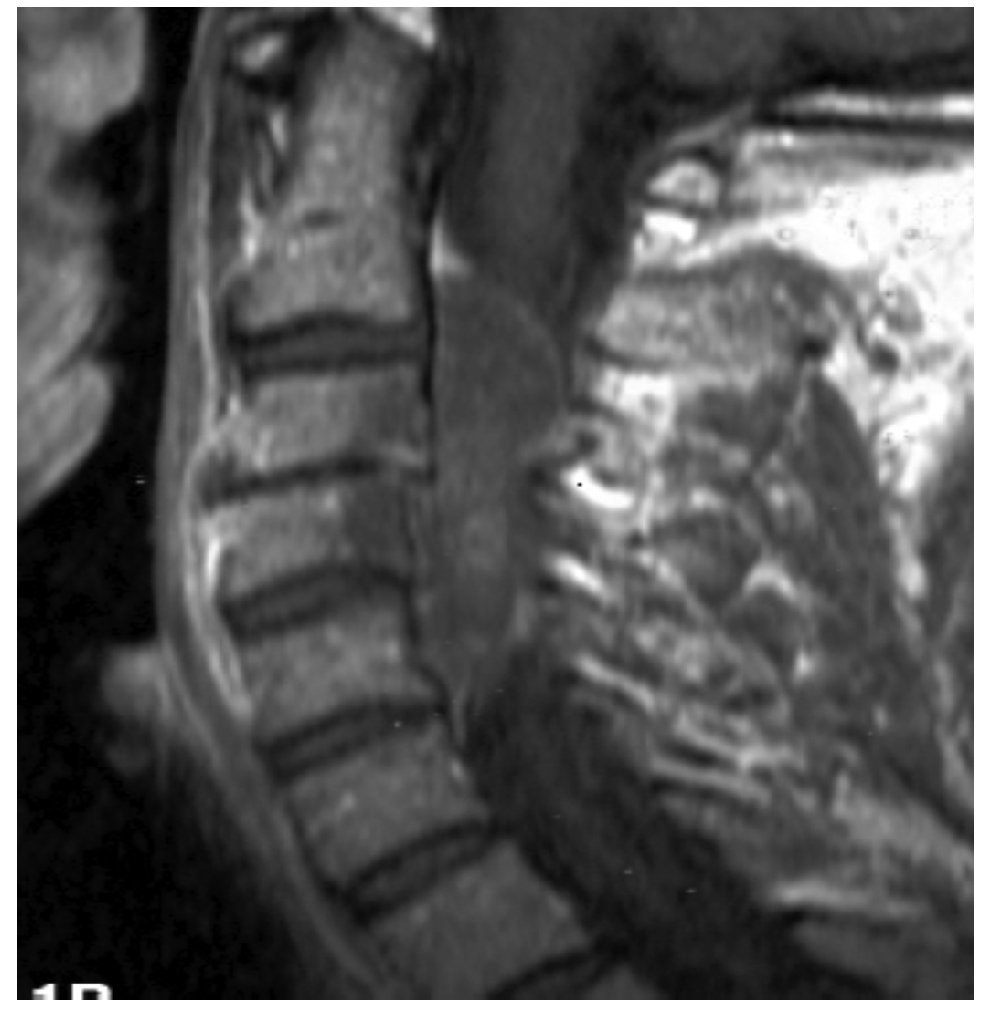
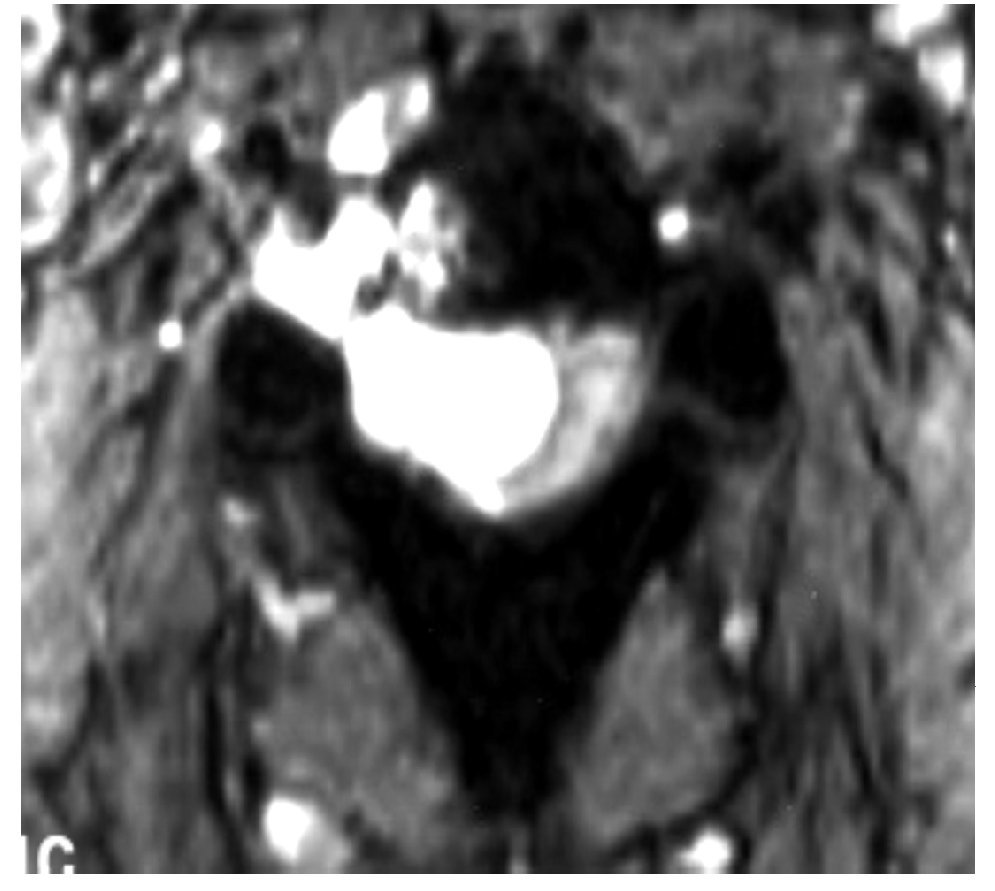
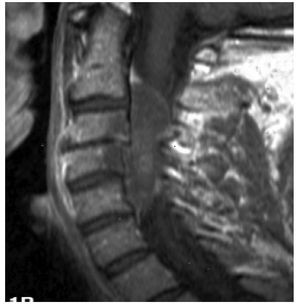
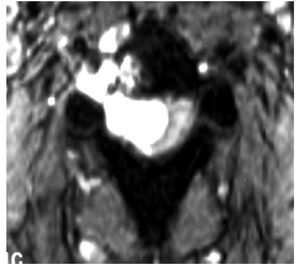
La IRM es el método de elección en compresión con una sensibilidad del 91%, una especificidad de 97% y una agudeza diagnóstica del 95%. El estudio muestra adecuadamente el nivel de la compresión, tiene alta resolución en tejidos blandos y además identifica lesiones intradurales e intramedulares. Dos patrones de compresión pueden identificarse con resonancia magnética: enfermedad epidural de tejidos blandos en el 73% y colapso vertebral en 24%. Con IRM se pueden identificar lesiones metastásicas espinales múltiples que se presentan hasta en el 70% de los casos.1,11 El estudio de IRM debe incluir imágenes sagitales ponderadas en T1 y T2 de toda la médula espinal. Imágenes ponderadas en T1 permiten diferenciar tumores que tienen baja señal con la grasa de la médula ósea que tiene alta señal (Figura 2). La imagen T2 se usa más para evaluar infiltración del saco tecal, debido a que el líquido cefalorraquídeo que tiene alta señal genera un efecto de mielografía. Imágenes T1 sagital únicas no son suficientes para evaluar compresión ya que tienen una sensibilidad de 87% por lo que se recomienda también imágenes T1 y/o T2 axiales en lesiones de compresión medular (Figura 3). Imágenes axiales identifican mejor infiltración de raíces nerviosas. En lesiones intramedulares el uso de gadolinio mejora la identificación de éstas.11,12
Figura 2. IRM sagital ponderada en T1 en compresión medular por cáncer de mama metastásico.
Figura 3. IRM axial ponderada en T2 en compresión medular torácica por cáncer pulmonar.
La tomografía por emisión de positrones (PET) es un estudio que mide la captación de 18-fluorodesoxiglucosa y puede identificar lesiones metastásicas captantes, pero tiene escasa resolución anatómica comparada con la IRM.3
¿ TRATAMIENTO
El objetivo principal en el manejo de pacientes con compresión es preservar o recuperar la función nerviosa y la estabilidad de la columna, con lo que debe presentarse el alivio del dolor. El tratamiento debe individualizarse según las condiciones del paciente, las opciones son radioterapia y cirugía sola o combinada. La quimioterapia tiene un nivel de evidencia 3 y puede indicarse en jóvenes y adultos con tumores quimiosensibles que no son candidatos a cirugía o radiación. El reposo es una de las primeras indicaciones para los pacientes, seguido de medicación a base de esteroides (nivel de evidencia 1) si ya se ha confirmado compresión medular. En los linfomas los esteroides tienen un efecto antitumoral. El efecto de estos agentes es que reducen el edema, inhiben la respuesta inflamatoria y estabilizan la membrana vascular, retardando el déficit neurológico. En metástasis epidurales los corticosteroides alivian rápidamente el dolor y generan rápida recuperación. La dexametasona es el esteroide más utilizado, su beneficio está en relación con la dosis. En 1998 se recomendaban 96 mg/24 horas por tres días y después reducción. Un estudio piloto del Trans-Tasman Radiation Oncology Group (TROG) 01.05 compara 96 mg vs. 16 mg/día, sin encontrar diferencia en sobrevida, pero sí mayor toxicidad con dosis más elevadas de esteroides.4 Otros estudios reportan que dosis altas como 100 mg en bolo intravenoso (IV) seguido de 24 mg cada 6 horas/día durante tres días son una opción adecuada, pero no hay evidencia importante para soportar estas dosis. Por lo tanto, dosis de 16-100 mg por día pueden ser apropiadas.1,3 Se obtiene mayor beneficio cuando se combinan radioterapia y esteroides, hasta 81% de los pacientes son ambulatorios después del manejo vs. 63% cuando sólo reciben radioterapia. La dosis de dexametasona debe disminuirse en forma paulatina cuando se adiciona radioterapia.1
Los analgésicos pueden utilizarse en combinación de esteroides y radioterapia; cuando hay dolor severo se manejan opioides y en dolor neuropático se utilizan gabapentina y amitriptilina.
RADIOTERAPIA
La radioterapia es el estándar de manejo en pacientes con metástasis en columna y datos de compresión medular. Radioterapia sola o combinada con cirugía puede ser una opción terapéutica, aunque es debatible. La radioterapia es más factible de administrar y ofrece menos toxicidad, está indicada en casos de metástasis epidurales, cuando hay lesiones múltiples, en pacientes con tumores radiosensibles y cuando no son candidatos a cirugía. Los resultados con radioterapia son excelentes en los tumores radiosensibles (linfomas, sarcoma de Ewing, mieloma, seminoma y neuroblastoma) y adecuados en cáncer de mama, próstata y células pequeñas de pulmón. La respuesta completa se expresa como recuperación o preservación de la marcha. El alivio parcial o completo del dolor de espalda se observa en 70% a 85% de los pacientes y 80% a 100% permanecen ambulatorios si antes de radioterapia se encontraban así. Hay un 30% de pacientes tratados con radiación que sobreviven un año, pero el tiempo es mayor en quienes son capaces de caminar antes y después de recibir radioterapia, y en aquellos con histología favorable. Pacientes con cáncer de próstata tienen mejoría en la función motora en el 50% a 60% después de radioterapia y en linfoma no Hodgkin que son paréticos a la presentación; en su mayoría son ambulatorios y tienen una larga sobrevida después de radiación.
Los fraccionamientos de radiación más frecuentes son: 30 Gy en 10 sesiones, 40 Gy en 20, 37 Gy en 15 o esquemas muy cortos como 20 Gy en cinco sesiones y 8 Gy en dosis única semanal o dos dosis semanales. Maranzano y colaboradores reportan que este esquema puede ser efectivo en pacientes con pobre estado neurológico.13 En la mayoría de las revisiones no hay diferencia en los resultados funcionales ni en la sobrevida con los diferentes esquemas, pero sí en el control local: esquemas largos ofrecen mejor control que esquemas cortos. Pacientes con corta expectativa de vida (<6 meses), enfermedad metastásica extensa y tumor primario de pulmón, melanoma, sarcoma se benefician de esquemas más cortos, a diferencia de aquellos con mayor expectativa (mieloma, linfoma, cáncer de mama y próstata) que se pueden tratar con esquemas más prolongados.15-17 Se ha observado que pacientes que reciben esquemas más largos de radiación tienen menos porcentaje de recurrencia en el sitio previamente irradiado.16
El tratamiento con radioterapia en años previos utilizaba sólo equipos de cobalto que daban menor protección a órganos de riesgo. En la actualidad la mejor técnica de radiación es con equipos de megavoltaje para ofrecer radioterapia conformal con una dosis superior al volumen blanco e inferior a los tejidos sanos; esto se logra porque el plan de tratamiento se realiza mediante imágenes de TC o IRM que visualizan adecuadamente el sitio de la lesión. Otra modalidad es radioterapia de intensidad modulada (IMRT) en la que es aún menor la dosis a los órganos de riesgo; esta técnica puede usarse en reirradiación con buenos resultados: hasta el 94.7% de control local, 81% alivio del dolor y en el 42% mejoría neurológica.4
La radiocirugía es otra modalidad de tratamiento con una dosis única y grande de radiación en el volumen blanco mediante una guía esterotáctica, son pocos los reportes y el rol es aún limitado en compresión medular.
La braquiterapia es una técnica en la cual se implantan semillas radioactivas (I125) directamente en el sitio de la lesión, pero es una modalidad de irradiación limitada a pacientes con buen estado funcional y una larga expectativa de vida. La cirugía seguida de braquiterapia ofrece buenos resultados incluso con un 84.7% de control local a dos años.4
CIRUGÍA
Es un procedimiento que alivia en forma inmediata la compresión y lleva a estabilidad mecánica directa de la columna vertebral. Es una decisión multifactorial y debe considerarse riesgo/beneficio en cada paciente. La cirugía sola se indica en pacientes en quienes sea factible realizar descompresión quirúrgica y en quienes no pueden recibir radioterapia (tumores poco sensibles, no factibles de reirradiación). Pacientes con metástasis extensas y expectativa de vida <3 meses no son candidatos a cirugía. Pacientes con columna inestable en quienes la descompresión y fijación es la única forma de preservar la marcha deben someterse a cirugía y radioterapia. La descompresión puede indicarse también para impedir disfunción de esfínteres. Cirugía y radioterapia pueden mantener ambulatorios a los pacientes por más tiempo que la radioterapia sola, aunque con las nuevas técnicas de radiación puede haber mejores resultados. 1,3,17
Existen algunos sistemas de clasificación (Harrington, Weinstein-Boriani, Tokuhashi, Tomita,19-22 incluyendo el estado de Karnofsky) que ayudan a definir el tipo de cirugía más adecuado, ya que valoran el grado de deterioro neurológico, colapso vertebral, inestabilidad, número de cuerpos vertebrales afectados y extensión, y finalmente localización del primario.
Laminectomía: Desde los setenta hasta mediados de 1980 se utilizaba laminectomía y detumorización. La primera consiste en remover el arco posterior de la vértebra, un nivel arriba y un nivel abajo del sitio de la compresión, con lo que se logra la descompresión del canal y de la médula espinal. Este procedimiento sólo es efectivo para la compresión posterior, no así para la anterior (más común). Niños con tumores de tejidos blandos o adultos con sarcoma óseo podrían beneficiarse de este procedimiento. Estudios retrospectivos muestran mayor beneficio en pacientes que recibieron radioterapia después de la laminectomía vs. radioterapia sola.1,3,17
Descompresión anterior: Es una resección del cuerpo vertebral con lesión que permite además remover el tumor. Se puede realizar mediante una toracotomía o una disección retroperitoneal (individualizar en cada paciente). Este tipo de procedimiento permite una descompresión neural directa y mantiene la estabilidad. Está indicado en compresión epidural focal, pacientes con buen estado funcional y con paraparesia. El cuerpo vertebral es reemplazado por una prótesis sintética (2-metil metacrilato) y varios instrumentos de fijación, que se colocan adyacentes a los cuerpos vertebrales. La instrumentación puede ser aplicada anteriormente, posteriormente o ambas, según el objetivo de la estabilidad. No se indica injerto óseo porque el lecho tumoral queda con tumor y además la radioterapia puede generar rechazo del mismo. En diferentes estudios retrospectivos y prospectivos no aleatorizados se ha observado mejoría en el 80% de los pacientes en términos de alivio del dolor y estabilidad ambulatoria, pero la estabilidad se mantiene si se adiciona radioterapia. El tiempo para iniciar radiación no es claro pero se propone que sea de tres a seis semanas. El riesgo de complicación puede limitar la opción quirúrgica.1,3,17
Vertebroplastia: Método utilizado como paliación del dolor en lesiones de cuerpo vertebral con o sin colapso. La técnica consiste en la fijación de tornillos o de metacrilato en el pedículo posterior del cuerpo vertebral. El abordaje percutáneo ha sido reportado en estudios retrospectivos, iniciando con Galibert y colaboradores en 1987,4 que indican adecuada mejoría del dolor. Algunas series han informado complicaciones como embolia pulmonar, infarto cerebral, choque cardiogénico y lesión medular por fuga del cemento dentro del canal medular. El único estudio prospectivo en este procedimiento es multi-institucional fase I/II del Japan Interventional Radiology in Oncology Study Group (JIVROSG) 0202, y los reportes en términos de alivio del dolor son similares a los ya referidos.13
El mayor beneficio de vertebroplastia se ha visto en pacientes con mieloma, con alivio del dolor en el 83% de los casos. Cuando se compara este abordaje con radioterapia se benefician más los pacientes con vertebroplastia porque el alivio es inmediato luego del procedimiento (primer día) y con radiación se alcanza el control del dolor después de una a dos semanas.17,22,23
Quimioterapia y hormonoterapia: El tratamiento con quimioterapia en compresión es limitado y se reserva a tumores quimiosensibles. Tumores en niños como neuroblastoma, enfermedad de Hodgkin y tumor germinal tienen buena respuesta. El tratamiento combinado con cirugía o radioterapia es mejor por lo que quimioterapia sola únicamente se indica en pacientes no candidatos a los manejos previos.
El manejo hormonal sólo se indica en cáncer de mama y próstata y generalmente asociado a cirugía o radioterapia.1
¿ COMPLICACIONES
La cirugía es una buena opción de manejo pero debe ser selectiva para ciertos pacientes, previa identificación de factores pronósticos, debido a la dificultad de la técnica, el riesgo de complicación (10-53%) y la mortalidad perioperatoria (3-10%). La complicación más relacionada con radiación es la mielopatía, pero en la actualidad con las nuevas técnicas de radioterapia puede disminuir hasta 1%, por lo que la accesibilidad y el menor riesgo la hacen una excelente opción terapéutica.1,3
¿ PRONÓSTICO
La sobrevida en promedio oscila entre tres y seis meses. El pronóstico es individualizado, ya que depende de todos los factores relacionados con el paciente y el tumor, pero indudablemente el diagnóstico oportuno y el tratamiento ideal pueden mejorar la calidad de vida y la misma sobrevida.
Correspondencia: Dr. Efraín A. Medina Villaseñor.
Cirujano Oncó-logo, Hospital Ángeles Metropolitano. Tlacotalpan No. 59, Torre Diamante, Consultorio 735, Col. Roma Sur, 06760, México, DF.
Teléfono: 5858 4039.
Página web: www.oncologiabetania.com
Correo electrónico:efra73@hotmail.com