Introducción: El cáncer de mama localmente avanzado en mujeres, requiere de un tratamiento multidisciplinario, puesto que tiene un comportamiento más agresivo.
Objetivo: Determinar sobrevida total y libre de enfermedad, así como control local y factores pronósticos, relacionados con el manejo otorgado en nuestra institución en este patología.
Material y método: Estudio longitudinal, descriptivo y retrospectivo, de pacientes con cáncer de mama en etapa clínica III, tratados en la Unidad de Oncología del Hospital General de México, durante el periodo comprendido entre enero de 2005 a julio de 2010. El análisis estadístico mediante el sistema estadístico SPSS versión 17, utilizando frecuencias, prueba de ji cuadrada, regresión de Cox para análisis uni y multivariado y determinación de curvas de sobrevida de Kaplan-Meier.
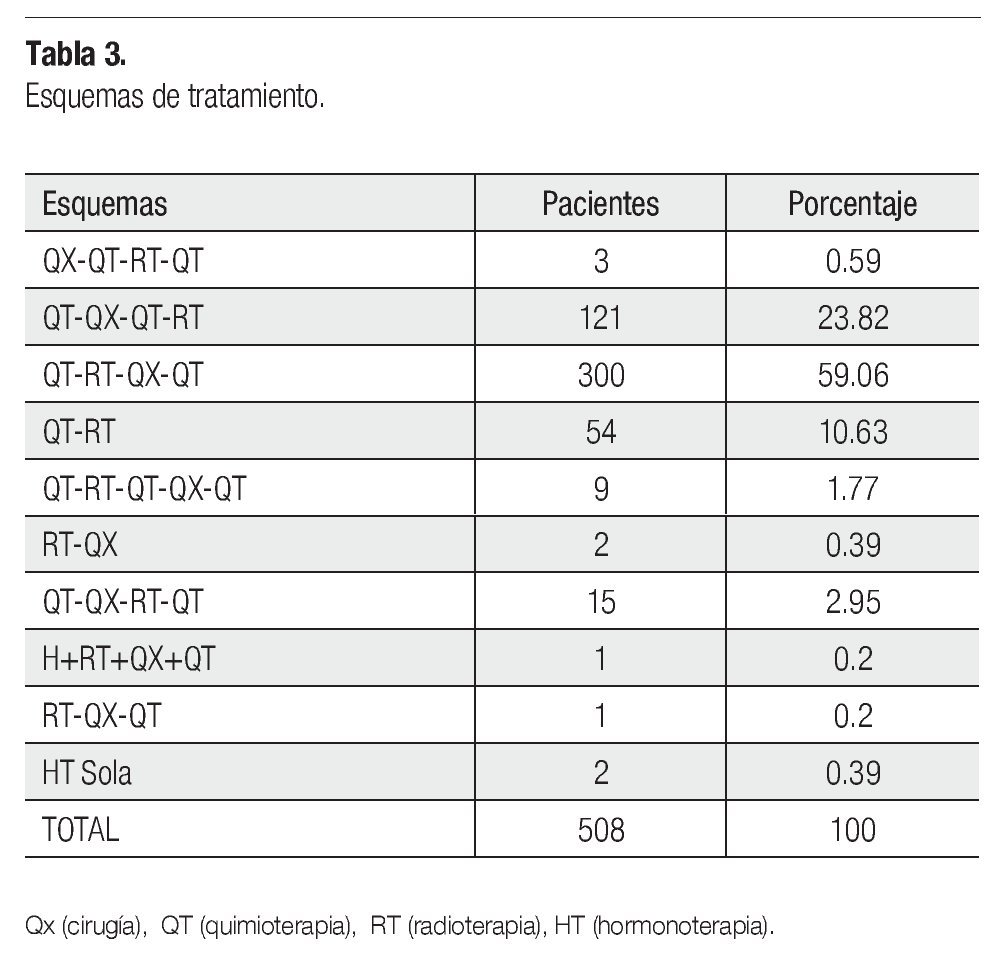
Resultados: Quinientas ocho pacientes fueron incluidas, la media de edad fue 51.64 años. Las pacientes se manejaron con diversos esquemas de tratamiento, dos fueron las principales terapias: 59.9% recibieron quimioradioterapia secuencial (neoadyuvante) prequirúrgica, seguido de quimioterapia de consolidación y 23.8% recibieron quimioterapia neoadyuvante prequirúrgica, seguido de quimioterapia de consolidación y radioterapia adyuvante, 17.1% se manejaron con otros esquemas. Cuatrocientos treinta y cinco se llevaron a mastectomía radical modificad, 62.3% fueron del grupo quimioradioterapia neoadyuvante, 36% del grupo de quimioterapia neoadyuvante, 0.9% recibió radioterapia prequirúrgica y 0.6% no recibió neoadyuvancia. La histología más frecuente fue carcinoma ductal infiltrante, la media del tumor patológico residual fue 1.9 cm, 385 tuvieron bordes, lecho, invasión linfovascular y perineural negativos y 187 ganglios negativos. El 49.9% tuvieron receptores positivos, 62.9% Her2/Neu negativo y 73 triple negativo. La media de seguimiento fue de 37.17 meses, la sobrevida total fue 95.9% y la sobrevida libre de enfermedad de 87.8%, El mejor resultado histopatológico pos quirúrgico fue con el esquema de quimioradioterapia neoadyuvante, siendo significativa con ji cuadrada (p<0.001), pero como predictor de sobrevida y control tumoral el grupo de quimioterapia neoadyuvante prequirúrgica fue mejor (p<0.001). Sólo los factores histopatológicos en un análisis multivariado, fueron significativos para sobrevida (p<0.008). Al final del estudio 74.4% estaban sin actividad tumoral (62.8% vivas, 15.2% pérdidas) y 25.6% con actividad (6.3% vivas y 11.6% pérdidas).
Conclusión: El control tumoral y sobrevida en el esquema de quimioterapia neoadyuvante prequirúrgica, ofrece resultados comparables con lo reportado en la literatura.
Introduction: The locally advanced breast cancer in women needing a multidisciplinary treatment, because havens a behavior more aggressive.
Objective: Determine total survival and disease free survival, so as local control and prognostic factors relationships with the management given in our institution in this pathology.
Material and method: Longitudinal, descriptive and retrospective study of patients with breast cancer in clinical stage (III) treated in the Oncology Unit from General Hospital of Mexico, from January 2005 to July 2010. The statistic analyses was with version 17 SPSS, utilizing frequencies, Chi2 test, Cox regression model for analyses uni and multivariate and Kaplan-Meier survival curves.
Results: Five hundred and eight patients were includes, the median age was 51.64%. To be given different schedules of treatment, two were the principles: 59.9% received chemo-radiotherapy sequence (neoadyuvant) presurgical followed of chemotherapy of consolidation, 23.8% received neoadyuvant chemotherapy presurgical followed of chemotherapy of consolidation and adyuvant radiotherapy, 17.1% to be management with others schedules. Four hundred thirty-five to taken for modified radical mastectomy, the histology most frequently was infiltrate ductal carcinoma, the medium pathology tumor residual was 1.9 cm, 385 patients had margin, surgical bed, linfo-vascular invasion and perineural negatives and 187 nodes negatives. The 49.9% haven receptors positives, 62.9% Her2/Neu negative and 73 negative triple. The follow-up was 37.17 months, the total survival was 95.9% and disease free survival of 87.8%, the best histopathology postsurgical result was got-up with chemoradiotherapy neoadyuvant schedule, been significant with Chi2 (p<0.001), but as survival predictor and tumoral control the group with neoadyuvant chemotherapy presurgical was best (p<0.001)) and only the histopathology factors in the multivariate analyses were significant for survival (p<0.008). At finish to study 74.4% were without tumoral activity (62.8% lives and 15.2% lost) and 25.6% with activity (6.3% lives and 11.6% lost).
Conclusion: The control tumoral and survival in the schedule of neoadyuvant chemotherapy presurgical given results similar with the literature.
¿ INTRODUCCIÓN
El cáncer de mama es la neoplasia maligna más común en mujeres. Actualmente, hay 4.4 millones de mujeres vivas con enfermedad.1,2 El tratamiento óptimo de cáncer de mama localmente avanzado (CMLA), requiere un abordaje multidisciplinario para lograr una efectividad máxima.3
El CMLA es un término relativamente inespecífico: se refiere a tumores voluminosos e invasivos con diversos grados de afección en la piel de la mama y/o de la pared torácica, o bien casos con afección ganglionar axilar o supraclavicular. De forma más común se refiere a estadios III, con enfermedad primaria y ganglionar avanzada sin evidencia de metástasis a distancia.3,4
El CMLA puede tener procesos biológicos divergentes, mujeres de edad avanzada pueden tener un tumor biológicamente indolente que se caracteriza por la capacidad de respuesta al tratamiento hormonal, por una alta expresión de receptores de estrógenos (RE), bajo grado y un índice proliferativo bajo.5 Por el contrario, pacientes jóvenes pueden presentar RE-negativos, tumores de alto grado con un índice de proliferación acelerado, aunque ambas presentan clínicamente una enfermedad localmente avanzada, el comportamiento biológico será diferente.
El cáncer de mama inflamatorio (CMI) es un subtipo agresivo de CMLA. Los pacientes tienen una peor evolución, porque las características biológicas incluyen: grado nuclear alto, menor expresión de RE y mayor expresión de marcadores asociados como p53, receptor del factor de crecimiento epidérmico (EGFR, por sus siglas en inglés), HER2, RhoC y GTPasa.6-8
La expresión de RE y progesterona (RP) en las células tumorales, llevó al inicio de terapias antiestrógeno, a que aquellos RE-positivo respondan a antiestrógenos y los RE-negativo, eran refractarios.9 En un análisis de 189 tumores de mama, mostraron que la amplificación del oncogén HER2/neu ocurre en el 25% a 30% de las muestras10 y predice pobres resultados clínicos. Esta es la base para el desarrollo de terapias blanco.11,12
Los subtipos moleculares en cáncer de mama predicen resultados clínicos como respuesta al tratamiento, sobrevida libre de enfermedad (SVLE) y sobrevida total (SVT). Varias revisiones han confirmado estos subtipos: 1) Luminal (subtipo A y B) con RE-positivos, 2) subtipo Basal-Like (BL) representan hasta el 15% al 20% de todos los cánceres de mama, caracterizado por una alta expresión de genes comunes al mioepitelio y genes de proliferación, pero baja expresión RE y HER2, y 3) el erbB2-like/HER2-like (sobreexpresado), que muestra alta expresión de genes de proliferación y HER2-relacionados, así como baja expresión de genes de RH relacionados.13-15 En una revisión de 49 pacientes con CMLA, se determinó que no hay diferencia significativa en la supervivencia entre estos subtipos.13 Los subtipos BL y HER2-sobreexpresado mostraron peor pronóstico por un tiempo de progresión y SVT cortos.
Los pacientes del subtipo luminal A (LA), tuvieron mejor pronóstico en comparación con todos los grupos, y el luminal B (LB) tuvo un resultado intermedio. Los subtipos luminal son los más heterogéneos con respecto a la biología y los resultados.13-17 Tumores LB tienen una expresión variable de HER2 y son más proliferativos que LA, así éstos tienen peores resultados comparados con LA, a pesar de ser RE-positivo. La asociación del subtipo molecular con características clínicas, difieren significativamente con la edad, raza, menopausia, afección ganglionar, grupo histológico, grado tumoral e índice mitótico.18 Estudios subsecuentes han confirmado que tumores basal-like son más frecuentes en pacientes jóvenes y afroamericanas,19,20 y tienen características más agresivas: grado nuclear e índice mitótico alto e histología desfavorable.
Recientemente se identificó un grupo de pacientes denominadas triple negativo (TN), representa hasta el 15% de los casos y tienen similitud con el subtipo molecular BL, porque no hay expresión de HER2-neu y los RH son negativos.17 Generalmente son: mujeres jóvenes (premenopáusicas) afroamericanas en etapa clínica (EC) III y IV, grado 3 y asociadas al subtipo BL. Además la mutación de p53 y del gen o la vía de BRCA1 es frecuente. Tienen pobre pronóstico con alto porcentaje de metástasis viscerales, pulmonares y cerebrales.17,20
El tratamiento multidisciplinario de CMLA con terapia sistémica, cirugía y radioterapia, ha mejorado la sobrevida. Antes del uso de quimioterapia, la supervivencia a cinco años era de aproximadamente 25%, en pacientes con enfermedad localmente avanzada.21 El tratamiento combinado produce una tasa de supervivencia a cinco años en pacientes EC IIIA quirúrgica y IIIB no quirúrgica del 80% y 45%, respectivamente.21 Sin embargo, pacientes con EC III y predictores pronóstico idénticos, siguen teniendo resultados muy variables, porque muchas desarrollan una rápida progresión de la enfermedad a pesar del tratamiento actual. El descubrimiento de los subtipos moleculares ha evidenciado resultados heterogéneos en CMLA, lo que lleva a identificar predictores de respuesta al tratamiento y supervivencia en función del perfil molecular del tumor.
El tratamiento de pacientes TN es complejo, con mutación de p53 hay resistencia a las antraciclinas. El subtipo molecular BL tiene buenos resultados con paclitaxel y con mutación de BRCA1, el manejo con ciclofosfamida y doxorrubicina es una opción.19-21
El uso de quimioterapia (QT) preoperatoria ha proporcionado la oportunidad para investigar los mecanismos moleculares de la respuesta del tumor a la terapia,22-31así se demostró que la tasa de respuesta patológica completa (RPC) (definida como tumor no invasivo en el tejido mamario y axilar removido en la cirugía), difiere considerablemente entre los subtipos moleculares.
El subtipo LA tiene una tasa muy baja de RPC en pacientes tratados con una variedad de regímenes de QT preoperatoria, por el contrario hay una alta tasa de respuesta en BL y subtipos HER2. El subtipo LB se asocia con una tasa de respuesta intermedia.25-30
Los objetivos de QT neoadyuvante (NAD) en CMLA, incluyen disminución del tumor primario para permitir cirugía (incluyendo cirugía conservadora en algunos casos), erradicación temprana de micrometástasis, prolongación de la supervivencia y mejoría en la calidad de vida. Los estudios iniciales de QT NAD vs adyuvante, fueron basados en el NSABP-B18 y B27, éstos concluyen que la RPC es un factor predictor de sobrevida con la neoadyuvancia, pero en enfermedad inicialmente quirúrgica, las ensayos de QT NAD vs adyuvante mostraron resultados equivalentes.32-34
Los primeros estudios de QT NAD en CMLA, basado en regímenes de antraciclinas, obtienen una tasa de RPC del 4% al 33% y mejoran la tasa de supervivencia (25% a 10 años), en comparación con la experiencia histórica de terapia local sola.35-39 Estudios más recientes se han centrado en la incorporación de nuevos agentes (en particular, taxanos). Un estudio fase III en tumores de gran tamaño (≥ 3 cm), mostró superioridad en la adición secuencial de cuatro ciclos de docetaxel, después de cuatro ciclos de neoadyuvancia con antraciclinas (ciclofosfamida, vincristina, doxorrubicina y prednisona, CVAP) en comparación con ocho ciclos seguidos de este régimen.40,41La respuesta clínica temprana, se asocia con mayor RPC y mejores resultados a largo plazo, no hay mejoría con cursos medios de QT con interrupción basada en la presencia o ausencia de respuesta. En el estudio GEPAR TRIO,42,43 los pacientes recibieron dos ciclos de docetaxel, doxorrubicina y ciclofosfamida (TAC) neoadyuvante, el 30% no respondieron clínicamente (definido como la falta de disminución del tamaño menor al 50% por ecografía) y se aleatorizaron para recibir cuatro ciclos más, de TAC y cuatro de capecitabina y vinorelbina antes de cirugía. La tasa de RPC fue de 5.3% y 6% para TAC y vinorelbine y capecitabine, respectivamente. El ensayo (ABERDEEN) evaluó la respuesta clínica temprana,44 todos los pacientes recibieron cuatro ciclos de neoadyuvancia con CVAP y en base a la respuesta, los pacientes con enfermedad estable o progresiva fueron cambiados a cuatro ciclos de docetaxel. La RPC en éstos fue del 2%, lo que sugiere que tumores que no responden a un régimen de QT es poco probable que muestren una respuesta mayor a otro. Los pacientes con respuesta clínica parcial o completa en los primeros cuatro ciclos de CVAP, se asignaron al azar para recibir cuatro ciclos más de CVAP o cuatro de docetaxel, la RPC fue dos veces mayor en el grupo que cambió a docetaxel (31% vs 16%) y también la SVLE y SVT fueron significativamente superiores.44 Ambos estudios sugieren que un plan de tratamiento, debe ser diseñado desde el principio y no debe ser alterado basado en la respuesta temprana, a menos que haya evidencia clara de progresión de la enfermedad. En cambio, en la terapia en pacientes que no responden clínicamente, no ha demostrado aumento en la RPC o SVT. Los pacientes con progresión durante la NAD sistémica, se deben cambiar a un régimen alternativo que pueda ofrecer mejor resultado.44
La alta tasa de respuesta con QT NAD, incrementa la posibilidad de una cirugía más conservadora (lumpectomía más disección ganglionar) en lugar de una mastectomía radical (manejo estándar), ya que siguen los mismos principios que en etapas iniciales, y en ciertas instituciones se indica en seis pacientes seleccionadas. La recurrencia en la mayoría de las pacientes es generalmente a distancia, así la posibilidad de una cirugía más conservadora no compromete SVLE o SVT, y en recurrencia local es posible el rescate con mastectomía.45
El tratamiento con radioterapia (RT) sola en CMLA, no ofrece buenos resultados (la tasa de control local es de 54% a 64% y de SVLE menor del 25%). La RT NAD no es un régimen establecido en CMLA, aunque algunos reportes indican que puede ofrecer un procedimiento quirúrgico más conservador con adecuado control, hay un efecto aditivo o supraaditivo al combinarla con QT. El manejo QT-RT concomitante como NAD es aún más raramente utilizado, son pocos los estudios que muestran una mayor RPC (por ejemplo, estudio S14, fase II).46
Generalmente el uso de RT es como adyuvancia posmastectomía, y el impacto del subtipo molecular en la respuesta a la radiación, fue recientemente investigado con 1 000 pacientes radiadas posmastectomía incluidas en el estudio Danés (DBCG82).47 Las características de alto riesgo incluyeron tumores grandes (mayor de 5 cm), ganglios linfáticos positivos o invasión del tumor primario a la piel adyacente o fascia pectoral. Los subtipos BL y HER2 sobreexpresado, no mostraron una reducción en la recurrencia en paciente radiadas posmastectomía, en comparación con el subtipo luminal. Una explicación para el aumento de la tasa de recurrencia local, podría estar relacionada con la agresividad intrínseca de las células supervivientes de estos tumores.47 En el análisis Harvard, 793 mujeres tratadas con cirugía conservadora seguida de radiación,48 tuvieron un incremento significativo en recurrencia local a los cinco años en BL y subgrupos HER2-sobreexpresado (7.1% y 8.4%, respectivamente) en comparación con subgrupos luminal A y B (0.8 % y 1.5%, respectivamente). Reportes previos no indican aumento en la recurrencia local ipsilateral en BL y TN tratadas con cirugía conservadora y radioterapia.49,50 Hay algunas diferencias entre estos reportes y el estudio de Harvard, la tasa global de recurrencia local fue muy superior en estudios anteriores (13% de Dent y colaboradores,49 17% para Haffty y colaboradores50 vs 1.8% Nguyen y colaboradores48). Aún con la discrepancia en la recurrencia en estos reportes, todos muestran aumento en la tasa de metástasis a distancia (viscerales) y disminución de SVT en pacientes BL. Tumores LA desarrollan mayor enfermedad metastásica a hueso y HER2 sobreexpresado, BL y TN tienen predilección por metástasis a cerebro.51,52 Este efecto puede ser causado por falta de penetración de trastuzumab (TZM), a través de la barrera hematoencefálica. Hay un efecto protector en tumores RE-positivo para metástasis cerebrales, lo que sugiere que no tienen la propiedad biológica de metastatizar.48,50
Tumores RH negativo/HER2 positivo, pueden tener un beneficio menor a la radiación después de mastectomía, lo que indica una relativa radioresistencia de este subtipo. Los datos aunque limitados indican que la sobreexpresión de HER2, se relacionan con radioresistencia.53,54 La terapia blanco con TZM se ha convertido en una terapia estándar para pacientes HER2 positivo, pudiendo alterar la sensibilidad de este subtipo a la radiación y resultar en una mejoría del control local, sin embargo los datos clínicos y resultados aun son limitados.
La consolidación de QT posquirúrgica debe indicarse, los estudios reportan beneficio en el control de la enfermedad. El régimen utilizado en NAD es el que debe continuar, si hubo respuesta o valorar el resultado patológico para definir el mejor esquema que incluya taxanos. Aún es tema de debate, el mejor agente de QT que debe indicarse para consolidar. En pacientes con progresión de la enfermedad, deben valorarse otras líneas de quimioterapia, así como terapia molecular.54
El objetivo de este estudio es mostrar los resultados en cuanto a sobrevida total, sobrevida libre de enfermedad, control tumoral y factores pronósticos obtenidos con el manejo oncológico de pacientes con CMLA en nuestro Servicio.
¿ MATERIAL Y MÉTODO
Estudio longitudinal, descriptivo y retrospectivo de pacientes con CMLA, tratados durante el periodo comprendido entre enero de 2005 a julio de 2010, en el Servicio de Oncología del Hospital General de México.
Se incluyeron pacientes de cualquier edad con diagnóstico de cáncer de mama, confirmado por biopsia en EC III (cualquier T, N2M0, T3N1M0, cualquier T, N3M0 y T4, cualquier N, M0). La terapia debía otorgarse en el Servicio de Oncología y tener mínimo, seis meses de seguimiento. Se excluyen pacientes con enfermedad a distancia al momento del diagnóstico, lo mismo que pacientes con enfermedad bilateral sincrónica o metacrónica o bien con segundo primario. Pacientes que recibieron alguna modalidad de tratamiento fuera del Hospital se excluyeron, igualmente con un seguimiento menor al mencionado.
Los datos de las variables del estudio fueron obtenidos, a través del expediente clínico del archivo del Servicio de Oncología. La determinación de receptores hormonales y HER2/Neu fue con estudio inmunohistoquímica (IHQ), mediante la muestra de biopsia diagnóstica o de la pieza quirúrgica, en caso de cirugía (mastectomía radical modificada, MRM). La evaluación de toxicidad por radioterapia fue mediante la escala del RTOG y de quimioterapia con NCCI. Posteriormente, los datos se analizaron mediante el sistema estadístico SPSS versión 17, utilizando frecuencias, prueba de ji cuadrada, regresión de Cox para análisis uni y multivariado y determinación de curvas de sobrevida de Kaplan-Meier.
¿ RESULTADOS
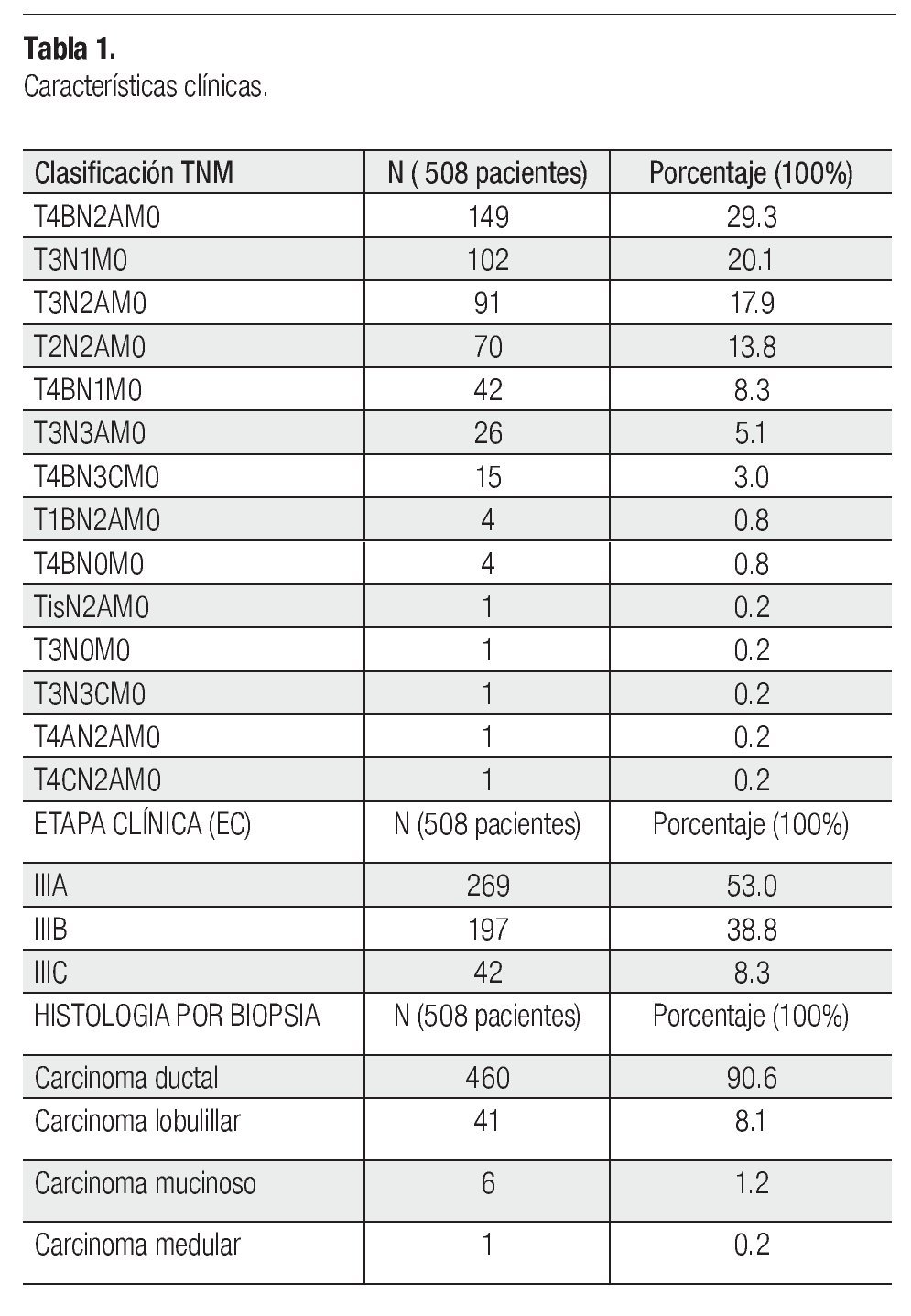
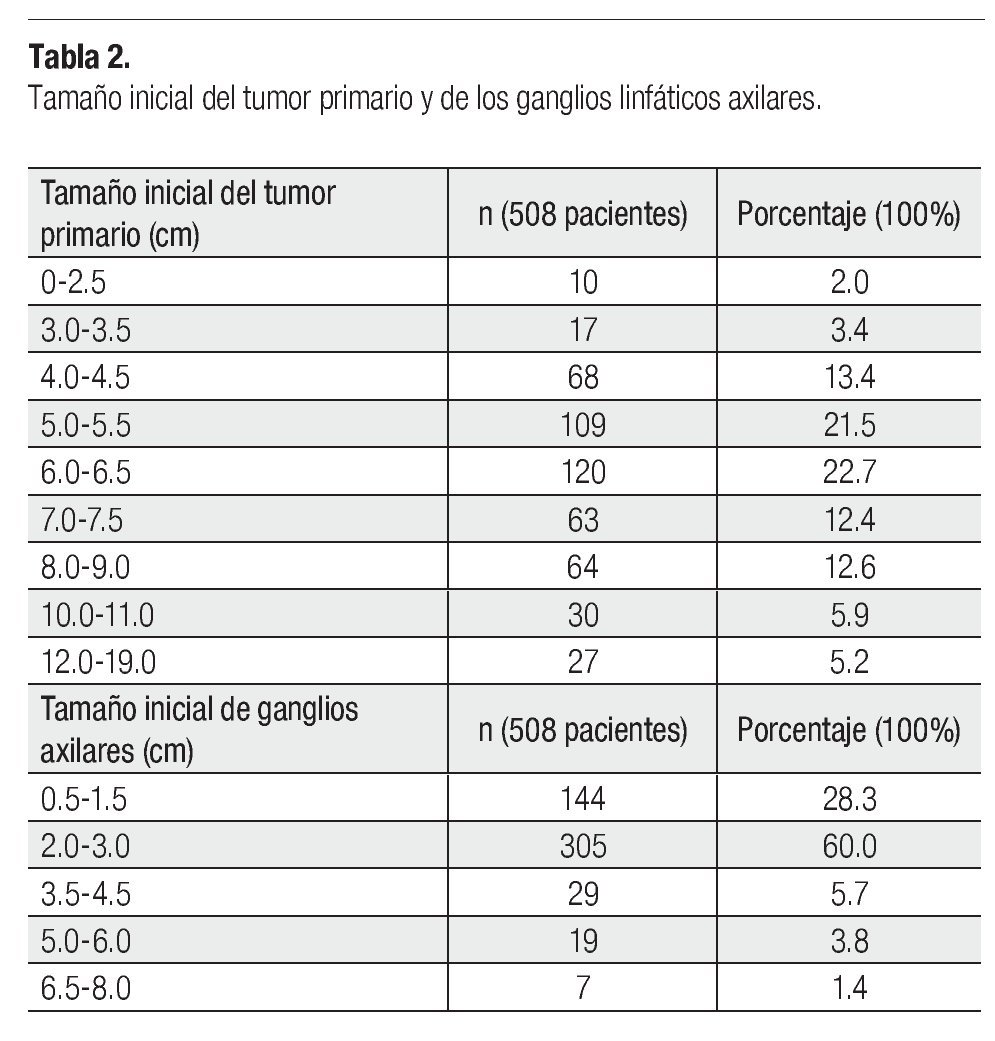
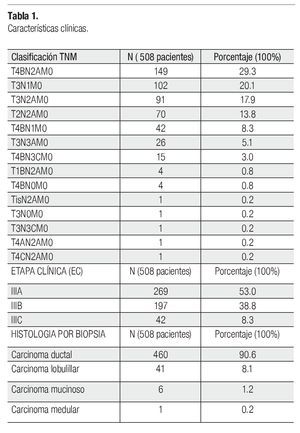
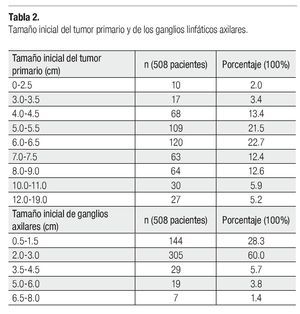
Se incluyeron 508 pacientes de 800 analizadas (292 se excluyeron por falta de criterios). La media de edad fue 51.64 años (rango entre 26-102). Trescientos ochenta y cinco pacientes (75.8%) no tuvieron enfermedades comórbidas. La clasificación TNM, EC y subtipo histológico se muestran en la Tabla1. La media del tamaño inicial del tumor primario fue de 6.4 cm (rango 0-19) y la de ganglios axilares 2.3 cm (rango 0.5-8), la distribución por tamaño se muestra en la Tabla 2. Las ganglios axilares clínicamente estaban libres en el 69.9% (335 pacientes), fijos 21.7% (110) y no reportados 8.5%.
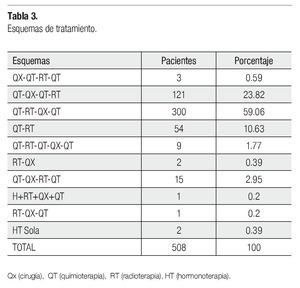
Diferentes esquemas de tratamientos fueron planeados, pero hubo dos principales: 300 pacientes (59.1%) se programaron con QT-RT secuencial (neoadyuvante) prequirúrgica (MRM más disección axilar nivel I y II), seguida de QT de consolidación. Ciento veintiún pacientes (23.8%) a QT neoadyuvante prequirúrgica, seguido de QT de consolidación y RT adyuvante, y el 17.1% a otros esquemas de tratamiento (Tabla 3).
Cuatrocientos cuarenta y cinco pacientes (87.6%) de 508, recibieron QT NAD en alguno de los esquemas de tratamiento, 409 de 445 (91.9%) recibieron el esquema habitual 5-fluroracilo, adriamicina y ciclofosfamida (FAC), 28 pacientes FAC-paclitaxel, en cuatro se cambió adriamicina por metotrexato (CMF), cinco únicamente AC, uno recibió docetaxel y otra paclitaxel. El número de ciclos también fue heterogéneo, el máximo 16 y el mínimo un ciclo, 85.1% (379 pacientes) recibieron cuatro ciclos. Seis de 28 pacientes que se manejaron con FAC-paclitaxel, recibieron ocho ciclos y dos casos 16. La respuesta a la QT NAD fue en el 35.7% (159 pacientes) menor del 50% en el tumor primario, pero mayor del 50% a nivel ganglionar, 31% (138) tuvo respuesta mayor del 50%, tanto en el primario como a nivel ganglionar y 17.5%, la respuesta fue mayor del 50% en el primario, que a nivel ganglionar. Treinta y seis pacientes (8.1%) tuvieron respuesta clínica completa (RCC), 21 no presentaron respuesta y en 13 sin reporte. La toxicidad por QT en 39.10% (174 pacientes) fue hematológica grado uno, del tipo de la neutropenia, 20% (89) hematológica grado dos, 16.1% gastrointestinal grado uno y 5.6% grado dos. El 18.8% (84 pacientes) no tuvo toxicidad.
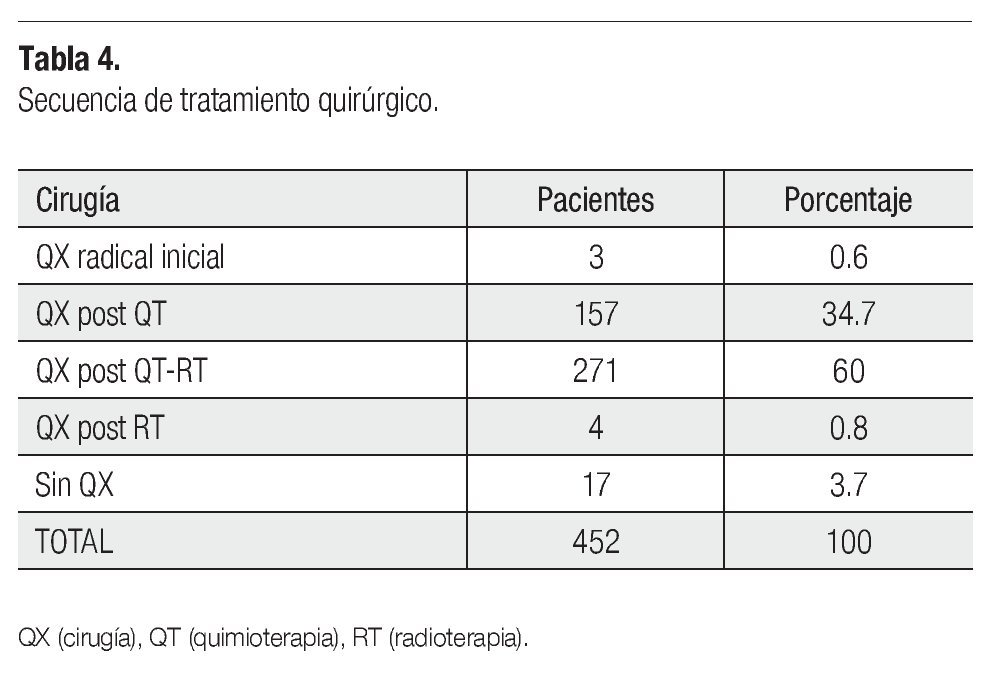
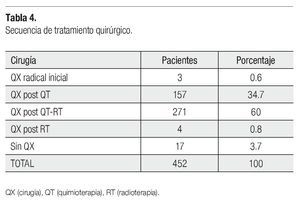
Trescientos trece pacientes fueron programadas inicialmente para recibir RT prequirúrgica: dos con RT más HT, dos con RT sola y 309, recibieron QT previamente en algún esquema. Veintiún casos con RCC a la QT no recibieron RT, así 292 se manejaron con RT preoperatoria: 273 con RT convencional (energía de 1.25mV) con dos campos tangenciales y un campo axilosupraclavicular, y 19 con RT conformada (18 con 6mV y uno con 10mV), con los mismos campos. La dosis indicada fue 50Gy en 288 pacientes, 50.4Gy en un caso, 35Gy en dos y 30Gy en uno. Las dosis hipofraccionadas fueron para acortar el tiempo de tratamiento, en las dos pacientes que se manejaron solo con RT. La respuesta en 230 de 292 pacientes (78.7%) fue de más del 50%, en el tumor primario y a nivel ganglionar, 45 respondieron mayor al 50% en el primario pero no a nivel ganglionar. Trece tuvieron mayor del 50%, respuesta ganglionar y menor del 50% primario, sobre todo en tumores mayor de 8 cm. Dos pacientes sin respuesta, se enviaron a una segunda línea de QT y en dos no se reportó respuesta. Ochenta y cuatro pacientes no tuvieron toxicidad, 111 presentaron radiodermitis seca grado uno y 50 grado dos, en la región de la cicatriz, seis pacientes radiodermitis húmeda grado uno y tres pacientes grado dos, a nivel axilar. Radiodermitis mixta grado uno y dos en cinco casos, en 33 no se reporta. Cuatrocientos treinta y cinco de 452 pacientes fueron operadas, porque 17 suspendieron cirugía por motivos personales. Ciento treinta y seis pacientes que recibirían QT neoadyuvante en los esquemas programados, aumentó a 157 porque 21 tuvieron RCC a la QT. La Tabla 4 muestra la modalidad de cirugía.
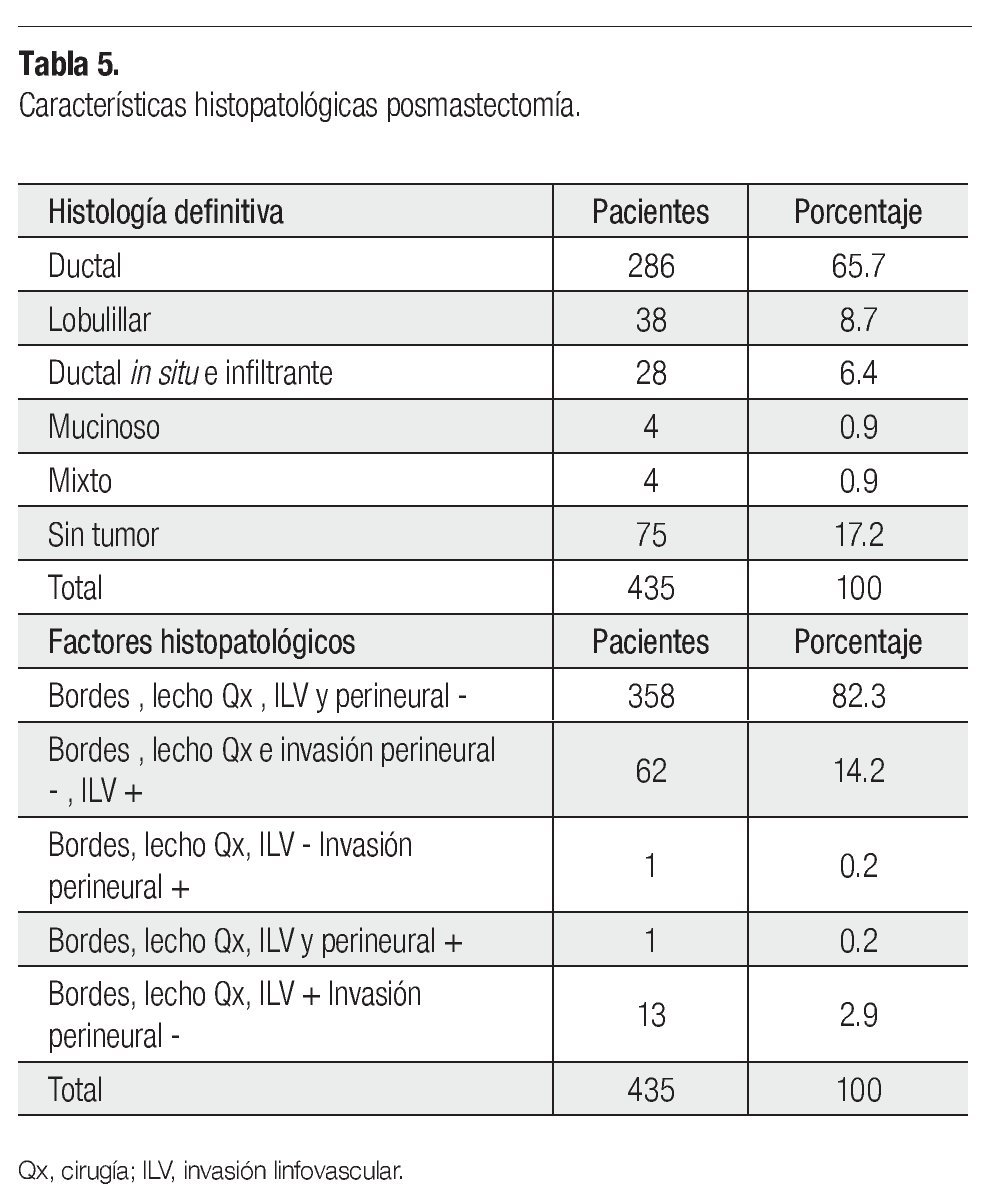
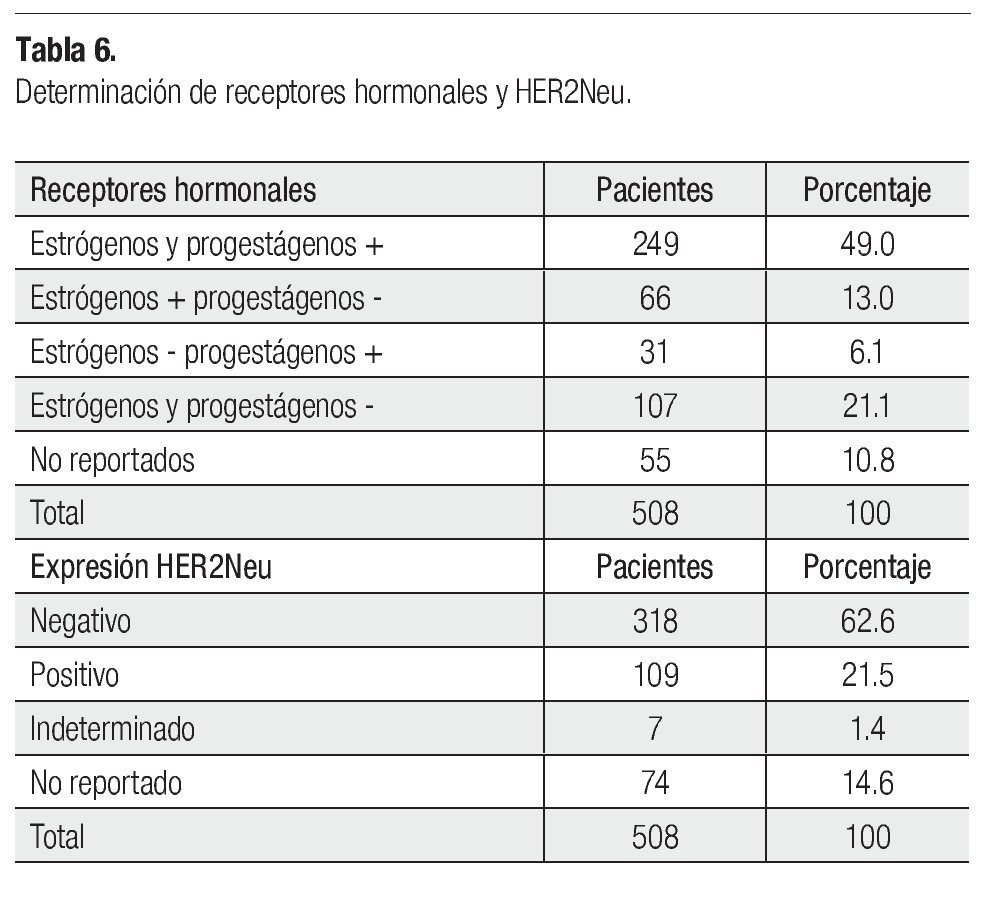
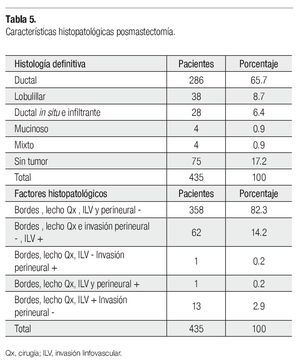
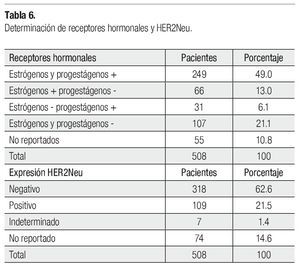
La histología definitiva y los factores histopatológicos (FHP) se indican en la Tabla 5. La media del tamaño del tumor patológico fue 1.9 cm (0-13), en 22 de 435 pacientes no se reportó el tamaño, 75 estaban sin tumor, el residual en 114 fue 2 cm, el resto fue 1 cm o 3 cm y un caso de 13 cm. La media de ganglios patológicos positivos fue 2.85 (0-49), uno de 435 no se reportó, 172 pacientes tuvieron uno a cuatro positivos, ocho tuvieron 18 y un caso 49, el resto quedó distribuido, 187 tuvieron ganglios negativos. Si consideramos RPC tanto del primario como a nivel ganglionar, 45 de 435 la tuvieron. El número de GL resecados no se reportó en tres casos, 72 se resecaron cinco a 10, 149 (11-15), 132 (16-20), 51 (21-25) y 28 (26-30). En la prueba ji cuadrada de Pearson hay significancia estadística del menor tamaño residual y ganglios positivos, así como mayor número de éstos resecados (p<0.001, p<0.002 y p<0.001, respectivamente), en el esquema QT-RT secuencial prequirúrgica. Pero sin significancia en la RPC (p=0.13) y FHP (p<0.4), aunque en un análisis univariado éste último si es significativo (p=0.0001), con este esquema. En la Tabla 6, se presenta la expresión de RH y de HER2Neu. Setenta y tres de 508 pacientes fueron TN.
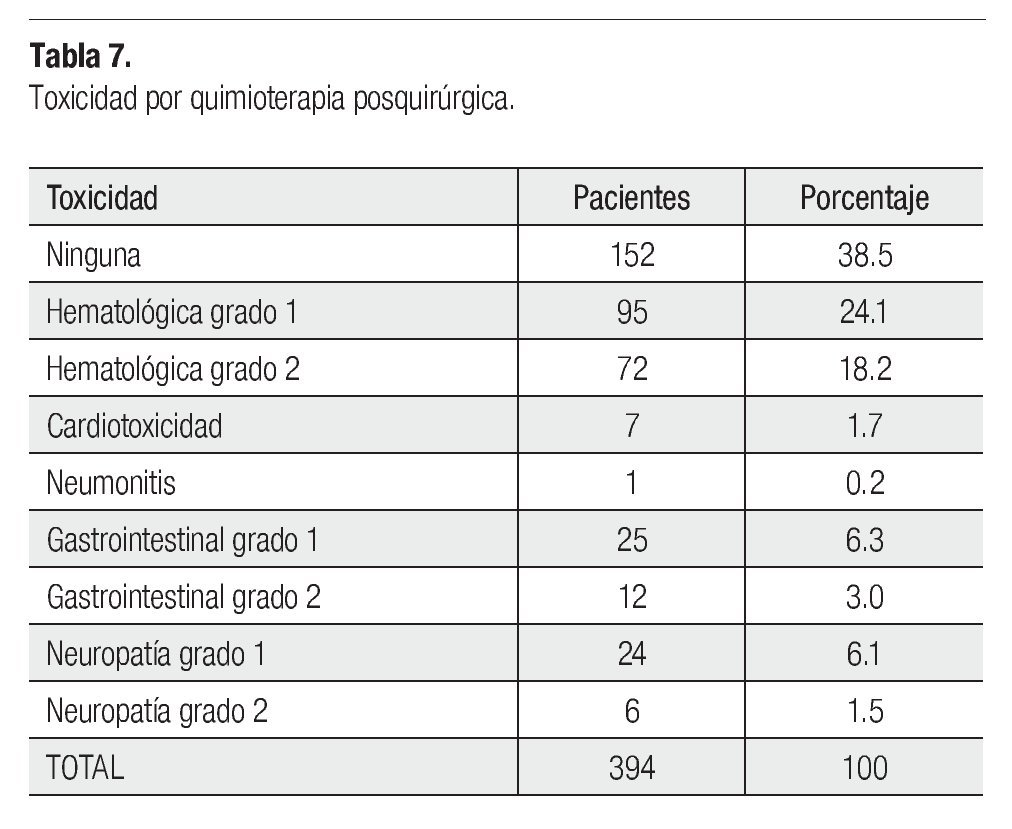
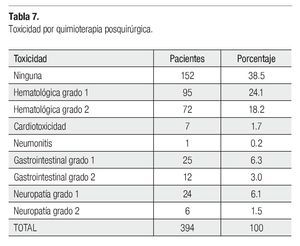
Solamente 394 de 435 operadas, recibieron QT posquirúrgica: 386 como complemento de la neoadyuvancia, tres adyuvante, cinco técnica de Sándwich con RT, 39 no consolidaron la NAD y dos que recibieron RT preoperatoria sola, no recibieron QT adyuvante. El esquema de QT más utilizado tanto para adyuvancia como consolidación fue FAC en 304 pacientes, paclitaxel en 55 y otros esquemas (19 carboplatino-paclitaxel, nueve paclitaxel-trastuzumab) en 35 por mayor tamaño residual patológico, ganglios positivos y/o HER2Neu positivo. Trastuzumab se utilizó en 10 casos por ser poco accesible y por toxicidad cardiaca, determinada con dos reducciones consecutivas de la fracción de eyección (menor del 75%). La media de número de ciclos de QT fue 4.3 (uno a 15), 328 de 394 pacientes recibieron cuatro ciclos, 23 casos tres ciclos y 16 recibieron 12 (paclitaxel semanal), el resto se distribuyó. La toxicidad por QT posquirúrgica se observa en la Tabla 7.
La radioterapia adyuvante se otorgó a 155 pacientes, 21 de éstas fueron las que por respuesta completa a QT continuaron con cirugía, siete no recibieron adyuvancia por motivos propios. Ciento cincuenta y cuatro recibieron 50Gy y un caso 30Gy, 141 se manejaron con energía de 1.25 mV (139 con campos tangenciales y axilosupraclavicular y dos sólo tangenciales), y 14 casos con RT conformal (11 con 6mV y tres con 10mV).
En trescientos cuatro de 508 pacientes se manejó HT (262 tamoxifen, TMX y 42 anastrazol) y dos recibieron TMX, como única modalidad de manejo en el estudio.
El esquema radical de QT-RT secuencial, se otorgó en 54 casos por gran volumen tumoral. Cuarenta y cuatro recibieron 50Gy y el resto dosis menores. Seis ciclos de QT fue lo más común, tres casos recibieron hasta 20 ciclos porque se utilizó una tercera línea de QT.
La media de seguimiento fue 37.17 meses (siete a 79). Al final de la terapia multimodal, 428 pacientes (84.3%) respondieron y estaban sin actividad tumoral (AT) y 80 con actividad: 29 con persistencia, 10 enfermedad a distancia (EAD) y 41 persistencia más EAD.
Mediante ji cuadrada de Pearson se correlacionó mayor respuesta al tratamiento con los dos principales esquemas programados, siendo significativo (p=0.001). En el grupo QT-QX-QT-RT respondieron 120 de 121 y en el QT-RT-QX-QT, 275 de 300. En los otros esquemas, sólo 33 de 87 respondieron. Sin significancia la respuesta al tratamiento y el estado de los RH, así como expresión de HER2/Neu (209 de 249 pacientes con RE y RP positivo respondieron, 93 de 107 con receptores negativos respondieron, 277 de 318 pacientes con HER-2neu positivo respondieron y 91 de 109 con HER2neu - respondieron). En relación a TN, 67 de 73 pacientes respondieron.
Cincuenta y cuatro pacientes de 428 que respondieron inicialmente, presentaron recurrencia, la media en meses fue 14.65 (seis a 58), por lo menos 15 recurrieron al año. En las curvas de Kaplan-Meier entre esquema inicial de tratamiento y tiempo de recurrencia el Log Rank no muestra significancia (p=0.28). Con prueba de ji cuadrada no hay significancia entre recurrencia y el esquema inicial de tratamiento (p=0.3), tampoco con TN (p=0.18). Los sitios de recurrencia fueron 22 casos EAD (la mayoría metástasis óseas), 15 loco regional (LR), 11 LR más EAD y seis local. Cuarenta y dos de 54 pacientes que recurrieron, fueron TN. Con ji cuadrada no hay significancia (p=0.07) entre el sitio de EAD y TN.
El tratamiento paliativo en pacientes con AT al final del tratamiento inicial y con recurrencia fue con QT en la mayoría. En 53 casos no se otorgó porque abandonaron su seguimiento o fallecieron,
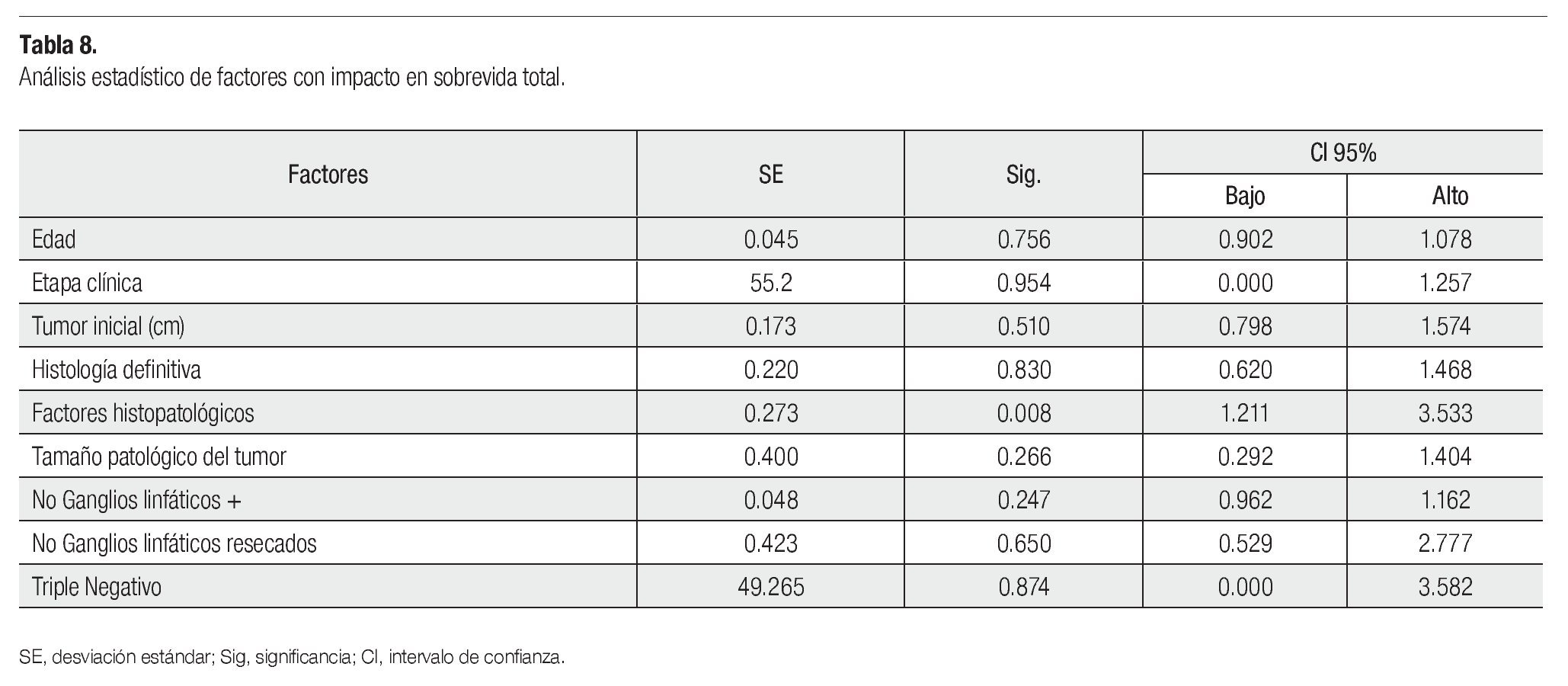
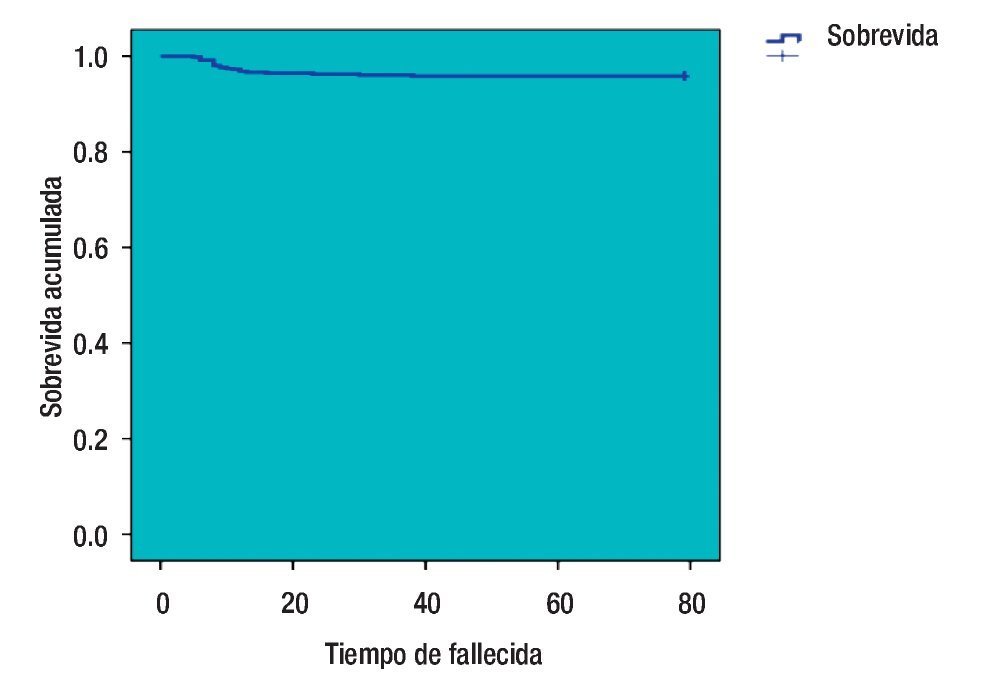
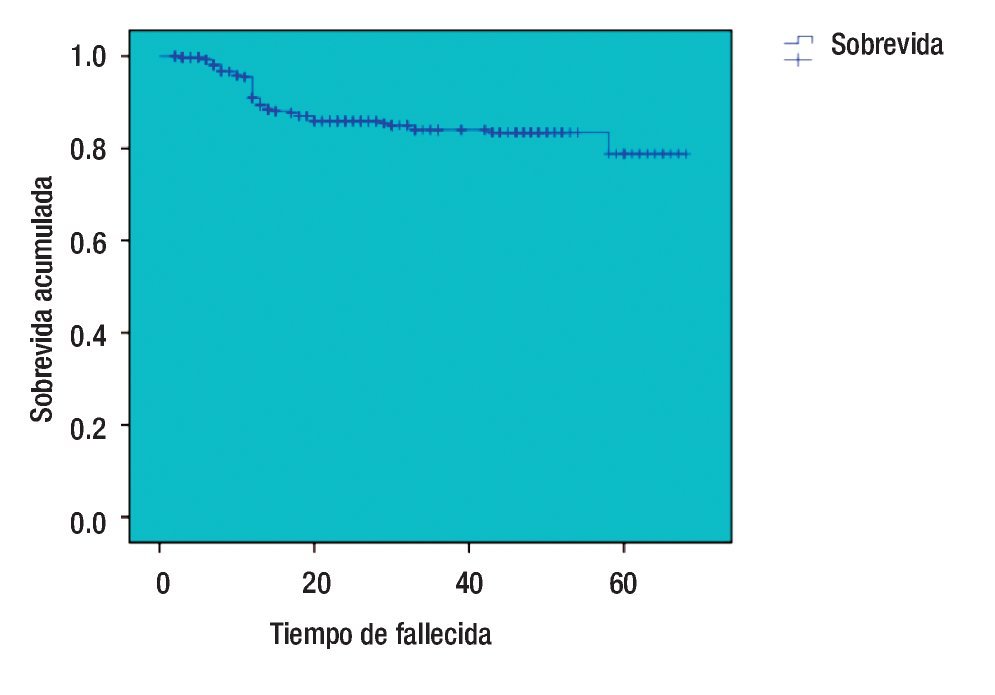
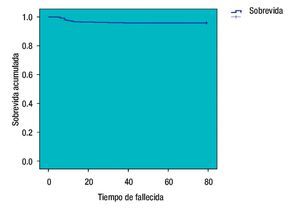
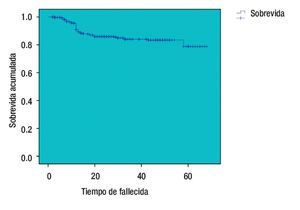
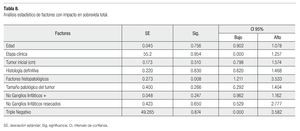
La curva de SVT de Kaplan-Meier es del 95.9% (Figura 1), se registraron 21 pacientes fallecidas y las que se perdieron en el seguimiento, se desconocía su estado. La media del intervalo libre de enfermedad fue 27.03 meses (dos a 68) y la SVLE de 87.8% (IC 95%) (Figura 2). Al analizar los esquemas de tratamiento otorgados y la SVT, fue significativo (p<0.001), para el esquema QT-QXQT-RT. En un análisis multivariado con regresión de Cox, los FHP fueron los únicos significativos (p=0.008) para SVT (Tabla 8), pero en un análisis univariado si hubo significancia entre SV y EC (p=0.001) (IC 95%).
Figura 1. Curva de sobrevida total (Kaplan-Meier).
Figura 2. Sobrevida libre de enfermedad (Kaplan-Meier).
Al final del estudio, 378 (74.4%) pacientes estaban sin AT y 130 (25.6%) con AT, (47 con persistencia LR, 31 EAD y 52 ambas). Trescientos setenta y cuatro de 428 casos que estaban sin AT al final del tratamiento, permanecieron en control al final del estudio, 4 de 54 pacientes que recurrieron alcanzaron control al final del estudio y las 50 restantes permanecieron con AT. Al realizar prueba de ji cuadrada hubo mayor significancia (p<0.001), entre el grupo QT-QX-QT-RT y el control al final del estudio (112 de 121 pacientes estaban sin AT), en el grupo QT-RT-QX-QT 238 de 300 y con otros esquemas 28 de 87 pacientes.
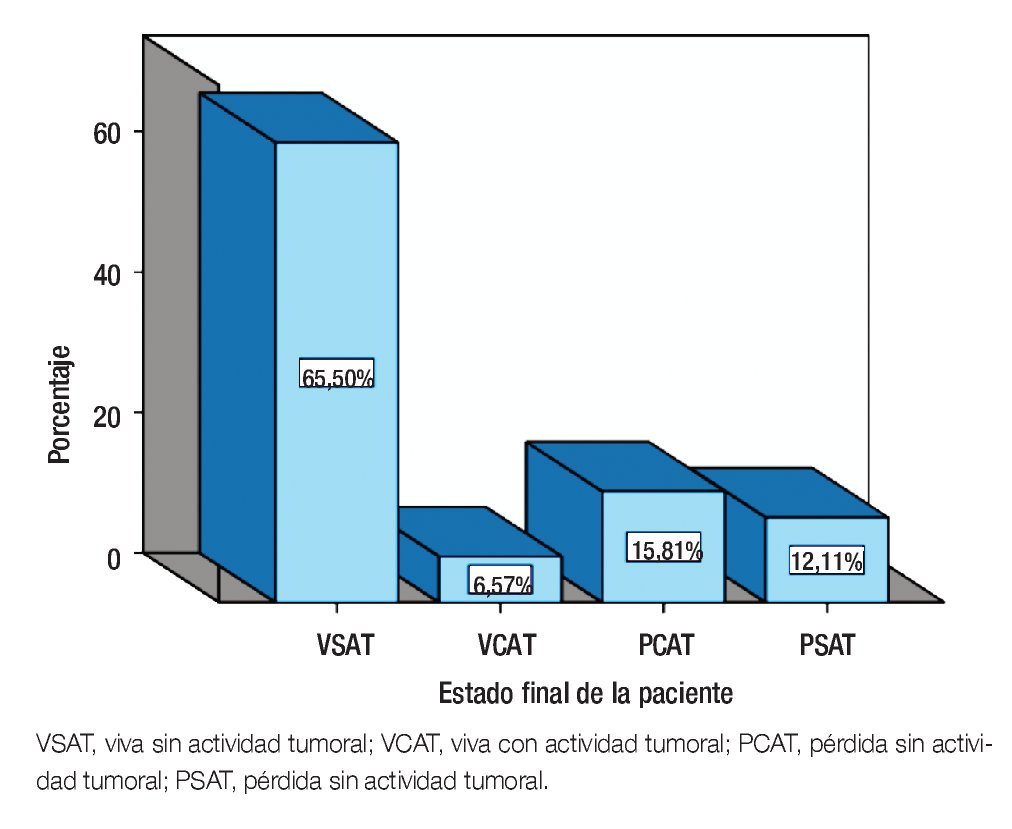
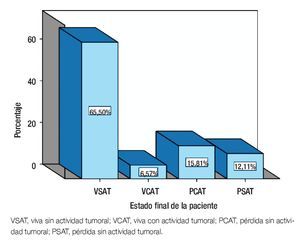
Al desglosar el estado final de las paciente: 319 (62.8%) estaban vivas sin AT (VSAT), 32 (6.3%) vivas con AT (VCAT), 77 (15.2%) pérdidas sin AT (PSAT) y 59 (11.6%) pérdidas con AT (PCAT) (Figura 3).
Figura 3. Estado final del paciente.
¿ DISCUSIÓN
El CMLA en mujeres es un reto y el manejo multidisciplinario está indicado, debido a su conducta que está determinada por diferentes factores, la edad es uno de ellos, en nuestra serie la media fue 51.64 años.1-4 El 75.8% de las pacientes no tuvieron enfermedades comórbidas, lo que resulta favorable. La EC más frecuente fue IIIA (53%), pero los casos T4bN2AM0 (28.3%) fueron mayor y el pronóstico es más desfavorable. La histología determinada por biopsia fue carcinoma ductal (90.6%), seguido de lobulillar (8.1%) como se describe en las revisiones publicadas.3,4 El tamaño tumoral es otro factor pronóstico,20,21 la media del tamaño clínico inicial en nuestro estudio fue 6.4 cm, y hasta un 21.7% tenían 6 cm antes de la terapia. Lo mismo que el tumor primario, el estado de los ganglios es importante, la media del tamaño clínico inicial fue 2.3 cm y hasta el 32.5% tenían 2 cm de tamaño ganglionar axilar, en cuanto a su fijación a planos profundos, sólo el 21.7% estaban fijos y el 69.9% libres. Los datos comentados demuestran lo avanzado de la EC, diferentes esquemas de manejo se otorgaron, pero hubo dos principales: 1) QT-RT secuencial prequirúrgica seguido de QT de consolidación (59.1%) (QT-RT-QX-QT) y 2) QT neoadyuvante prequirúrgica seguido de QT de consolidación y RT adyuvante (23.8%) (QT-QX-QT-RT), y 17.1% otros esquemas (la diversidad de éstos, fue determinado por el juicio clínico y las condiciones de la paciente). El manejo de QT NAD en CMLA es uno de los tratamientos estándar previo a cirugía, con la finalidad de hacer resecable el tumor y erradicar micrometástasis,30-35 los estudios iniciales de NSABP-B18 y B27 comparan QT NAD y adyuvante dando beneficio a la NAD en etapas avanzadas, ya que demuestran que la RPC es una factor predictor de SVT25-27 y en nuestra serie fue el segundo esquema más indicado y aunque el tratamiento de RT secuencial o concomitante con QT prequirúrgica no es estándar fue el más utilizado, la decisión del mismo fue en base a lo avanzado de la enfermedad. Los agentes quimioterapéuticos de primera línea en la NAD son las antraciclinas, que mejoran la tasa de supervivencia hasta un 25% a diez años y obtienen una RPC de 4% a 33%.25,27 En nuestra serie, el 87.6% recibieron NAD en alguna modalidad de manejo inicial, 409 casos con antraciclinas a base de FAC, similar a lo reportado en las literatura médica.40-43 Estudios recientes indican, que agentes como taxanos tienen buena respuesta tanto clínica como en relación a la RPC, aunque algunos estudios reportan que si el tumor no responde a un esquema inicial, es menos probable que responda a otro régimen.41,44 Se otorgaron taxanos en 28 pacientes que tuvieron pobre respuesta a antraciclinas y en dos casos, como monoterapia. Es evidente que una vez propuesto un esquema inicial, no debe ser modificado a menos que haya evidencia de progresión de la enfermedad, esto porque al no tener respuesta clínica no se ha visto que aumente la RPC o mejore SVT. Algunos estudios proponen llevar la NAD hasta ocho ciclos, comparado con los cuatro que se manejaba como estándar. En nuestro estudio, 379 recibieron cuatro, cuando se agregó paclitaxel al esquema inicial de FAC se incrementaron a más de ocho.
El 35.7% respondieron a QT NAD, más a nivel ganglionar que en el tumor primario, probablemente porque la media del tamaño ganglionar fue 2.3 cm, la respuesta en el 31% fue mayor del 50%, tanto en el primario como ganglionar, y aún así se enviaron a RT prequirúrgica, porque estaban programadas en este esquema. El 17.5% tuvieron mayor respuesta ganglionar (superior al 50%), que en el primario porque el tumor inicial era mayor de 8 cm. Sólo en el 8.1% se obtuvo RCC. La toxicidad hematológica fue la más frecuente y estuvo asociada al esquema de FAC.
En la mayoría de los casos la RT prequirúrgica fue con energía de Cobalto 60 y dosis de 50Gy. El 78.7% que tuvieron mayor del 50% de respuesta ganglionar y del primario, fueron las que habían tenido buena respuesta con QT NAD. La mayoría de los pacientes como era de esperar, tuvieron radiodermitis seca grado uno y dos, debido a la energía utilizada, pero en 84 casos no hubo toxicidad.
La cirugía realizada en nuestras pacientes fue MRM más disección axilar (nivel I y II), en ninguna se ofreció cirugía conservadora aún con RCC a la NAD, no es estándar pero puede tener beneficio al no comprometer la SVLE y SVT.45 Son pocos los estudios a favor de RT prequirúrgica,45,46 al analizar nuestros resultados histopatológicos definitivos, encontramos que utilizar QT-RT secuencial prequirúrgica vs QT NAD ofrece mejor respuesta patológica en relación al residual del primario, ganglios positivos y ganglios resecados con significancia estadística. Sólo en un análisis univariado, los FHP favorables fueron significativos (p=0.001), al adicionar RT a la QT prequirúrgica. La RPC no tuvo significancia al recibir QT NAD sola o con RT prequirúrgica. En nuestra revisión no se analizaron los subtipos moleculares por no contar con la tecnología necesaria, son importantes en la respuesta al tratamiento porque la biología tumoral depende también de estos factores y la SVLE y SVT se ve influenciada por éstos.13-19,23,28
Por otra parte, el 49% tuvieron RE y RP positivos, por lo cual la respuesta a la HT en 304 pacientes se vio favorecida, sobre todo con TMX en posmenopáusicas. La expresión de HER2Neu fue negativo en 62.6% y positivo en 21.5% y el manejo con TZM fue limitado. Setenta y tres pacientes fueron TN en nuestra serie, generalmente tienen una evolución más agresiva, menor respuesta al tratamiento y mayor posibilidad de EAD, sobre todo cuando se asocia al subtipo Basal-Like,17,18,52 pero en nuestra revisión no son significativos para la respuesta al tratamiento, aunque fueron pocos casos.
La consolidaron de la QT NAD fue en la mayoría también con FAC y algunos casos con taxanos, por factores patológicos adversos. A diferencia de la NAD, la mayoría (152) no tuvo toxicidad.
La radioterapia adyuvante es el estándar de tratamiento en CMLA, en la mayoría de las series. En nuestro caso, sólo 155 pacientes la recibieron. La RT ofrece control local, pero el estudio Danés47 no muestra impacto en SVT, y su papel en reducir la recurrencia en subtipos moleculares BL y HER2Neu-sobreexpresado es limitado, porque estos subtipos modifican la respuesta al tratamiento.
La media del seguimiento en este estudio fue 37.17 (siete a 79 meses). Al finalizar los esquemas de tratamiento, el 84.3% respondieron y estaban sin AT, teniendo mayor significancia (p=0.001) el grupo QT-QX-QT-RT. A pesar del beneficio en los resultados histopatológicos al adicionar RT a la QT NAD, las pacientes que reciben QT-QX-QT-RT permanecen más libres de AT que este grupo.30-35
La recurrencia fue en 54 pacientes de 84.3% que habían respondido, la mayoría después de un año y fue independiente del esquema de tratamiento utilizado (sin significancia). Lo mismo sucedió con TN, ya que recurrieron más las que no eran TN. Hubo pacientes que recibieron RT prequirúrgica y recurrieron loco regionalmente y aunque no influyó el esquema de tratamiento, hay que recordar que la RT ofrece control local, pero se ve modificado también por la biología de los subtipos moleculares.46,47,54
La curva de SVT de Kaplan-Meier fue del 95.9%, a pesar de tener un sesgo por las pacientes que perdieron el seguimiento y se desconocía su estado es adecuada para esta EC, lo mismo sucede con la SVLE que fue del 87.8%. El impacto de QT NAD como predictor de SVT está descrito y así lo reveló este estudio porque tuvo mayor significancia el grupo QT-QX-QT-RT (p<0.001), en un análisis multivariado de diferentes factores pronósticos, solo los FHP posquirúrgicos fueron significativos (p=0.008) para sobrevida total. Hay que recordar que 358 de 435 pacientes tuvieron bordes, lecho quirúrgico, ILV y perineural negativos. En nuestra revisión, la EC solo fue significativa (p=0.001) para SVT en el análisis univariado, aunque es bien conocido que es factor de sobrevida.
Al final del seguimiento, el 74.4% estaban sin AT y el 25.6% con actividad (incluye persistencia y EAD). Trescientos setenta y cuatro de 428 pacientes que estaban sin AT al final del tratamiento, permanecieron así hasta el final del estudio. Lo mismo que para la respuesta al final del tratamiento y la SVT, el esquema QT-QX-QT-RT fue significativo (p<0.001), para el control tumoral al final del estudio. Finalmente, el 62.8% estaban VSAT, 6.3% VCAT, 15.2% PSAT y 11.6% PCAT.
Vemos en nuestra serie que el estándar de manejo en CMLA con QT NAD prequirúrgica seguido de QT de consolidación y RT adyuvante, fue el segundo esquema más utilizado, pero con mayor significancia en control tumoral, SVT y SVLE. Aunque el manejo con QT-RT secuencial prequirúrgico seguido de QT de consolidación fue el más utilizado, su mayor impacto sólo se observa en resultado histopatológico posquirúrgico. Al final el grupo QT-QX-QT-RT, logra más control. Otro dato interesante encontrando es que ni los factores hormonales, ni la presencia de TN modificaron la respuesta al tratamiento. Es importante poder identificar en un futuro en nuestra institución, los subtipos moleculares y determinar el grado de influencia en la respuesta al manejo en nuestra población.
Correspondencia: Dra. Yicel Bautista Hernández.
Calle Encinos N° 2. Col. Ampliación Tlacoyaque. Del. Álvaro Obregón. C.P. 01859.
Teléfono: 5810 6552.
Correo electrónico: yiselbautista@prodigy.net.mx