Introducción: El osteosarcoma (OS) es el tumor óseo maligno más frecuente. Los resultados del tratamiento en pacientes con OS no han mostrado la mejoría que se reporta en otras neoplasias malignas pediátricas. En el Hospital Infantil de México Federico Gómez (HIMFG), los pacientes en general acuden con enfermedad avanzada.
Métodos: Se realizó un estudio retrospectivo, retrolectivo, descriptivo de 81 pacientes con OS en el HIMFG entre 1996 y 2010.
Resultados: Las características clínicas en los pacientes del HIMFG fueron similares a las descritas en la literatura médica. El 37% tuvo metástasis al diagnóstico. Los esquemas de quimioterapia empleados no han mostrado variaciones significativas en los últimos años. El 60.9% tuvieron recaída, 86.4% fueron sometidos a cirugía radical. El 23.5% de los pacientes murió por progresión de la enfermedad y 43.2% abandonaron el seguimiento en el hospital. Dos pacientes continúan en tratamiento.
Discusión: La enfermedad metastásica así como la pobre respuesta histológica son suficientes para explicar estos resultados. Sin embargo, es evidente que en OS es necesario buscar más factores pronósticos clínicos, radiológicos y moleculares. Existen problemas de logística locales como son los retrasos en la administración de quimioterapia, que pudieran explicar en parte la pobre respuesta histológica después de la neoadyuvancia en nuestra institución.
Conclusión: Los resultados en nuestros pacientes con OS metastásico y pobre respuesta al tratamiento son similares a los descritos en otras series. El abandono en este grupo de niños superó el 40%. Es necesario hacer un análisis más detallado para evaluar el impacto del inicio de la cobertura del Seguro Popular, así como de la toxicidad durante el tratamiento y la calidad de vida.
Introduction: Osteosarcoma (OS) is the most common bone tumor in childhood and adolescence. Although treatment improve have been described in other diseases, in OS it has been difficult. At Hospital Infantil de Mexico Federico Gomez (HIMFG) patients arrive in general with advanced disease.
Methods: We performed a retrospective, retrolective and descriptive study of 81 patients diagnosed with OS at HIMFG between 1996 and 2010.
Results: Clinical features at diagnosis are similar as one described in literatura. The 37% were metastatic at diagnosis. The 86.4% had a radical surgery. Chemotherapy treatments had no changes along time. The 60.9% relapsed. The 23.5% died because of disease progression and 43.2% abandoned follow up. Two patients are still on treatment.
Discussion: Metastatic disease as well as bad histological response is enough to explain our results. Although, it is evident that it is a need to find more clinical, radiological and molecular prognosis factors. There are local structural deficiencies as chemotherapy administration delay that could explain the high percentage of bad histological response after neoadyuvance.
Conclusion: Results in OS children with metastasis and bad histological response are similar as one described in other series. Abandonment in this group of patients is above 40%. A more detailed analysis must be done to evaluate the impact of the coverage of Seguro Popular as well as toxicity and quality of life.
¿ IntRoduccIón
El osteosarcoma (OS) es el tumor óseo más frecuente en la niñez y adolescencia, se caracteriza por la formación de osteoide maligno inmaduro por las células tumorales, así como por la proliferación de células fusiformes del estroma.1 Se describen dos picos de presentación, uno en la edad pediátrica y el segundo entre la séptima y octava década de la vida.2,3 En el caso de la edad pediátrica, según datos del Surveillance, Epidemiology, and End Results (SEER) Program del National Cancer Institute (NCI) la incidencia de esta neoplasia por grupos de edad es de: cinco a nueve años, 2.4 casos por millón al año; 10 a 14 años, 7.6 casos por millón por año; 15 a 19 años, 8.2 casos por millón por año; siendo extremadamente raro en edades menores de cinco años con una incidencia de 0.4 casos por millón por año.4,5 La etiología del OS no está completamente dilucidada. Existen algunas teorías que tratan de explicarla. Una de ellas ha sido, dado que la mayor incidencia de este tumor se ha descrito en adolescentes de alta estatura, que el aumento de los factores de crecimiento en esa etapa de la vida favorece el desarrollo de estos tumores.6-8 La exposición a radiación ionizante también se ha relacionado con la aparición del OS, siendo significativa con una exposición entre 10 a 20 años, asociándose aproximadamente con el 2% de OS en la edad adulta.9,10
Anormalidades citogenéticas como ganancia de un cromosoma 1, pérdidas cromosómicas en los cromosomas 9, 10, 13 y/o 17, así como pérdida completa o parcial del brazo largo del cromosoma 6 (6q-) se han descrito en estudios recientes.11 Los síndromes de Li Fraumeni, Bloom y síndrome de Rothmund Thomson han sido asociados a algunos casos de OS.12,13 Sobreexpresión del gen p53 y mutaciones del gen Rb también se han descrito. La sobreexpresión de p53 se ha descrito en un 22% de los casos. El gen Rb, mutado en el retinoblastoma, se ha asociado con OS, ya sea como primera o más comúnmente segunda neoplasia.11 Además de los anteriores existen diversas asociaciones que tratan de explicar la oncogénesis de este tumor óseo (virus, factores ambientales, factores de crecimiento, enfermedad de Paget, traumatismos, enfermedad de Ollier, displasia fibrosa, exostosis múltiple hereditaria, entre otros), siendo todos ellos insuficientes para su explicación.14
Los pacientes con OS usualmente tienen sintomatología inespecífica; sin embargo, el dolor en el área afectada es la presentación clínica más común,15 frecuentemente se asocia con el ejercicio o algún trauma dos a cuatro meses previos al diagnóstico.16 El aumento de volumen hasta la presencia de una masa o tumor firme, visible y palpable, pérdida o disminución de los ángulos de movimiento en la articulación afectada y manifestaciones cutáneas perceptibles (eritema superficial, signos de hipervascularidad) son algunos de los datos que con mayor frecuencia pueden estar presentes al examen médico.1,17 Síntomas generales como anorexia, pérdida de peso, fiebre y fatiga están raramente asociados con esta neoplasia maligna.18 El 80% de los OS ocurre en huesos tubulares, entre el 50% y 70% próximo a la rodilla, siendo la región distal del fémur y proximal de la tibia, los sitios primarios más frecuentes, seguido de hombro (región proximal del hombro) y cadera (región proximal de tibia). La presentación en esqueleto axial (pelvis, columna, mandíbula, etc.) es infrecuente, siendo aún menor en tejidos blandos, glándula tiroidea, corazón, riñones, útero o pulmón.19-21
El estudio inicial es la evaluación con radiografía simple de la zona afectada debiendo ser comparativa, incluyendo al menos dos planos longitudinales a la zona que se evaluara, lo que permite apreciar la arquitectura ósea y partes blandas (triángulo de Codman, lesiones líticas, blásticas, imagen en rayos de sol, hasta fracturas patológicas).22-24 Los hallazgos de laboratorio son incremento de fosfatasa alcalina (FA) y en un 30% acompañada con el incremento de deshidrogenasa láctica (DHL) sérica, la presencia de anemia moderada puede estar también presente al diagnóstico.25 La biopsia es la clave para la confirmación diagnóstica.26 Según la Organización Mundial de la Salud (OMS) se reconocen cuatro subtipos histológicos para OS: osteoblástico, fibroblástico, condroblástico y telangiectásico, reflejando el tipo de matriz ósea tumoral. Este último relacionado al peor pronóstico. La sobrevida a cinco años para pacientes con OS era del 10% a 20% antes de 1970, cuando el tratamiento consistía en la amputación de la extremidad afectada.27 El desarrollo de quimioterapia antes y después del evento quirúrgico así como técnicas quirúrgicas modernas no sólo han elevado la sobrevida global (SG), sino que además aumentaron la calidad de vida de estos pacientes, salvando en muchas ocasiones la extremidad con resección del bloque tumoral.28,29 Con esta terapéutica se ha reportado SG de hasta el 77% a cinco años.30
En un estudio previo, analizamos las características clínicas y las imágenes radiológicas de una parte de esta cohorte de pacientes que presentaremos. 31
¿ Métodos
Se realizó un estudio retrospectivo, retrolectivo y descriptivo con un número de 109 pacientes con OS, diagnosticados entre agosto de 1996 y agosto de 2010 en el Hospital Infantil de México Federico Gómez (HIMFG). Se eliminaron 28 pacientes, ya que los expedientes contenían información incompleta, dando un total de 81 pacientes.
¿ ResultAdos
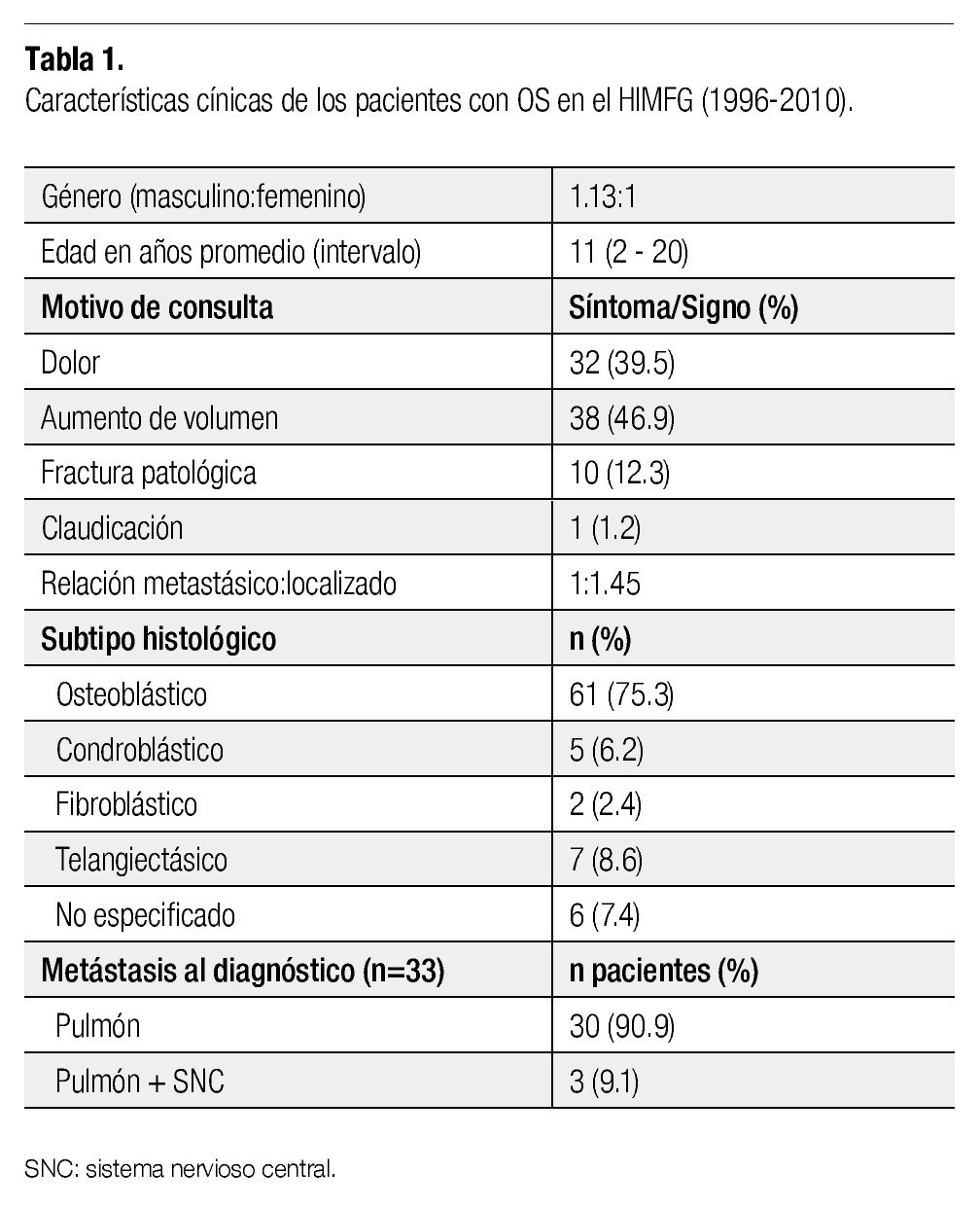
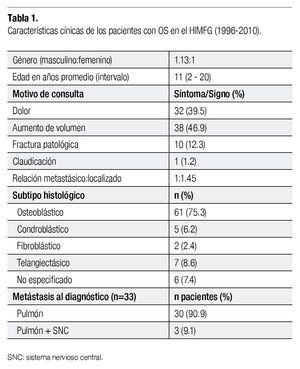
Del total de pacientes analizados, 43 eran de sexo masculino y 38 femenino representando el 53% y 47%, respectivamente (relación de 1.13:1). La edad promedio al diagnóstico fue 11 años y seis meses (desviación estándar DS 3.24) con una edad mínima y máxima de 2.11 y 20.13 años.
El motivo de consulta o referencia fue la presencia de aumento de volumen en el sitio del tumor en 38 casos (46.91%), seguida por dolor en 32 de los pacientes (39.5%).
La histología que con mayor frecuencia se registró fue la osteoblástica con 61 casos, representando una importante prevalencia comparada con las otras; cinco de histología condroblástica, dos fibroblástica y siete telangiectásica. En seis de los casos estudiados, el reporte de patología no refiere la histología tumoral. En la Tabla 1 se resumen las características de los niños.
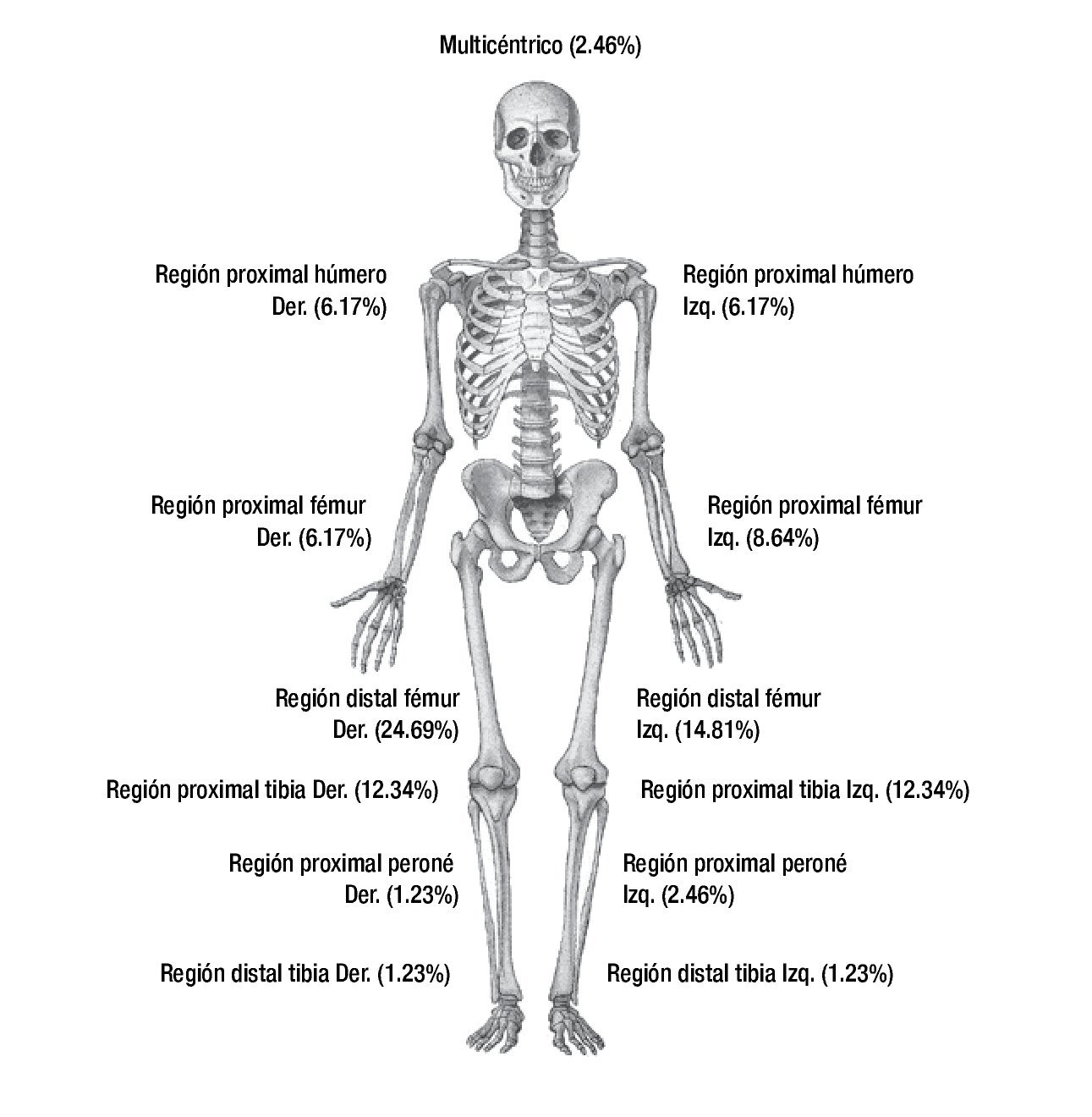
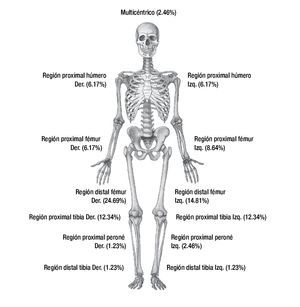
La localización más frecuente del tumor primario fue en región distal de fémur derecho con un total de 20 casos (25%), seguida por región distal de fémur izquierdo con 12 casos (15%), región proximal de tibia izquierda y derecha con 10 casos cada una (12.5% cada uno), totalizando más del 50% del total de los casos. El resto de las localizaciones del tumor primario se muestran en la Figura 1.
Figura 1. Distribución de sitio anatómico del tumor primario en los pacientes con osteosarcoma (HIMFG 1996-2010).
Treinta y tres pacientes presentaron metástasis al diagnóstico. Estas metástasis fueron observadas en placas de rayos X o por tomografía axial computada (TAC). Tres pacientes tuvieron metástasis tanto en pulmón como en sistema nervioso central (SNC) al diagnóstico.
El resto, 30 pacientes presentaron metástasis en ambos pulmones en el 90% de los casos.
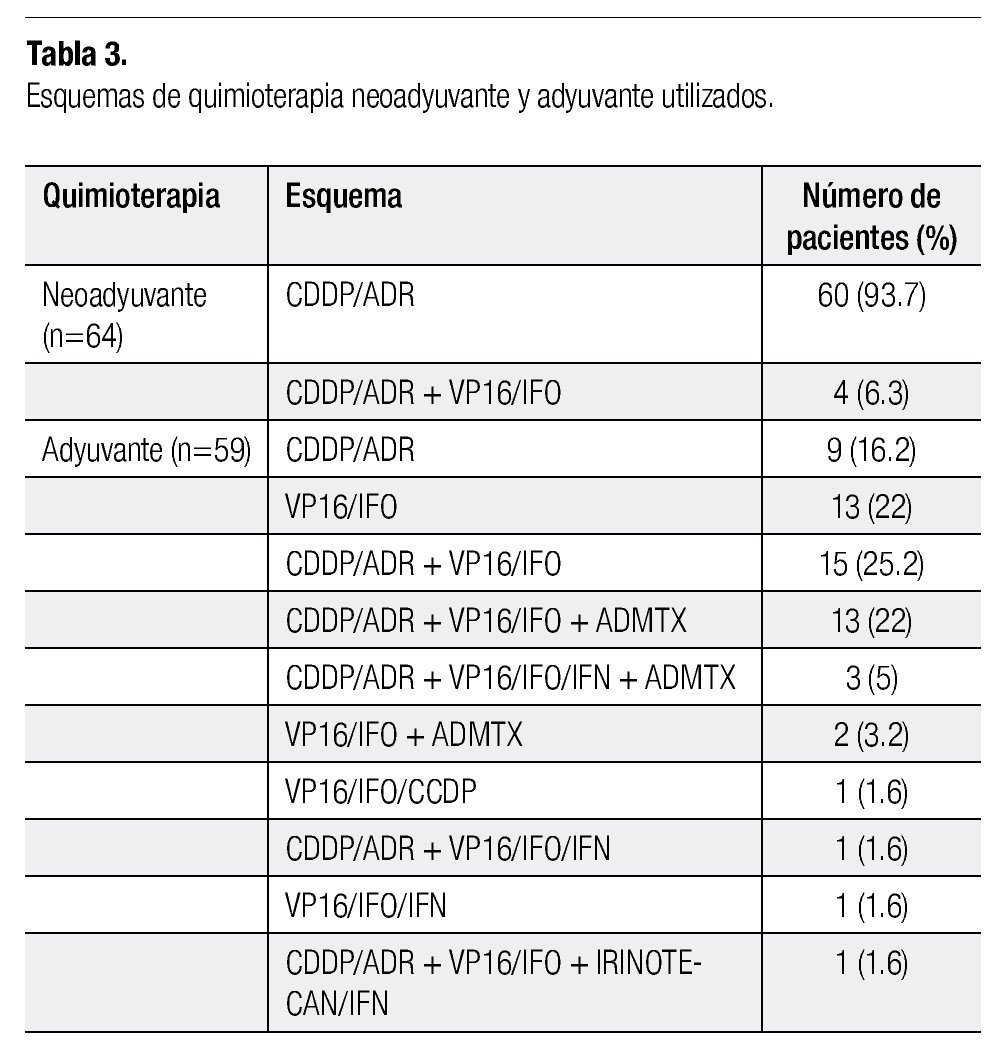
Sesenta y cuatro pacientes fueron tratados con quimioterapia neoadyuvante. De este total, 60 (93.7%) recibieron la neoadyuvancia con adriamicina (ADR) y cisplatino (CDDP), con un número promedio de cuatro ciclos (intervalo de uno hasta nueve ciclos). A cuatro pacientes se les aplicó quimioterapia preoperatoria con CDDP y ADR, combinados con ifofosmida (IFO) y etopósido (VP16) con un promedio de cinco ciclos (intervalo de cuatro hasta 10). Del total, cuatro pacientes abandonaron el tratamiento posterior al diagnóstico sin iniciar quimioterapia y 13 se sometieron a cirugía sin previa aplicación de quimioterapia. Los pacientes que abandonaron se consideraron censados en las curvas de Kaplan Meier.
Se realizó cirugía a 70 pacientes (86.41%), de los cuales conocemos que a 33 pacientes (47.1%) se les realizó cirugía conservadora, es decir, resección tumoral con colocación de endoprótesis por el Servicio de Traumatología y Ortopedia. El resto, 37 pacientes (42.9%) fueron sometidos a cirugía radical con desarticulación. Un total de 11 pacientes no se les realizó ningún tipo de procedimiento quirúrgico como parte del tratamiento, teniendo como principal causa la negativa a la cirugía. A ocho de los pacientes a los cuales se trató de preservar la extremidad con cirugía conservadora se reintervinieron, realizando amputación por presentar recaída tumoral en sitio primario acompañado o no de metástasis pulmonares y/o al SNC.
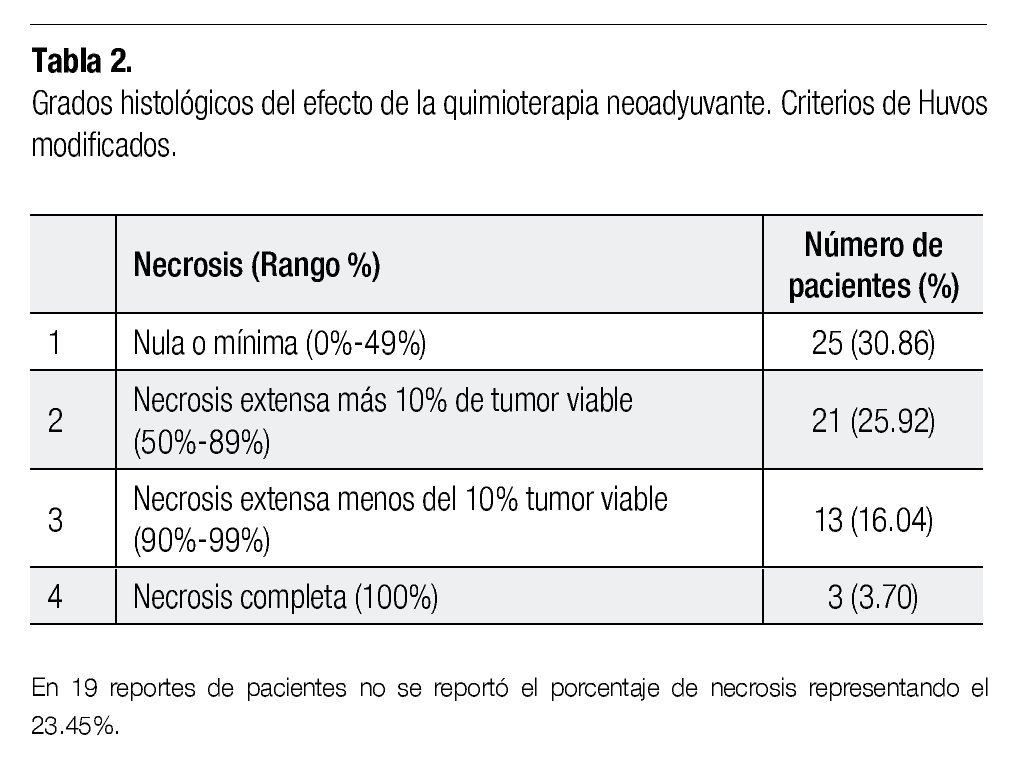
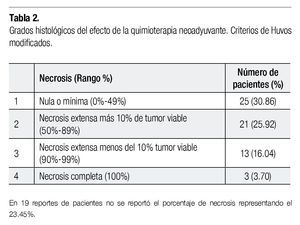
Del estudio histopatológico efectuado a los especímenes quirúrgicos, se recabaron los porcentajes de necrosis tumoral como respuesta a la quimioterapia neoadyuvante para ser clasificados dentro de cuatro grupos propuestos por Huvos, en relación al porcentaje de necrosis como efecto al uso de quimioterapia neoadyuvante (Tabla 2).
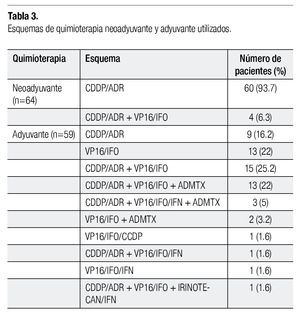
Los esquemas de quimioterapia adyuvante administrados en los pacientes sometidos a cirugía conservadora o no fueron diversos. El total de pacientes que completó el tratamiento incluyendo la quimioterapia adyuvante fueron 59 pacientes, donde el esquema más utilizado fue CDDP/ADR, alternando con VP16/IFO en 15 pacientes (25.42%). Otros esquemas utilizados fueron CDDP/ ADR individuales, VP16/IFO individuales, CDDP/ADR más VP16/IFO más altas dosis de metotrexate (ADMTX), irinotecan, entre otros. El promedio de ciclos aplicados fue de seis (mínimo cuatro; máximo 14). Veintidós pacientes no recibieron quimioterapia posoperatoria ya que abandonaron tratamiento. En la Tabla 3 se resumen los esquemas de quimioterapia neoadyuvante y adyuvante que se administraron a los pacientes.
Recaídas
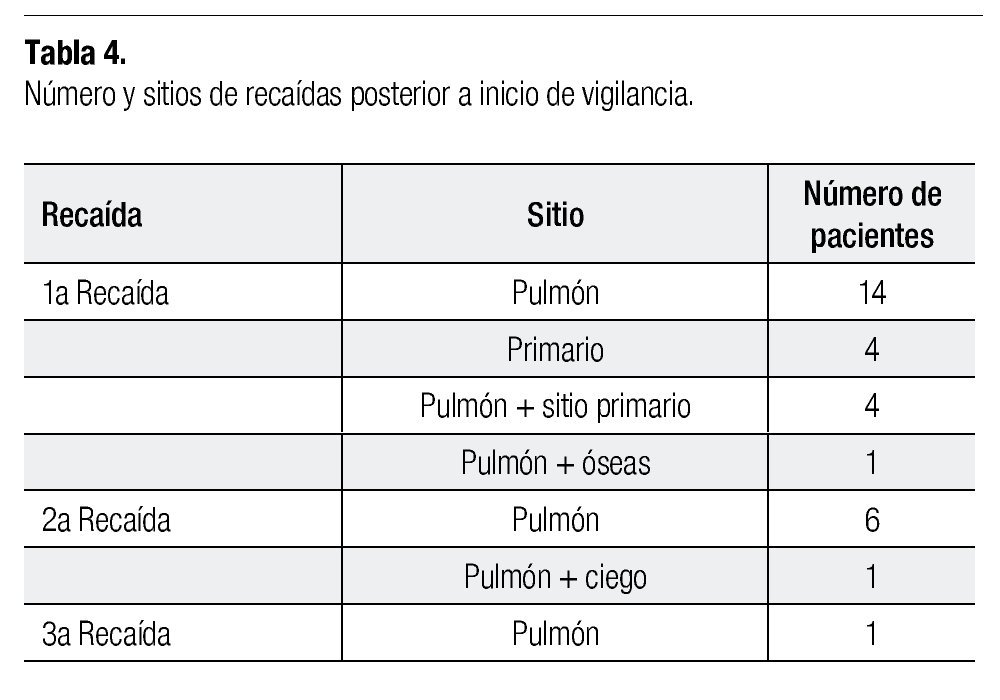
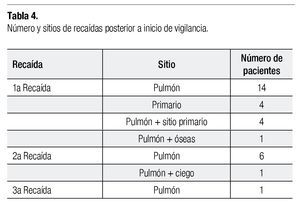
Veintitrés pacientes presentaron recaída tumoral posterior al inicio de la vigilancia. Este tipo de recaída se presentó en el pulmón en 19 pacientes (82.6%). De éstos, 14 fueron metástasis pulmonares uni o bilaterales, cuatro en pulmón acompañado de sitio primario y uno en pulmón acompañado de presencia de metástasis óseas en región lumbo-sacra, pubis e isquion. Estos pacientes fueron tratados con cirugía, realizando toracotomías, lobectomías y neumonectomías, así como desarticulación de extremidad posterior a cirugía conservadora en primera intervención. En los 19 pacientes, se complementó el tratamiento quirúrgico con quimioterapia. De estos 23 pacientes, siete sufrieron una segunda recaída tumoral de los cuales seis fueron a pulmón, y solamente uno presentó recaída a pulmón, ciego y colon ascendente. A este último se le realizó hemicolectomía, así como resección de metástasis pulmonares. El tratamiento consistió al igual que en la anterior recaída en toracotomías, lobectomías y neumonectomías, más quimioterapia. De estos siete pacientes que presentaron segunda recaída, uno presentó tercera recaída siendo ésta a nivel pulmonar, recibiendo dos ciclos de quimioterapia con VP16/IFO/CDDP y una única cirugía de neumonectomía, muriendo durante el tratamiento por progresión de la enfermedad.
Sólo dos pacientes recibieron radioterapia; uno posterior a primera intervención con una dosis total de 30Gy. El otro caso al cual se decidió dar radioterapia fue en su primera recaída en sitio primario, con una dosis de 45Gy.
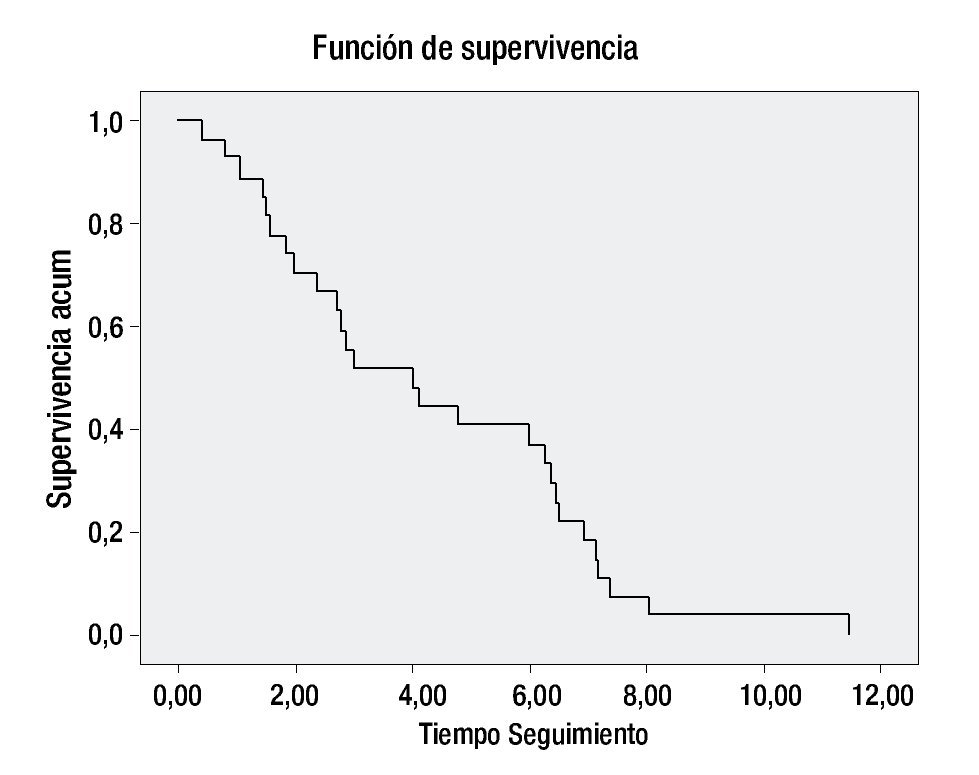
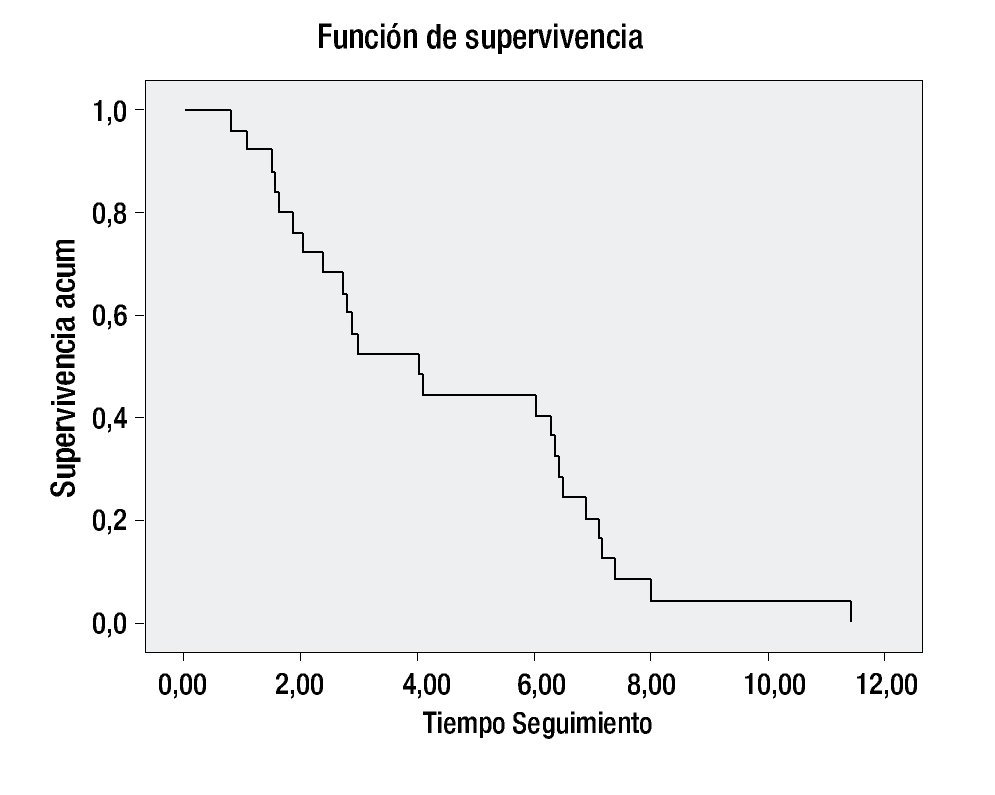
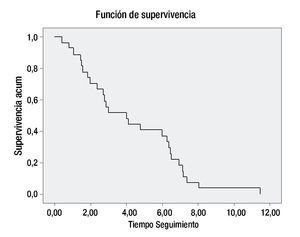
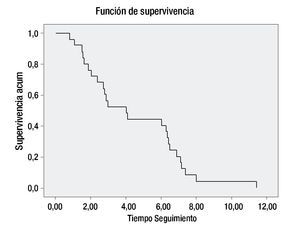
De los 81 pacientes incluidos en la revisión, 25 continúan vivos en vigilancia, dos aún están en tratamiento actualmente y 19 fallecieron con actividad tumoral. Treinta y cinco de los pacientes abandonaron el tratamiento en cualquier etapa, ya sea por continuar manejo en otra institución o no aceptar el tratamiento ofrecido. La SG a cinco años fue del 40% (Figuras 2 y 3) (Tabla 4).
Figura 2. Supervivencia global.
Figura 3. Supervivencia libre de evento.
¿ DisCUSIÓN
Con la implementación de la quimioterapia y de mejores técnicas quirúrgicas, el pronóstico del OS ha mejorado. Sin embargo, en la actualidad con todos los adelantos mencionados, la supervivencia de estos pacientes es baja comparada con la de otras neoplasias malignas. Claro ejemplo de ello es la leucemia linfoblástica aguda, tumor de Wilms y ciertos linfomas.
Las características clínicas de los pacientes fueron similares a las descritas en la literatura médica. El OS en nuestra Institución afectó más a los niños que a las niñas. La edad promedio es menor a la descrita en otras series, aunque el promedio está sesgado ya que existe un paciente de dos años que, por cierto, es un caso excepcional.
En relación a los signos y síntomas al diagnóstico, se confirma que el dolor es un síntoma común aunque referido en menor frecuencia que otras series, donde se menciona que hasta el 77.7% de los casos tienen dolor.31,32 La localización anatómica del tumor primario y la distribución de las variedades histológicas no varía. El porcentaje de pacientes con enfermedad metastásica al diagnóstico es superior al 40% en nuestros pacientes, lo que habla de que llegan en etapas avanzadas. Los esquemas de quimioterapia neoadyuvante y adyuvante son los considerados estándar en OS, y la variación en cuanto al número de ciclos se debió a la decisión del cirujano de realizar la cirugía. El 42% de los pacientes finalmente fueron sometidos a cirugía radical con desarticulación, lo que es elevado en comparación con lo referido en la literatura médica, y se debe básicamente al volumen de los tumores que desafortunadamente no tenemos documentado en todos los casos. El 57% de los pacientes en los cuales se realizó de inicio una cirugía conservadora, finalmente terminaron en cirugía radical, lo que debe hacernos realizar una reevaluación de la indicación quirúrgica de inicio. De igual manera es posible realizar posteriormente un análisis por épocas de tratamiento, ya que con el tiempo el equipo multidisciplinario ha obtenido mayor experiencia en la evaluación de los casos.
El análisis de las recaídas en el HIMFG no da mayor información de la descrita en la literatura, y debemos insistir en la medición del número de las metástasis para poder realizar análisis sistematizados y comparables a los de series internacionales.29 El 2.5% tuvo metástasis a SNC lo que es inferior a lo descrito, aunque los pacientes de nuestra serie son pacientes que murieron tempranamente por lo que no tuvieron el tiempo de desarrollarlas, considerando que el cerebro es la última barrera para el OS.33 El uso de radioterapia en dos niños con OS puede ser controversial, ya que por definición este tumor se considera radioresistente.34
Finalmente, la supervivencia en nuestra Institución, tomando en cuenta que son pacientes con enfermedad avanzada es similar a la descrita en la literatura.4
El niño de dos años de esta serie nos obliga a pensar en el OS como una probabilidad diagnóstica no sólo en pacientes adolescentes sino en etapas más tempranas de la vida, concibiéndolo ya como un diagnóstico diferencial obligado. Ante la presencia de signos y síntomas como claudicación acompañada o no de dolor en la zona, así como el aumento de volumen en la región anatómica afectada hace necesaria la evaluación clínica completa, y mínimamente la realización de un estudio radiográfico simple comparativo con la búsqueda intencionada a lesiones sugestivas de esta neoplasia maligna, así como datos más aparatosos pudiendo llegar hasta la fractura patológica.
La quimioterapia neoadyuvante es una gran herramienta terapéutica, debido al importante papel que juega la necrosis como factor pronóstico. El que exista tan sólo el 16% de nuestros niños con reporte histológico favorable (grado 1 y 2 de los criterios de Huvos), nos explica hasta cierto grado la problemática terapéutica que afrontamos. Es por ello que se han tratado de desarrollar técnicas que nos permitan conocer el grado de respuesta a la quimioterapia prequirúrgica previo al reporte por patología, el cual es obtenido hasta el evento quirúrgico incluso días después, y así graduar al paciente con OS individualmente, disminuyendo la toxicidad por la quimioterapia, mejorando su calidad de vida y aumentando su SG.
¿ CONCLUSIÓN
El OS es un reto para el oncólogo pediatra. En el HIMFG los resultados del tratamiento de estos pacientes pueden mejorarse. Esta mejoría podría lograrse internamente con la protocolización adecuada de la administración de los ciclos de quimioterapia que no se administran de manera regular, debido a la sobreocupación hospitalaria. Asimismo, podemos mejorar el control de los eventos adversos relacionados a la toxicidad de los esquemas de quimioterapia que reciben estos pacientes, a través de la implementación de redes de acceso al hospital en caso de urgencias. Sin embargo, la mejoría principal y más sencilla que debemos lograr entre todos es realizar diagnósticos oportunos. Esto únicamente lo lograremos a través de la sensibilización de los médicos en las carreras de medicina, así como del personal de enfermería. La educación médica en fases tempranas debe ser la prioridad.
Existen limitantes en este trabajo como es la falta de medición del tumor primario. Es importante mencionar que a partir del establecimiento de la clínica de OS, el abordaje de estos niños se ha sistematizado y actualmente a todos se les realiza la medición del volumen tumoral al diagnóstico, una angiorresonancia del tumor primario así como de una TAC de cortes finos para pulmón, para tener la posibilidad de contar las metástasis a ese nivel. Asimismo, se están realizando estudios de investigación para caracterizar las alteraciones moleculares de los tumores de pacientes, con el fin de buscar blancos terapéuticos y nuevos factores pronósticos que obviamente aún son insuficientes.
Los resultados en los niños con OS son similares a los descrito en pacientes con metástasis y con pobre respuesta histológica de otras series. El abandono en este grupo de niños superó el 40%. Es necesario hacer un análisis más detallado para evaluar el impacto del inicio de la cobertura del Seguro Popular, así como de la toxicidad durante el tratamiento y la calidad de vida.
Correspondencia:
Marta Zapata Tarrés.
Departamento de Oncología, Hospital Infantil de México Federico Gómez,
Dr. Márquez 162, Colonia Doctores, Delegación Cuauhtémoc.
C.P. 06720. México D.F., México.
Teléfono: 5228 9917, ext. 2124. Celular: (044) 555418 4099.
Correo electrónico: magazapata@yahoo.com