¿ INTRODUCCIÓN
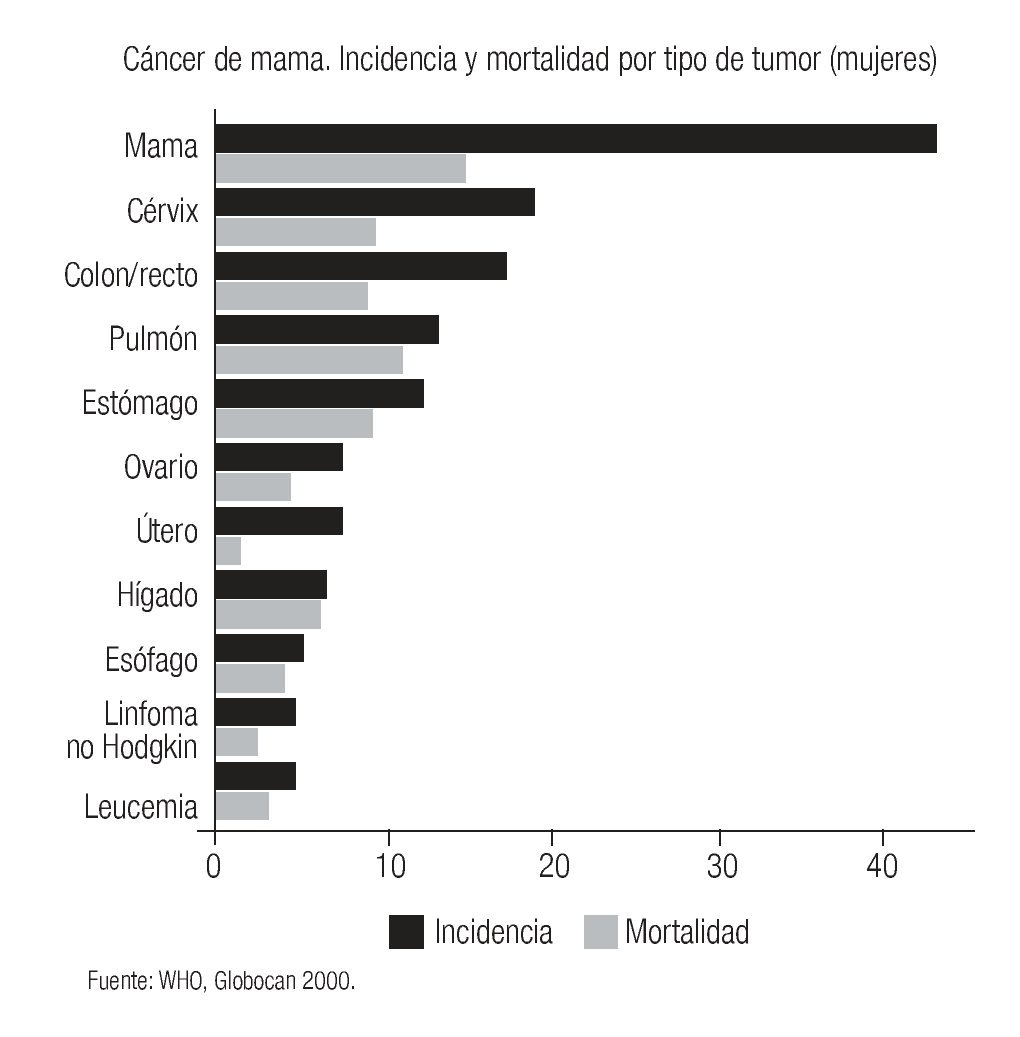
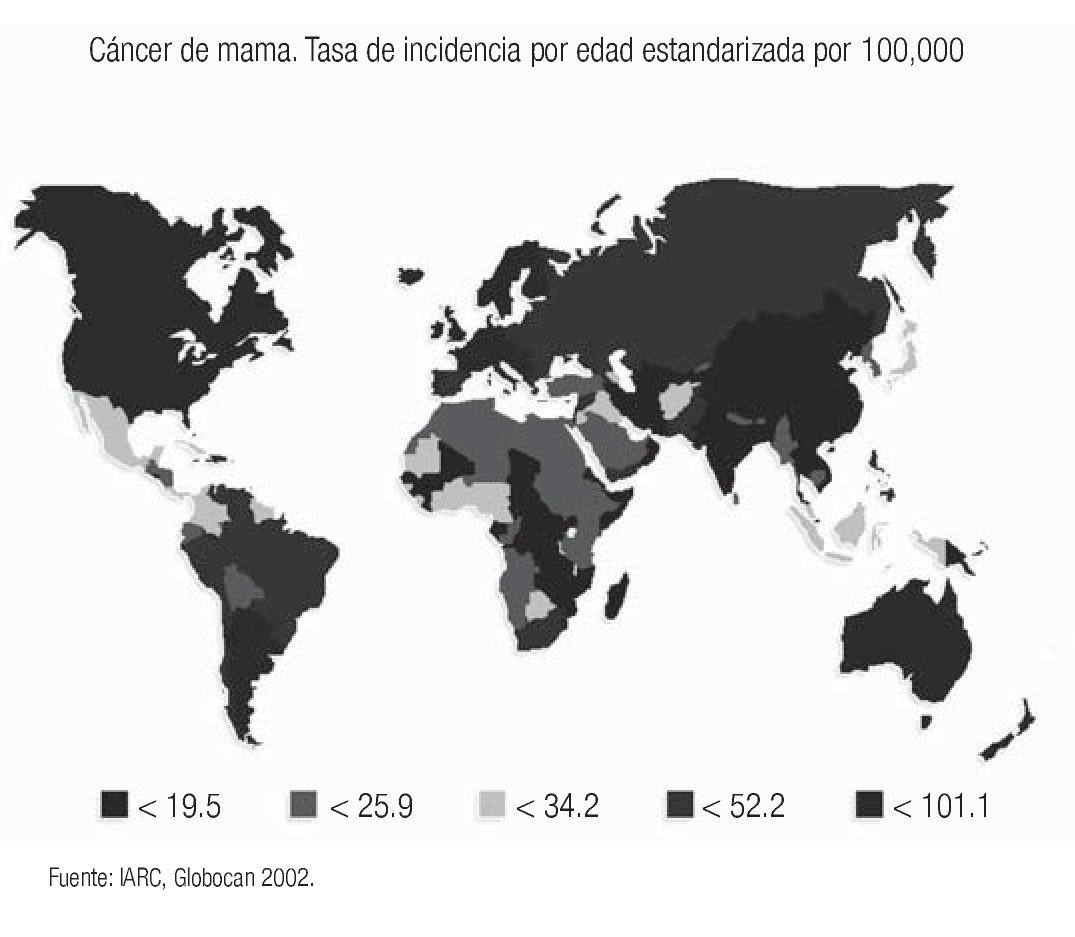
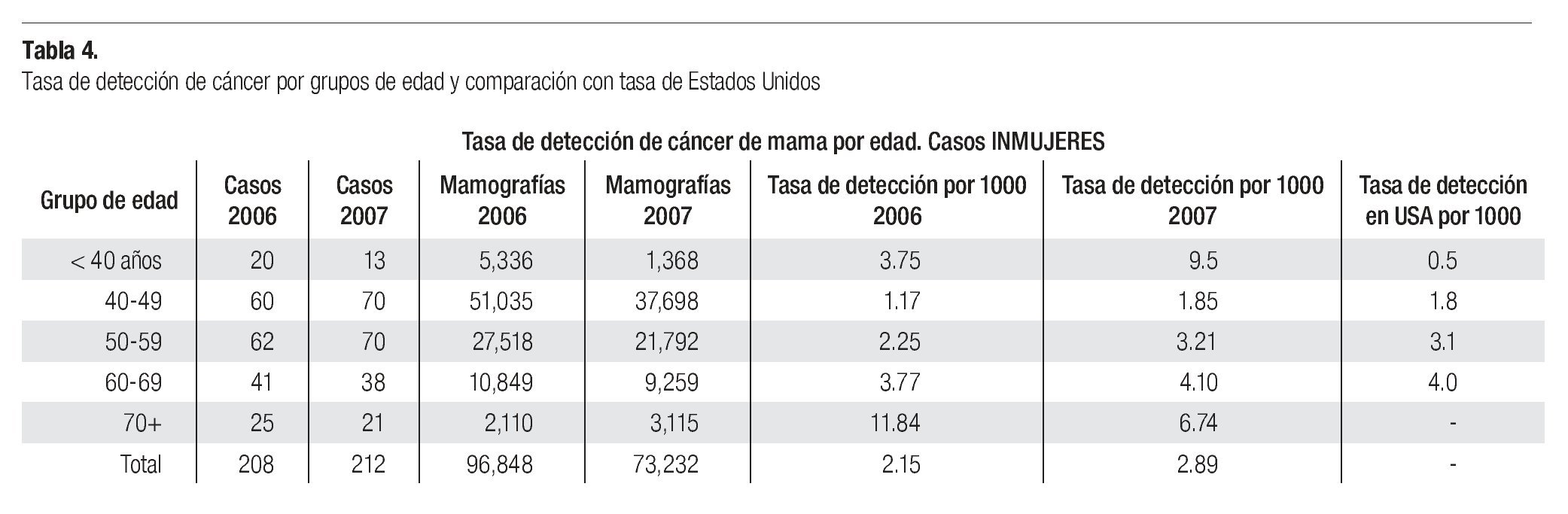
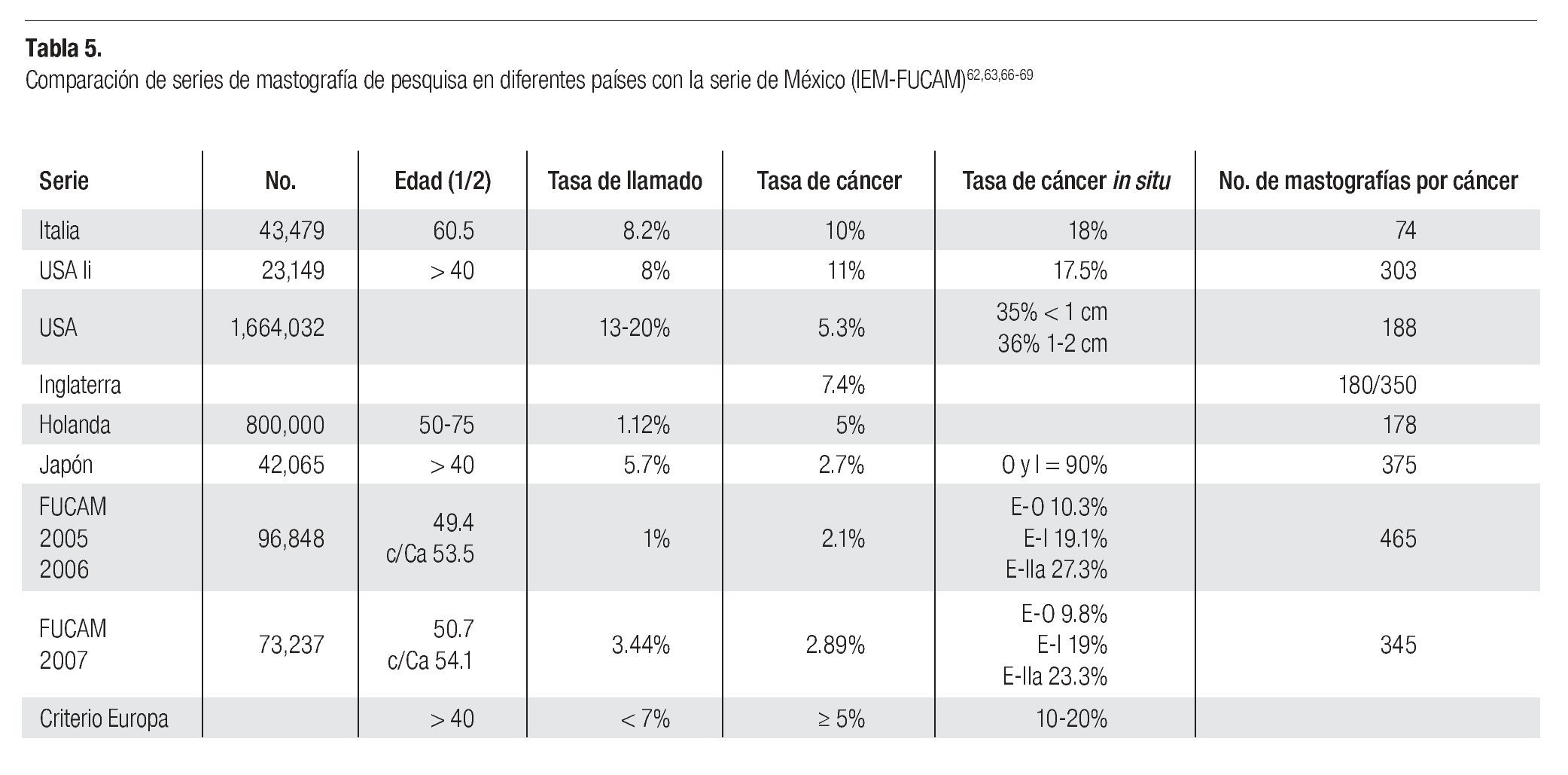
El cáncer de mama continúa como la primera neoplasia maligna de las mujeres en el mundo y es un problema de salud pública, tanto en los países desarrollados como en los emergentes, donde se ha evidenciado un incremento en su frecuencia y mortalidad (Imagen 1). Para el año 2004 la Organización Mundial de la Salud calculó que se diagnosticarían más de 1'200,000 nuevos casos de cáncer de mama (19% del total de cánceres en la mujer).1 Su frecuencia varía ampliamente y así los países norteamericanos y europeos son los que tienen la frecuencia más elevada, mientras que los países de Asia y África tienen la más baja.2 Los países latinoamericanos, en general, también tienen una baja frecuencia, excepción hecha de Argentina y Uruguay que tienen tasas semejantes a la de los países europeos2 (Imagen 2). Este hecho es posiblemente explicable por la conformación mayoritariamente europea del origen de su población, a diferencia del resto de los países latinoamericanos donde el mestizaje entre indígenas, europeos y negros es la característica predominante.
Imagen 1. Incidencia y mortalidad mundial por cáncer en mujeres. Organización Mundial de la Salud
Imagen 2. Distribución de la incidencia de cáncer de mama en el mundo
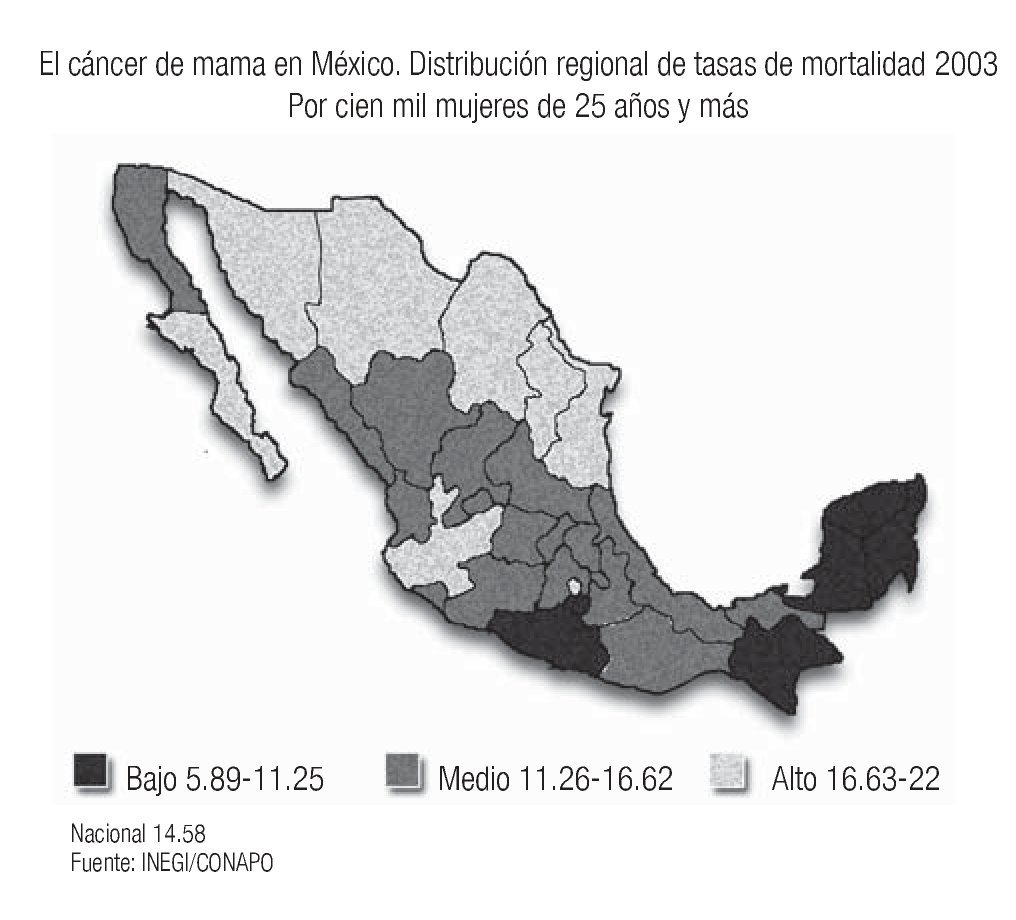
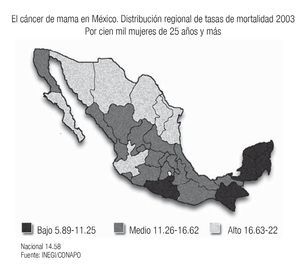
En años recientes se ha informado un incremento paulatino del cáncer de mama en muchos países asiáticos, en particular en Japón y Singapur, donde se ha producido un cambio en el estilo de vida ("occidentalización")3 y existe evidencia de que los descendientes de migrantes hispanos en Estados Unidos, tienen tasas de cáncer que se acercan a la de las mujeres blancas no-hispanas, debido a la transculturización.4 Este fenómeno también está siendo observado en nuestro país, donde tenemos diferencias regionales importantes, con mayor frecuencia de cáncer de mama en los estados del norte y centro del país, en el que las mujeres gozan de un estado socioeconómico y cultural más elevado, con estilo de vida más semejante al de las mujeres de Estados Unidos (tabaquismo, obesidad, sedentarismo, ingesta de alcohol, dieta rica en grasas animales, ausencia de lactancias y embarazos tardíos), mientras que, en los estados donde predomina la población indígena y de menor nivel socioeconómico (Chiapas, Oaxaca, Yucatán) la frecuencia es mucho más baja5-7 (Imagen 3). Estas observaciones sugieren que los factores ambientales y de estilo de vida juegan un papel muy importante en el desarrollo del cáncer de mama, ya que los estudios de las poblaciones emigrantes de Asia en Estados Unidos, han demostrado que en la siguiente generación, ya nacida en Estados Unidos, se incrementa el riesgo de desarrollar cáncer de mama, 60% mayor que el de sus poblaciones de origen, sobre todo si en su país de origen eran habitantes rurales.8
Imagen 3. Distribución de la mortalidad por cáncer de mama en México. INEGI/CONAPO
En México existen, incluso, estados donde el cáncer de mama ha rebasado ya al carcinoma cervicouterino como primera causa de mortalidad en mujeres. En el estado de Jalisco, por ejemplo, desde 1997 el cáncer de mama ocupa el primer lugar, con una tasa de mortalidad de 15.82% por 100,000 mujeres y la frecuencia de cáncer de mama es ya casi similar (17.9% vs. 18.8%) a la del cáncer cervicouterino.9
Es notorio que en todo el mundo persiste un incremento en la frecuencia del cáncer de mama y que este incremento es mayor en los países desarrollados, por ejemplo, en Estados Unidos el número de casos aumentó progresivamente de 1970 a 1997 en 161% (de 69,000 a 180,200) y el número de muertes por esa enfermedad en cerca de 50% (de 30,000 a 49,000).10-11 Este cambio fue en gran parte debido al aumento del número de mujeres en riesgo, particularmente mujeres mayores,12 pero independientemente, cuando se analiza la tasa de incidencia ajustada a la edad, ésta muestra un incremento anual de 1% de 1940 a 1980, y a partir de ese año el incremento se aceleró a 4% anual, estabilizándose en 111.3 por 100,000 a partir de 1995.13 Recientemente, se reportó una disminución en el número de cánceres de mama (180,510 para el 2007), debido al declive en el uso de terapia hormonal de reemplazo en las mujeres posmenopáusicas de ese país.14 El crecimiento acelerado a partir de 1980 es debido, en parte, a que desde entonces se ha ido generalizando el uso de la mastografía de pesquisa.15-16 Así, la proporción de mujeres blancas de 50 a 59 años de edad, de Estados Unidos que han tenido mastografía fue de 46% en 1987, 68% en 1990 y 76% en 1992.17 Otras causas que explicarían el aumento en la frecuencia a partir de 1980 serían los cambios en la maternidad, con tendencia a retardar el primer nacimiento y disminuir la paridad, uso generalizado de anticonceptivos orales y terapia estrogénica de reemplazo, aun cuando el papel exacto de estos factores en el desarrollo del cáncer de mama no está bien definido.
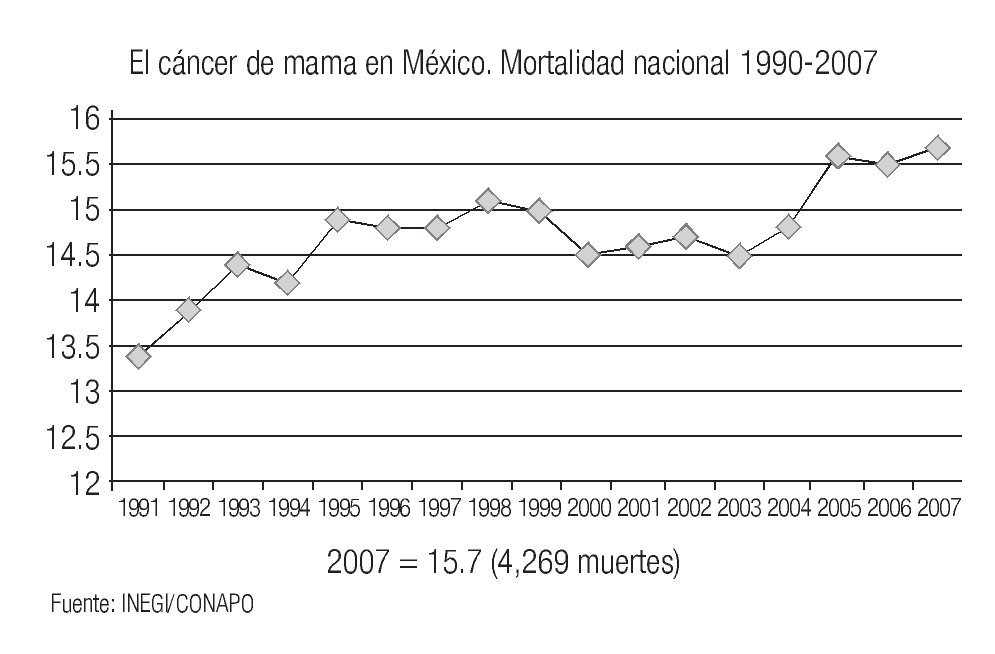
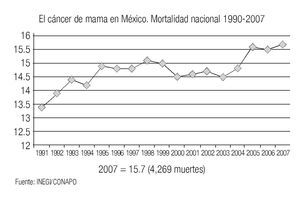
Si bien, en los países del norte de Europa, Canadá y Estados Unidos se ha observado una disminución evidente de la mortalidad por cáncer de mama, gracias al uso generalizado de la mastografía de pesquisa y a la disponibilidad de mejores terapéuticas, esta disminución no ha alcanzado a los países mediterráneos o ex socialistas europeos (España, Portugal, Grecia, Italia, Hungría y Polonia).18 En Estados Unidos el cáncer de mama es la neoplasia maligna más frecuente, con 214,600 nuevos casos en 2006, que representan 32% del total de cánceres en la mujer, de las cuales se estiman que morirán 41,430 (19%).19 Globalmente, se considera que 1 de cada 8 mujeres en ese país desarrollará cáncer de mama y que 1 en 28 tienen riesgo de morir por esa enfermedad. En México, el cáncer afecta más frecuentemente a las mujeres (62.5% vs. 37.5%). En el 2001 se informaron 102,657 casos de cáncer en el Registro Histopatológico de Neoplasias Malignas, SSA,6 de los cuales el cáncer de mama representó 11,242 casos, ocupando el segundo lugar de los cánceres en la mujer, con 17% del total. La tasa de mortalidad por cáncer de mama se ha elevado en México de 13.6 por 100,000 mujeres a 15.7 por 1000,000 en el 2007 (Imagen 4). En México, 47% de las muertes por cáncer de mama ocurren en mujeres entre los 45 y 64 años y la Secretaría de Salud calcula un promedio de 21 años de Vida Productiva Perdidos por cada mujer con un impacto económico de $3,107'505,000 pesos en el 2001.
Imagen 4. Tasa de mortalidad por cáncer de mama en mujeres mexicanas mayores de 25 años (por 100,000). INEGI/CONAPO
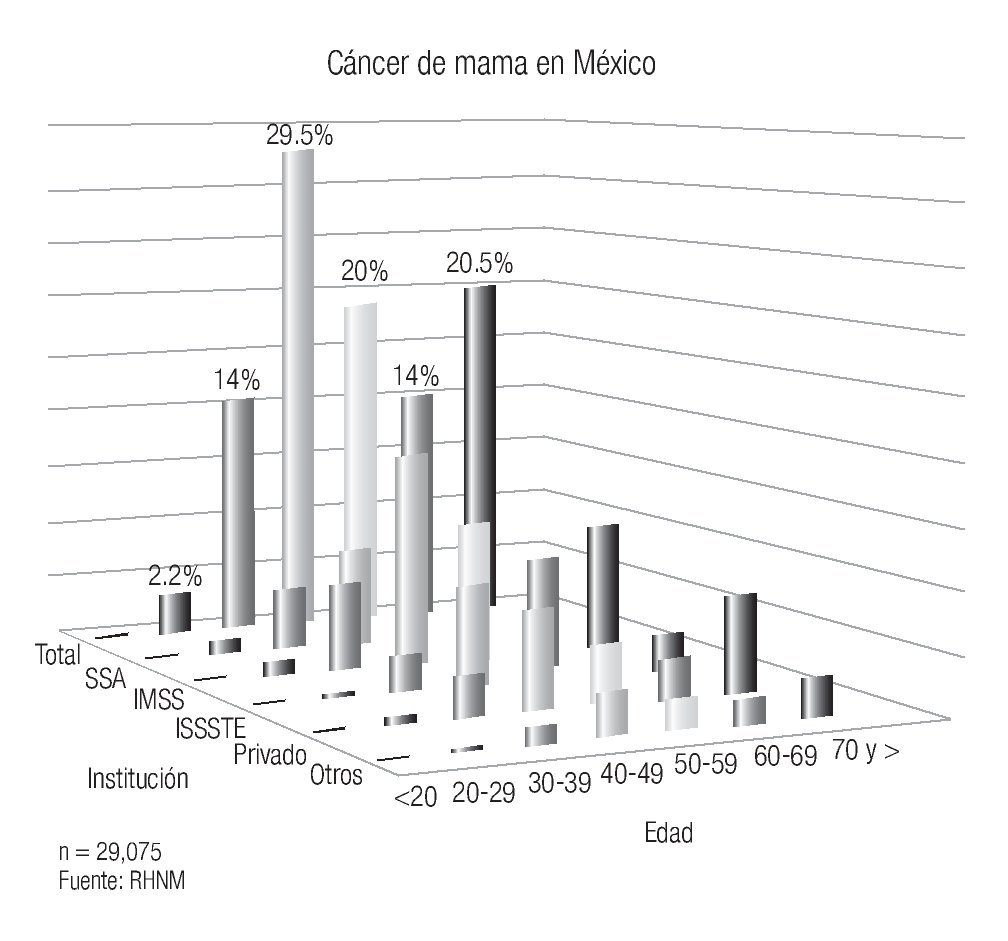
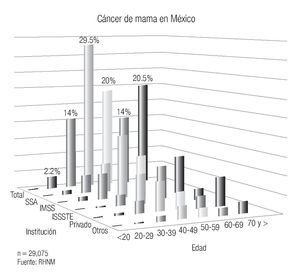
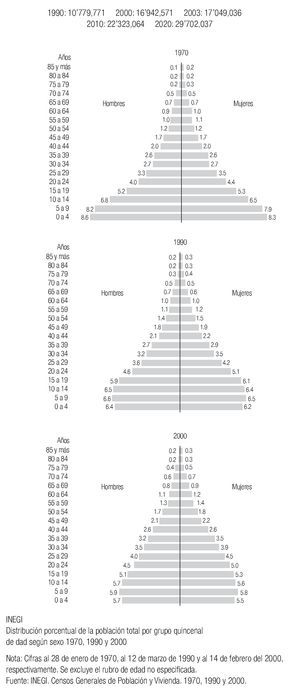
En México se presentan casos de cáncer de mama desde la segunda década de la vida y se incrementa su frecuencia rápidamente hasta alcanzar la máxima entre los 40 y 54 años y luego mostrar un descenso paulatino después de la quinta década6 (Imagen 5). Es importante mencionar que en México, la mujer desarrolla el cáncer de mama en promedio, una década antes que las europeas o norteamericanas (51 vs. 63 años), hecho en parte explicable por la conformación de la pirámide poblacional mexicana, donde predominan las mujeres jóvenes.20
Este hecho también se presenta en muchas de las poblaciones latinoamericanas y en las de Japón y China, sugiriendo la existencia de factores genéticos y/o estilos de vida comunes. Esto representa a su vez un problema en el diagnóstico, ya que el estándar de oro del diagnóstico oportuno, la mastografía, es menos eficaz en las mamas densas de las mujeres jóvenes y explica en parte, por qué en ese grupo de mujeres (menores de 45 años) en nuestro país, el diagnóstico es más frecuentemente tardío, con media de edad de las mujeres con etapas III de 48 años y 68% son premenopáusicas.21 En los países desarrollados el riesgo es mayor en las mujeres posmenopáusicas y se incrementa hasta los 70 años.
Imagen 5. Distribución del cáncer de mama por edad e institución. Registro Histopatológico de Neoplasias Malignas, SSA
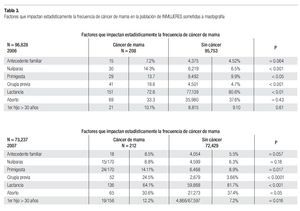
Es evidente que existe un aumento considerable de riesgo cuando hay antecedente familiar de cáncer de mama, especialmente si la neoplasia se presentó en edad premenopáusica o en forma bilateral, en familiares de primer grado de consanguinidad, con un incremento de riesgo de 1.5 a 3 veces mayor del esperado en la población general, y si son varios los familiares consanguíneos afectados, el riesgo puede elevarse hasta 5 a 9 veces más.22 Sólo existe un estudio en México que analiza la historia familiar de cáncer de mama en una muestra pequeña, donde informan 10% de familiares con antecedente de cáncer de mama en las mujeres con cáncer de mama y de 1% en los controles,23 y no se han hecho estudios para determinar la frecuencia de mutaciones genéticas en nuestra población.
La edad temprana de la menarquia (antes de los 12 años) ha sido invocada como uno de los factores que incrementan el riesgo de 1 a 1.8 veces en las mujeres blancas de Estados Unidos.24 En nuestro país hemos observado que la edad de la menarquia es con mucha frecuencia menor a los 12 años, sobre todo en las mujeres indígenas o habitantes de "tierra caliente" donde se reportan embarazos desde los 9 años de edad. Desgraciadamente sólo existe un estudio previo relativo a la menarquia en México, que data de 1970, donde se demuestra que la media de edad de la menarquia es de 12 años.25 Dado que nuestro país tiene una baja frecuencia de cáncer de mama, no podríamos pensar que fuera un factor que incremente el riesgo en nuestras mujeres, sin embargo, es necesario conocer mejor este aspecto que no ha sido estudiado ampliamente en nuestra población.
La aparición tardía de la menopausia (55 años o más) incrementa 2.5 el riesgo, mientras que la menopausia artificial por castración quirúrgica, antes de los 40 años, ha mostrado disminuir significativamente el riesgo.26 La lactancia y la multiparidad han sido demostradas como factores que disminuyen el riesgo de cáncer de mama, mientras que cuando tienen el primer embarazo a término por arriba de los 30 años o son nulíparas, el riesgo de cáncer de mama se eleva.27 El efecto protector de la lactancia difiere en forma importante en las diferentes poblaciones analizadas. Así, en las poblaciones asiáticas y en México, entre las poblaciones indígenas y de menores niveles socioeconómicos, donde la duración de la lactancia es sustancialmente mayor, es donde se ha demostrado un mayor efecto protector.28,29
La utilización de anticonceptivos orales no ha mostrado, en la mayoría de las investigaciones publicadas, un aumento o disminución del riesgo de cáncer de mama, pero el uso de estrógenos exógenos conjugados en la terapia hormonal de reemplazo, administrada por periodos prolongados (mayor a 5 años) incrementa, en estudios de meta-análisis, 2% anual el riesgo de las mujeres posmenopáusicas.30 Recientemente, se publicó que el uso de combinación de estrógenos y progestágenos, continuos o secuenciales, incrementa aún más el riesgo de cáncer de mama (51% mayor cuando los utilizan más de 5 años), lo que ha llevado a suspender el reclutamiento de pacientes en varios estudios prospectivos que se desarrollan en Europa y Estados Unidos.31-34 No existen estudios en nuestro país acerca de la relación entre uso de anticonceptivos o terapia hormonal y cáncer de mama en mujeres mexicanas.
Desde hace muchos años se ha sugerido una asociación entre dieta y cáncer mamario. La mayor frecuencia de esta enfermedad en Estados Unidos y Europa, y la baja incidencia en Asia y América Latina han sido correlacionadas con el mayor consumo de grasas animales y azúcares refinados en la dieta occidental.35
Se ha sugerido que la estatura, volumen mamario, estructura corporal y la obesidad son factores de riesgo. Mujeres cuya tallas es mayor a 1.67 m tienen un mayor riesgo que las que miden menos de 1.59 m. Mujeres altas y delgadas con mamas grandes tienen mayor riesgo, sobre todo antes de los 45 años.36 Las mujeres que aumentan de peso más de 27 kg de su juventud a la edad madura, doblan su riesgo de cáncer de mama.37
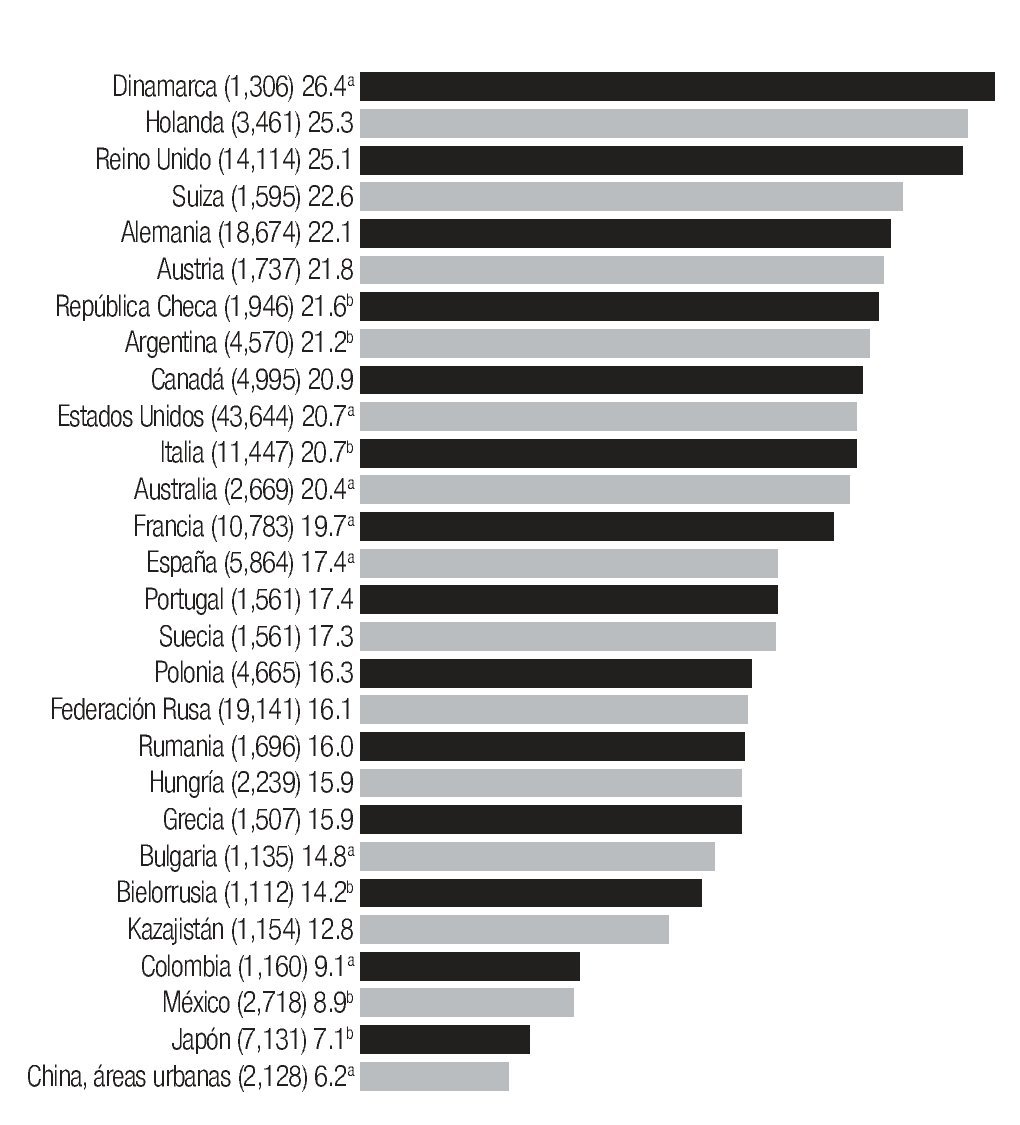
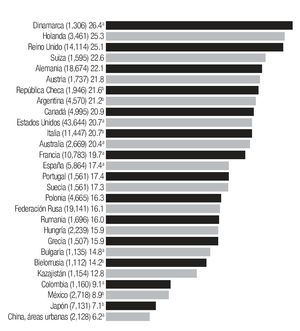
En la actualidad existe suficiente evidencia de que la tasa de mortalidad está declinando en Estados Unidos, así como en Canadá, Inglaterra y Gales, en proporción de 6 a 10%2,38-40 y que hay una tendencia a disminuir en Austria, Alemania, Suecia, Dinamarca y Francia, sin embargo, estas tendencias favorables no se ven en países como España, Portugal, Grecia, Hungría, Polonia, Italia, Japón y México, donde se ha reportado incremento en la tasa de mortalidad por cáncer de mama.18,41 (Imagen 6).
Imagen 6. Tasa global de mortalidad ajustada a edad por 100,000 mujeres, por cáncer de mama, para 1995, 1994a o 1993b banco de datos de la Organización Mundial de la Salud
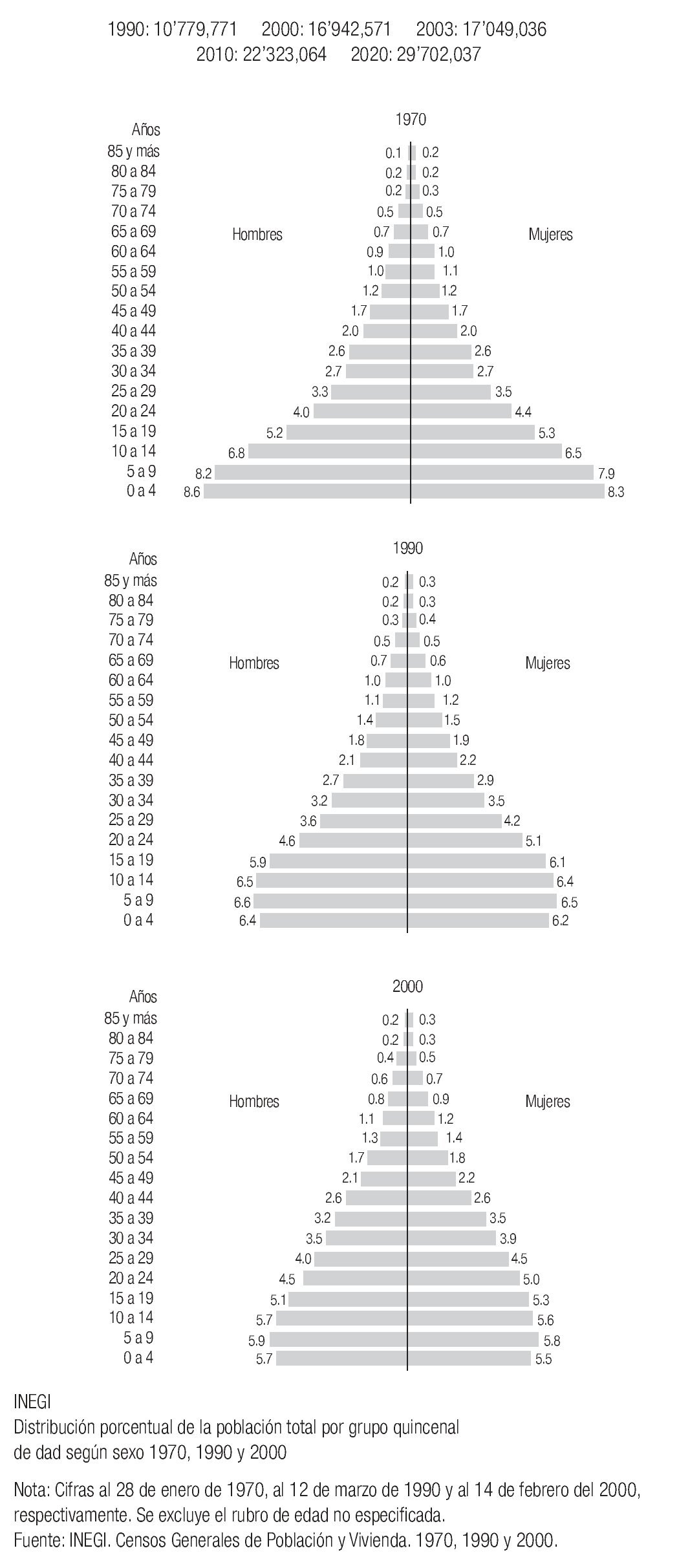
En México, debido a la estructura de la pirámide poblacional, esperamos un incremento sustancial de cánceres de mama, ya que están arribando a la edad de riesgo un gran número de mujeres cada año, incrementando de 17'049,036 mujeres mayores de 35 años en el 2003 a 29'702,037 en el año 2020 (Imagen 7).
Imagen 7. Tipo de patología de mama según BIRADS
En Estados Unidos se utiliza un modelo matemático para calcular el riesgo de cáncer de mama (modelo de Gail) en mujeres blancas, sin embargo, dicho modelo no ha sido validado en mujeres mexicanas o latinoamericanas.42
En el año 2000, la Organización Panamericana de Salud publicó el informe "La Salud en las Américas", donde la principal tendencia fue el incremento de casos de cáncer de mama. Reportaron que hubo 69,924 casos y 22,735 muertes en Sudamérica, 18,663 casos y 5,888 muertes en América Central y 6,210 casos y 2,310 muertes en el Caribe.43
En la década de los noventa, se inició en Estados Unidos la práctica masiva de la mastografía de pesquisa, lo que ocasionó un incremento de 4% anual en el número de cánceres de mama diagnosticados, pero a partir de 1990, el programa de pesquisa con mastografía ocasionó una caída del número de casos, hasta llegar a un pequeño declive anual y se observó una disminución de la mortalidad desde 1995.44,45 El meta-análisis de esas investigaciones mostró una reducción de la mortalidad estadísticamente significativa, pero modesta, particularmente en mujeres mayores de 50 años, que en ese país son la mayoría que padecen esa enfermedad y de menor impacto en mujeres de 40 a 49 años.46
Recientemente, Tabar y cols.,47,48 en el análisis de toda una población geográfica (Suecia) a las que se les ofreció pesquisa mastográfica anual, con 85% de adherencia, demostró una reducción de 63% en la mortalidad, en comparación con mujeres de 40 a 69 años que no se sometieron a ese escrutinio mastográfico.
Esta dramática demostración del beneficio de la pesquisa con mastografía rebasó el contexto de las investigaciones imperfectamente diseñadas que cuestionaban el beneficio de la utilización de la mastografía de pesquisa.49,50 Después de muchas controversias y debates, la conclusión final está clara. La mastografía de pesquisa, efectuada regularmente con una adherencia anual de 90%, reduce marcadamente la mortalidad por cáncer de mama en mujeres de 40 y más años,51 como ha sido propuesto por la American Cancer Society52 en sus metas para el 2015 para reducir la mortalidad en 80% o más, por ello la US Preventive Services Task Force53 de Estados Unidos, estableció en sus guías para pesquisa de cáncer de mama, las recomendaciones de hacer este estudio cada 1 a 2 años en todas las mujeres mayores de 40 años. Esta misma recomendación fue emitida en la Norma Oficial Mexicana para cáncer de mama54 en 2003 y por el Consenso Nacional sobre Diagnóstico y Tratamiento del Cáncer de Mama55 (2002), revalidado en enero del 2008 en su tercera revisión.
Con el uso de la mastografía se logra un efecto inmediato en la reducción del tamaño de los tumores diagnosticados, de su invasividad, de la cantidad de pacientes con metástasis a ganglios axilares y de las etapas al diagnóstico,56,57 pero el efecto en disminuir la mortalidad es más tardío y requiere, como lo mostró Tabar,47,48 la continuidad de los programas y la adherencia de las mujeres a los programas de escrutinio.
Extrapolando los datos actuales de la literatura, podemos postular que se puede disminuir la mortalidad por cáncer de mama al menos en 42% y probablemente más en 15 años de un programa de escrutinio y, adicionalmente, la incidencia de la enfermedad puede disminuirse en 30% o más si se extirpan los carcinomas ductales in situ (preinvasores) descubiertos por la mastografía.58
No obstante, los adelantos en el tratamiento tanto quirúrgico, farmacológico y radioterápico que se han logrado en los últimos años y el impacto mayor en la disminución de mortalidad, se ha atribuido a la posibilidad de hacer diagnósticos de cáncer de mama en fases más tempranas de la evolución de la enfermedad, lo que ha permitido no sólo disminuir la tasa de mortalidad, sino ampliar la utilización de tratamientos no mutilantes de la mama a un número cada día mayor de mujeres. Es entonces la mastografía el estudio estándar de oro actual disponible para poder efectuar campañas de escrutinio en mujeres asintomáticas, lo que ofrece la mejor posibilidad de lograr, a través del diagnóstico temprano, el poder reducir la mortalidad por cáncer de mama en nuestro país a mediano plazo. Las tasas de mortalidad que durante largo tiempo permanecieron en incremento, han logrado revertirse en los países donde se utiliza ampliamente a la mastografía de pesquisa, mostrando su impacto en el diagnóstico oportuno y en la utilización de modernas estrategias terapéuticas. Más de la mitad (56.2%) de todos los cánceres de mama reportados en 1995 en Estados
Unidos fueron diagnosticados en etapas 0 y I, comparado con 42.5% en 1985, lo que ha permitido incrementar a 58% el tratamiento conservador de la mama en esas pacientes, con tasas de supervivencia a 10 años de 95% en etapa 0 y de 88% en etapa I.59 El informe del SEER Cancer Statistics del 2006 de Estados Unidos, mostró que 61% de los cánceres diagnosticados por mastografía de pesquisa se encontraban en estadios iniciales, con probabilidades de supervivencia de 98.1%.60
En las sociedades o en los países donde existe alta frecuencia de cáncer de mama, o en los que la mortalidad por esta enfermedad constituya una de las principales causas de muerte entre las mujeres, como lo es en México y se tenga los recursos para hacerlo, el escrutinio con mastografía a la población en riesgo debe ser el primer método de control de cáncer de mama.
¿ MATERIAL Y MÉTODOS
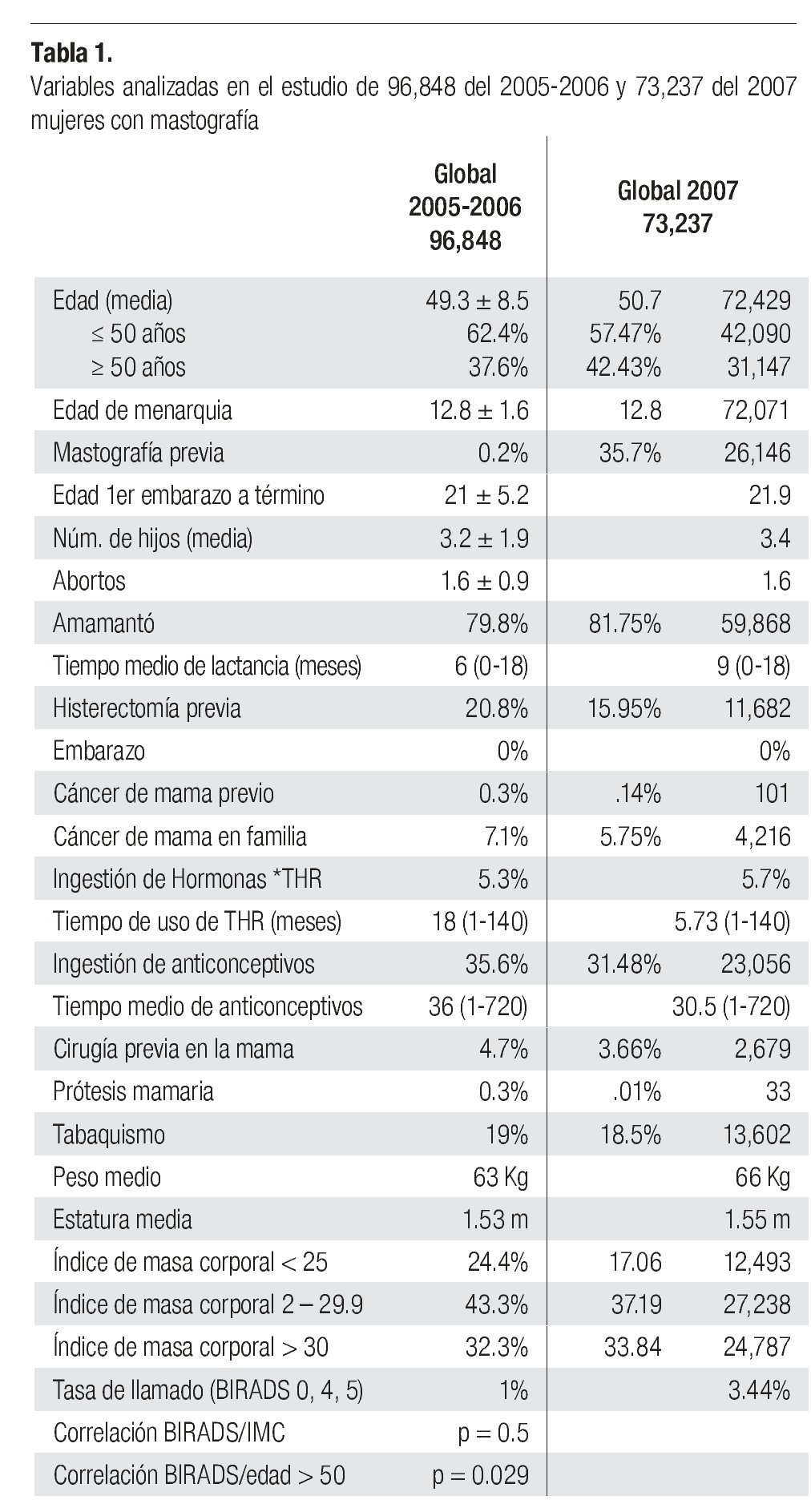
Nuestra fundación, FUCAM, es una sociedad civil con fines no lucrativos que inició en 2005, en combinación con INMUJERES del D.F., la Primera Campaña de Pesquisa de Cáncer Mamario en mujeres mayores de 40 años, habitantes del Distrito Federal en México, que voluntariamente quisieran someterse a mastografía con dos tomas por mama (ML y CC), misma que se efectuó con mastógrafos analógicos en unidades móviles que se llevaron a la zona de residencia (barrio o colonia) y se creó, en agosto del 2005 un centro hospitalario especializado en Enfermedades de la Mama para atender a todas las mujeres derivadas de esa campaña que lo requirieran. Se calculó, acorde al INEGI que había 1'800,000 mujeres en edad de riesgo en el Distrito Federal, de las cuales 45 a 50% tienen derecho a algún tipo de Seguridad Social (IMSS, ISSSTE, PEMEX, etc.) responsables de efectuarles los estudios que requieran, que 5 a 8% pertenecen a la clase socioeconómica alta que puede financiarse sus estudios, quedando 800,000 mujeres sin derecho a ningún tipo de atención médica. Se acordó con el gobierno del Distrito Federal iniciar con la cobertura de 10% de esa población (80,000) para efectuar mastografías en el término de un año (2005-2006). Este trabajo es la revisión de los 96,828 estudios mastográficos efectuados de marzo del 2005 a diciembre del 2006 y de 73,232 efectuados de enero a diciembre del 2007. De ellos, 71,478 (73.8%) fueron considerados de pesquisa (mujeres asintomáticas) y 25,369 (26.2%) diagnósticos en la primera serie y 58,535 (79.9%) como pesquisa y 13,870 (20.1%) diagnósticos en el 2007 debido a presentar signos o síntomas de patología mamaria (retracción de piel o pezón, masa palpable o secreción por pezón). Se calculó, acordé a un estudio de pesquisa efectuado en mujeres de bajos recursos (Low Income) en Estados Unidos, tener 2% de mastografías anormales ("tasa de llamado") acorde a la clasificación BIRADS del Colegio Americano de Radiología,61 en las categorías 0, IV y V, lo que implicaría tener, en 2006, que profundizar con estudios adicionales y o biopsias en 1,600 mujeres y diagnosticar y tratar 400 casos de cáncer de mama en un año.62
Se presenta la descripción de las variables estudiadas y la comparación de las variables entre la población total y los grupos de "pesquisa" y "diagnóstica". Las variables son: edad, edad a la menarquia, número de hijos, abortos, edad al primer embarazo a término, lactancias y tiempo de lactancia, histerectomía previa, mastografía previa, gravidez, antecedente de cáncer de mama en madre, hermana, tía o hija, ingesta de hormonales y tiempo, ingesta de anticonceptivos y tiempo, biopsia previa en mamas, cáncer de mama previo, presencia de signos o síntomas de patología mamaria, tabaquismo, cirugía previa en mama, índice de masa corporal y resultado de la clasificación de BIRADS en la mastografía.
Se hizo además la revisión de los expedientes clínicos de las mujeres con BIRADS anormal para determinar el número real de cánceres diagnosticados.
¿ RESULTADOS
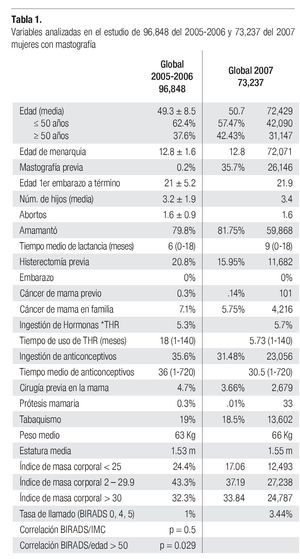
Los resultados se presentan en la Tabla 1. No hay diferencias significativas entre las variables estudiadas en los diferentes grupos. Se pudo identificar en esta serie a la edad mayor de 50 años como factor que incrementa el riesgo de tener una mastografía anormal (BIRADS 0, 4 y 5), con diferencia estadísticamente significativa entre el grupo global y en el de pesquisa (p = 0.029 y p = 0.031). El porcentaje de mastografías anormales en 2005-2006 (Tasa de llamado) BIRADS 0, 4 y 5 fue de 1% en 2005-2006 y 3.44% en 2007, sin diferencia significativa entre los grupos analizados de pesquisa o diagnóstico (0.91% vs. 1.4%).
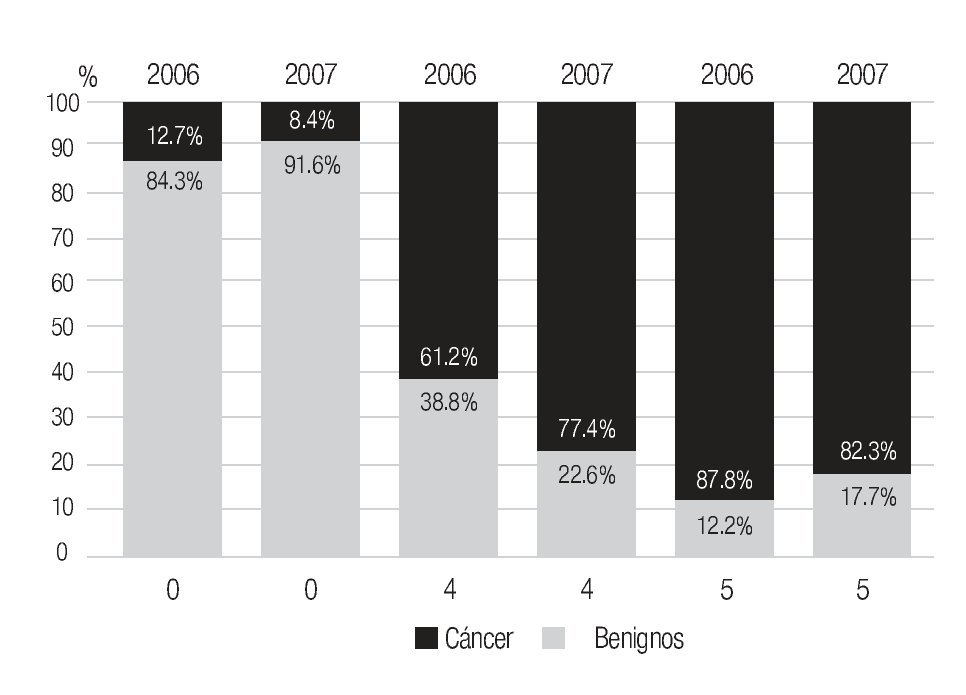
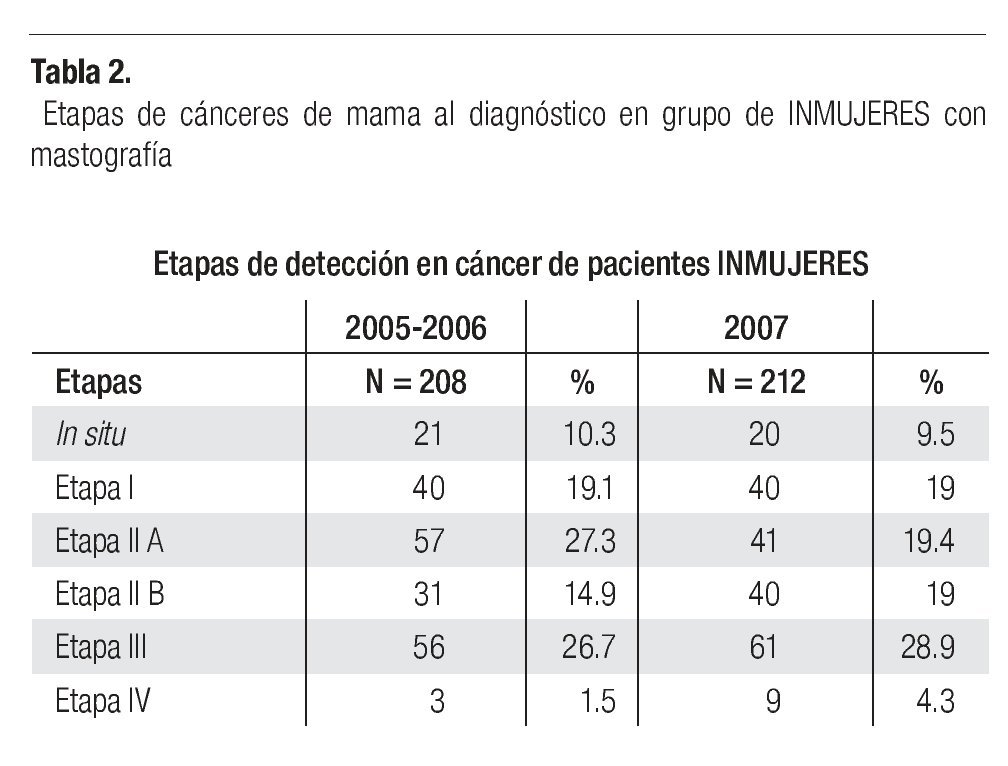
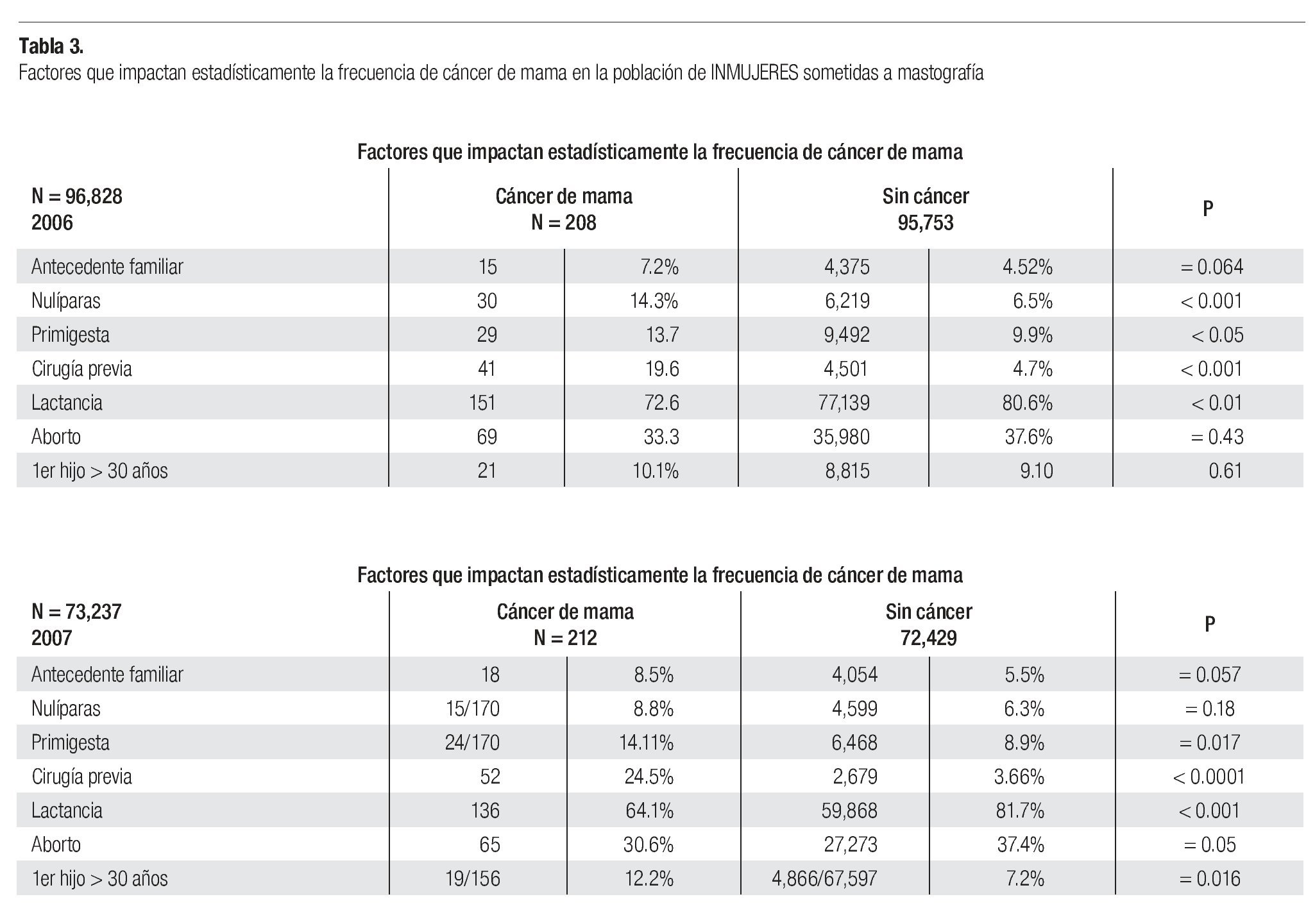
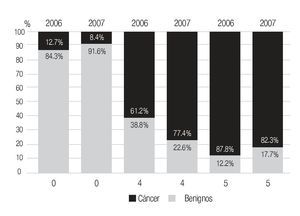
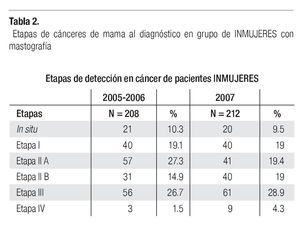
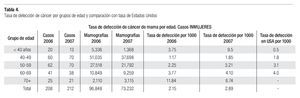
En la serie 2005-2006 hubo 643 casos en el grupo mastografía de pesquisa (MP) y 355 en el grupo mastografía diagnóstica (MD) que tuvieron categorías 0, 4 y 5 de BIRADS (949/96,828 = 1%). De ellos, 194 (21%) no acudieron para efectuar la revisión clínica y profundizar en el diagnóstico, no obstante haber recibido el citatorio en su domicilio. En 12.7% de casos BIRADS 0, 38.8% de BIRADS 4 y en 88% de BIRADS 5 se corroboró diagnóstico de cáncer (Imagen 7). En total, 208 de 750 casos evaluados fueron malignos (27.7%). La mayoría de los cánceres (68.5%) se diagnosticaron en mujeres menores de 60 años con media de edad de 53.5 años. Las etapas al diagnóstico se muestran en la Tabla 2. La tasa de cáncer fue de 2.1 al millar y se incrementó a 3 al millar en mujeres con antecedente familiar de cáncer de mama (Tabla 3) (7.1% de las mujeres), a 4.6 al millar en mujeres nulíparas, (6.5% de las mujeres) y a 9 al millar en mujeres con antecedente de biopsias previas de mama (4.7% de las mujeres). Hubo diferencia estadísticamente significativa entre las mujeres que no lactaron y que desarrollaron cáncer (27.4% vs. 19.4%, p < 0.01). Incluso las mujeres con un solo hijo tuvieron diferencia estadísticamente significativa de riesgo en comparación con las multíparas (p = 0.05). La tasa de cánceres detectados se incrementa proporcionalmente a partir de los 40 años, de 1.17 al millar hasta 11.84 al millar en las mujeres mayores de 70 años (Tabla 4). El grupo de mujeres menores de 40 años tiene una tasa de 3.75% en 2005-2006 y de 9.5% en 2007 y de ese grupo de mujeres, la gran mayoría correspondió a mastografía diagnóstica, ya que el criterio de inclusión al programa fue a mayores de 40 años o menores con síntomas o signos que indicaran el estudio. La distribución de edad en pacientes con cáncer muestra que casi 60% se sitúan entre los 40 y 59 años con media de 53.9 años, mientras que las mujeres sin cáncer representan 81% de ese grupo de edad.
En la serie del 2007 se diagnosticaron 212 casos de cáncer de mama para una tasa de 2.89 al millar, lo que significa que es necesario efectuar 345.4 mastografías por cada caso de cáncer diagnosticado. La tasa de 2.89% se incrementó a 3.26% en mujeres nulíparas, a 3.7% en mujeres con un solo hijo, a 3.9% en mujeres con primer hijo después de los 30 años, a 4.44% en mujeres con antecedente familiar de cáncer de mama y a 19.1% en mujeres con cirugía previa en la mama, mientras que la tasa disminuyó a 2.38% en mujeres que tuvieron al menos un aborto y a 2.27% en mujeres que dan lactancia a sus hijos (Tabla 3).
Tuvieron antecedente de cáncer mamario en familiares directos 18 de 212 (8.49%) de las mujeres con cáncer vs. 5.54% del total de las mujeres sometidas a mastografía. La tasa de detección de cáncer en mujeres menores de 40 años fue de 9.5 al millar (la más elevada) y posteriormente se incrementa, en proporción al aumento de la edad, de 1.85 en las de 40-49 hasta 6.7 al millar en las mayores de 70 años (Tabla 4).
Del resto de variables analizadas no hay diferencia en cuanto los hallazgos de la serie 2005-2006 y la distribución son similares.
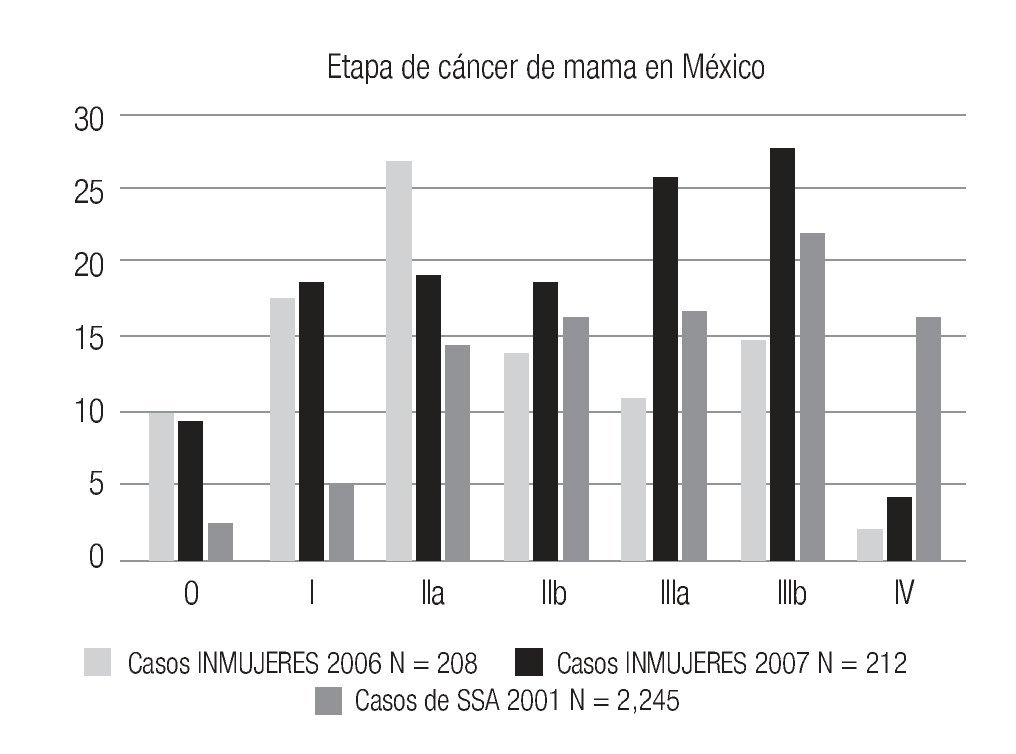
Las etapas clínicas de las mujeres estudiadas en 2007 (Tabla 2) muestran que 48% corresponden a etapas tempranas (0-I-IIA), (101/212), 48% (101) a etapas localmente avanzadas (E-IIB y III) y sólo 4.3% a casos con metástasis (E-IV). Globalmente, en la totalidad de casos de cáncer de mama del 2005, 2006 y 2007 (n = 400) 50.1% correspondió a etapas tempranas (0, I y IIA) y 9.8% a carcinoma in situ (Tabla 2). La media de edad de las mujeres con cáncer es de 54.1 años con rango de 31 a 91. La media de edad de mujeres con etapas tempranas es de 56 años vs. 52.4 años de las mujeres con etapas III y IV, p = 0.016. En 96 (52.7%) se documentaron metástasis ganglionares histopatológicamente.
En 88 casos (42.1%) el cáncer se diagnosticó por medio de mastografía de pesquisa y 121 (57.9%) por mastografía diagnóstica. Cuando se hizo mediante mastografía de pesquisa 71/88 (80.7%) correspondieron a etapas tempranas (0-I-IIA) vs. 30/121 (24.8%) cuando la mastografía fue diagnóstica.
¿ DISCUSIÓN
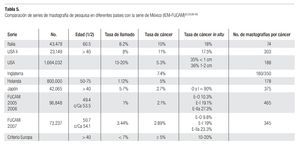
El porcentaje de casos reportados como BIRADS 0, 4 y 5 (tasa de llamado) que requieren estudios subsecuentes, biopsias y/o tratamiento, de 1% en 2005-2006 y de 3.44% en 2007, es más bajo que 2 a 8% informado en series americanas o europeas62-68 (Tabla 5). Esta diferencia puede indicar que nuestra población efectivamente tenga menor frecuencia de lesiones malignas, o bien, que nuestros radiólogos estén diagnosticando menos casos sospechosos, sin embargo, el hecho de que en 39% de las mastografías catalogadas BIRADS 4 y en 88% de las BIRADS 5 se haya corroborado diagnóstico de cáncer avalan su trabajo y tendremos que esperar a tener varios años de seguimiento de las pacientes catalogadas con BIRADS 1, 2 y 3 para que aparezcan los cánceres de "intervalo" y poder aclarar esa duda. Para minimizar este problema, en muchos centros de Estados Unidos hacen doble lectura independiente por radiólogos o utilizan el sistema de ayuda computarizada (CAD), con lo que se puede disminuir el índice de falsas negativas de 31 a 19%.69-70 En nuestro Instituto iniciamos en 2007 la utilización del CAD para placas analógicas, con objeto de incrementar la seguridad de las lecturas de las mastografías clasificadas como BIRADS 0 y la tasa de llamado se incrementó de manera significativa. Desgraciadamente en México y en la mayoría de los países de América Latina hay una carencia de técnicos y médicos radiólogos especialistas en imagen mamaria, como muestra, en México existen sólo 62 radiólogos con la certificación agregada en imagenología mamaria por el Consejo Mexicano de Radiología para una población de 100 millones de habitantes, por lo que debemos impulsar la creación de centros especializados en mama donde podamos capacitar al personal que requeriremos en el futuro, acorde al crecimiento de la población femenina en edad de riesgo.
El número de casos de cáncer de mama diagnosticados en 2005-2006 (208), implicó la necesidad de tomar 465 mastografías para diagnosticar un cáncer. Si extrapolamos que 27.6% de los casos con BIRADS anormal, citadas y que no acudieron a evaluación clínica fueran malignos y adujéramos que se pudieron haberse diagnosticado 52 casos adicionales, entonces se requerirían 369 mastografías para diagnosticar un cáncer. En el año 2007 se necesitaron 345.4 mastografías para diagnosticar cada cáncer. Esto es superior a las 180 que se requieren en Italia63 y a las 107-298 en Estados Unidos,62,64-68 pero similar a lo observado en Japón71 (Tabla 5). Si bien el costo de la mastografía en unidades móviles para nosotros es mucho más bajo (40 dólares) que en los países desarrollados (100 dólares), representaría 13,800 dólares por cada paciente diagnosticada con cáncer de mama.
La tasa de cáncer en nuestra serie, de 2.1 en 2005-2006 y 2.89 al millar en 2007, es mucho más baja que la reportada en países desarrollados de Europa occidental o de Norteamérica (5 a 11 al millar), pero más o menos similar a la encontrada en programas de pesquisa en Japón (Tabla 5). La frecuencia de historia familiar de cáncer de mama de 7.2 y 8.5% en nuestras mujeres es menor a la de 15% informada en Estados Unidos y sólo 6.5% de nuestras mujeres son nulíparas, pero ambos factores incrementaron significativamente el riesgo de cáncer de mama en nuestra serie (p > 0.001). Asimismo, la ausencia de lactancia incrementó con significancia estadística (p > 0.001) el riesgo de cáncer. La edad mayor de 50 años aumenta significativamente el riesgo (p < 0.001), sin embargo, el grueso de nuestras mujeres con cáncer están en el grupo de menores de 50 años, debido a que representan al mayor número de mujeres sometidas a pesquisa.
Nuestro estudio confirma que la media de edad de menarquia en nuestra población, de 12.8 años, es menor a la de poblaciones de Europa y Norteamérica, así como la media de edad al primer embarazo de 21 años en nuestras mujeres y afortunadamente también nuestra población tiene un bajo porcentaje de uso de terapia de reemplazo hormonal (5.3%).
Educar y sensibilizar a nuestras mujeres es prioritario para que acepten acudir a los centros especializados, ya que si bien acceden a efectuarse la mastografía en las unidades móviles llevadas al lugar donde habitan, un alto porcentaje (21%) no acude a ser atendidas cuando deben desplazarse, aun dentro de la misma ciudad, ocasionando que el costo del programa se eleve y disminuya el beneficio de una campaña de detección oportuna.
Es importante señalar, como hallazgo colateral, que sólo 22% de nuestras mujeres tienen índice de masa corporal dentro de la normalidad, que 43.9% tienen sobrepeso y 34% obesidad, lo que implica la coexistencia de otro severo problema de salud, pero que no incide en elevar el riesgo de cáncer de mama.
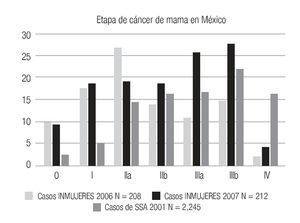
El número de casos de cáncer de mama (400) es aún bajo, pero muestra claramente que ya alrededor de 10% de los casos se diagnostican en etapas in situ y globalmente 50.1% en etapas tempranas (0, I y IIA) y sólo 27.8% en etapas III (Tabla 2), a diferencia de lo habitualmente publicado en series mexicanas6,55 (Imagen 8), donde más de 50% son etapas III y sólo 21% en etapas I y II, lo que subraya el beneficio del diagnóstico oportuno gracias a la campaña de pesquisa y que se enfatiza por el hecho de que las mujeres sometidas a mastografía de pesquisa se encuentren en 80.7% en etapas tempranas (0, I y II A) del cáncer de mama, a diferencia de sólo 24.8% de las sometidas a mastografía diagnóstica, p < 0.0001.
Imagen 8. Comparación de etapas clínicas al diagnóstico entre casos de INMUJERES sometidos a mastografía y población abierta atendida en unidades de la Secretaría de Salud
Este estudio confirma que nuestras mujeres diagnosticadas con cáncer de mama tienen una edad media (54 años) una década menor que las de Europa occidental o Norteamérica como consecuencia de nuestra estructura poblacional, lo que representa un mayor impacto en el número de años de vida productiva perdida (21 años según la SS) de las mujeres que mueren por esta enfermedad y que enfatiza la necesidad del diagnóstico oportuno, sobre todo ante el arribo masivo de mujeres a la edad de riesgo (Imagen 9). El hecho de que en los dos primeros años de trabajo de un programa de pesquisa se hayan alcanzado estándares internacionales de eficacia intermedia (tasa de cáncer in situ de 10%, 51% de etapas tempranas, tasa de llamado < a 5%) confirma que el trabajo efectuado ha sido adecuado y que podremos alcanzar la meta de disminuir la mortalidad por esta enfermedad a mediano plazo si continuamos con el programa planeado e incrementamos la adherencia al mismo.
Imagen 9. Estimación del incremento de la población mexicana mayor de 35 años, acorde a la conformación de la pirámide poblacional femenina. INEGI 2000.
Debemos unir esfuerzos e intercambiar información entre los médicos de diferentes instituciones en nuestro país y entre los países de América Latina para optimizar los escasos recursos con que contamos para este tipo de programas y apoyarnos en la capacitación del personal especializado.
Correspondencia:
Dr. Sergio A. Rodríguez Cuevas.
Av. Bordo 100, Viejo Ejido Santa Úrsula Coapa, Coyoacán, C.P. 04980. México, D.F.
Teléfono: 56 79 83 07.
Correo electrónico: sergiorocue@gmail.com.