La enfermedad metastásica hepática, es la causa más común de muerte en pacientes con cáncer. La resección quirúrgica completa se considera actualmente el tratamiento curativo, sin embargo sólo el 25% de los pacientes son candidatos en el momento del diagnóstico. Mostramos las distintas técnicas de Radiología Intervencionista Oncológica, que se han desarrollado para el tratamiento de metástasis hepáticas. El objetivo de estos procedimientos es permitir a los pacientes opciones de tratamiento curativo o paliativo, y en aquellos que no son candidatos a cirugía, convertirlos en candidatos a cirugía e incluso mejorar la supervivencia. Entre los procedimientos más realizados están: la ablación percutánea, quimioembolización intraarterial, radioembolización y embolización de la vena porta (EVP). Esta revisión describe las indicaciones y técnicas para la aplicación de los procedimientos mencionados.
Hepatic metastatic disease is the most common cause of death in cancer patients. Complete surgical resection is currently considered curative treatment, however only 25% of patients are candidates at the time of diagnosis.
Show the different techniques oncologic interventional radiology has been developed for the treatment of hepatic metastases. The purpose of these procedures is to allow patients options curative or palliative treatment and those who are not candidates for surgery, making them candidates for surgery and even improve survival.
Among the most commonly performed procedures are: percutaneous ablation, intraarterial chemoembolization, radioembolization and embolization of the portal vein. This review describes the indications and techniques for implementing those procedures.
Introducción
La enfermedad metastásica hepática es una de las causas comunes de muerte en los paciente con cáncer; en las metástasis hepáticas de cáncer de colon y recto fallecen 2 terceras partes de los pacientes. La resección quirúrgica completa ofrece la mejor supervivencia a largo plazo con tasas de supervivencia a 5 años de alrededor del 50%1,2, sin embargo sólo el 25% de los pacientes son susceptibles a cirugía en el momento del diagnóstico, mientras que los regímenes actuales de quimioterapia proporcionan una supervivencia de 22 meses1,3.
La Radiología Intervencionista ha buscado diferentes métodos para aumentar el número de candidatos a cirugía, ofrecer opciones de tratamiento curativo y en aquellos que no son candidatos a cirugía, mejorar la supervivencia y calidad de vida.
Aunque inicialmente el enfoque de estos tratamientos estuvo orientado principalmente a metástasis de colon y recto, actualmente se ha demostrado su uso en metástasis de cáncer de mama, neuroendocrinos y melanoma uveal1,5.
Procedimientos percutáneos como la ablación térmica y dentro de éstas, la ablación por radiofrecuencia (ARF) es la técnica más comúnmente utilizada. De los procedimientos vasculares, la quimioembolización intraarterial y embolización de la vena porta (EVP), son las que han ofrecido mejores resultados, otras técnicas como la radioembolizacíon de microesferas con Itrio90 han demostrado buenos resultados1.
Procedimientos percutáneos
La ablación percutánea con alcohol para el tratamiento del carcinoma hepatocelular fue reportada inicialmente con resultados favorables, sin embargo fue menos eficaz para el tratamiento de las metástasis hepáticas al igual que la inyección de quimioterapéuticos directos5-7. La ablación con láser fue una de las primeras técnicas descritas de ablación hipertérmica, la ARF es actualmente el método más utilizado y con mayores números de reportes en la literatura, ya que ofrece la posibilidad de realizar una zona de ablación predecible con resultados similares a los obtenidos en el tratamiento del hepatocarcinoma. Recientemente otras técnicas como ablación por microondas y crioablación están disponibles para este mismo fin, cuyo objetivo es lograr un mayor tamaño de ablación7, sin embargo estos método no han demostrado ser superiores a la ARF y en la técnica de crioablación se han publicado mayor número de complicaciones que con la ARF1,8,9.
La electroporación irreversible tiene la ventaja sobre las demás técnicas de destruir la lesión, sin afectar estructuras como los conductos biliares10.
La ablación hipertérmica destruye los tumores mediante calentamiento de las células a más de 50°C a 60ºC, para lograr la muerte celular irreversible11.
La ablación con crioterapia se logra al exponer el tejido tumoral a temperaturas idealmente de -50ºC, aunque con temperaturas de -20 a -40ºC se llegan a obtener buenos resultados12.
El principio por el cual funciona la ablación es la producción de calor o frío por el equipo, el cual es trasmitido por la aguja hacia el tejido, esto se propaga por el tejido condicionando la muerte celular; el contacto con estructuras vasculares disipa el calor o el frío, lo cual disminuye el efecto ablativo de estos procedimientos7,13,14.
Se han realizado múltiples estudios en donde se combinan tratamientos para obtener resultados más óptimos como ARF o microondas más quimioterapia intraarterial selectiva15.
Ablación por radiofrecuencia
Es una corriente sinusoidal en frecuencia de KHz que calientan los tejidos por medio de fricción condicionada por la agitación iónica, es necesario la colocación de placas de conducción puestas en el paciente, las cuales van conectadas al equipo para cerrar el circuito; existen varios tipos de agujas (rectas y cuervas) algunas con sistemas de enfriamiento cuyo objetivo es lograr mayores áreas de ablación, evitando la carbonización del tejido adyacente a la aguja, y varios tipos de equipos que modulan la frecuencia de KHz, así como el tiempo de aplicación de la energía para obtener el mismo objetivo; también equipos que permiten la colocación de varias agujas simultáneas las cuales son de tipo bipolar1.
Ablación por microondas
La diferencia con al ARF es que en la ablación por microondas (MWA, por sus siglas en inglés), no es necesaria la utilización de placas de conducción. En este método se excitan dipolos eléctricos de las moléculas de agua del área a tratar, lo cual condiciona calentamiento por fricción determinando calentamiento, carbonización y vaporización en la porción adyacente a la aguja16.
Este método alcanza temperaturas más altas (160ºC-180ºC) en la punta de la aguja electrodo y en menor tiempo que la ARF, lo cual ha demostrado en estudios en modelos animales que tiene un menor efecto de disipación del calor en la proximidad de grandes vasos sanguíneos16, sin embargo la reducción de recurrencia local en la proximidad de vasos sanguíneos aún no se ha demostrado en la práctica clínica.
Una ventaja técnica es que se pueden colocar hasta 6 agujas electrodo al mismo tiempo, alcanzando así áreas de ablación de mayor tamaño17.
Indicaciones y resultado de la ablación en enfermedad metastásica hepática
Inicialmente estos métodos fueron utilizados para metástasis hepáticas de pacientes que no eran candidatos a cirugía, sin embargo actualmente y debido a las ventajas que ofrece como mínimamente invasivo, menor morbimortalidad, tratar múltiples segmentos en pacientes con resecciones quirúrgicas previas y estancia hospitalaria más corta, así como disminución en los costos18, ha evolucionado al punto de utilizarse en simultáneo a las resecciones quirúrgicas; desafortunadamente no existen estudios clínicos aleatorizados prospectivos, únicamente retrospectivos en donde se demuestra que la cirugía es ligeramente superior a la ARF19, sin embargo en aquellos pacientes los cuales ya fueron sometidos a resecciones quirúrgicas previas, la ARF a demostrado ser el mejor método de tratamiento, lo cual se ve reflejado tanto en la sobrevida como en la calidad de vida de los pacientes20.
Los criterios utilizados para la realización de estos métodos en la mayor parte de los centros, se limitan a menos de 5 lesiones que midan menos de 3 cm de diámetro.
Hay datos limitados disponibles en la literatura sobre la utilidad de microondas, crioablación y láser en enfermedad metastásica hepática1.
La supervivencia general a 5 años de paciente tratados con ARF menores a 3 cm, igualó a los resultados obtenidos con cirugía21, en cuanto al abordaje percutáneo vs. el intraoperatorio, las últimas publicaciones demuestran supervivencias similares, con menor morbilidad y costo en el abordaje percutáneo15,21.
Otros factores como la experiencia del operador y localización, así como proximidad a vasos sanguíneos afectaron el resultado. Una mayor tasa de recurrencia local está asociada en forma importante cuando el tratamiento fue adyacente a vasos sanguíneos del 48% vs. 7% cuando no se encontraban adyacentes1,14.
La supervivencia global se ha visto afectada cuando existe enfermedad extrahepática22; aunque no hay datos disponibles suficientes del tratamiento combinado de ARF con quimioterapia, parece ser beneficioso en comparación con la ARF sola23, al igual que el uso de la ARF en primera línea vs. después de la segunda línea.
Estudios recientes muestran resultados similares de ARF vs. microondas y resección1,24.
Los pacientes con cáncer de mama presentan metástasis confinadas al hígado en el 5% y el pronóstico es pobre, la supervivencia global con tratamiento sistémico es de 25 meses1. El uso de ARF y láser han demostrado supervivencias medias que van de 30 a 60 meses, lo cual es comparable con la cirugía25,26.
Los pacientes con metástasis hepáticas de neuroendocrinos rara vez son candidatos a cirugía como método curativo, la cirugía citorreductora ha demostrado mejorar la calidad de vida, por lo cual el control sintomático es necesario27. El uso de la crioablación en estos pacientes se publicó hace más de 15 años, sin embargo este método fue rápidamente reemplazado por la ARF. El objetivo del tratamiento en estos tumores no es la erradicación completa de las lesiones, sino mejorar la calidad de vida y la supervivencia, la cual con ARF oscila entre 29 y 72 meses; además se logró alivio parcial o completo de los síntomas hasta en el 90%1,28,29 (figs. 1 y 2).
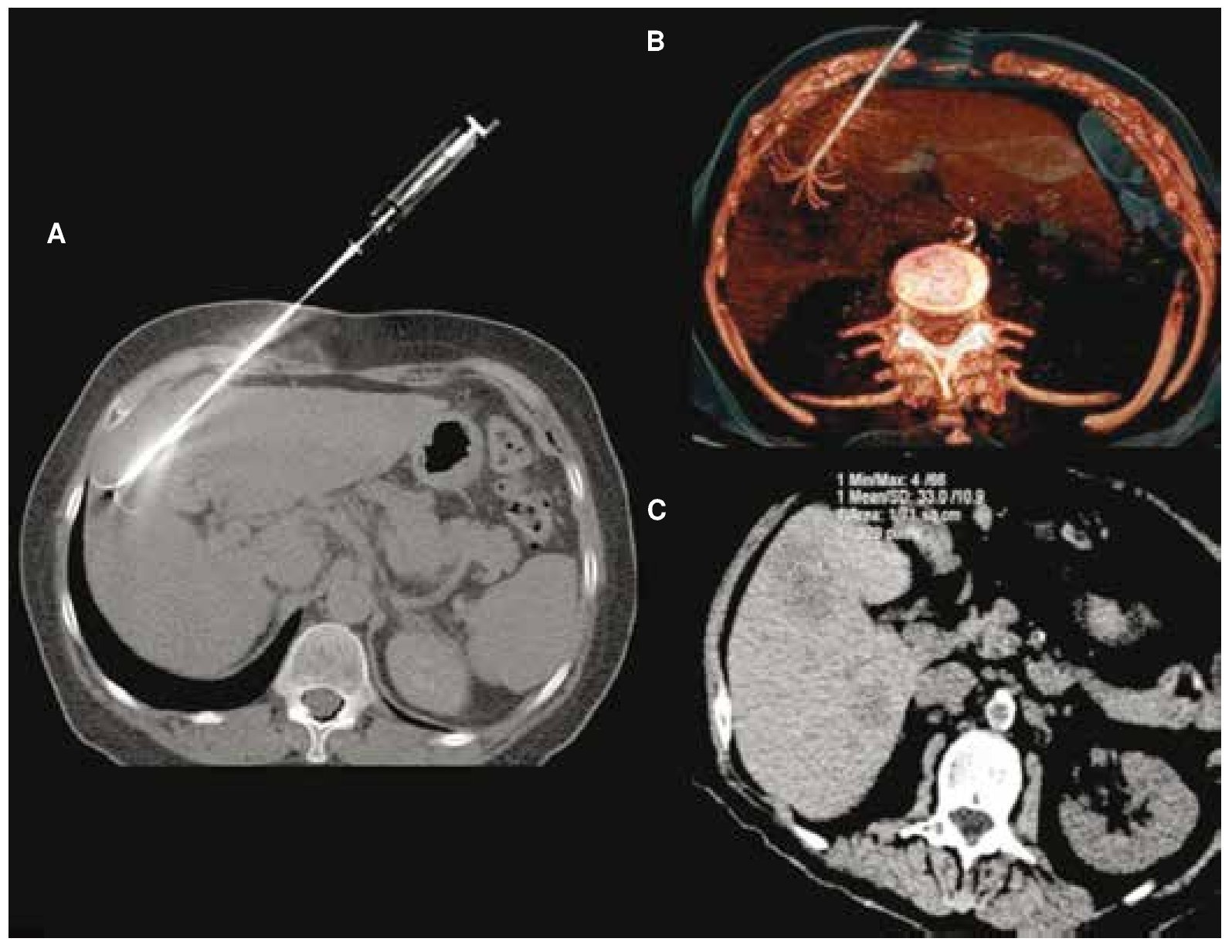
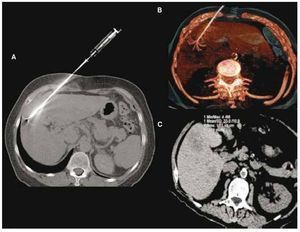
Figura 1. Paciente femenino de 43 años con metástasis de cáncer de mama en el segmento V. A) Aguja de radiofrecuencia curva en adecuada posición, visualizada en reconstrucción topográfica en máxima intensidad de proyección (MIP) y en B) reconstrucción tridimensional. C) Control por ARF con adecuada área de necrosis postratamiento.
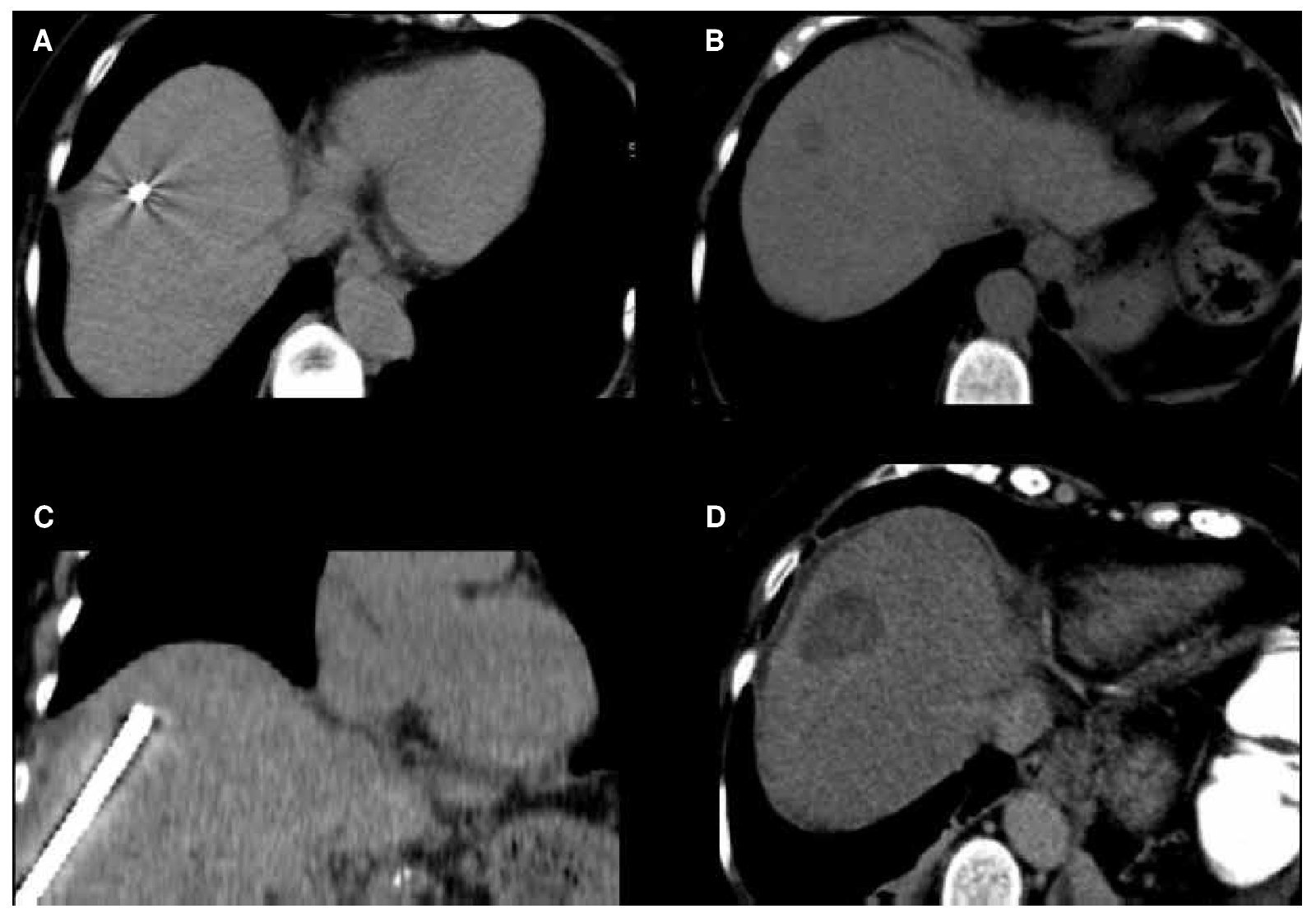
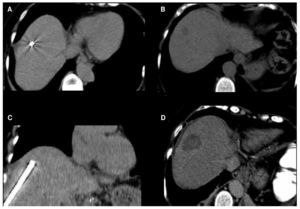
Figura 2. Paciente masculino de 56 años con cáncer de colon y recto. A) Aguja recta de radiofrecuencia visualizada en TC axial. B) Metástasis única en el segmento VIII del hígado de 16 mm de diámetro. C) TC con reconstrucción coronal donde se visualiza la vía de abordaje, con una aguja de radiofrecuencia de 30 mm de exposición en adecuada posición. D) Control post-ablación por radiofrecuencia, en donde se observa un adecuado resultado del tratamiento.
Procedimientos vasculares
La enfermedad metastásica se logra controlar o disminuir e incluso curar con la administración de quimioterapia sistémica; la administración intravenosa de oxaliplatino e irinotecan es uno de los pilares del tratamiento del cáncer colorrectal metastásico1; recientemente el uso de terapias blanco dirigidas a vías moleculares implicadas en el crecimiento tumoral o angiogénesis están siendo utilizadas30.
La administración a través de la arteria hepática de algunos agentes citotóxicos proporciona mayores tasas de respuesta, que las administradas por vía intravenosa1,31. Debido a que las metástasis tienen un irrigación de casi el 100% arterial, esto proporciona mayor concentración del fármaco en las metástasis, así como el factor embolizante del procedimiento, lo cual disminuye toxicidad sistémica.
La quimioembolización y la radioembolización intraarterial hepática son 2 técnicas comúnmente utilizadas para el tratamiento de las metástasis hepáticas de diferentes tumores primarios, este último procedimiento aún no está disponible en México.
La quimioembolización combina 2 mecanismos de acción: quimioterapia local e isquemia local; la radioembolización intenta destruir el tumor por medio de altas dosis de radiación local administrada por vía arterial hepática1.
Indicaciones
Los pacientes con carcinoma hepatocelular y enfermedad metastásica hepática son candidatos a estas 2 técnicas de tratamiento, aunque ambas tienen mecanismos de acción diferentes, aún no se ha establecido cuando elegir uno u otro método.
Los candidatos ideales para quimioembolización son aquellos que no son candidatos a cirugía y tienen pruebas de función hepática adecuada y sin trombosis de la vena porta contralateral al lóbulo a tratar; los candidatos deben tener una expectativa de por lo menos 3 o más meses, idealmente con estado del Eastern Cooperative Oncology Group de 2 o superior y una suficiente reserva funcional de hígado. No hay ningún acuerdo formal en lo que se considera suficiente función del hígado, pero un nivel de bilirrubina superior a 3 mg/dL (> 51.31 μmol/L), un nivel de menos de 3 g/dL de albúmina (< 30 g/L), son a menudo considerados como contraindicaciones para la quimioembolización o radioembolización1.
La dilatación de la vía biliar o insuficienca del esfinter de Oddi deben de ser tratadas, corregidas o en su caso administrar antibioticoterapia para evitar complicaciones como necrosis biliar o formación de abscesos1.
La quimioembolización se utiliza actualmente como terapia neoadyuvante antes de la cirugía o ablación local, o como tratamiento paliativo32,33 en pacientes con tumores neuroendocrinos, en donde puede aliviar los síntomas del síndrome carcinoide.
Quimioembolización: consideraciones técnicas
Todos los pacientes deben recibir premedicación, incluyendo hidratación y administración de antieméticos; en tumores grandes se recomienda administarción adicional de esteroides intravenosos.
En pacientes con anomalías biliares (dilatación o anastomosis biliodigestivas), se debe administrar antibióticos previo al procedimiento y posterior al mismo, para evitar complicaciones1.
En pacientes con tumores neuroendocrinos se recomienda administrar tratamiento previo con octreótido, para evitar crisis carcinoide postembolización.
Se debe realizar angiografía diagnóstica de las arterias celíacas y mesentéricas en todos los casos para evualuar la vascularidad del tumor e identificar variantes anatómicas, fístulas arteriovenosas o arterioportales; en el caso de fístulas o variantes anatómicas que condicionen emboliaciones no blanco deben ser embolizadas previo al tratamiento; tanto la embolización como la quimioterapia que se administrará no está estandarizada. El lipiodol es un medio de contraste oleoso que puede condicionar embolización y actúa como un portador de la quimioterapia, su potencial embólico es limitado, por lo cual se recomiendan utilizar agentes embolizantes adicionales como partículas de polivinil alcohol (PVA), microesferas o partículas de esponja hemostática34.
Los agentes quimioterapéutico más usados son la doxorrubicina, cisplatino y mitomicina C; se han introducido nuevos fármacos como el irinotecán en emboesferas de liberación que permiten una administración de dosis más fija, controlada y durante mayor tiempo1,26.
Resultados clínicos de la quimioembolización
Actualmente, se utiliza como tratamiento paliativo en pacientes refractarios a la quimioterapia sistémica de segunda o tercera línea, aunque existen trabajos publicados desde los años 90´s, estudios actuales (Martin et al.35) han demostrado que las microesferas cargadas con irinotecan reportaron una supervivencia global media de 19 meses; Fiorentini et al.36 reportó una sobrevida media de 22 meses que fue superior a la terapia sistémica actual, la cual reporta sobrevidas de 15 meses; por lo cual esta terapia puede convertirse en una alternativa viable en pacientes con metástasis colorrectales refractarias a tratamiento sistémico1.
La quimioembolización intraarterial se utiliza también en metástasis de tumores neuroendocrinos, cáncer de mama y melanoma uveal. Para pacientes con melanoma uveal no existe ningún tratamiento sistémico eficaz37; ya que la quimioembolización da una sobrevida de 19.5 meses, debe considerase como tratamiento de los melanomas uveales metastásicos29. En tumores neuroendocrinos ha demostrado ser una técnica muy potente para el control de los síntomas del síndrome carcinoide, con tasas de respuesta parcial y completa que van del 68% al 100%1.
Dos terceras partes de los pacientes pueden desarrollar síndrome postembolización, algún grado de náusea, fatiga, fiebre, leucocitosis y niveles elevados de enzimas hepáticas. Complicaciones mayores como absceso hepático, insuficiencia hepática son menos comunes y embolizaciones no blanco en menos del 1%; las lesiones biliares son más frecuentes debido a que dependen de irrigación arterial, por lo cual se puede encontrar hasta en un 11.3%1 (figs. 3 y 4).
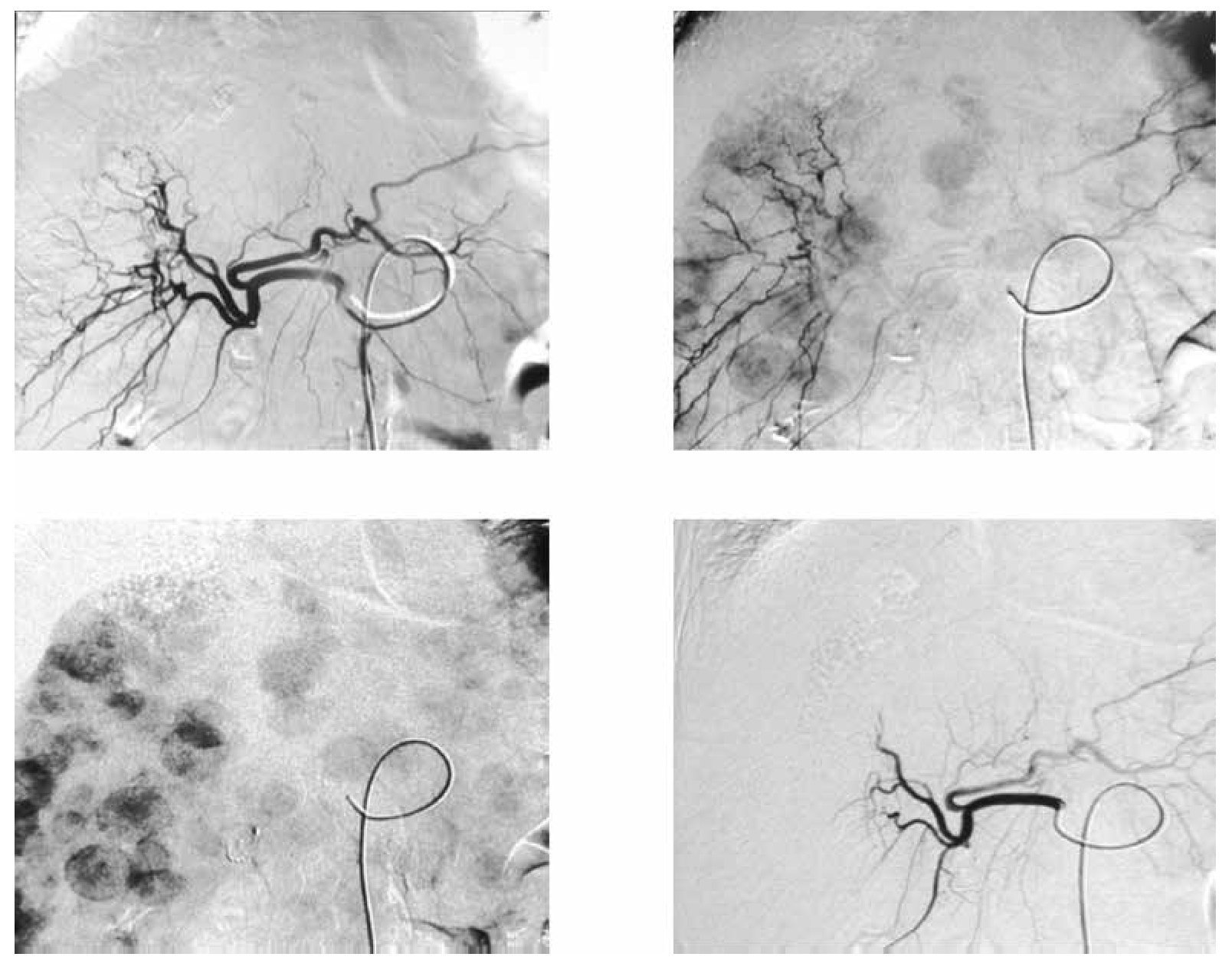
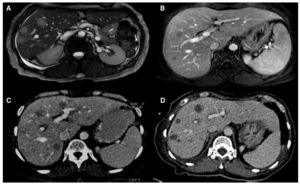
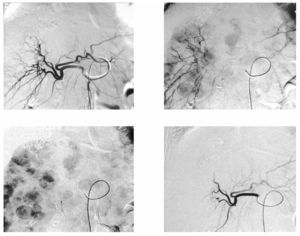
Figura 3. Paciente femenino de 68 años con cáncer de colon y recto con múltiples metástasis hepáticas, en tercera línea de tratamiento con progresión de la enfermedad. A) y B) Resonancia magnética pre y postratamiento con quimioembolización intraarterial selectiva con emboesferas cargadas con irinotecan, en donde se visualiza, en el control, disminución en el tamaño y número de metástasis. C) y D) TC contrastada en fase portal en donde se identifican disminución en número, tamaño y densidad de las metástasis hepáticas.
Figura 4. Imágenes de angiografía con sustracción digital del mismo paciente en la arteria hepática derecha, previa al tratamiento donde se visualizan múltiples lesiones metastásicas hipervasculares.
Radioembolización: consideraciones técnicas
La radioterapia externa en pacientes con enfermedad metastásica hepática no está indicada, esto debido a que la tolerancia del tejido hepático normal es de 30Gy y la dosis necesaria para destruir un tumor sólido es de 70Gy38, por lo cual surgió la idea de administrar por vía intraarterial radiación en forma selectiva: yodo 131-lipiodol, renio 188-4-hexadecil 1-2, 9, 9-tetrametil-4, 7-diaza-1,10-decanetiol (HDD)-lipiodol y diferentes microesferas con itrio90 (90Y); las microesferas de 90Y son actualmente la base de radioembolización1.
Actualmente, hay 2 tipos de microesferas radioactivas (resina o vidrio) aún no disponibles en México, ambas se basan en 90Y, su vida media es de 64.2 horas y decae a zirconio estable 90. La penetración al tejido es de 2.5 mm39.
Al igual que en los pacientes de quimioembolización intraarterial, se les realiza un angiografía celíaca y mesentérica previa, se tiene que asegurar que no exista flujo hepatofuga y se realiza embolización de arterias como la gastroduodenal, gástricas derechas y falciformes, así como ramas pancreatoduodenales40. Otro punto importante es determinar la derivación arteriovenosa, puesto que la dosis máxima tolerada por el pulmón en una sola aplicación es de 30Gy; por este motivo es necesaria la realización de estudios de medicina nuclear como el SPEC/CT para determinar posibles acumulaciones extrahepáticas1.
Resultados clínicos de la radioembolización
Los estudios realizados actualmente están enfocados a las microesferas de resina, esto debido a su aprobación para uso por la Food Drug Administration (FDA), estos estudios están enfocados en metástasis de tumores neuroendocrinos, cáncer de mama y melanoma uveal, los datos son heterogéneos y la mayor parte de los estudios son tratamientos combinados entre quimioterapia sola, radioembolización sola, y la combinación de ambos e incluso con bombas de infusión de quimioterapia arterial; los mejores resultados se han obtenido de la combinación de los métodos. En el 2001, Gray et al. compararon la infusión de quimioterapia con la bomba de infusión arterial con y sin radioembolización, demostrando un periodo libre de progresión mucho mayor cuando el tratamiento fue combinado (9.7 vs. 15.9 meses)1. Estudios actuales y meta-análisis han demostrado resultados similares, sobre todo si se utiliza como neoadyuvante41.
Hasta el 90% de los pacientes desarrollan síndrome post-embolización, náusea, fatiga, fiebre y niveles elevados de enzimas hepáticas, este puede durar hasta 2 semanas; existen menos complicaciones que las reportadas en la quimioembolización. Existen otras complicaciones descritas en la radioembolización, como son: neumonitis, úlceras gastrointestinales, pancreatitis, hipertensión portal, falla hepática, colecistitis y lesiones de la vía biliar1.
Embolización de la vena porta
Menos del 25% de los pacientes con enfermedad metastásica hepática de colon y recto son o serán candidatos a cirugía1; la quimioterapia aumenta sólo en un 15% el número de los pacientes que podrán ser llevados a cirugías óptimas.
La EVP pretende volver a los pacientes que inicialmente no eran quirúrgicos por el volumen hepático residual reducido en candidatos a cirugía, esto mediante la embolización de las ramas de la vena porta que alimentan el hígado que va a ser resecado. Este método se ha utilizado desde hace más de 20 años y se ha convertido en un estándar de atención para los candidatos no quirúrgicos por hígado residual limítrofe o menos al deseado1,42.
Unos de los límites para resección hepática es un volumen pequeño del hígado remanente futuro, que llevaría a una insuficiencia hepática mortal. La EVP condiciona hipertrofia del remanente hepático, lo que hace factible la hepatectomía en estos pacientes. Desde 1920 se ha recurrido a este mecanismo de hipertrofia con la ligadura de la vena porta en cirugía, lo que produjo reducción del tamaño del lóbulo afectado por la ligadura con la hipertrofia del contralateral1.
Embolización de la vena porta: consideraciones técnicas
Se debe realizar un tomografía tridimensional del hígado antes de decidir el procedimiento, esto con la finalidad de calcular el volumen del remanente hepático en caso de la hepatectomía; 4 a 6 semanas después de haber realizado la posterior a la EVP se debe de efectuar otra nueva tomografía para realizar una volumetría y valorar los cambios post-EVP; el volumen pre y post-EVP se realiza con los programas que cuentan los equipos de tomografía al delinear el contorno hepático deseado, excluyendo las lesiones hepáticas1.
El abordaje de la vena porta debe hacerse guiado por ultrasonido; existe controversia si se debe abordar el lóbulo que se va a resecar o hacer un abordaje por el lóbulo remanente; también no hay guías definidas del material de embolización que se debe utilizar1. El abordaje ipsilateral tiene la ventaja de que se aborda el hígado que va a ser retirado, por lo cual no se condiciona trauma del parénquima remanente, sin embargo técnicamente la embolización se torna más compleja debido a que se tienen que utilizar catéteres curvos o microcatéteres. La desventaja de un abordaje contralateral es el probable daño del hígado remanente, este último abordaje facilita la embolización por el trayecto del flujo sanguíneo1.
Se ha utilizado una gran variedad de materiales embolitos, tanto temporales como permanentes, sin embargo la mayor cantidad de publicaciones y experiencia en este método está descrita con cianoacrilato con lipiodol®; materiales temporales como esponja hemostática, trombina o fibrina deben evitarse, ya que producen menos hipertrofia del lóbulo remanente. Microesferas de gelatina han demostrado una embolización más distal y completa, y por lo tanto, un mayor grado de hipertrofia43.
Resultados clínico de la embolización de la vena porta
En un hígado no cirrótico o que no ha recibido tratamiento con quimioterapia, se considera un volumen remanente de parénquima hepático adecuado el 25%; sin embargo en un hígado con enfermedad crónica o que el paciente ha sido sometido a quimioterapia, se debe de considerar un hígado remanente del 40%1. La hipertrofia del hígado sucede rápidamente después de la EVP, y se debe realizar una volumetría entre 4 y 6 semanas después del procedimiento; el hígado no embolicado seguirá creciendo durante un año1. La cantidad de hipertrofia es inversamente proporcional al tamaño del hígado remanente, por lo cual incluso en hígados remanentes muy pequeños está indicado. Las quimioterapias con platino y bevacizumab reducen la cantidad de hipertrofia del hígado remanente44,45. La EVP más quimioembolización aumentan la hipertrofia del hígado remanente, éstas deben realizarse por separado y con un periodo entre una y otra de 3 a 6 semanas5.
La tasa de complicaciones está descrita en un 6% y éstas abarcan obstrucción parcial o completa de la vena porta, hemoperitoneo o hemobilia transitoria. En caso de existir lesiones metastásicas en el hígado remanente, éstas deben ser tratadas previas a la embolización, ya sea con radiofrecuencia o resección quirúrgica, ya que se ha demostrado crecimiento de las mismas post-EVP1 (figs. 5 y 6).
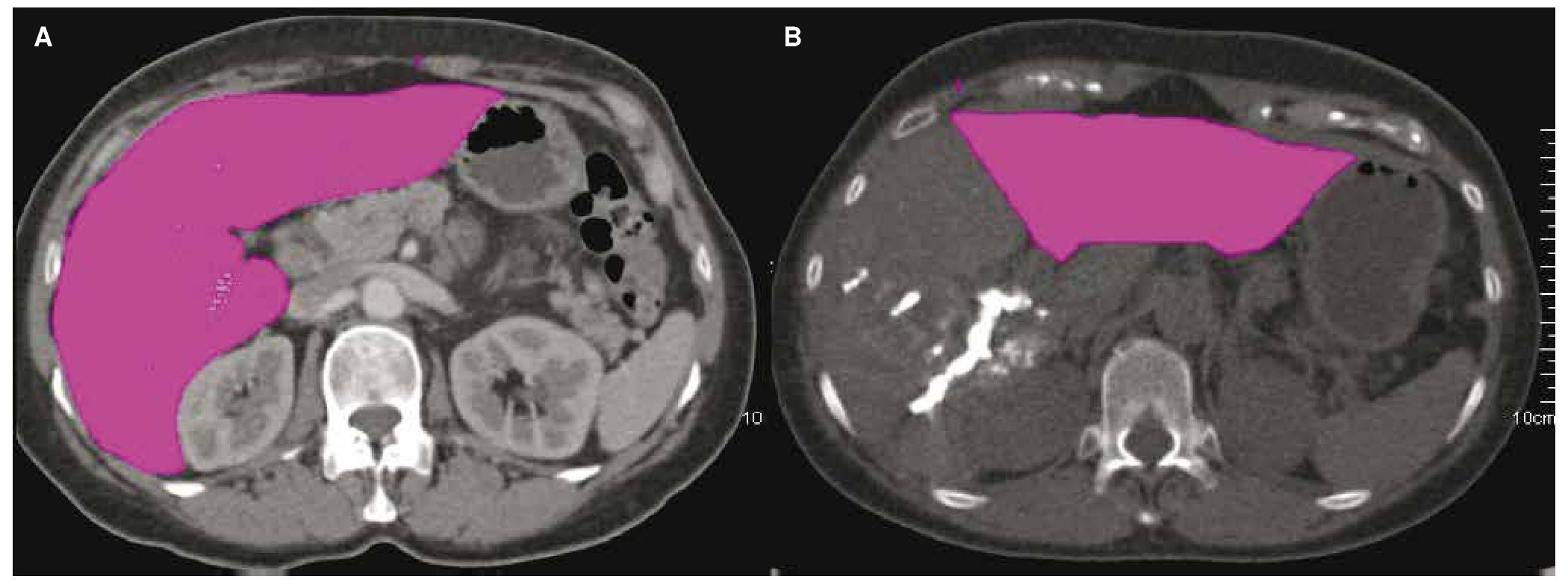
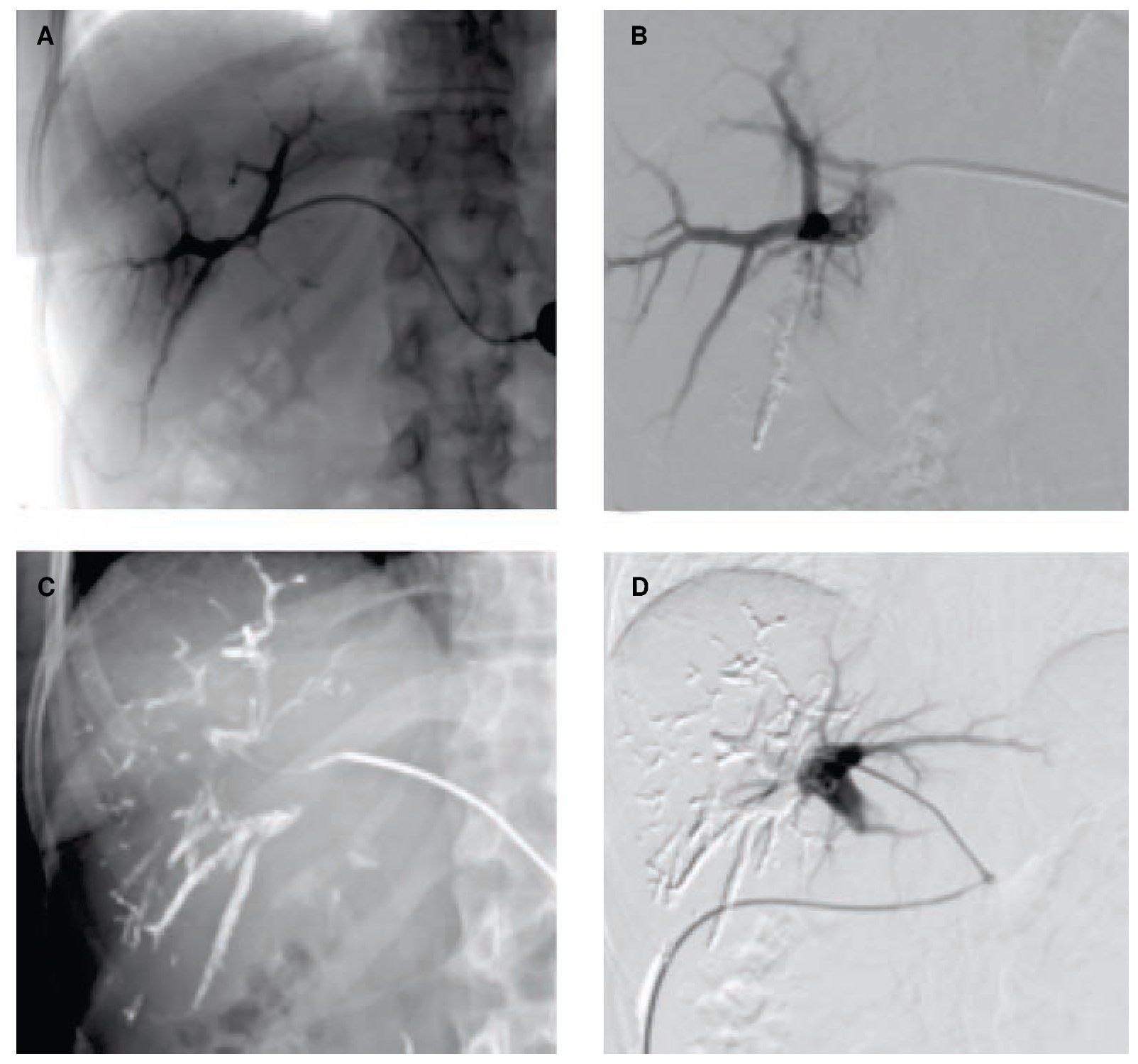
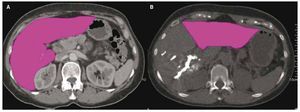
Figura 5. Paciente femenino de 57 años con cáncer de colon y recto con metástasis en ambos lóbulos hepáticos, en segunda línea de tratamiento con adecuada respuesta a la quimioterapia y lesiones residuales en lóbulo derecho. A) Volumetría previa a la hepatectomía derecha, en donde se identifica un lóbulo hepático remanente del 24%. B) Volumetría 6 semanas después del la embolización de la vena porta derecha donde se puede identificar crecimiento el lóbulo izquierdo, con un remanente hepático del 44%, la paciente fue llevada a cirugía con éxito y sin complicaciones posquirúrgicas.
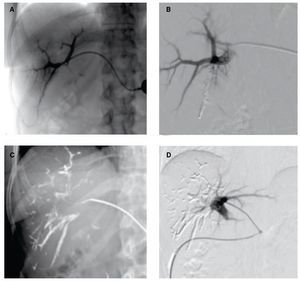
Figura 6. Misma paciente del caso anterior. A) Portografía con abordaje percutáneo contralateral. B) Imagen por sustracción digital de embolización de una de las ramas de la porta derecha con cianoacrilato y Lipiodol®C) Imagen radiológica de embolización parcial de las ramas de la vena porta derecha D) Control con sustracción digital al finalizar el procedimiento de EVP derecha, se identifica adecuada permeabilidad de la vena porta izquierda.
Conclusiones
Los pacientes oncológicos necesitan un abordaje multidisciplinario para su diagnóstico y tratamiento; dentro de este equipo de manejo de los pacientes es fundamental el uso de los procedimientos de Radiología Intervencionista Oncológica que han demostrado ser técnicas seguras y eficientes en el tratamiento de la enfermedad metastásica hepática que tienen por objetivo mejorar la sobrevida de los pacientes, así como su calidad de vida y en algunos casos llevar a resección quirúrgica aquellos que inicialmente no eran candidatos a cirugía.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Departamento de Radiodiagnóstico, Servicio de Radiología Intervencionistas, Instituto Nacional de Cancerología.
Av. San Fernando Nº 22, Colonia Sección XVI, Delegación Tlalpan, C.P. 14080, México D.F., México.
Teléfono: 3002 3507. Celular: 55 5454 9215.
Correo electrónico: enriquerojasmd@hotmail.com (Carlos Enrique Rojas-Marín).