¿ INTRODUCCIÓN
Los agentes citotóxicos antitumorales ejercen sus efectos en distintos órganos, uno de sus principales blancos primarios es la médula ósea, un sitio donde pueden reducir la hematopoyesis y causar anemia, trombocitopenia y/o neutropenia. Esta última predispone al paciente a las infecciones bacterianas, que pueden poner en peligro su vida. La incidencia de leucopenia severa –relacionada con quimioterapia– varía entre 2% y 28%, mientras que la de neutropenia febril (NF) oscila entre 10% a 57%, y la mortalidad por NF es de 0 a 7%.1 Hasta 50% de los pacientes con NF sufre una infección oculta y 20% bacteriemia. En la mayoría de los pacientes la infección es causada por organismos gram positivos, negativos u hongos.2, 3
Los pacientes que padecen neutropenia severa (NS) sin fiebre también tienen riesgo de infección y de ver afectada adversamente su calidad de vida. Además, la NS obliga a reducir la dosis de los fármacos quimioterapéuticos y/o a retrasar su aplicación, lo cual puede disminuir su eficacia. 2 La NS se define como el descenso < 0.5 x 10 9 células/L, y se ha observado que la frecuencia de infecciones correlaciona con la profundidad y duración del nadir hematológico (el punto más bajo en la cuenta de neutrófilos inducido por quimioterapia). 4 Por lo anterior, se considera que la NF constituye una urgencia oncológica que amerita hospitalización, aislamiento y antibióticos, lo que aumenta mucho los costos de tratamiento. 5 En EUA se registran 60 mil admisiones hospitalarias al año de pacientes con NF asociada a quimioterapia; 6.8% de ellos fallece. Se ha informado, además, que el costo promedio de la hospitalización es de $13,332 dólares. 6Dados los problemas que derivan de la NS y NF, se consideró necesario valorar el riesgo de provocar estos efectos mielotóxicos, identificar y, a la vez, conocer cuáles son los factores de riesgo que dan origen a estos trastornos. Con base en distintos análisis, se ha informado que los principales factores de riesgo son: edad, mayores 65 años, estado físico funcional deficiente, episodios anteriores de neutropenia febril, radioterapia previa con campos amplios de tratamiento, administración de radioquimioterapia combinada, citopenias debidas a afección de la médula ósea, estado nutricional deficiente y etapas avanzadas de cáncer.7-11
Con el fin de reducir la incidencia de NS - NF y sus complicaciones, se han empleado los factores estimulantes de colonias de granulocitos, entre ellos filgrastim, lenograstim y pegfilgrastim. La American Society of Clinical Oncology (ASCO), la European Society of Medical Oncology (ESMO) y la National Comprehensive Cancer Network (NCCN) recomiendan emplear la profilaxis primaria cuando el riesgo de neutropenia febril sea mayor de 20%.1,7,8,11,12 Los factores estimuladores de colonias de granulocitos comprenden un tipo de citocinas que regulan la proliferación, diferenciación y función de las células hematopoyéticas e inducen aumento de los neutrófilos circulantes.13 pegfilgrastim es la forma pegilada del factor estimulador de colonias de granulocitos recombinante humano; la pegilación significa que los residuos de metionina de la cadena N-terminal de filgrastim se encuentran unidos a una molécula de polietilenglicol (20 kD), éstas moléculas son polímeros con pH neutro, no tóxicas e hidrosolubles, capaces de aumentar el tamaño de se estructura original, lo que les permite prolongar la vida media de eliminación renal (de 15 a 80 vs 3.5 horas), según parece, sin alterar las propiedades biológicas de filgrastim. Cuando disminuye la eliminación renal entra en juego un mecanismo llamado autorregulación neutrofílica; experimentos de laboratorio han mostrado que la unión de pegfilgrastim al receptor del factor estimulante del crecimiento de granulocitos en la superficie del neutrófilo da lugar a su internalización y degradación.3,4,14,15
La Food & Drug Administration (FDA) aprobó en enero del 2002, el pegfilgrastim por su capacidad de disminuir la frecuencia de infecciones, manifestadas por NF, en pacientes con neoplasias no mieloides, a quienes se administran agentes antitumorales mielosupresores asociados a una elevada frecuencia de NF.13,16 Estudios internacionales han valorado la eficacia y seguridad de pegfilgrastim en comparación con filgrastim para prevenir el desarrollo de NS y NF. Los resultados indican que la terapia profiláctica primaria con pegfilgrastim reduce la incidencia de NF, los episodios de hospitalización, el uso de antibióticos, así como el número de retrasos y de ciclos de quimioterapia con reducción de dosis. Estos resultados se han observado en pacientes con neoplasias sólidas y hematológicas, así como a grupos de alto riesgo.5,15,17,18
El propósito de éste estudio consistió en evaluar la eficacia y seguridad de pegfilgrastim en la prevención primaria de la NS y NF inducidas por quimioterapia.
¿ PACIENTES Y MÉTODOS
Estudio retrospectivo, no comparativo, realizado en un centro oncológico privado entre octubre de 2006 y junio de 2008. El estudio incluyó a todos los pacientes entre 18 y 80 años, sin distinción de sexo, con diagnóstico confirmado de cáncer, que fueron tratados con quimioterapia combinada, en intervalos de 14 o 21 días, ya fuera como terapéutica complementaria primaria o contra la enfermedad metastásica, y quienes recibieron al menos una dosis de pegfilgrastim como profilaxis primaria para prevenir NS y NF.
Por profilaxis primaria se entiende la administración de un factor estimulador de colonias de granulocitos en el primer ciclo de quimioterapia, antes de que inicie la neutropenia.19 Veinticuatro horas después de concluir cada ciclo, se aplicó pegfilgrastim 6 mg, dosis fija y única, por vía subcutánea. El día previo o el mismo día de la administración del tratamiento antitumoral, se tomó una muestra sanguínea para determinar la cuenta de leucocitos, neutrófilos, hemoglobina y plaquetas, estos valores se consideraron como los basales de cada ciclo. Se tomó una segunda muestra en el periodo de nadir hematológico (día +7 para esquemas bisemanales y día +10 para los trisemanales) para contabilizar de nuevo las células hematológicas.
En lo que atañe a los pacientes incluidos en este estudio, se elaboraron registros de cada uno, en los que se consignaron los datos siguientes: edad, sexo, sitio anatómico de la neoplasia primaria, variedad histológica, etapa clínica, estado físico funcional (ECOG), número y tipo de factores de riesgo que los predisponían a padecer NS y NF,11,20 esquema de quimioterapia utilizado, número de ciclos aplicados, cuenta de leucocitos y neutrófilos basales (día -1 o 1) y en el nadir en cada ciclo, síntomas relacionados con la aplicación del factor estimulador, así como las hospitalizaciones, uso de antibióticos, aplicación de filgrastim, retraso en la administración de la quimioterapia o reducción de la dosis de los fármacos. Los resultados de cada biometría hemática, basales y en el nadir, se colectaron en forma retrospectiva.
Con el propósito de cumplir con los objetivos de éste estudio, la NF se definió como la cuenta absoluta de neutrófilos < 1.0 x 109 células/L y la fiebre como la temperatura corporal > 38.2°C, mientras que la NS se definió como leucopenia o neutropenia de grados 3 y 4, de acuerdo a los criterios comunes de toxicidad del National Cancer Institute (CTCAE v3). La leucopenia de grado 3 correspondió a cifras entre 1.0 y 2.0 x 109 células/L, y la de grado 4 a cuentas inferiores a 1.0 x 109 células/L; la neutropenia de grado 3 comprendió una cuenta absoluta de 0.5 a 1.0 x 109 células/L, y la grado 4, valores menores a 0.5 x 109 células/L., mientras que la hospitalización incluyó toda estancia en el nosocomio mayor de 24 horas. También, se determinó la frecuencia de uso de antibióticos en cada paciente y en cada ciclo de tratamiento. Por otra parte, la seguridad del tratamiento se determinó por medio del análisis de los efectos secundarios relacionados con la administración de pegfilgrastim, así como por la frecuencia de reducciones, retrasos u omisiones en la administración de los ciclos programados de quimioterapia.
El análisis de los resultados se efectuó con los métodos de estadística descriptiva, con medidas de tendencia central y de dispersión. La diferencia entre las cuentas de leucocitos y neutrófilos, tanto basales como al nadir, se analizaron con la prueba ANOVA.
¿ RESULTADOS
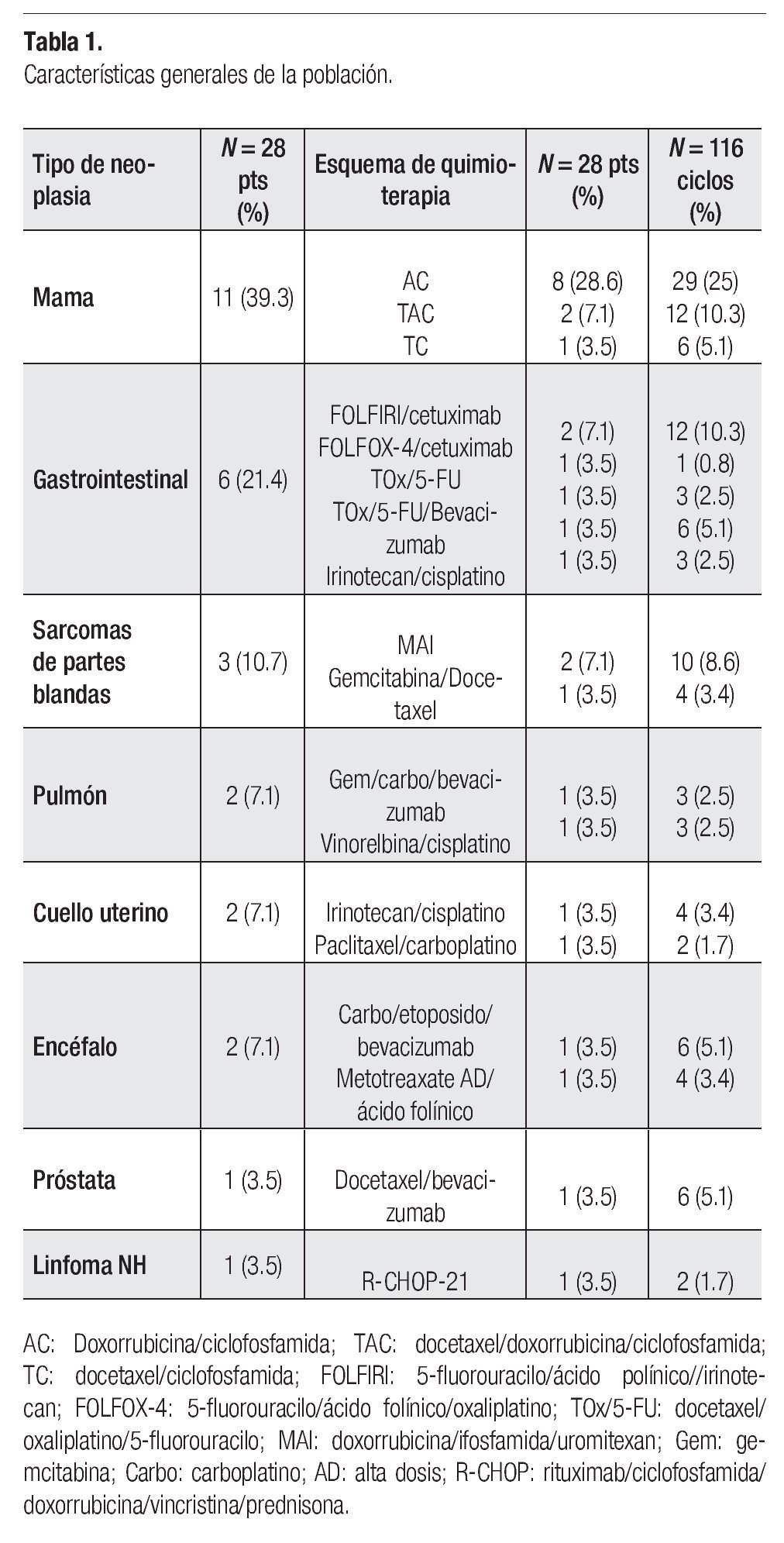
Durante el periodo que abarcó el estudio, 28 pacientes, con edad promedio de 53.5 años (34 a 77), 22 de mujeres (76.8%) y seis hombres (21.4%), recibieron tratamiento primario con pegfilgrastim para prevenir NS y NF. Las características generales de los pacientes se muestran en la Tabla 1. Quienes fueron incluidos en el estudio tenían: cáncer de mama, 11 (39.3%); gastrointestinal, seis (21.4%), y sarcomas de partes blandas, tres (10.7%). Predominaron las neoplasias en etapas avanzadas, nueve (32.1%) en etapa IV, y ocho en etapa III (28.6%); seis pacientes (21.4%) en etapa II y tres (10.7%) en etapa I; además una mujer con neoplasia del cuello uterino y otra de colon recibieron tratamiento por enfermedad recurrente.
En los 28 pacientes se aplicaron 116 ciclos de quimioterapia, mediana de cuatro y rango de uno a seis (Tabla 1). Once de los 28 pacientes (39.2%) recibieron cuatro ciclos; nueve (32.1%), seis ciclos; cuatro (14.3%), tres; dos (7.1%) y otros dos un solo ciclo de quimioterapia. Los esquemas de tratamiento consistieron en doxorrubicina y ciclofosfamida (AC) en 29/116 ciclos (25%), docetaxel, doxorrubicina y ciclofosfamida (TAC) en 12 (10.3%), FOLFIRI/cetuximab en 12 (10.3%), doxorrubicina, ifosfamida y uromitexan (MAI) en 10 (8.6%) ciclos. En todos los pacientes se utilizó terapia combinada, en 20 de ellos (71.4%) con fármacos citotóxicos y, en los ocho restantes (28.6%), agentes citotóxicos y biológicos. En 20 sujetos (71.4%) se empleó la combinación de dos fármacos, en cuatro (14.3%) se usaron tres agentes y en los otros cuatro casos (14.2%) cuatro fármacos. La terapia sistémica tuvo indicación complementaria en 11 pacientes (39.2%); primaria en 6 (21.4%), y para enfermedad metastásica o recurrente en los otros once (39.2%).
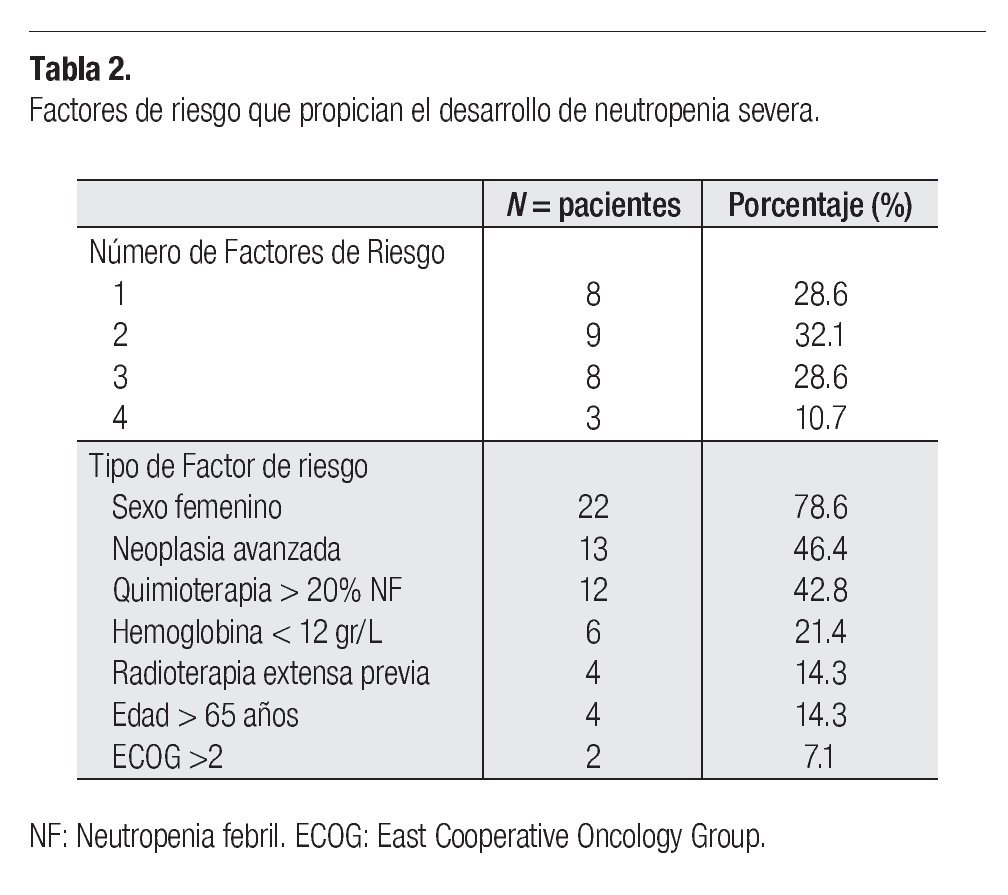
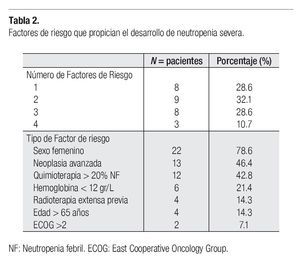
Todos los enfermos analizados tuvieron al menos un factor de riesgo de padecer NS o NF (Tabla 2). Ocho pacientes (28.6%) acumularon 3 factores, y tres (10.7%) tuvieron 4 factores de riesgo. Entre éstos el más frecuente fue el sexo femenino en 22 casos (78.6%), seguido de neoplasia avanzada en 13 (46.4%) y quimioterapia con riesgo > 20% de NF en 12 casos (42.8%). En lo que respecta a edad mayor a 65 años hubo cuatro sujetos y con radioterapia extensa previa, cuatro más (14.3%).
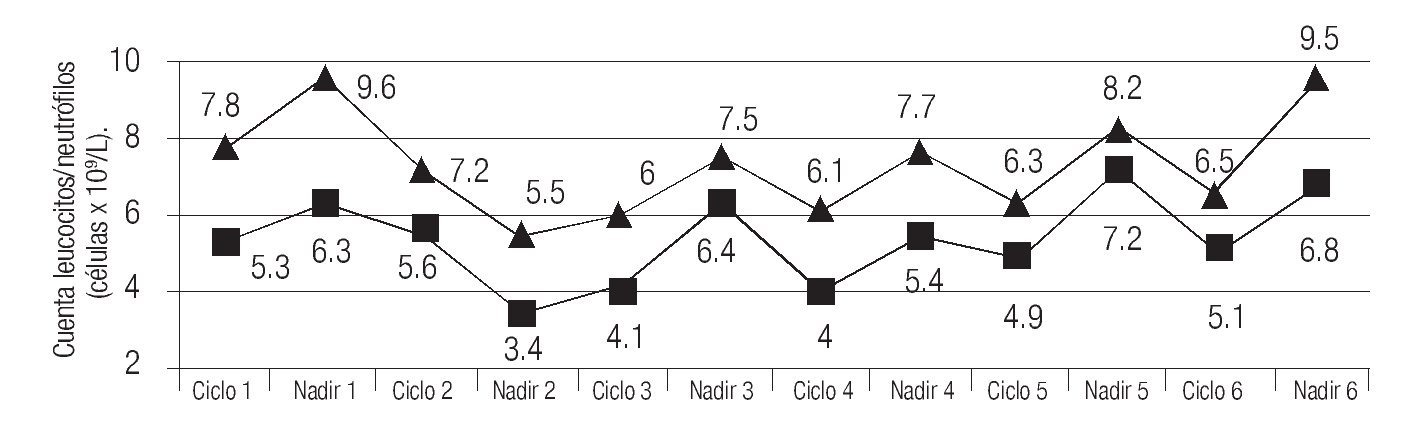
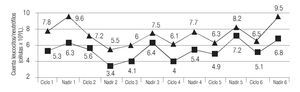
De los 116 ciclos de quimioterapia aplicados se obtuvieron cuentas hematológicas basales en 111 (95.7%) y al nadir hematológico en 90/116 (77.6%). Se encontró que, para cada ciclo de tratamiento (primero al sexto), la mediana de leucocitos fue 7.8, 7.2, 6.0, 6.1, 6.3, 6.5 x 109 células/L (p > 0.05) y al nadir 9.6, 5.5, 7.5, 7.7, 8.2, 9.5 x 109 células/L (p > 0.05). Cabe mencionar, que no se observó diferencia estadística alguna entre las cuentas basales y las tomadas al nadir (por ciclo) p > 0.05. La cifras de neutrófilos basales, en cada uno de los ciclos, fueron: 5.3, 5.6, 4.1, 4.0, 4.9, 5.1 x 109 células/L (p > 0.05) y al nadir de: 6.3, 3.4, 6.4, 5.4, 7.2, 6.8 x 109 células/L (p > 0.05); tampoco se observó diferencia entre las determinaciones basales y al nadir (por ciclo) p > 0.05 (Imagen 1). En ninguna de las mediciones basales se detectó leucopenia o neutropenia de grados 3-4, mientras que en las mediciones al nadir se detectaron tres casos de leucopenia grado 3 (3.3%) y uno de grado 4 (1.1%), así como cuatro episodios de neutropenia grado 4 (4.4%) (Imagen 1). La totalidad de los episodios de leucopenia y/o neutropenia ocurrieron en cinco pacientes (17.8%); cuatro de ellos tenían menos de 50 años, dos con neoplasia avanzada, dos con cáncer de mama y dos recibieron docetaxel. Un paciente (3.5%) cursó con NF y hubo de ser hospitalizado, ya que sufrió herpes zoster severo y ameritó terapia con agentes antivirales, luego de una estancia de cinco días fue egresado con recuperación hematológica completa. Por otra parte, la mediana de hemoglobina en cada uno de los ciclos basales fue: 13.3, 12.5, 11.8, 11.5, 11.7 y 11.7 gr/dL (p > 0.05); se detectaron cuatro episodios de anemia de grado 3 (3.6%), y uno de grado 4 (1.1%), mientras que en las cuentas realizadas al nadir, la mediana fue: 12.6, 11.8, 12.1, 11.8, 11,7 y 11.7 gr/dL, respectivamente, (p > 0.05), sin eventos tóxicos de grados 3 o 4. En lo que atañe a las plaquetas, solo se observó un evento de grado 4 en el nadir del primer ciclo en un paciente.
Imagen 1. Relación entre las cifras de leucocitos y neutrófilos, y número de eventos de toxicidad de grados 3 - 4 observados.
En lo que respecta a la seguridad de pegfilgrastim, sólo un paciente (3.5%), en un ciclo, manifestó síntomas relacionados con la administración del pegilado; éstos consistieron en náusea y cefalea. Dos pacientes (7.1%) con NS sin fiebre requirieron antibióticos profilácticos; en ambos, y en el que sufrió Herpes Zoster, se utilizó filgrastim como tratamiento en contra de NS y NF.
Por otra parte, tres pacientes (10.7%) requirieron transfusiones de paquete globular, dos de ellos en una ocasión y uno en cuatro. Además, hubo necesidad de reducir la dosis planeada de los fármacos antitumorales en un paciente (3.5%) durante un ciclo (0.9%), asimismo, de retrasar su aplicación en nueve ciclos (8.1%). Además, en las cuentas hematológicas basales de los ciclos 2 a 6, se observaron 14/88 ciclos (15.9%) con leucocitosis > 11 x 109 células/L [mediana 16.3, rango de 11.4 a 18.6]; neutrofilia (> 8 x 109 células/L en 9/88 ciclos (10.2%) [mediana 11.8, rango de 11.6, rango de 8.2 a 14.2 x 109 células/L] y trombocitosis (> 500 x 109 células/L) en 6/88 (6.8%) de los ciclos [mediana 600, rango 515 a 755 mil].
¿ DISCUSIÓN
En este estudio observamos que con el uso de pegfilgastim, como prevención primaria, hubo baja incidencia de neutropenia de grado 4 (5.5% de ciclos y 17.8% de pacientes) y de neutropenia febril (3.5% de pacientes) inducida por quimioterapia. También, notamos baja incidencia de eventos adversos (3.5%), retraso de tratamientos (8.1%) y de ciclos con reducción de dosis (0.9%). Estos resultados son similares a los reportados en otros estudios comparativos.
La aplicación de factores estimulantes de colonias de granulocitos reduce el riesgo de muerte por infección [RR: 0.55; IC95% 0.33 – 0.90, p = 0.018], la mortalidad temprana [RR: 0.60; IC95% 0.43 – 0.83, p = 0.002] y la muerte por neutropenia febril [RR: 0.46; IC95% 0.43 – 0.67, p< 0.001]. Además, permite mantener la intensidad de dosis de la quimioterapia, en comparación con los pacientes que no reciben el factor estimulador.19 En varios estudios prospectivos se ha comparado la eficacia y seguridad de pegfilgrastim con la de filgrastim, como fármacos de prevención primaria en contra de NS, tanto en neoplasias sólidas,21-25 como hematológicas.26-29 Dichos estudios han encontrado que el rango de NF, NS, duración de la recuperación e incidencia de dolor óseo para pegfilgrastim oscila entre 1% a 14%, 15.8% a 84%; 0.6 a 2.8 días, 7% a 45%, respectivamente, mientras con filgrastim los porcentajes fueron: 4% a 27%, 27% a 83%, 1.1 a 2.4 días y 10% a 42%, respectivamente.
En el año de 2007, se publicaron los resultados de un meta-análisis de cinco estudios,21-23,26,27 diseñados para determinar la eficacia y seguridad del agente pegilado en comparación con filgrastim como prevención primaria en contra de NS y NF. Este meta-análisis30 incluyó tres estudios fase II y dos de fase III, tres de ellos se realizaron en pacientes con cáncer de mama y dos en sujetos con linfomas. En los cinco ensayos, 319 participantes recibieron pegfilgrastrim y 293 filgrastim; el cociente de riesgo acumulado para neutropenia febril en el primer ciclo de tratamiento favoreció al pegilado [RR: 0.64, IC95% 0.43 a 0.97], no hubo diferencia entre ambos medicamentos en relación a la incidencia de neutropenia de grado 4, ni en el tiempo de recuperación de la misma (p > 0.05). Otros reportes, con carácter retrospectivo, han informado resultados similares a los detectados por nuestro grupo en relación a la incidencia de NF, proporción de ciclos con retardo o reducción de dosis de los fármacos, hospitalizaciones y uso de antibióticos.5,17,31-34 Tanto en los estudios prospectivos como en los retrospectivos se ha informado que se requieren de 10 a 14 aplicaciones subcutáneas de filgrastim para lograr una cuenta sostenida de neutrófilos > 1.5 x 109 células/L, mientras que sólo se requiere de una sola aplicación de pegfilgrastrim para alcanzar la misma cifra de células.
Como antes se expuso, en nuestro trabajo, la dosis de los fármacos antitumorales se redujo en un ciclo y se retrasó la aplicación del tratamiento en nueve ciclos. Otros estudios han hallado que la necesidad de reducir las dosis es, aproximadamente, de 5%, mientras que los retrasos y/o diferimientos se observan entre 5% y 20% de los ciclos cuando se emplea el pegilado.21,29,35,36 En nuestro reporte, sólo un paciente desarrolló síntomas asociados a la aplicación de pegfilgrastrim. Diversos autores señalan que el evento adverso más común es el dolor óseo, 7% a 45%;21,23,25,27,29,35,36 otros eventos adversos, infrecuentes, son púrpura vascular,29 aumento en los niveles séricos de fosfatasa alcalina, deshidrogenesa láctica, ácido úrico,21,23 así como pioderma gangrenoso 37 y ruptura esplénica.38 En nuestro estudio detectamos leucocitosis (15.9%), neutrofilia (10.2%) y trombocitosis (6.8%) sostenida; no se conoce el significado de estos hallazgos; sin embargo, es posible que la leucocitosis se asocie a la premedicación con corticoesteriodes, pero no queda clara la explicación en torno a la trombocitosis. Aunque ésta se observa en una pequeña proporción de los ciclos de tratamiento requiere de vigilancia estrecha, ya que la mayoría de los pacientes tienen otros factores de riesgo de sufrir estados de hipercoagulabilidad que pueden favorecer la aparición de eventos trombóticos.
El presente estudio tiene las limitaciones inherentes a su carácter retrospectivo y no es comparativo; el reducido número de sujetos y los pacientes con edades > 65 años, así como la heterogeneidad de las neoplasias estudiadas. No obstante, nuestros resultados son compatibles con los reportados en la literatura, lo cual es producto de una adecuada selección de pacientes con mediano y alto riesgo de NS y NF inducida por quimioterapia. Nuestro trabajo es uno de los pocos que señala con precisión los factores de riesgo para el surgimiento de NS y NF. En la práctica cotidiana es necesario valorar cada uno de los factores que incrementan el riesgo de NS y NF relacionado con la quimioterapia.
Por su carácter retrospectivo, nuestro estudio no incluyó un análisis de calidad de vida ni de los costos. La literatura señala que la neutropenia aumenta el dolor físico, la ansiedad y disminuye la interacción social; también, se reporta que el paciente neutropénico frecuentemente refiere fatiga y emociones negativas.39 Se sugiere evaluar el impacto de la neutropenia severa sobre la calidad de vida del paciente, mediante el instrumento denominado Functional Assessment of Cancer Therapy-Neutropenia (FACT-N), el cual muestra correlación entre la neutropenia, malestar físico, preocupación y síntomas parecidos a los de la gripe.40 Por otra parte, un estudio de 189 pacientes, tratados con quimioterapia, encontró que quienes son tratados con algún factor estimulador de colonias acuden con menor frecuencia al médico. En ese mismo reporte, se observó que las actividades que ven más afectadas los pacientes neutropénicos son las laborales, relaciones sociales, obligaciones familiares y responsabilidades diarias, así como el trabajo de casa y el cuidado familiar.39
En nuestro estudio, no se realizamos el análisis de costos; sin embargo, en distintos modelos fármaco-económicos se ha reconocido el valor de pegfilgrastim en la prevención primaria de la NF y NS en pacientes de alto riesgo.40,41,42 Morgan y colaboradores,43 informaron los resultados de un estudio fármaco-económico, en el que usaron un modelo costo-eficacia en una cohorte hipotética de 100 pacientes tratados con quimioterapia y prevención primaria en contra de la NF con filgrastrim, oegfilgrastim o ningún factor estimulante. Para el escenario sin profilaxis se consideró incidencia de NF en 20%, con filgrastim de 12% y con el agente pegilado de 2%; el número de hospitalizaciones, manejo ambulatorio, muerte y supervivencia se estandarizó en los tres grupos. Los autores concluyeron que pegfilgrastim reduce la frecuencia de episodios de neutropenia febril y sus costos, los cuales se estimaron en $1 290 000 pesos sin profilaxis, $ 939 400 con filgrastim y $760, 800 con el agente pegilado, lo que implica una reducción de costos del 35%.
¿ CONCLUSIONES
Pegfilgrastim es eficaz y seguro como instrumento de prevención primaria de neutropenia severa y/o neutropenia febril inducida por quimioterapia. En la planeación del tratamiento con quimioterapia se debe evaluar los factores de riesgo que pueden provocar neutropenia severa. Con base en estas evidencias sugerimos que todo paciente con alto riesgo, debe recibir terapia profiláctica primaria con pegfilgrastim.
Correspondencia: Dr. Alberto Serrano-Olvera.
Departamento de Oncología Médica Centro de Cáncer ABC. Sur 128, No. 203. Colonia las Américas. México D.F. CP 01120. Fax: 2572 8430.
Correo electrónico:serranoolvera@yahoo.com.mx, lfad_doc@hotmail.com, avillabosabc@yahoo.com.mx, rgerson1@yahoo.com