Se presenta el caso de paciente femenino de 26 años de edad, sin antecedentes de importancia para el padecimiento oncológico, presentó lesiones dérmicas nodulares y escamosas en región de tórax, posteriormente generalizadas en forma de placa en cara y extremidades superiores, acompañadas de síntomas B. Se realizó protocolo de estudio con toma de biopsia, en la cual se reportan células poco diferenciadas con núcleos de aspecto blástico, con tinciones de inmunoperoxidasa fuertemente positiva para CD45, CD56, TdT y débilmente positivas para CD4, CD123. Así como médula ósea con 80% de blastos. Basados en estos hallazgos se confirma neoplasia blástica de células dendríticas plasmocitoides, se inició tratamiento con esquema HyperCVAD con adecuada respuesta clínica. Esta es una neoplasia rara, recientemente descrita y con poca experiencia en su tratamiento, con evolución en su nomenclatura debido al origen histológico de sus células tumorales pertenecientes al linaje de las células dendríticas, clasificándose actualmente para la OMS dentro de las leucemias agudas. El estudio histopatológico con las tinciones pertinentes es parte fundamental para establecer el diagnóstico. La agresividad de esta neoplasia y el tratamiento con esquemas utilizados en leucemias agudas, debido a que no existe una estrategia específica de tratamiento, le confieren una supervivencia global aproximadamente de 17 meses. Presentamos este caso como experiencia de la integración clínica y patológica, así como del tratamiento utilizado.
We report a case of a 26-year-old female with no significant past medical history, presented with nodular and squamous skin lesion in chest, later generalized with skin plaques in face and upper extremities accompanied by B symptoms, work-up with skin biopsy was made, in which poorly differentiated cells with nuclei of blastic aspect were reported, intensive staining for CD45, CD56, TdT and slightly for CD4, CD123, the bone marrow biopsy demonstrated 80% of blast cells; Based on this findings, the patient was diagnosed with a hematodermic neoplasm called plasmacytoid dendritic cell tumor, the patient was treated with HyperCVAD regimen, with suitable clinical answer. One is considered a rare entity, recently described, with little experience in its treatment, there has been a constant evolution in the disease´s nomenclature because of its histological origin with tumorlike cells belong at the moment to the lineage of the dendritic cells, classifying itself for the WHO within acute leukemias. Histopathological examination with appropriate stain is the main issue for the diagnosis. The aggressiveness of this neoplasia and its treatment with schemes used in acute leukemias, because there is no defined treatment strategy, confers a poor prognosis with overall survival of approximately 17 months. We presented this case like experience of clinical, pathological, molecular behavior, as well as of the used treatment.
Pagina nueva 1
¿ INTRODUCCIÓN
Es una neoplasia rara que afecta principalmente al sexo masculino, jóvenes, y raramente a pacientes pediátricos.1,2
La etiología no está bien definida, se ha asociado al virus de Epstein Barr (VEB) y virus de inmunodeficiencia humana (VIH), sin embargo, en los estudios no se ha establecido una clara correlación. A nivel molecular se detectó que la neoplasia blástica de células dendríticas plasmocitoides se caracterizan por tener deleciones en los cromosomas 4 (4q34), cromosoma 9 (9p13-p11 y 9q12-q34) y cromosoma 13 (13q 12-q31), estas regiones contienen varios genes supresores de tumor, con baja expresión de Rb1 y LATS2, también se encontraron niveles altos de oncogenes (HES, RUNX2, FTL3), sin embargo, estos no fueron asociados con amplificación.3
La mayoría de estos casos se manifiesta como una enfermedad cutánea localizada en forma de nódulos, parches, áreas eritematosas e hiperpigmentación que simulan pequeñas contusiones y eritema, al poco tiempo estas lesiones se vuelven generalizadas. La primera valoración clínica generalmente es efectuada por dermatólogo. En el 50% de los casos al momento del diagnóstico, la enfermedad se encuentra limitada a la piel, 40% a 50% de los casos pueden presentar afección a ganglios linfáticos, 60% a 90% infiltran la médula ósea y es raro que se afecte el bazo, las mucosas o que presenten síntomas B al diagnóstico.4
El diagnóstico se establece con el estudio histopatológico de las lesiones cutáneas, por la proliferación de células monótonas de tipo blástico que infiltran densamente la dermis con expresión positiva para marcadores CD4, CD43, CD45RA y CD56, y por la positividad para el antígeno asociado con células dendríticas CD123 (receptor de cadenas alfa-interleucina 3).
Es una neoplasia agresiva y muchos pacientes mueren en un periodo corto después del diagnóstico, con una superviviencia global de 17 meses aproximadamente.5 Los diagnósticos diferenciales incluyen: linfomas de células NK de tipo nasal y linfoma cutáneo de células T.6
¿ PRESENTACIÓN DEL CASO
Femenino de 26 años de edad, sin antecedentes de importancia, inicia su padecimiento en julio de 2011 con lesiones dérmicas en la región posterior del tórax, las cuales se generalizan de forma centrífuga, iniciaron en forma de ronchas y en dos meses se tornaron nodulares de 1 a 3 cm de diámetro, escamosas, eritematovioláceas, predominando en tronco, brazos y cara, asociado a diaforesis nocturna, hipertermia no cuantificada, pérdida de peso de 5 Kg en dos meses y voz nasal.
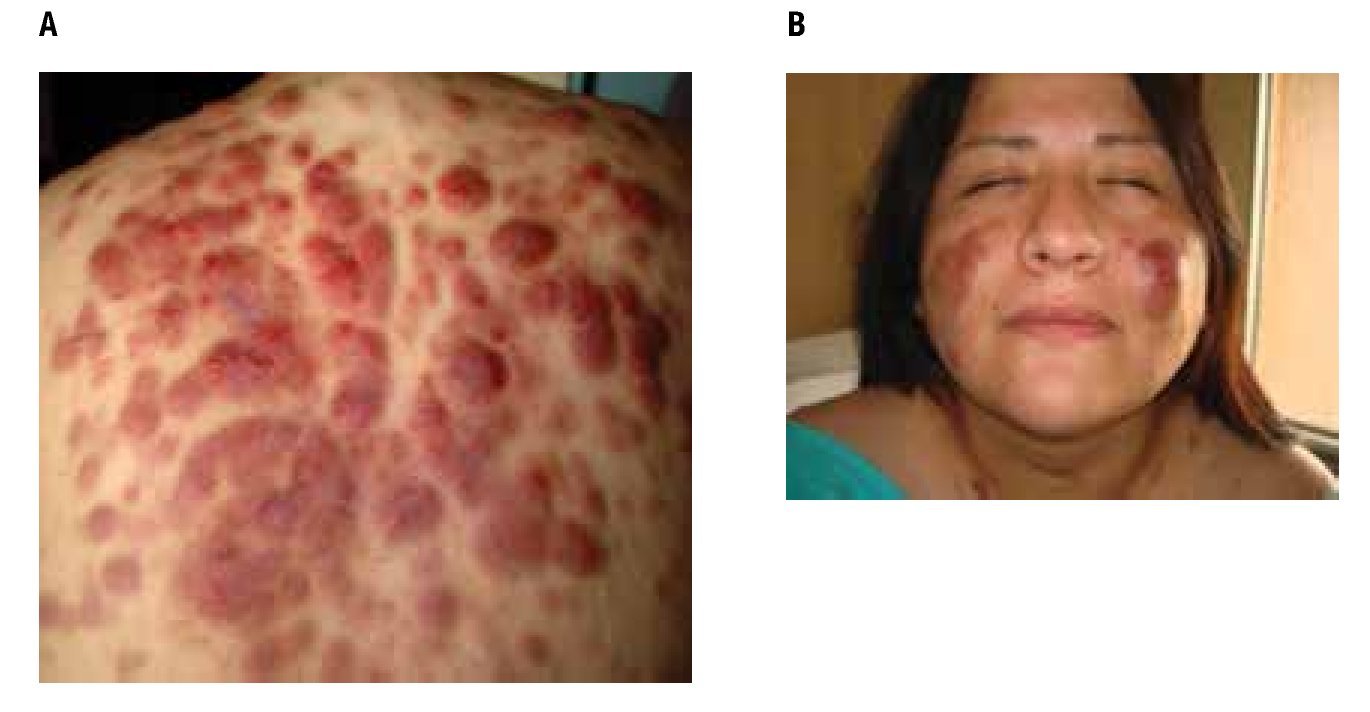
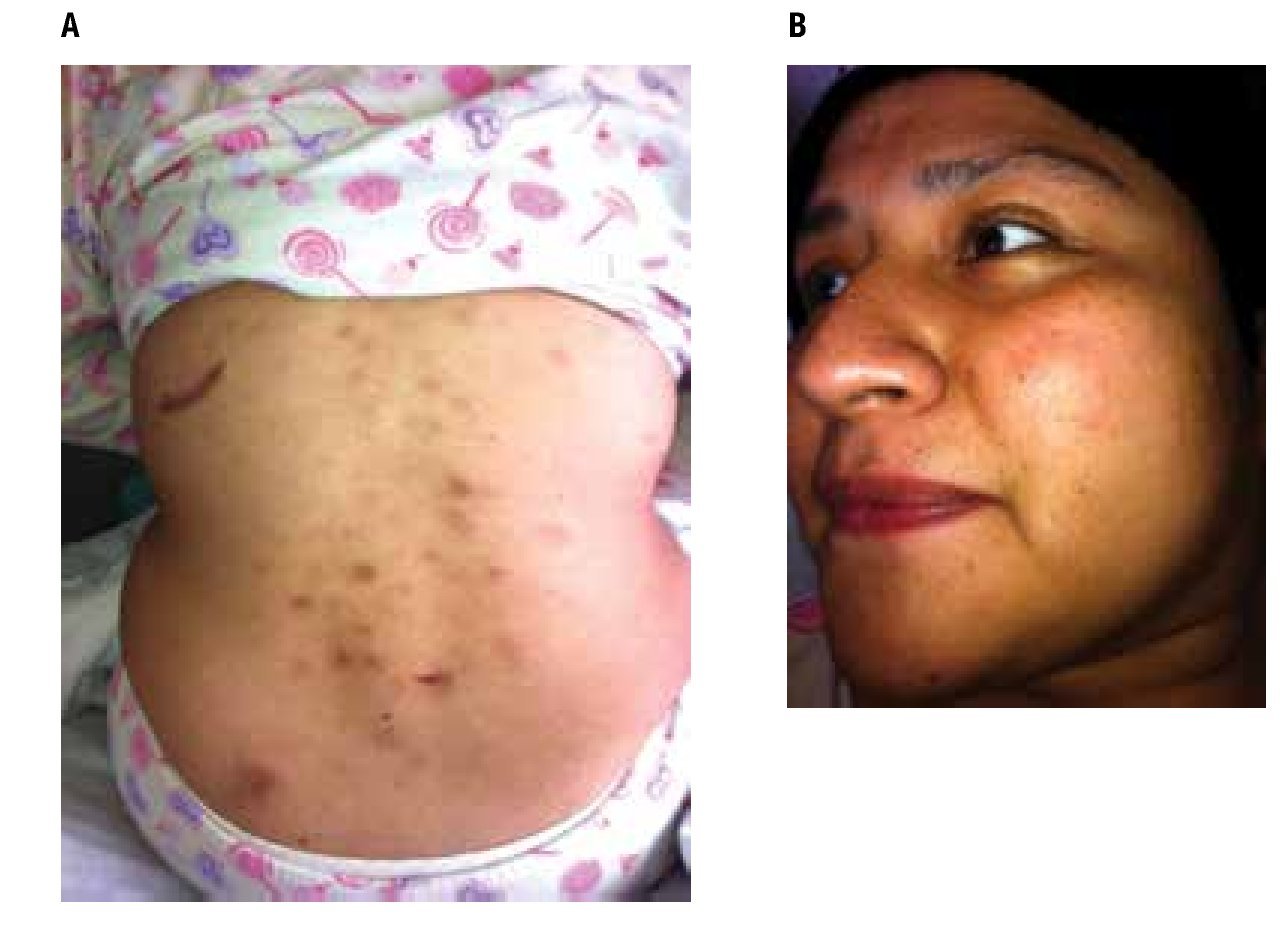
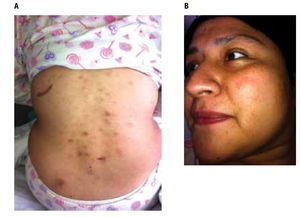
A la exploración física: peso 95 Kg, talla 164 cm, IMC 35.3, SC 2.0, ECOG 1, en la piel hay lesiones nodulares, eritematoescamosas, generalizadas predominando en cara, tórax y abdomen, de bordes irregulares y adheridos a planos profundos, de 1 a 3 cm de diámetro (Figura 1). No se palpan adenomegalias, sin hepatomegalia, ni esplenomegalia.
Figura 1. Lesiones cutáneas iniciales con presencia de nódulos y lesiones eritemato-escamosas, rojo-violáceas, con distribución difusa predominantemente en tórax posterior y cara.
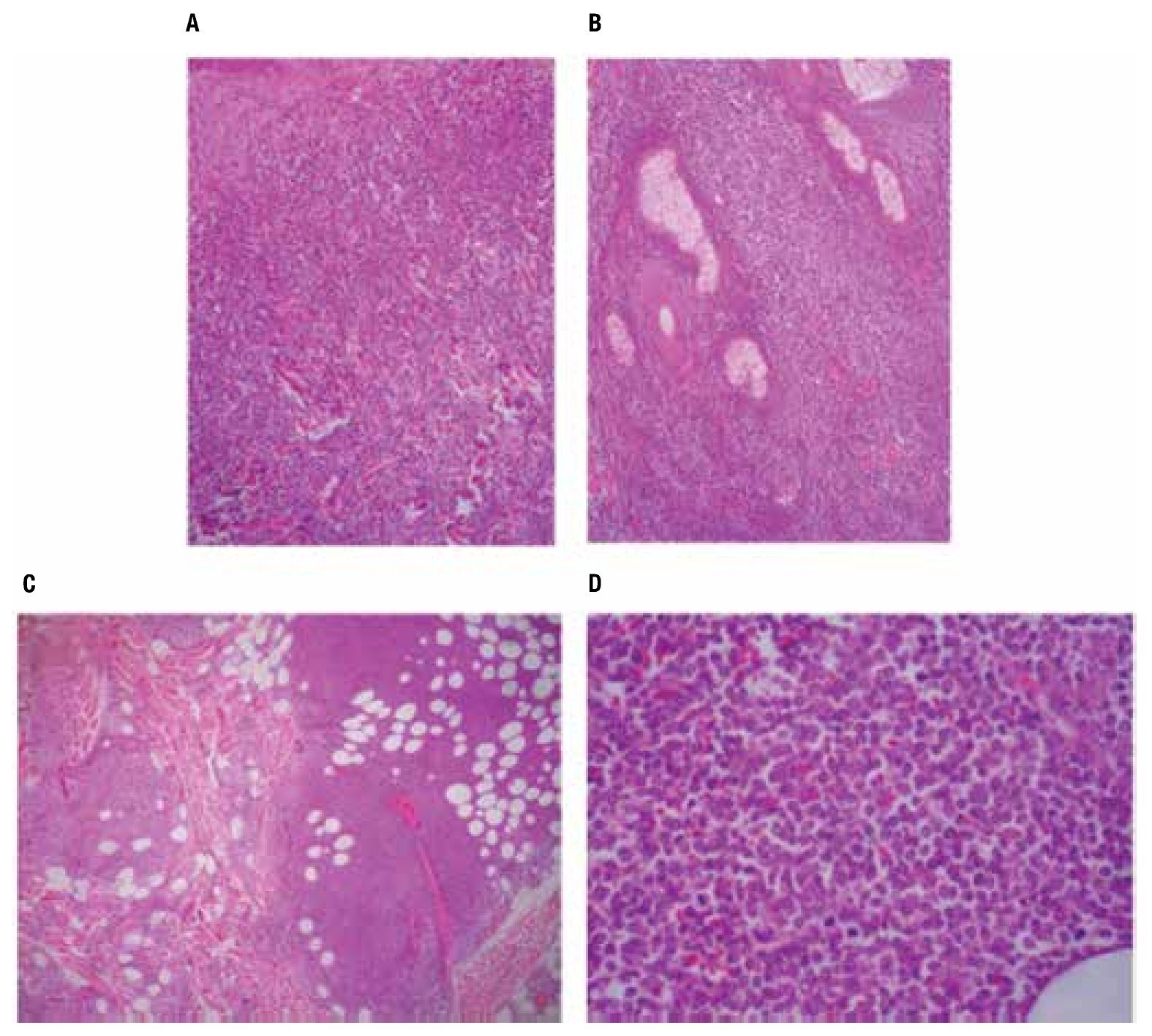
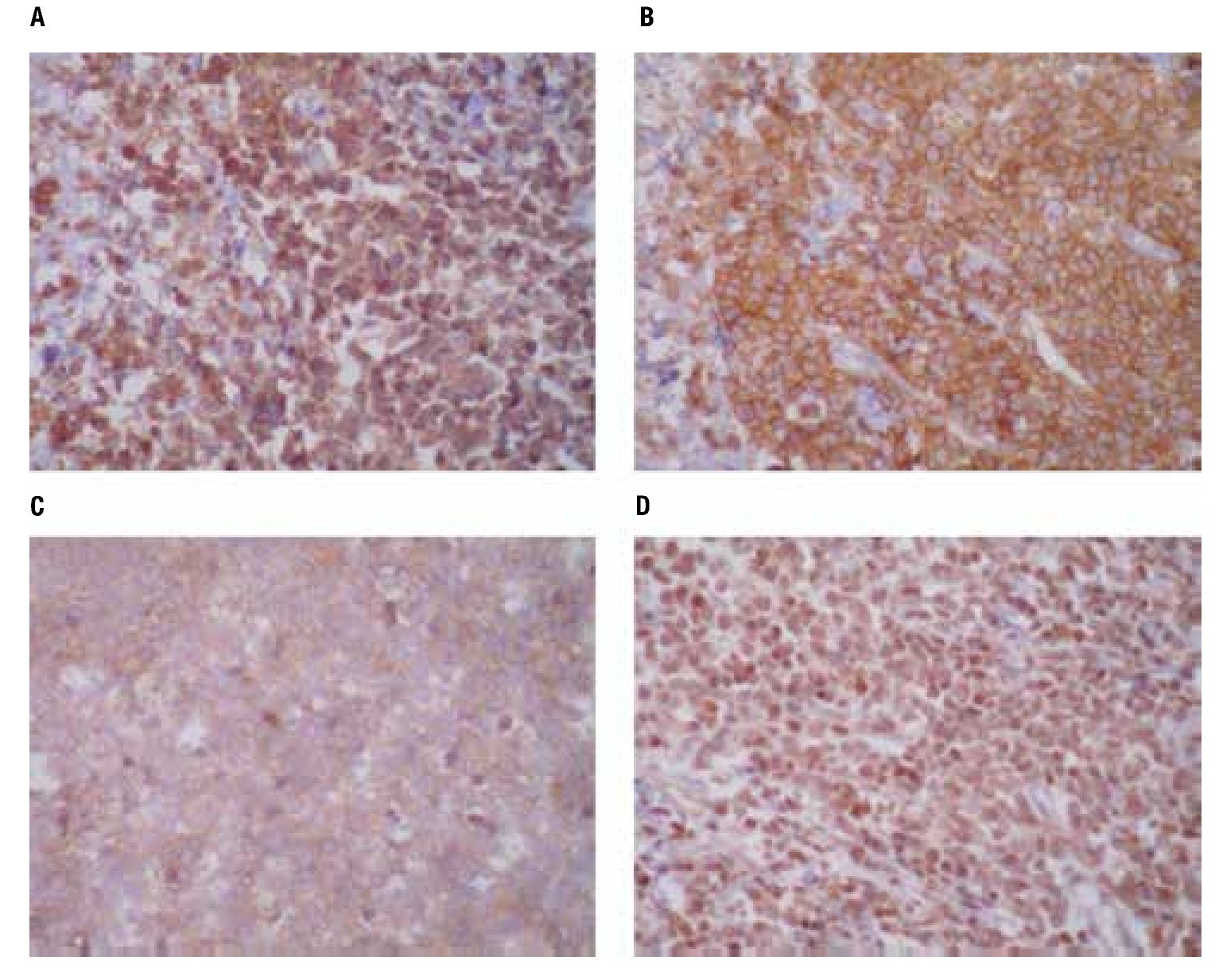
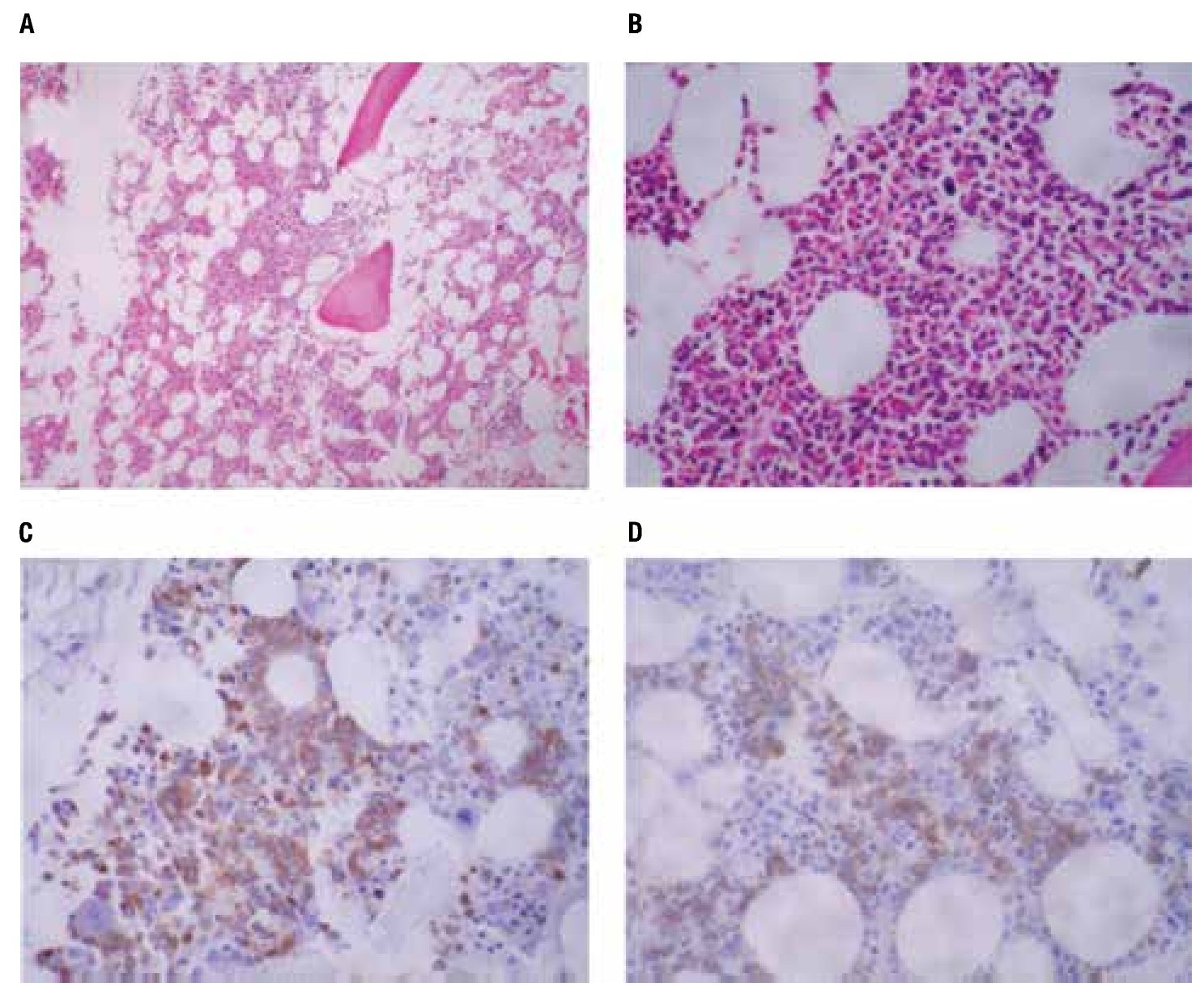
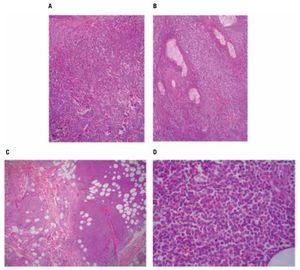
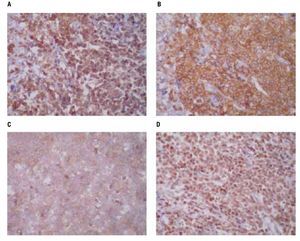
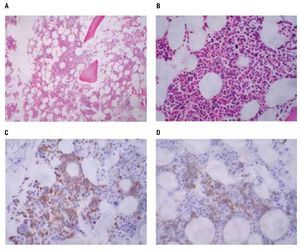
Las pruebas de funcionamiento hepático, química sanguínea, biometría hemática dentro de parámetros normales. Nasolaringoscopia sin datos de actividad tumoral. Las biopsias de piel mostraron en los cortes histológicos teñidos con hematoxilina y eosina, un infiltrado denso compuesto por células monótonas dispuestas en la dermis superficial, media y profunda con extensión al tejido celular subcutáneo, sin epidermotropismo, con infiltración a anexos cutáneos y tejido celular subcutáneo (Figura 2). Las células neoplásicas exhiben núcleos ovoides y redondos con la cromatina fina, nucleólo evidente y numerosas mitosis, el citoplasma es escaso ligeramente eosinofílico (Figura 2D). Las tinciones con inmunoperoxidasa demostraron una positividad fuerte en las células neoplásicas con los anticuerpos CD45, CD56 (Figura 3), y con la enzima deoxinucleotidiltransferasa terminal (TdT) (Figura 3D); y una positividad débil con CD4 y CD123 (Figura 3C). Marcadores para linaje celular B, T, mieloide y monocítico fueron negativos (CD20, CD3, CD8, CD10, CD68, mieloperoxidasa, PAX5). El líquido cefalorraquídeo fue negativo para células neoplásicas. El aspirado de médula ósea se observó con celularidad del 80% a expensas de células monótonas con aspecto de blastos linfoides, la biopsia de hueso mostró una celularidad del 30% con presencia de elementos hematopoyéticos maduros, y un infiltrado intersticial compuesto por agregados de células de tamaño pequeño poco diferenciadas (Figura 4), que mostraron inmunorreacción positiva con CD45 (Figura 4C) y CD56 (Figura 4D), sin expresar positividad con CD4 y TdT. Se establece el diagnóstico de: Neoplasia blástica de células dendríticas plasmocitoides con infiltración a la médula ósea.
Figura 2. Biopsia de piel: A: el corte teñido con hematoxilina y eosina exhibe una fitración difusa en la dermis, B: infiltración a anexos cutáneos, C: extensión hasta el tejido celular subcutáneo D: el detalle celular de la neoplasia muestra células poco diferenciadas de tipo blástico, redondas, alargadas y con numerosas mitosis.
Figura 3. A: tinciones con unmunoperoxidasas mostraron una positividad difusa para CD45, B: intensamente para CD56, C: débilmente para CD123, D: con expresión nuclear para TdT.
Figura 4. Biopsia de médula ósea (hueso) A: infiltrado intersticial poco aparente de células neoplásicas mezcladas con elementos hematopoyéticos normales, B: con mayor detalle se aprecia un infiltrado de células pequeñas, C: la tinción para CD45 torna evidente el infiltrado linfoide, D: las células se tiñeron débilmente con CD56.
En septiembre de 2011, inicia quimioterapia (QT) con HIPERCVAD fase A con apoyo de factor estimulante de colonias (FEC), sin complicaciones. Posteriormente, recibe fase B, en el día +10 de QT presenta toxicidad hematológica con neutropenia y trombocitopenia G IV, con respuesta a FEC y apoyo transfusional
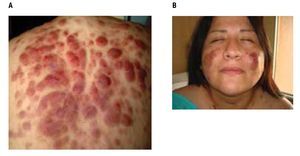
Ha continuado su tratamiento con QT por cuatro ciclos sin complicaciones, con adecuada respuesta clínica y disminución notable de las lesiones (Figura 5).
Figura 5. Repuesta clínica parcial posterior a 4 ciclos de quimioterapia con HyperCVAD, disminución notable de las lesiones cutáneas.
¿ DISCUSIÓN
La neoplasia blástica de células dendríticas plasmocitoides, es una entidad rara que ha sido reportada esporádicamente, sin reconocer los orígenes reales en un inicio de esta neoplasia y conocida hasta hace unos años como "linfoma de células NK blástico" o "neoplasia blástica hematodérmica agranular CD4+ CD56+".7-12
Por lo raro de esta neoplasia existe poca experiencia sobre el tratamiento, actualmente debe ser manejada por centros especializados. Desde el reconocimiento de esta neoplasia han surgido importantes cambios principalmente en la década pasada. Laurence y colaboradores en el año 2001, analizaron células tumorales de neoplasias que afectaban la piel y que eran consideradas linfomas CD4+ CD56+; se caracterizaban por infiltrar la médula ósea en algún momento de la evolución de la enfermedad, progresando hacia una franca leucemia en pocos meses con desenlace fatal, ellos confirman que estas células neoplásicas pertenecen al linaje de células dendríticas al demostrar que producen interferón alfa (IFN-α) cuando son estimuladas por virus, expresan marcadores similares a las células dendríticas, sobreviven y se diferencian en respuesta a la IL-3, inducen respuesta en los linfocitos T de tipo TH2 gracias a los altos niveles de IL-3, y ratifican el perfil inmunohistoquímico propio de las células dendríticas (CD4+, CD56+, CD3-, CD13-, CD33-, CD19-).13
Marco y colaboradores describen la sobreexpresión del protooncogén TCL1 en el 83% en células tumorales, que afectan la piel y que expresan CD4+ y CD56+, así como también expresaron que este protooncogén no se expresa en células tumorales de linaje NK, marcando una diferencia entre estas dos neoplasias.14 Francine y colaboradores determinan que la neoplasia blástica de células dendríticas plasmocitoides puede o no expresar CD33, un marcador del linaje mieloide, eso no excluye el diagnóstico.15
En el año 2005, la clasificación de la OMS y la Organización Mundial Europea para la Investigación y Tratamiento del Cáncer (OMS-EORTC) incluye y propone como una entidad provisional al linfoma blástico de células NK, bajo la nomenclatura de neoplasia hematodérmica (CD4+/CD56+), en la categoría de neoplasia de precursores hematológicos. Sin embargo, ya se sugiere como una entidad diferente a la luz de las nuevas investigaciones y probablemente, estas células se originen a partir de células mieloides.16 Ahora se sabe que estas células dendríticas derivan de los monocitos que se encuentran en la médula ósea denominados precursores de células plasmocitoides, en estudios recientes se ha demostrado que estas células en la médula ósea necesitan de quimiocinas para su diferenciación, dentro de las cuales se encuentran Ftl3L, que induce diferenciación tanto in vivo como in vitro.17-19 Otras quimiocinas involucradas en la diferenciación de las células precursoras de las células dendríticas son CXCL 12-CXCR 4, demostrado por Hiroshi y colaboradores.20 El factor de crecimiento de monocitos (FEC-M) ha demostrado favorecer la diferenciación de células progenitoras hacia células dendríticas plasmocitoides en la médula ósea.21, 22
Con toda la investigación, la neoplasia blástica de células dendríticas plasmocitoides CD4+, CD56+, ha dejado de ser incluida en la lista de linfomas. En la cuarta edición del año 2008 de la OMS para la clasificación de tumores hematopoyéticos y tejidos linfoides, la incluye en el capítulo de leucemias mieloides y neoplasias precursoras relacionadas, bajo la nomenclatura de neoplasia blástica de células dendríticas plasmocitoide23 (NBCDP).
¿ CONCLUSIONES
Con el tratamiento desafortunadamente se tiene poca experiencia, y por lo raro de la enfermedad no se cuenta con ningún estudio clínico aleatorizado, sólo con reportes de casos y experiencias anecdóticas, los mejores resultados se han observado con esquemas utilizados en leucemias agudas y con profilaxis del sistema nervioso central (SNC).24
El trasplante de médula ósea autólogo y alogénico resulta una opción de tratamiento, ya que se han reportado remisiones duraderas después de un trasplante.25,26 Esta remisión completa fue más duradera, cuando en el momento del trasplante ya existía una remisión completa de la enfermedad.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FINANCIAMIENTO
Los autores no recibieron patrocinio para llevar a cabo este estudio.
AGRADECIMIENTO
Queremos brindar un agradecimiento especial a la Dra. Castañeda, médico adscrito al Servicio de Hematología del Centro Médico Nacional Siglo XXI, por su participación y acceso que nos dio a la información para lograr la publicación.
Correspondencia:
Av. Cuauhtémoc N° 330,
Colonia Doctores, Delegación Benito Juárez,
C.P. 06760, México D.F., México.
Teléfono: 5627 6900, ext. 22816. Celular: (044 55) 4181 5448.
Correo electrónico: marynambo@yahoo.com.mx