El cáncer de mama triple negativo (CMTN) representa el 10% al 15% de los casos de CM, predomina en mujeres jóvenes, muestra alta sensibilidad a quimioterapia (QT), se asocia a alta tasa de recurrencia y pobre pronóstico. El CMTN habitualmente induce metástasis a pulmón, sistema nervioso central e hígado. Las metástasis del CM al tubo digestivo y la piel son infrecuentes, se reportan entre el 8% a 35% y 23%, respectivamente; el subtipo molecular triple negativo parece asociarse con mayor frecuencia a este patrón de diseminación.
Se presenta el caso de una mujer de 71 años con CMTN metastásico al diagnóstico con diseminación a sitios anatómicos múltiples, entre ellos recto-sigmoides y piel, que fueron detectados por tomografía por emisión de positrones (PET/CT), colonoscopia y confirmados a través de estudio histopatológico. Se indicó quimioterapia con gemcitabina y cisplatino, ambos en día 1 y 8 durante 7 ciclos, con lo que se observó respuesta parcial > 80%.
Triple-negative breast cancer (TNBC) accounts for 10-15% of all breast cancers, it occurs predominantly in young women, shows high sensitivity to chemotherapy (CT), and is associated with a high rate of recurrence and poor prognosis. TNBC usually induces metastases to the lung, the central nervous system and the liver. Breast cancer metastases to gastrointestinal tract and skin are infrequent, and are reported in 8-35% and 23%, respectively; the molecular triple-negative subtype appears to be associated more frequently with this distribution pattern.
We present the case of a 71-year old woman with metastatic TNBC at diagnosis, spread to multiple anatomic sites including the rectosigmoid and the skin, detected by positron emission tomography (PET/CT) and colonoscopy, and confirmed by histopathological analysis. Chemotherapy with gemcitabine and cisplatin was indicated, both given on day 1 and 8 for 7 cycles, with partial response being observed in > 80%.
Introducción
Mundialmente, el cáncer de mama (CM) ocupa el primer lugar en incidencia y mortalidad entre las mujeres1. En los Estados Unidos de Norteamérica, se estimó incidencia de 234,580 casos y mortalidad de 40,030 en el año 20132. En México, durante el año 2009, se reportaron 4,897 defunciones por CM3.
La mortalidad asociada al CM ha declinado como resultado de la detección en fases más tempranas de la enfermedad y del uso de la quimioterapia adyuvante4. Sin embargo, en mujeres con enfermedad localmente avanzada y metastásica la supervivencia media es de aproximadamente 2 años4,5; este parámetro puede variar dependiendo de la etapa clínica, factores pronóstico, sitio de metástasis y subtipo molecular del CM5.
Mediante microarreglos, el CM fue clasificado en 5 subtipos moleculares: luminal A, luminal B, normal, HER2 y basal-like. El CM basal-like se caracteriza por la ausencia de receptores hormonales y HER2, está representado por genes involucrados en la proliferación y diferenciación celular, vías mediadas por p21 así como vías de señalización del ciclo celular6. Condiciones económicas y de infraestructura para realizar perfiles de expresión genética permitieron que se utilizara la inmunohistoquímica como medio para caracterizar los subtipos del CM7,8, la ausencia de expresión de RE, RP y la proteína del gen HER2 o de su amplificación, define al grupo de pacientes con CM triple negativo (CMTN)8.
Los términos "basal-like" y "triple negativo" comúnmente son utilizados como sinónimos, sin embargo, representan a grupos poblacionales y técnicas de diagnóstico diferentes que comparten características clínicas y de pronóstico.
El CMTN representa el 15% de los casos con CM, este subtipo se caracteriza por afectar a mujeres jóvenes, principalmente; se asocia con tumores de alto grado histológico, elevada tasa de recurrencia, frecuente asociación a mutación germinal de BRCA-1 y mayor predisposición de recurrencia a pulmón, hígado y sistema nervioso central en plazo menor a 3 años7,9,10. Las metástasis cutáneas ocurren entre el 0.6% y 10.4% de los pacientes oncológicos; el CM es la principal causa de metástasis cutáneas entre las mujeres (70% de los casos)5. Por otra parte, las metástasis al tubo digestivo asociadas a CM se consideran una entidad infrecuente, la información disponible se basa en estudios descriptivos de series de autopsias, casos clínicos y pequeñas series de pacientes11.
Presentamos el caso de una mujer de 71 años de edad con CMTN y diseminación a sitios no habituales (piel y tubo digestivo), quien cursó con buena respuesta a quimioterapia (QT) a base de gemcitabina/cisplatino.
Presentación del caso
Mujer de 71 años de edad, con antecedentes familiares de cáncer de páncreas, próstata y vía biliar en la rama materna. Inició el padecimiento en febrero del 2010 con fatiga, vómito, cambios en el hábito intestinal y pérdida de peso no cuantificada. En diciembre de 2012, detectó un nódulo axilar izquierdo y otro subcostal derecho con crecimiento progresivo. En abril de 2013, acudió a evaluación médica por dolor abdominal constante y generalizado, durante la exploración se documentaron adenomegalias axilares bilaterales, masa de 7 x 6 cm en la mama izquierda, lesiones fibrosas en la mama derecha, un nódulo subcutáneo en la línea axilar posterior izquierda, indurado y móvil de 2 x 2 cm, otro nódulo subcutáneo localizado en la parrilla costal derecha, ulcerado de 2 x 2 cm; derrame pleural bilateral del 20%, hepatomegalia de 3 x 3 x 3 cm debajo del borde costal y masa pararrectal izquierda de 8 cm, fija y no dolorosa, por lo que fue admitida al hospital para estudios y tratamiento.
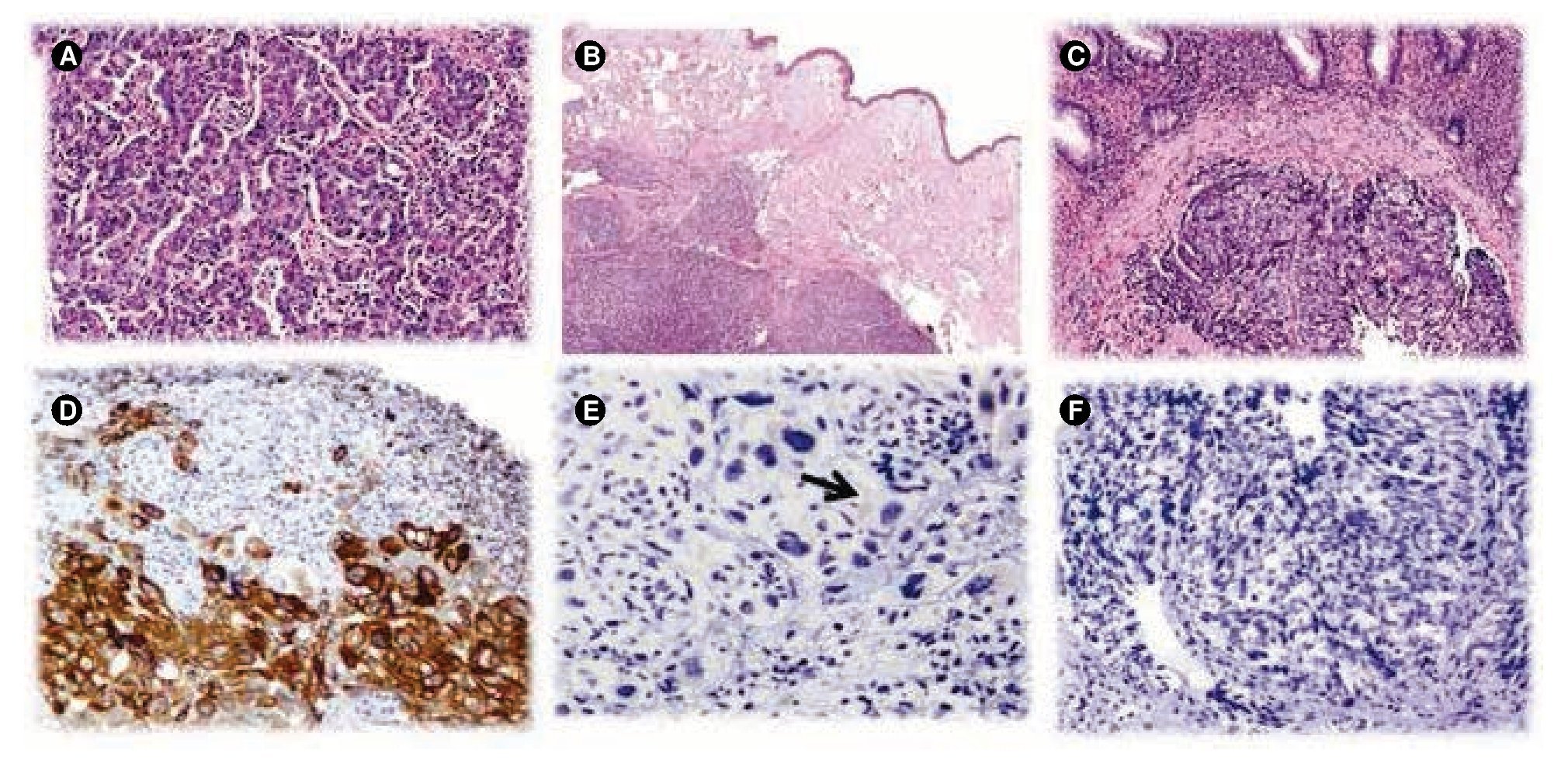
En los estudios hematológicos se detectó hemoglobina 8.8 g/dL (normal=13-16.5 g/dL), creatinina 0.7 mg/dL (normal=0.4-1.4 mg/dL), fosfatasa alcalina 248 UI/L (normal=40-117 UI/L). El CA 15-3 fue 104.0 U/mL (normal=0-28 UI/mL), CA 27-29 124 UI/mL (normal=<38 UI/mL), antígeno carcinoembrionario 3.2 ng/mL (normal=0-3 ng/ mL), CA 19-9 13 UI/mL (normal=0-37). Ante la sospecha clínica de cáncer de recto metastásico o doble primario sincrónico se realizó mastografía bilateral, la cual reportó lesión mamaria izquierda calificada como BIRADS 5. Se realizó biopsia con aguja de corte en la mama izquierda que reportó carcinoma ductal infiltrante, grado histológico 3, RE 0%, RP 0%, HER2 1+, Ki 67 89.86% (fig. 1A). La biopsia de las lesiones cutáneas reportó carcinoma metastásico poco diferenciado (fig. 1B). La biopsia de mama derecha informó la presencia de carcinoma ductal in situ, grado nuclear 2, RE 81.1%, RP 0%, HER2 negativo y Ki 67 4.65% (< 4%). La colonoscopia mostró una tumoración exofítica y ulcerada a 15 cm del margen anal, friable, de 4 cm, sin obstrucción de la luz intestinal; el estudio histopatológico determinó carcinoma poco diferenciado, metastásico con extensa ulceración de la mucosa del recto (fig. 1C), con citoqueratina 7 positiva (fig. 1D), GCDFP-15 (gross cystic disease fluid protein-15, por sus siglas en inglés) positivo (fig. 1E); RE y RP negativos (fig. 1F).
Figura 1 A) Fotografía de glándula mamaria que presenta una neoplasia epitelial maligna, dispuesta en patrón trabecular, con células de citoplasma eosinófilo, de núcleos pleomórficos y con nucléolos evidentes (H & E, 400x). B) Biopsia de piel que muestra carcinoma poco diferenciado metastásico, con patrón predominantemente sólido que afecta la dermis profunda (H & E, 100x). C) Biopsia de recto con carcinoma poco diferenciado metastásico con invasión en la lámina propia, que por inmunohistoquímica es positivo a la citoqueratina 7 (H & E, 200x), D) de manera débil y focal a la GCDFP-15 (inmunohistoquímica, 200x) (E, flecha, inmunohistoquímica, 400x) y es negativo a los receptores hormonales (F, receptores de estrógenos, inmunohistoquímica, 400x).
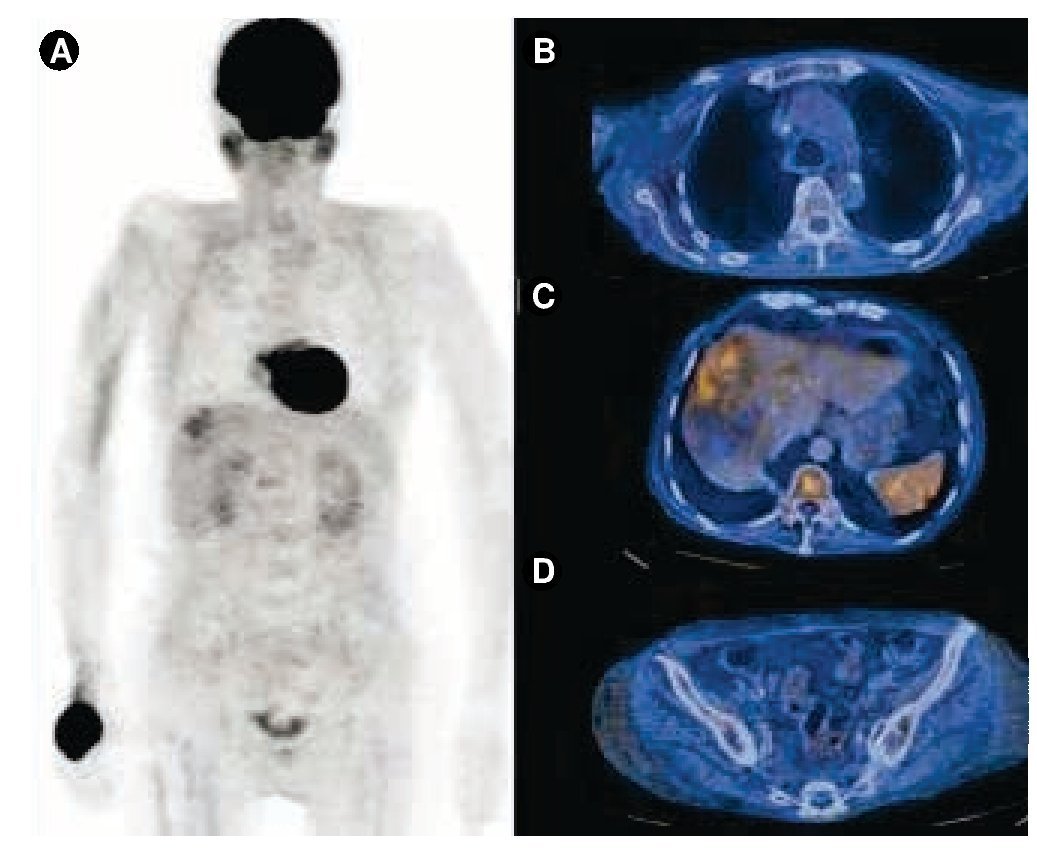
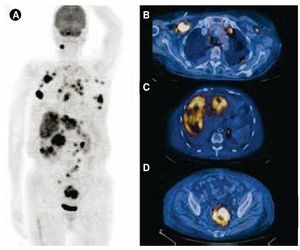
Se realizó tomografía por emisión de positrones (PET/CT) con 18F-FDG, la cual reveló lesión en el hemisferio cerebeloso derecho, de 13 x 11 mm, SUV-máx 5.6 y conglomerado ganglionar mediastinal de 41.1 x 1.8 cm, SUV-máx 3.3-5.3; adenopatías axilares bilaterales, la mayor de ellas en el lado derecho, de 2.6 cm y SUV-máx 10; nódulos pulmonares múltiples, SUV-máx 2.2-4.6; derrame pericárdico y pleural bilateral así como numerosas y heterogéneas lesiones hepáticas en el segmento V, SUV-máx 7.1; además, el PET/CT confirmó la masa dependiente de la pared rectal izquierda, de 41 x 46 x 65 mm, SUV-máx 6.2 (fig. 2). Durante su estancia hospitalaria, la paciente desarrolló disnea e insuficiencia cardiaca, el ecocardiograma 2D reportó fracción de eyección del 65%, derrame pericárdico > 900 mL, insuficiencia mitral y tricuspídea leves e hipertensión arterial pulmonar leve, por lo que se realizó ventana pericárdica sin complicaciones. La citología del líquido pericárdico fue negativa a células neoplásicas.
Figura 2 Estudio PET/CT con 18F-FDG basal. La imagen de proyección de máxima intensidad A) muestra múltiples zonas de concentración del radiotrazador que corresponden a B) lesiones pulmonares y adenopatías en distintos niveles, C) múltiples lesiones hepáticas que alcanzan SUV máximo de 7.1, D) así como una lesión en la pared del sigmoides hipermetabólica con SUV máximo 6.1.
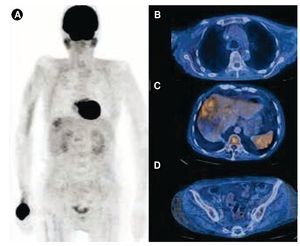
El diagnóstico final fue CM bilateral: 1) lado derecho: carcinoma ductal in situ, luminal A, 2) lado izquierdo: carcinoma ductal invasor, T3N3bM1 estadio clínico IV, triple negativo (metástasis a sistema nervioso central, pulmón, hígado, piel, recto y ganglios no regionales). La paciente fue tratada con QT a base de cisplatino 30 mg/m2 y gemcitabina 1 g/m2 ambos en día uno y 8. Se aplicaron 7 ciclos de tratamiento entre abril y septiembre de 2013, la toxicidad hematológica y no hematológica fue calificada con grado 2. Clínicamente, se observó desaparición de lesiones previamente descritas pero persistió la induración difusa en la mama derecha. Nuevamente, la PET/CT se empleó para evaluar la respuesta terapéutica documentándose respuesta parcial > 80% (fig. 3).
Figura 3 Estudio PET/CT con 18F-FDG para valorar respuesta a tratamiento. En la imagen de proyección de máxima intensidad A) se observa disminución en los sitios hipermetabólicos al comparar con el estudio previo (fig. 2), B) han desaparecido las adenopatías, las lesiones pulmonares no muestran hipermetabolismo, C) persiste únicamente aumento de la actividad metabólica en las lesiones hepáticas, con SUV máximo 3.5 y D) en sigmoides se identifican únicamente cambios inflamatorios periféricos.
La paciente se mantuvo en seguimiento estrecho sin datos clínicos de actividad tumoral hasta marzo del 2014 cuando se documentó progresión hepática y pulmonar, por lo que se propuso reiniciar QT, no obstante la paciente desarrolló severa urosepsis y estado de choque que provocó su muerte.
Discusión
El caso aquí reportado integra 3 puntos de interés, 1) CMTN en mujer de 71 años, 2) quien desarrolló sitios múltiples metastásicos, entre ellos recto-sigmoides y piel, que 3) mostró buena respuesta a la QT con gemcitabina/cisplatino en primera línea de tratamiento.
El CMTN es reconocido como entidad más frecuente entre pacientes jóvenes10. Un estudio publicado previamente por nuestro grupo, observó frecuencia del CMTN del 15.4%, la mediana de edad fue 43 años (34-64 años)8. El Instituto Nacional de Cancerología de México reportó la prevalencia y pronóstico de mujeres hispanas con CMTN12; en el estudio se incluyeron 469 casos con CMTN y 1,596 con CM no triple negativo, la edad promedio fue 49.2 + 12.2 en comparación a 52.2 + 12.2 (p<0.001), respectivamente. El CMTN fue más frecuente en las mujeres premenopáusicas que en las postmenopáusicas, 57.4% vs. 42.6% (p=0.002), respectivamente; a través de un análisis multivariado se determinó que el estado premenopáusico, el número de embarazos, la escala de Scarff-Bloom-Richardson y el estadio clínico se asocian con el diagnóstico de CMTN12. El caso presentado registró inmunofenotipo triple negativo, recordamos que triple negativo y basal-like no son condiciones idénticas, concordancia que oscila entre 55%-80%, por lo que es más probable encontrar CMTN a edad avanzada, nuestro grupo ha registrado varios casos con CMTN entre mujeres postmenopáusicas.
Por otra parte, la literatura médica señala que entre el 5% y 10% de los casos con CM son detectados en la etapa metastásica al momento del diagnóstico13. Los sitios anatómicos más frecuentes de metástasis a distancia son huesos, pulmón e hígado14. Actualmente, dependiendo de la variedad histológica, tipo molecular y perfil de expresión genética, distintos patrones de metástasis han sido reconocidos5.
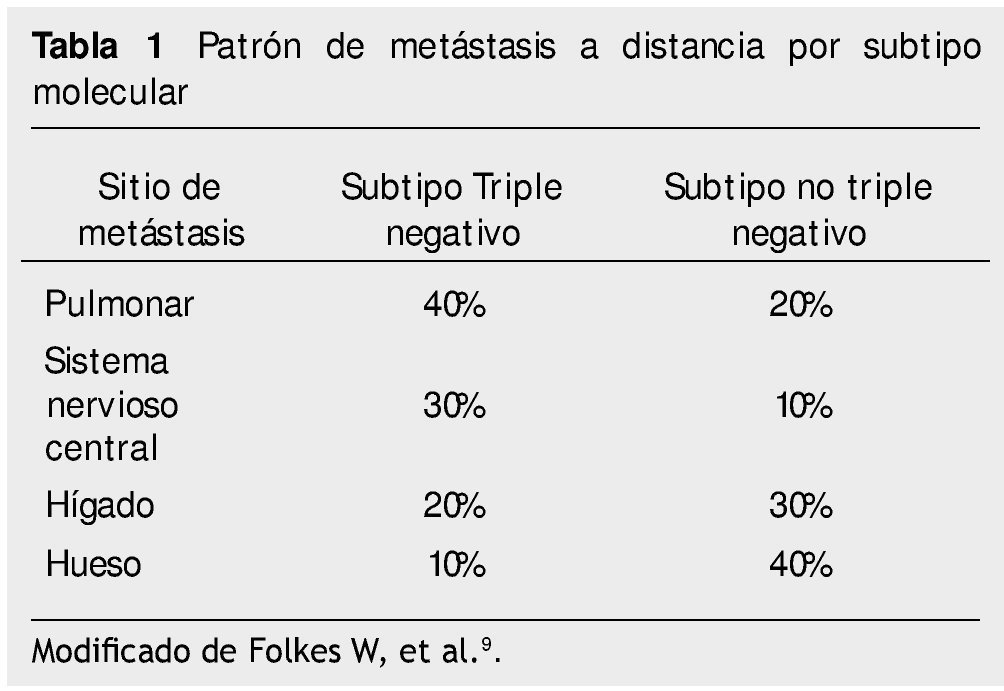
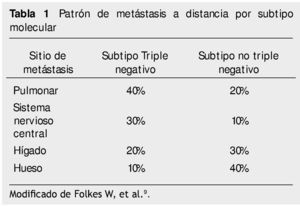
Sihto et al.5 entre 234 pacientes quienes desarrollaron metástasis, observó mayor tendencia a la diseminación ósea en el subtipo luminal A, diseminación hepática y/o pulmonar en el subtipo HER2 y metástasis cerebrales en el subtipo basal-like o triple negativo. Otros reportes indican que los sitios de metástasis más frecuentes en el CMTN son pulmón, sistema nervioso central e hígado7,15 (Tabla 1).
El caso aquí presentado comparte características clínicas que han sido informadas en la literatura médica internacional. En relación a la diseminación cutánea se ha observado en 0.6% a 10.4% de los pacientes oncológicos16. El tumor primario del que se origina la afectación cutánea parece variar dependiendo del género; entre las mujeres el sitio primario más frecuente es el CM (70%), seguido por cáncer de ovario (3.3%), cavidad oral (2.3%) y, pulmón (2%)5. Sittart et al.17 entre 209 casos con metástasis cutáneas, 144 mujeres y 65 hombres, observó que la pared anterior del tórax y la del abdomen fueron los sitios de asiento más frecuentes de diseminación cutánea, 31.9% y 20.3%, respectivamente; además, los autores reportaron que el CM fue responsable en la mayoría de los casos de metástasis cutáneas en mujeres (63.1%)17.
La diseminación cutánea puede ocurrir por diferentes vías, tales como la linfática, hematógena, contigüidad o implantación iatrogénica. Histopatológicamente, existen 4 patrones morfológicos de metástasis cutáneas: nodular, infiltrativo, difuso e intravascular17. La presentación nodular es la más frecuente, se caracteriza por lesiones de uno a 3 cm, apariencia firme, puede ser lesión solitaria o múltiples localizadas en la dermis o en el tejido celular subcutáneo. Abed et al.18 reportó que la variedad histológica más comúnmente identificada es el adenocarcinoma (34% de los casos). Generalmente, la lesión es de color similar a la piel normal adyacente, algunos nódulos llegan a desarrollar ulceración o infección secundaria19. Mediante pruebas de inmunohistoquímica, las metástasis cutáneas pueden expresar citoqueratina 7, citoqueratina 19, RE, RP, mamaglobina, GCDFP-15, antígeno carcinoembrionario, E-cadherina y HER219.
Kong et al.20 evaluó los patrones de infiltración a los tejidos blandos en relación a los subtipos moleculares del CM; 125 casos fueron analizados, 53 pacientes expresaron receptores hormonales positivos (42.4%), 43 HER2 positivo (34.4%) y 29 fueron catalogados como CMTN (23.2%). Los autores observaron que las lesiones ulceradas predominaron en el subgrupo con receptores hormonales positivos (57.1%), la infiltración eritematosa se detectó con mayor frecuencia en el grupo triple negativo (84.6%) y la infiltración a los tejidos blandos ante HER2 positivo y triple negativo (41.9% y 48.3%, respectivamente). Por lo anterior, se ha considerado que las modalidades de infiltración cutánea pueden reflejar, indirectamente, el subtipo molecular de CM20.
Por otra parte, en el contexto de las metástasis al tubo digestivo por CM, éstas son consideradas una entidad poco habitual y de presentación inespecífica; la incidencia se ha reportado entre el 8% y 35% de los casos13,21. Esta entidad parece asociarse con mayor frecuencia a la variedad histológica lobulillar5,21. Mourra et al.22 en un estudio multiinstitucional con 10,365 pacientes con neoplasia colorrectal identificó 35 casos con actividad neoplásica no asociada a un cáncer primario colorrectal, de ellos 17 (48.6%) fueron debidos a CM (10 con histología ductal, 6 lobulillar y un apocrino), melanoma en 7 (20%), seguidos por cáncer pulmonar y sarcoma, 4 casos cada uno (11.4%), respectivamente. Borst et al.23 analizó el patrón metastásico del CM en relación a la estirpe histológica en 2,605 casos, 359 fueron lobulillares (14%) y 2,246 ductales (86%); los autores informaron mayor prevalencia de metástasis a sistema gastrointestinal, ginecológico y retroperitoneo en asociación a la estirpe lobulillar23.
Dentro de las metástasis al tubo digestivo, la localización más común es el intestino delgado, estómago, seguido del colon y recto24. Ambroggi et al.25 entre 980 casos con CM reportó 5 pacientes con metástasis gastrointestinales, 2 tuvieron histología ductal, 2 lobulillar y uno más con células en anillo de sello. La localización anatómica correspondió a estómago en 3 casos, uno en el yeyuno y otro en el recto. Las manifestaciones clínicas son diversas, puede caracterizarse por un cuadro inespecífico con náusea, vómito, diarrea y dolor abdominal, sangrado, obstrucción o perforación, sintomatología que pudiera ser asociada a otra enfermedad gastrointestinal o carcinomatosis peritoneal, lo cual puede retrasar el diagnóstico y por lo tanto el tratamiento específico22,25. La endoscopia juega un papel importante en el diagnóstico de las lesiones del colon pero por sí sola no es capaz de distinguir entre la presencia de un tumor primario o la afectación por enfermedad metastásica24,26; en todo caso la biopsia es el estudio que permite establecer el diagnóstico diferencial inequívoco24,26.
La inmunohistoquímica puede ser de utilidad para dirigir el diagnóstico, en el reporte de Ambroggi et al.25 todos los casos fueron catalogados como HER2 negativo y RE positivo; no obstante, en 2 casos se determinó RP negativo. Otra inmunotinción que puede auxiliar en el diagnóstico diferencias es GCDFP-15, la cual frecuentemente muestra expresión positiva ante enfermedad metastásica26. En el caso aquí descrito, la inmunohistoquímica fue compatible con CMTN, mientras que las lesiones de piel y rectosigmoides también fueron negativas a RE, RP y HER2, pero positivas a GCDFP-15. Es remarcable la necesidad de realizar biopsias en todos los sitios anatómicos accesibles, principalmente cuando se trata de CM ya que ante este caso sólo el tumor izquierdo fue el responsable de la actividad metastásica, mientras que el derecho fue carcinoma in situ. La omisión de las biopsias puede inducir errores en el diagnóstico certero y en el tratamiento correcto. Finalmente, ante cáncer recurrente o enfermedad en etapa clínica IV el objetivo del tratamiento oncológico es prolongar la supervivencia y mejora la calidad de vida5,13. La combinación de 2 agentes antitumorales debe ser considerada en aquellos casos con enfermedad sintomática o con progresión visceral rápida, mientras que el empleo de agente único se reserva pacientes con curso indolente4,5,13,27. Actualmente, se reconoce que el CMTN muestra alta sensibilidad a los efectos de la QT; los fármacos más activos y frecuentemente utilizados en la terapia del CMTN son las antraciclinas y taxanos4,8,27, aunque otros agentes han sido ensayados, entre ellos agentes platinados, inhibidores del factor de crecimiento epidérmico, antiangiogénicos, inhibidores de la enzima de reparación polimerasa-1 Poli(ADP) [PARP1], inhibidores del sistema Scr, m-TOR, AKT, TOP2A7,10,28.
Actualmente, no hay un tratamiento oncológico específico para el CMTN pero se ha informado que su asociación a la mutación de BRCA-1 podría conferir cierta sensibilidad a los análogos del platino28. Gemcitabina ha demostrado sinergismo citotóxico con cisplatino al inhibir la reparación de daño a la cadena de DNA inducido por cisplatino, diversos ensayos clínicos evidencian que es una combinación efectiva como primera línea de tratamiento en casos pretratados, en dichos ensayos se ha observado tasa de 43% (rango 26 a 50%), con perfil de toxicidad aceptable28.
Estudios clínicos recientes han mostrado la eficacia y seguridad de gemcitabina y cisplatino en mujeres con CMTN. En el caso aquí reportado se optó por este esquema de QT ante la edad de la paciente, la cirugía pericárdica reciente y los reportes acerca de la eficacia y seguridad del esquema informado en estudios fase II. Koshy et al.29 incluyó 36 pacientes con CM metastásico, 17 (47%) con subtipo triple negativo y 19 (53%) no triple negativo, quienes recibieron la combinación con cisplatino y gemcitabina. Los autores señalaron mayor supervivencia libre de progresión mayor en el subgrupo triple negativo (5.3 meses) comparado con 1.7 meses en el subgrupo no triple negativo28. Ozkan et al.30 evaluaron la eficacia y tolerabilidad de gemcitabina y cisplatino en CMTN, quienes progresaron a antraciclinas y/o taxanos; en 33 pacientes se observó tasa de respuesta objetiva en 27.3%, mientras que la tasa de beneficio clínico absoluto fue 48.4%; la mediana de supervivencia libre de progresión fue 5 meses y la supervivencia global 14 meses; los efectos tóxicos más frecuentes grado 3 o 4 fueron neutropenia y trombocitopenia (27.7% y 24.9%, respectivamente).
Conclusión
El CMTN predomina en las mujeres jóvenes pero algunas veces se observa en aquellas de la tercera edad. Este subtipo del CM se caracteriza por afectar distintos sitios anatómicos con predominio en vísceras; sin embargo, otros sitios anatómicos pueden verse afectados con menor frecuencia, entre ellos piel y tubo digestivo. Todos los síntomas y signos sospechosos de enfermedad metastásica deben ser evaluados en forma minuciosa. Gemcitabina y cisplatino es una terapia eficaz y bien tolerada en CMTN, pero aún debe ser probado en más estudios clínicos prospectivos.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Centro de Cáncer ABC, 2° piso N° 203. Sur 128 N° 143,
Colonia Las Américas, Delegación Álvaro Obregón,
C.P. 01120, México D.F., México.
Teléfono: (+55) 5272 3345. Fax: (+55) 5272 8430. Celular: (+55) 5437 4105.
Correo electrónico: serranoolvera@gmail.com (Juan Alberto Serrano-Olvera).