El cáncer de próstata es la segunda causa de muerte por neoplasias en hombres. Así como en otros tumores sólidos, el microambiente tumoral está emergiendo como una pieza fundamental en la progresión de la enfermedad y como un potencial blanco terapéutico. Este microambiente contiene líneas celulares no malignas, entre ellas los macrófagos asociados a tumores (TAM), los cuales pueden controlar o favorecer el crecimiento tumoral. Por lo tanto, el conocimiento de la forma en que estas células interactúan con las células tumorales y el microambiente resulta fundamental en la comprensión del cáncer de próstata. La presente revisión se centra en el papel de los TAM en el microambiente del tumor prostático y en cómo estos pueden promover la progresión de dicha enfermedad.
Prostate cancer is the second leading cause of malignancy-associated death in males. As with other solid tumours, their microenvironment is emerging as a key player in the progression of the disease, and as a potential therapeutic target. This microenvironment contains non-malignant cell lines, among them tumour-associated macrophages (TAMs), which can control or promote tumour growth. Thus, knowledge on how these cells interact with tumour cells and with the microenvironment is central to the understanding of prostate cancer. This review focuses on the role of TAMs in tumour microenvironment of prostate cancer and how they can promote the progression of this disease.
El cáncer de próstata ocupa el segundo lugar de incidencia en el ámbito mundial de acuerdo con estadísticas de la Organización Mundial de la Salud1. Datos de la Agencia Internacional de Investigación del Cáncer (International Association for Research on Cancer [IARC]) indican que en 2012 se registraron 1,242,601 casos de dicho padecimiento y 307,471 defunciones en el mundo, siendo el segundo cáncer con mayor incidencia en hombres1. Según el Instituto Nacional de Estadística Geografía e Historia (INEGI), en México fue el tumor más frecuente a partir de los 50años de edad en 2013, y ese mismo año fallecieron 5,889 pacientes2.
Los cambios celulares ocurren bajo diferentes circunstancias, lo cual contribuye a la heterogeneidad y variabilidad de la aparición y desarrollo de fenómenos que dan como resultado la enfermedad neoplásica. Este complejo proceso se genera en varias etapas, en las cuales las células normales adquieren ciertas ventajas de crecimiento por medio de un mecanismo análogo a la evolución darwiniana3.
Aunque muchos esfuerzos son dirigidos hacia aspectos genéticos en la búsqueda de la causa del cáncer de próstata, cada vez se reconoce más la importancia del papel del microambiente en el desarrollo de este tipo de tumores4.
El microambiente tumoral está constituido no solo por células malignas, sino que en él también se encuentran otros tipos celulares residentes y células de linaje hematopoyético infiltradas, como los macrófagos, neutrófilos, linfocitos y mastocitos. Todas estas células producen un ambiente único de interacción entre los leucocitos del hospedero y las células tumorales, lo cual sugiere ciertas características inmunogénicas del tumor prostático5. Estudios previos han confirmado una relación positiva entre la presencia de leucocitos intratumorales y la supervivencia del paciente6. Por otro lado, los macrófagos asociados a tumores (tumor-associated macrophages [TAM]) representan la población más abundante que infiltra estas neoplasias y participan tanto en el control como en la progresión maligna7. La presente revisión se centra en los diversos papeles de los TAM en la próstata y el cáncer prostático.
Macrófagos asociados a tumoresLos macrófagos son células del sistema fagocítico mononuclear (SFM)8 derivados de los monocitos circulantes en sangre, los cuales se extravasan a los tejidos y se diferencian en respuesta a diferentes estímulos, aunque este dogma debe ser revisado a la luz de nuevas evidencias que sugieren que los macrófagos están dotados de capacidades de autorrenovación y para poblar los tejidos incluso antes del nacimiento por la hematopoyesis temprana que ocurre en el saco vitelino9.
Los macrófagos comprenden un grupo heterogéneo de células de gran plasticidad10 y son capaces de desempeñar una amplia gama de funciones, entre ellas la fagocitosis de células y microorganismos, eliminación de células senescentes, detritus y cuerpos extraños, regulación de la hematopoyesis, presentación de antígenos para montar una respuesta inmunitaria específica, secreción de más de 100 productos biológicamente activos, actividad antitumoral (citotóxica y citotáctica)11,12, reparación de tejidos, una interesante interacción bidireccional con los linfocitos y participación en la homeostasis del hospedero. Se diferencian en distintos tipos funcionales13, entre los cuales destacan los macrófagos antagónicos: el macrófago M1 (clásicamente activado) y el M2 (alternativamente activado). En forma general, los TAM presentan un fenotipo M2 y muestran principalmente acciones oncogénicas, facilitando la supervivencia, la proliferación y la diseminación de las células malignas. La presencia de un elevado número de estos suele relacionarse con un mal pronóstico.
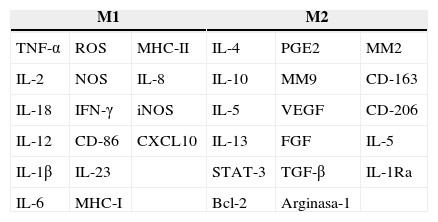
Estos 2 tipos funcionales de macrófagos son activados de manera distinta conforme al estímulo recibido. Los M1 son estimulados por patrones moleculares asociados a patógenos (pathogen-associated molecular patterns [PAMPS]), interleucina-12 (IL-12) e interferón gamma (IFN-γ), mientras que los M2 son estimulados por IL-4, IL-13, IL-21 e IL-33, complejos inmunitarios, activinaA y glucocorticoides14. Estos estados son un espejo de los Th1 y Th2 en la polarización de los linfocitosT15. Cada macrófago polarizado expresa un perfil diferente de citocinas, enzimas y marcadores de superficie. Los macrófagos M1 se caracterizan por la expresión de factores proinflamatorios como IL-1β, IL-6, IL-12, IL-18, IL-23 y factor de necrosis tumoral alfa (tumor necrosis factor alpha [TNF-α]), especies reactivas de oxígeno (reactive oxygen species [ROS]) y de nitrógeno (reactive nitrogen species [NOS]), además de niveles elevados del complejo principal de histocompatibilidad (major histocompability complex [MHC]) clasei y ii, así como de la quimiocina CXCL10. De esta manera, los macrófagos M1 participan en respuestas microbicidas y en la inmunidad antitumoral. Por otro lado, los macrófagos M2 expresan IL-4, IL-5, IL-10 e IL-13, arginasa1, antagonista del receptor de IL-1 (interleucin-1 receptor antagonist [IL-1Ra]), molécula CD-163 (receptor scavenger), CD-206 (macrophage mannose receptor C type 1) y están involucrados en la inmunidad humoral y en la cicatrización de las heridas16 (tabla 1).
Principales moléculas producidas por los 2 fenotipos de macrófagos: M1 y M2
| M1 | M2 | ||||
|---|---|---|---|---|---|
| TNF-α | ROS | MHC-II | IL-4 | PGE2 | MM2 |
| IL-2 | NOS | IL-8 | IL-10 | MM9 | CD-163 |
| IL-18 | IFN-γ | iNOS | IL-5 | VEGF | CD-206 |
| IL-12 | CD-86 | CXCL10 | IL-13 | FGF | IL-5 |
| IL-1β | IL-23 | STAT-3 | TGF-β | IL-1Ra | |
| IL-6 | MHC-I | Bcl-2 | Arginasa-1 | ||
Bcl-2: leucemia de células B-2; CD: grupo de diferenciación; CXCL10: ligando de la quimiocina 10; FGF: factor de crecimiento de fibroblastos; IFN-γ: interferón gamma; IL: interleucina; IL-1Ra: antagonista del receptor de interleucina 1; iNOS: sintetasa inducible de óxido nítrico; M1: macrófago activado clásicamente; M2: macrófago activado alternativamente; MHC: complejo principal de histocompatibilidad; MM2: metaloproteasa 2; MM9: metaloproteasa 9; NOS: especies reactivas de nitrógeno; PGE2: prostaglandina 2; ROS: especies reactivas de oxígeno; STAT3: transductor de señal activador de la transcripción-3; TGF-β: factor de crecimiento transformante beta; TNF-α: factor de necrosis tumoral alfa; VEFG: factor de crecimiento del endotelio vascular.
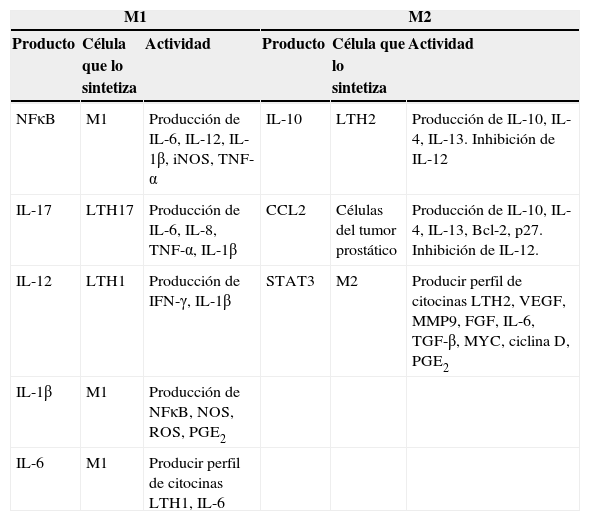
Por otra parte, cuando los monocitos se localizan en el sitio del tumor, son moldeados por diversas señales del microambiente tumoral y por las células presentes. Como se mencionó previamente, los TAM están polarizados hacia un fenotipo M2, en parte por la ausencia de señales M1, como IFN-γ (interferón gamma) o componentes bacterianos en el microambiente tumoral y por la presencia de señales M2, como TGF-β (transforming growth factor beta [factor de crecimiento transformante beta]), IL-4, IL-13 e IL-1016 (tabla 2).
Acciones de las principales moléculas sobre los 2 fenotipos de macrófagos en el microambiente tumoral: M1 y M2
| M1 | M2 | ||||
|---|---|---|---|---|---|
| Producto | Célula que lo sintetiza | Actividad | Producto | Célula que lo sintetiza | Actividad |
| NFκB | M1 | Producción de IL-6, IL-12, IL-1β, iNOS, TNF-α | IL-10 | LTH2 | Producción de IL-10, IL-4, IL-13. Inhibición de IL-12 |
| IL-17 | LTH17 | Producción de IL-6, IL-8, TNF-α, IL-1β | CCL2 | Células del tumor prostático | Producción de IL-10, IL-4, IL-13, Bcl-2, p27. Inhibición de IL-12. |
| IL-12 | LTH1 | Producción de IFN-γ, IL-1β | STAT3 | M2 | Producir perfil de citocinas LTH2, VEGF, MMP9, FGF, IL-6, TGF-β, MYC, ciclina D, PGE2 |
| IL-1β | M1 | Producción de NFκB, NOS, ROS, PGE2 | |||
| IL-6 | M1 | Producir perfil de citocinas LTH1, IL-6 | |||
Bcl-2: leucemia de células B2; FGF: factor de crecimiento de fibroblastos; IFN-γ: interferón gamma; IL: interleucina; iNOS: sintetasa inducible de óxido nítrico; LTH: linfocito T cooperador; M1: macrófago activado clásicamente; M2: macrófago activado alternativamente; MM9: metaloproteasa 9; NFκB: factor nuclear kappa de células B; NOS: especies reactivas de nitrógeno; PGE2: prostaglandina 2; ROS: especies reactivas de oxígeno; STAT3: transductor de señal activador de la transcripción; TGF-β: factor de crecimiento transformante beta; TNF-α: factor de necrosis tumoral alfa; VEFG: factor de crecimiento del endotelio vascular.
Cuando se considera de manera conjunta la información epidemiológica, genética y de la patogénesis molecular, todo converge en la hipótesis de que cualquier circunstancia que favorezca la inflamación crónica puede ser causa de cáncer prostático; de hecho, esta es un área de intensa investigación17.
Las lesiones en la atrofia inflamatoria proliferativa (proliferative inflammatory atrophy [PIA]) están estrechamente relacionadas con inflamación crónica, y en estas se aprecia un marcado índice de replicación celular, con concentraciones elevadas de moléculas antiapoptósicas como Bcl-2, la cual se encontró en un tipo de leucemia de células B, y una disminución de p27, el cual produce un bloqueo en el proceso de replicación celular. Histológicamente, se ha observado una transición celular entre áreas de PIA y neoplasia intraepitelial prostática de alto grado, y además entre PIA y cáncer de próstata18.
Evidencias recientes enfatizan un papel importante de la inflamación en la patogénesis del cáncer de próstata. Para poder estudiar mejor sus repercusiones en este tumor, la inflamación prostática por sí misma debe ser mejor comprendida19.
Se reconoce un origen multifactorial en la inflamación de la glándula prostática20.
Histológicamente, un tejido prostático inflamado se caracteriza por la presencia de abundantes linfocitos, mastocitos, macrófagos y, menos frecuentemente, eosinófilos y neutrófilos. La diferenciación, crecimiento y quimiotaxis de los monocitos circulantes y macrófagos residentes en el tejido inflamado son regulados por el microambiente a través de quimiocinas, citocinas, factores de crecimiento (entre los que destaca el factor estimulante de colonias-1 [colony-stimulating factor 1 [CSF-1]), componentes de la matriz extracelular (extracellular matrix [ECM]) e hipoxia. Pero la migración de estos hacia el sitio tisular inflamado se logra primordialmente bajo la influencia de la quimiocina CCL2 (proteína quimiotáctica de monocitos 1 [monocyte chemoattractant protein-1, MCP-1]) y por la supresión de la citocina inhibitoria de macrófagos-1 (macrophage inhibitory cytokine-1 [MIC-1]), la cual se encuentra disminuida en el tejido prostático inflamado, favoreciendo la infiltración de una mayor cantidad de macrófagos a la región. Existe una correlación entre la quimiocina CCL2 y la acumulación de macrófagos en el cáncer de próstata. La CCL2 es derivada de células del tumor prostático, y además actúa como un potente inductor de la polarización de los linfocitosT hacia el fenotipo Th2, favoreciendo así un perfil de M2 en los TAM. Otras quimiocinas consideradas actualmente de menor importancia son CCL3, CCL4, CCL5 (RANTES) y CCL22 (quimiocina derivada de macrófagos)21.
En el tejido prostático inflamado, los macrófagos comienzan a producir y secretar grandes cantidades de potentes moléculas proinflamatorias, como TNF-α e IL-1β, las cuales actúan a través de mediadores moleculares. Estas inducen la expresión de moléculas de adhesión en leucocitos, células estromales y endoteliales, lo cual promueve la inflamación y la infiltración celular en el sitio afectado. Concomitantemente, y de manera importante, la presencia de IL-17 producida por una variedad de leucocitos de linajeT, como los linfocitos LTh17 (linfocitosT cooperadores subtipo17) y los TCD8(+) (linfocitosT citotóxicos), estimula a los macrófagos a sintetizar mayor cantidad de TNF-α e IL-1β en el tejido glandular22.
Las moléculas de mayor relevancia inducidas la por IL-1β son ciclooxigenasa 2/prostaglandina E2 (COX2/PGE2), óxido nítrico sintetasa inducible (iNOS) e IL-6. Esto explica la rápida respuesta de las células estromales e inmunitarias para producir grandes cantidades de IL-1, PGE2, óxido nítrico y otras citocinas. No toda la producción de COX2/PGE2 es dependiente de la IL-1β en el ambiente prostático inflamado, también la IL-17 participa de manera importante a través del factor de transcripción nuclear kappa B (nuclear factor-kappa B [NF-κB])23. A su vez, se ha demostrado una capacidad autocrina de COX2/PGE2 inducida por la activación de IL-6, puesto que PGE2 estimula la liberación del receptor soluble de IL-6 (sIL-6R), la dimerización de gp130, la fosforilación del transductor de señal activador de la transcripción 3 (signal transducer and activator of transcription 3 [STAT3]) y la unión de este al ácido desoxirribonucleico (ADN)24.
La respuesta inflamatoria de los macrófagos es amplificada por el factor de transcripción NF-κB, el cual es activado por IL-1β y TNF-α25. Su actividad conduce a la síntesis de parte de los macrófagos, de IL-12, IL-6, IL-1, TNF-α e iNOS, lo cual provoca una retroalimentación positiva que hace que se incremente la expresión de mediadores inflamatorios, lo cual favorece la inflamación y la carcinogénesis26.
En el tejido prostático inflamado, los macrófagos son las principales células productoras de ROS y NOS, moléculas que reaccionan con el ADN de las células proliferantes y estimulan la expresión de enzimas que inducen alteraciones en los nucleótidos, lo cual puede provocar mutaciones cancerosas que podrían ser un importante factor oncogénico27. Otras acciones de las NOS y ROS incluyen la modulación de la actividad de las ADN metiltransferasas y de manera peculiar la desregulación de la autorrenovación y diferenciación de las células troncales hematopoyéticas28.
Por otra parte, la IL-17 es capaz de estimular a los macrófagos y a las células estromales para producir hasta 9 y 26 veces más IL-6 e IL-8, respectivamente, en la hiperplasia prostática benigna (HPB). En las lesiones características de la atrofia inflamatoria proliferativa, la producción de IL-17 depende exclusivamente de los macrófagos29.
La IL-6 posee capacidad autocrina y paracrina además de ser capaz de activar genes proinflamatorios y oncogénicos. Además de estar involucrada en la respuesta inmunitaria de la misma manera que la IL-1β, puede influir en procesos malignos como la angiogénesis y la actividad antiapoptósica, siendo este un efecto que la IL-6 promueve por la vía de señalización del fosfatidil inositol 3-cinasa (phosphatidylílinositol 3-kinase [PI-3K]) acompañado por la activación de la ciclinaA30.
Macrófagos asociados a tumores, inflamación prostática y cáncerDurante la progresión del tumor prostático, los macrófagos cambian totalmente de un fenotipo M1 predominante en áreas de inflamación crónica, que son los sitios donde el tumor se desarrolla, y se produce la transición de atrofia inflamatoria a neoplasia intraepitelial prostática de alto grado, un fenotipo M2 presente en áreas tumorales ya establecidas. Los TAM en el tumor prostático suprimen la actividad antitumoral del sistema inmunitario, incrementan la diseminación de las células tumorales, potencian la metástasis y estimulan la neoangiogénesis. Se considera que el 20% de los TAM posee un fenotipo M1 y el 80% un fenotipo M2, lo cual explica las concentraciones de IFN-γ e IL-4 hasta 10 veces mayores y de IL-13 4 veces superiores en relación con el tejido prostático normal31.
Los TAM secretan citocinas, como la IL-10, la cual ejerce un pronunciado efecto inmunosupresor que impide la producción de IL-12, la cual a su vez es un poderoso estimulante de la proliferación de linfocitosT, de células citolíticas naturales (natural killer [NK]) y de la producción de IFN-γ. Otra molécula producida de manera importante por los TAM es el factor de crecimiento transformante beta (TGF-β), el cual inhibe la actividad citotóxica de las células NK y de los LTCD8(+) y mantiene la diferenciación hacia linfocitos Treg (linfocitosT reguladores)32 favoreciendo la inmunosupresión, lo cual a su vez facilita el crecimiento y la invasión tumoral.
La hipoxia es el principal mecanismo implicado en la neoangiogénesis en el cáncer de próstata. Los TAM se acumulan principalmente en estas áreas del tumor en asociación con tejido necrótico, donde son reclutados por el factor de transcripción inducible por hipoxia-α (hypoxia-inducible factor alpha [HIFα]) cuya expresión en los TAM induce la activación de genes proangiogénicos, como el del factor de crecimiento del endotelio vascular (vascular endothelial growth factor [VEGF]), y en las células de la glándula prostática, los de las quimiocinas CXCL18 y CXCL1233.
La proliferación de las células cancerígenas se ve favorecida por la producción de c-MYC, ciclina D1 e IL-6 en estas células. En las células del cáncer de próstata, el NF-κB inhibe la muerte celular a través de la activación de genes antiapoptósicos como Bcl-2 y el TNF-α. Otra de las acciones del NF-κB estriba en la invasión y metástasis mediante la promoción de la síntesis de metaloproteasa de matriz 9 (MM9) en los TAM. Las concentraciones nucleares de NF-κB se incrementan en los TAM y en las células cancerígenas durante la transición de tejido prostático benigno a neoplasia intraepitelial prostática, y de esta a cáncer de próstata34.
Existe una relación positiva interesante entre la expresión de IL-6 y la agresividad del cáncer de próstata, y los valores de esta citocina superiores a 7pg/ml son consideradas un factor de pronóstico desfavorable en este tipo de tumores. Otro efecto importante de esta estriba en su capacidad para estimular la expresión de receptores de andrógenos en las células proliferantes del cáncer de próstata, lo cual implica cambios negativos en el pronóstico de la enfermedad y en la estrategia terapéutica para este tipo de tumores. Esta activación puede ser tanto por la vía de las cinasas de Janus/transductor de señal activador de la transcripción 3 (Janus kinases/signal transducer and activator of transcription 3 [JAK/STAT3]), como por la de la proteína cinasa activada por mitógenos (mitogen-activated protein kinase [MAPK]), lo cual de cierta manera explica cómo la IL-6 constituye un factor que media en la resistencia a la quimioterapia y a la terapia por castración. En las células luminales de la glándula prostática, STAT3 permite la expresión del receptor de andrógenos (RA), un factor central en la supervivencia y proliferación del cáncer de próstata35. Se ha demostrado que la molécula de STAT3 se asocia a dichos receptores en forma independiente de los andrógenos. También existe un incremento en la actividad de la vía JAK/STAT3 en el cáncer de próstata, de modo que el desarrollo de nuevas estrategias que tengan como blanco a STAT3 es una de las prioridades en la oncología36.
La IL-6, además de ser regulada por NF-κB, como otras moléculas, también es controlada por el factor supresor de tumores Rb (retinoblastoma), el cual frecuentemente se encuentra ausente en el cáncer prostático37.
Iliopoulos et al. presentaron en un estudio evidencia interesante de una retroalimentación positiva entre la inflamación y la activación de IL-6, STAT3 y NF-κB producidos por los macrófagos en el cáncer prostático, los cuales mantienen a las células en un estado de transformación constante38.
La fagocitosis de las células apoptósicas por los macrófagos, conocida como eferocitosis y mediada por la proteína factor de crecimiento epidérmico de glóbulos de grasa láctea8 (milk fat globule-EGF8 [MFG-E8]), favorece la polarización hacia un fenotipo M2; esto se logra utilizando la vía STAT3/SOCS3 al fosforilar STAT3 en la tirosina 705 e inhibir el supresor de la señalización de citocinas SOCS339.
En el cáncer de próstata, la vía JAK/STAT3 es crucial para una polarización completa y plena a un fenotipo M2, puesto que la IL-6, la IL-10 y el VEGF secretados por estos tumores, y que son vitales para la inmunosupresión y el crecimiento tumoral, son capaces de favorecer aún más la activación de STAT3, creando así un mecanismo anticipado que asegura su actividad incrementada, tanto en los TAM como en las células tumorales. La fosforilación de este factor de transcripción se logra por medio de los integrantes de la familia JAK40.
Los genes blanco de STAT3 están relacionados con la proliferación y la supervivencia, como en el caso de MYC, ciclina D1/D2, BCL-XL y p53; con la angiogénesis, como VEGF, FGF (gen del factor de crecimiento de fibroblastos), MMP9 y MMP2, y con la inmunosupresión, como IL-6, IL-10 y TGF-β41. Estas moléculas activadas por concentraciones elevadas de STAT3 fosforilado que migró al núcleo de los TAM, al ser sintetizadas y secretadas al microambiente, son los mediadores por los cuales este fenotipo de macrófagos ejerce funciones oncogénicas, de proliferación celular, antiapoptósicas y de promoción de metástasis y neoangiogénesis42. Esto explica por qué la densidad de los TAM es superior en los pacientes con cáncer prostático cuando este ya presenta extensión extracapsular y recurrencia bioquímica; en cambio, los macrófagos con el fenotipo M1 predominan más en el cáncer de próstata que se encuentra confinado a la glándula.
ConclusionesLos macrófagos asociados a tumores han demostrado desempeñar un papel clave en la creación de un microambiente inmunosupresor, así como en la promoción del crecimiento tumoral prostático, en la progresión, la metástasis y la angiogénesis. Los estudios mencionados en la presente revisión señalan algunos puntos a través de los cuales los TAM pueden constituir blancos terapéuticos, entre ellos IL-6, NF-κB y STAT3, y sugieren que la disminución de los niveles de TAM o la reversión a un fenotipo M1 puede derivar en un decremento en el crecimiento y la dispersión tumoral, así como en una mejor respuesta a la quimioterapia. En conclusión, se ha demostrado que los TAM son un componente importante en el microambiente del tumor prostático, y estudios adicionales deberán evaluar esta célula como un potencial blanco terapéutico.
Conflicto de interesesLos autores manifiestan no tener ningún conflicto de intereses.