Introducción: El cáncer de mama es el tumor maligno más frecuente en el sexo femenino. Estudios previos han demostrado la presencia de PDGFRβ en tejido tumoral mamario con implicaciones pronósticas, sin embargo, su participación en la carcinogénesis ha sido descrita parcialmente.
Métodos: Se evaluó el comportamiento tumoral en células con y sin PDGFRβ. La evaluación se llevó a cabo en 2 fases: in vitro, mediante pruebas de proliferación y migración celular e in vivo, en un modelo murino, donde se determinó la capacidad tumorigénica y secundariamente, la velocidad de crecimiento así como el volumen y peso tumorales.
Resultados: Los resultados demostraron que la tasa de proliferación y la capacidad migratoria fueron significativamente superiores en las líneas PDGFRβ en comparación con las líneas silenciadas; el silenciamiento del PDGFRβ condicionó disminución de la actividad de las MAPK's. Finalmente, la capacidad tumorigénica, en un modelo murino, determinada por el tiempo de aparición de las lesiones, fueron mayores en la línea PDGFRβ+.
Conclusión: PDGFRβ participa activamente en la proliferación, migración y tumorigénesis celular en cultivos primarios de cáncer de mama.
Introduction: Breast cancer is the most frequent malignant tumor in women. Previous evidence has shown the presence of PDGFRβ in breast cancer with some prognostic issues, but the carcinogenic role has been described partially.
Methods: Tumoral behavior was evaluated in cells with and without PDGFRβ expression. This evaluation was realized in two phases; in vitro by using proliferation and migration tests and in vivo, in a murine model where tumorigenic capacity was evaluated by the growth rate and tumoral weight.
Results: Proliferative rate and migration capacity were significantly higher in cellular lines with PDGFRβ expression in relation to silenced lines. The silence in the PDGFRβ receptor diminished the MAPK's activity. Finally tumorigenic capacity in murine models dictated by time to tumor appearance, growth rate, were higher in cell lines with PDGFRβ+.
Conclusion: PDGFRβ participates actively in proliferation, migration and tumorigenesis of primary cultures of breast cancer.
Introducción
El cáncer de mama es el tumor diagnosticado con mayor frecuencia y la principal causa de muerte por cáncer en mujeres. Las mayores tasas de incidencia se presentan en Norte América, Australia, norte de Europa y la región sur de Asia y África sub-Sahariana. El reporte por grupos de edad, muestra que este tumor corresponde al primer lugar de mortalidad por cáncer entre 40 y 59 años. Las probabilidades para el desarrollo tumoral son de un caso por cada 6 mujeres en general, y uno por cada 8 mujeres en el caso de tumores invasores1.
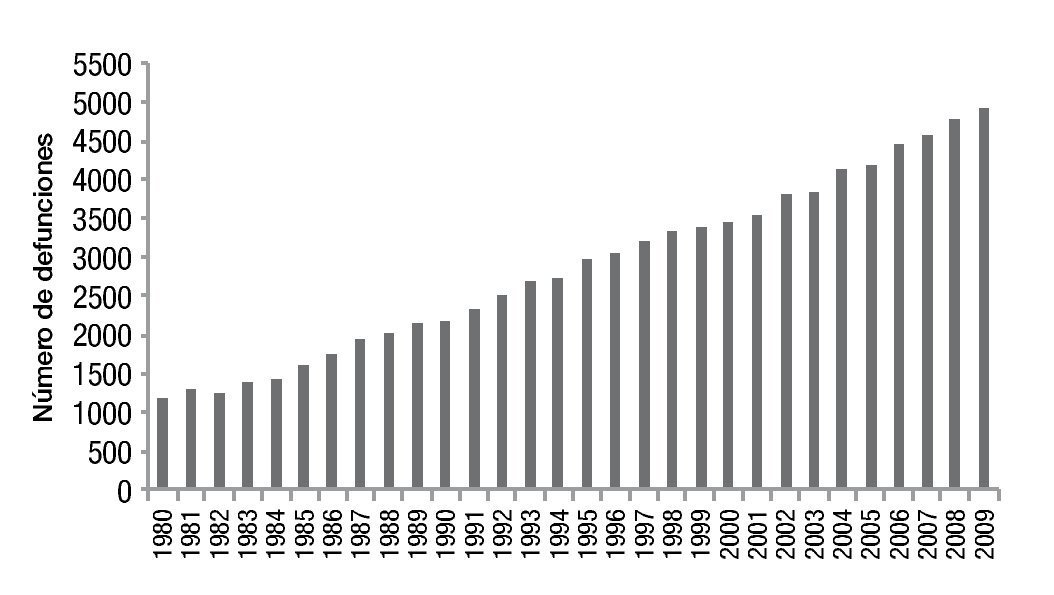
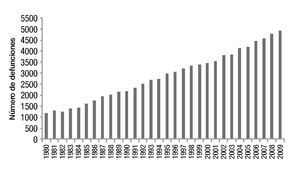
En México se presentaron 86,469 muertes por cáncer de mama en el periodo comprendido entre 1980 y 2009, con diferencias importantes entre ambos periodos. Se documentaron 1,206 defunciones en 1980 en comparación con 4,897 decesos en el 2009, estas cifras presentaron un incremento significativo en la tasa de mortalidad por este tumor, la cual pasó de 11.7 a 17 decesos por 100,000 muertes en mujeres en el año 2009 (fig. 1)2.
Figura 1. Mortalidad por cáncer de mama en México.
Este incremento en la mortalidad hace prioritario el desarrollo de estrategias eficaces en el tratamiento de este tumor. Un mejor entendimiento de la biología tumoral permitirá dirigir y optimizar su manejo, que se traducirá en mejores resultados en el control de la enfermedad y en supervivencia. En la actualidad, las investigaciones en esta área han aportado información sobre la presencia de factores pronósticos evaluables en tejido tumoral. Estos factores son reproducibles, accesibles, de fácil interpretación y no requieren un gran volumen de tejido. Dentro de los principales factores pronósticos que han sido reportados se encuentran: los receptores hormonales, los marcadores de proliferación, marcadores de invasividad y de potencial metastásico, así como receptores de factores de crecimiento, principalmente el receptor de factor de crecimiento epidérmico-2 (HER2)3.
La búsqueda constante de estos factores, ha dado pie al desarrollo de nuevas líneas de investigación en este campo. En nuestro centro, se ha profundizado la investigación del factor de crecimiento derivado de plaquetas y sus receptores en años recientes.
Factor de crecimiento derivado de plaquetas (PDGF)
El PDGF pertenece a la familia PDGF/VEGF que se caracteriza por tener 8 residuos de cisteína, y consta de 4 cadenas (A, B, C y D), que se codifican en los cromosomas 7p22, 22q13, 4q31 y 11q22, respectivamente.
Existen 2 cadenas principales del PDGF: A y B. La cadena A presenta 2 isoformas, conteniendo 196 y 211 aminoácidos resultantes de un splicing diferencial del producto de la transcripción. Estas cadenas son sintetizadas, dimerizadas y procesadas proteolíticamente a nivel de su N-terminal secretadas como un dímero de 30 kDa. Por otro lado, la cadena B se conforma por 241 residuos de aminoácidos, es dimerizada y procesada por proteólisis adicional y finalmente, secretada como un dímero de 24 kDa4.
La conformación de las cadenas del PDGF puede presentarse como homodímeros (AA, BB) o heterodímero (AB). En todos los casos se conforman por 3 puentes disulfuro entre los residuos 1-6, 3-7 y 5-8, los residuos 2 y 4 se conectan asimétricamente por 2 puentes disulfuro.
El papel del PDGF en el ciclo celular es el de un regulador "competente" durante la transición de la fase G0/G1. Las células estimuladas con este factor progresan de la fase tardía de G1 hacia la conclusión del ciclo celular, lo que conlleva a su división. Las funciones biológicas del PDGF son variadas y se han documentado en todos los niveles del desarrollo embrionario; desarrollo alveolar, cutáneo y de oligodendrocitos en sistema nervioso central5.
Receptores del PDGF
Los efectos de las isoformas del PDGF son ejercidos mediante la activación de 2 receptores de superficie con actividad de tirosina cinasa (PDGFRα y PDGFRβ). Los genes de los receptores se localizan en los cromosomas 4q12 y 5q33, respectivamente.
Ambos receptores constan de: un dominio extracelular que contiene 5 dominios tipo inmunoglobulinas, un dominio transmembranal, un domino yuxtamembranal, un dominio de cinasa, y un dominio de inserto. Estos receptores comparten 31% de homología en el dominio de unión a ligando, 27% en el del inserto de cinasas y 28% en el del C-terminal.
Los 3 receptores diméricos de PDGF (αα , αβ , ββ ) median señales de transducción específica de la isoforma del factor.
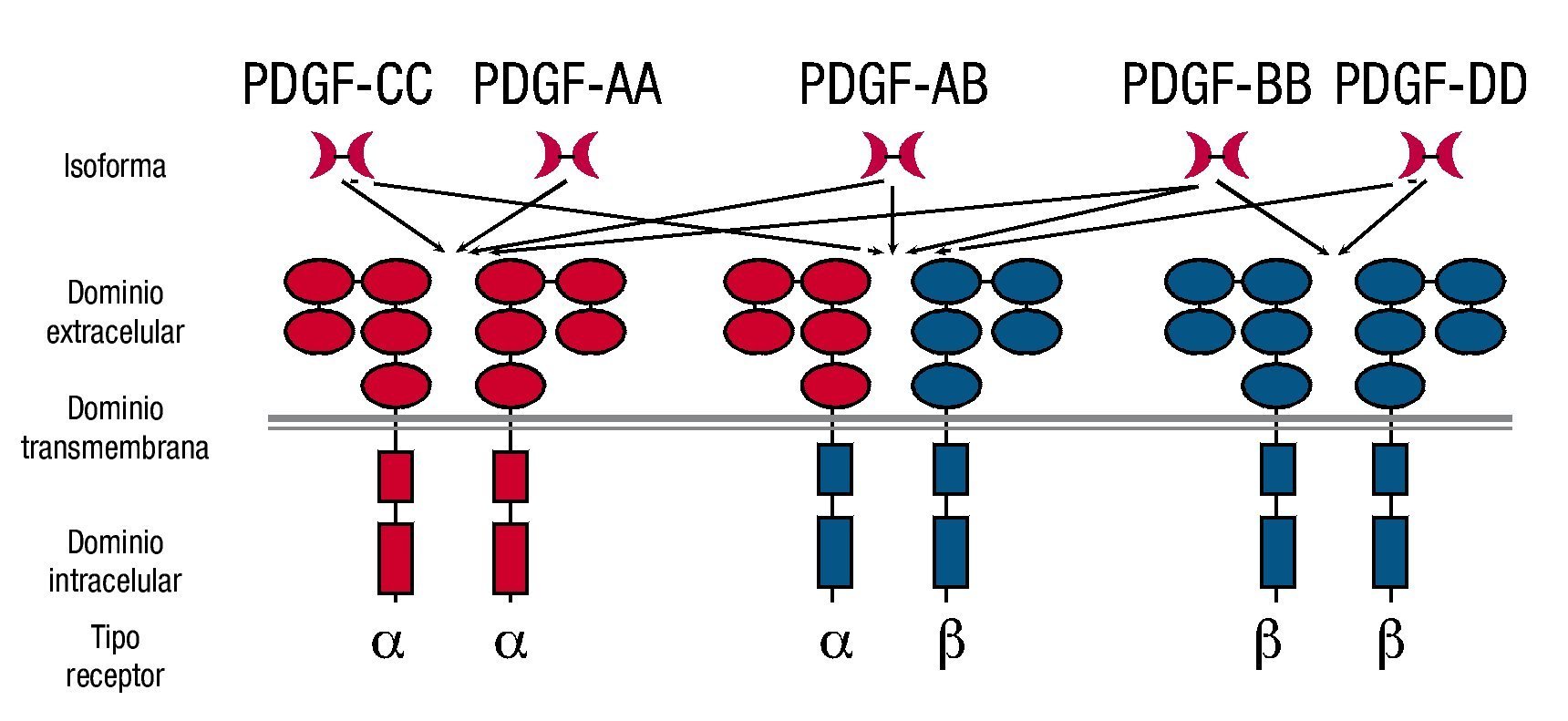
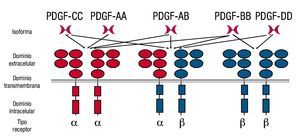
El homodímero PDGF AA activa sólo PDGFRαα, mientras que el heterodímero PDGF AB puede activar PDGFRαα o PDGFRαβ, el homodímero PDGF BB activa los 3 receptores diméricos, el homodímero PDGF CC activa PDGFRαα, PDGFRαβ y finalmente, el homodímero PDGF DD activa únicamente al receptor PDGFRββ (fig. 2).
Figura 2. Interacción de los insertos de PDGF con sus receptores.
Vías de señalización
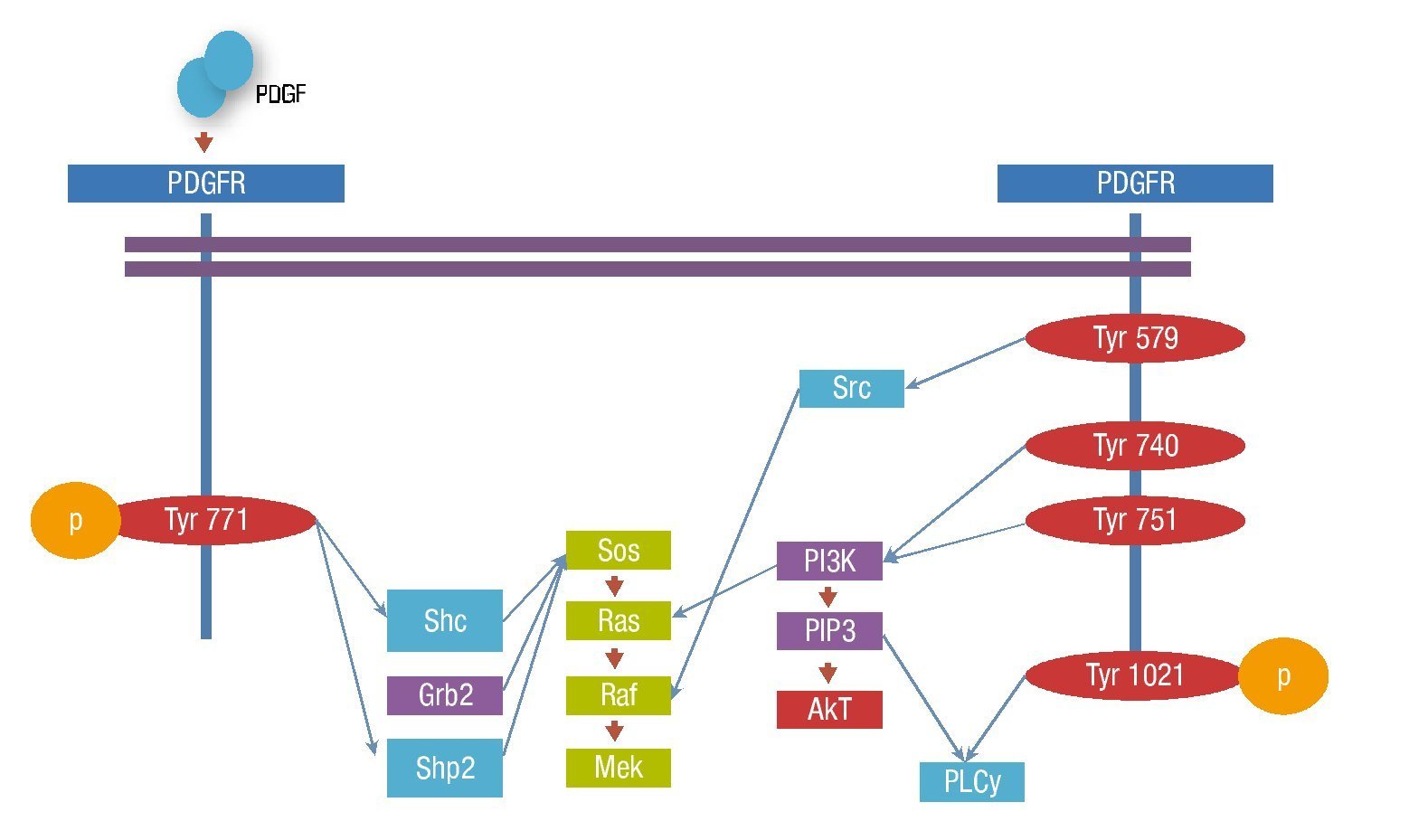
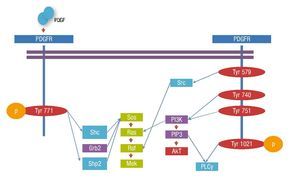
La unión del ligando induce la dimerización del receptor, condicionando un cambio conformacional que permite la autofosforilación de residuos de tirosina específicos en el dominio intracelular del receptor. La unión específica de moléculas de señalización intracelular a las tirosinas fosforiladas, se lleva a cabo a través de los dominios SH2 y PTB, que unen fosfotirosinas, resultando en la activación de la cascada de señalización7.
Existen más de 10 moléculas con dominios SH2 con capacidad de unión a distintos sitios de fosforilación del PDGFRβ.
Las moléculas con actividad enzimática incluyen al fosfatidilinositol 3' cinasa (PI3-K), fosfolipasa C- γ(PLCγ), la familia Src de tirosina cinasas, la tirosin fosfatasa SHP2 y la proteína activadora de RAS por GTP (GAP). Las moléculas adaptadoras que unen al receptor activado con otros componentes de la señalización incluyen Grb2, Sjc, Grb7 y Crk.
Los transductores de señal y activadores de la transcripción (STATS) son reclutados y fosforilados por receptores PDGFRβ activos y subsecuentemente presentan una migración nuclear como dímeros, activando directamente la transcripción de los genes diana. El reclutamiento y fosforilación puede ser directo como en el caso de STAT1 o indirecto como STAT3 (fig. 3).
Figura 3. Vías de señalización del PDGFR.
Debido a que la señalización descontrolada puede tener consecuencias fatales, varios mecanismos permiten limitar la transducción de señal mediante tirosina cinasas: internalización y degradación del complejo ligando-receptor en el endosoma, ubiquitinización de los receptores los receptores activados e inhibición mediante regulación negativa a través de proteínas como las fosfatasas de tirosina (PTP's) y la familia de citocinas supresoras (SOCS).
PDGFR y cáncer
En neoplasias mesenquimatosas, como glioblastoma, dermatofibrosarcoma protuberans y neoplasias del estroma gastrointestinal (GIST), se han demostrado alteraciones (mutaciones, sobreexpresión) del PDGFR señalización autocrina, que favorece la capacidad de crecimiento tumoral e incrementa la supervivencia celular y paracrina, que involucran el desarrollo estromal y vascular. Adicionalmente, el PDGF secretado por células tumorales tiene un comportamiento quimioatrayente y mitógeno para las células mesenquimatosas y tumorales8.
Existe poca información sobre el PDGFRβ en cáncer de mama, sin embargo, estudios retrospectivos han demostrando su expresión hasta en el 35% de los tumores estudiados, asociándose con volúmenes tumorales mayores, alto grado histológico, negatividad para receptores hormonales, altos índices de proliferación y coexpresión de HER2, lo que se traduce en un pobre pronóstico9. La información desarrollada en nuestro centro, ha confirmado la presencia de PDGFRβ en cultivos primarios de cáncer de mama. Los estudios preliminares mostraron que estas líneas celulares presentan un comportamiento más agresivo y paradójicamente, una mayor sensibilidad a los inhibidores de tirosina cinasa, y el silenciamiento del receptor PDGFRβ a través de la inserción de un RNA de interferencia (shRNA), condicionó una mayor viabilidad celular con incremento de la resistencia a inhibidores de tirosina cinasa.
Objetivo general: demostrar en cultivos primarios de cáncer de mama PDGFRβ+, la disminución del grado de agresividad celular dependiente de PDGFRβ silenciando este receptor a través de un RNA de interferencia (shRNA).
Objetivos específicos: evaluar y comparar la tasa de proliferación y la capacidad migratoria así como la capacidad tumorigénica, en un modelo murino, de células de cultivos primarios de cáncer de mama PDGFβR+ y PDGFRβ silenciado.
Métodos
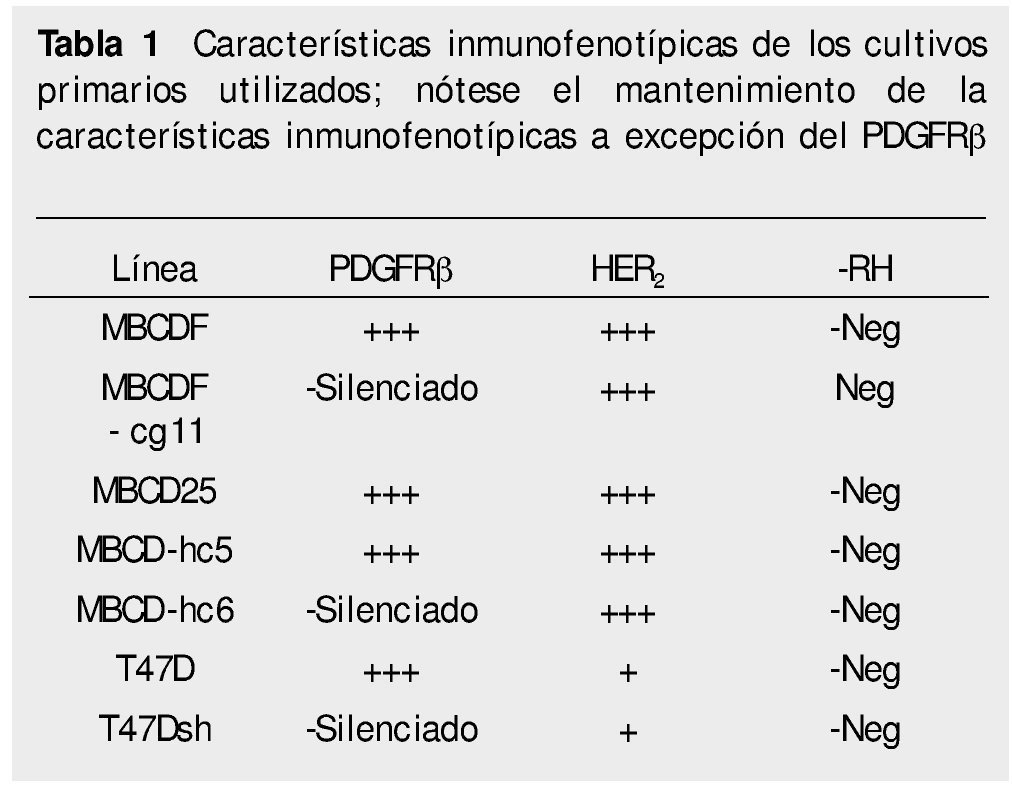
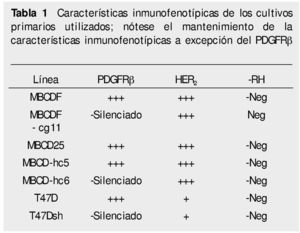
Cultivo celular. Los cultivos primarios de células de cáncer de mama fueron previamente establecidas en el laboratorio, al igual que las células silenciadas para PDGFR suplementado con 10% de suero fetal bovino (SFB), 1% de penicilina y estreptomicina a 37°C en una atmósfera de 5% de CO2. Los patrones de expresión de receptores de factores de crecimiento de las 7 líneas celulares utilizadas (5 lÍneas primarias: 2 líneas parentales; MBCDF y MBCD25 y 3 silenciadas MBCDF-cg11, MBCD-hc5, MBCD-hc6) y 2 comerciales (747D, T47Dsh) se presentan en la tabla 1.
Inmunoblott. Las células de cáncer de mama PDGFR shRNA fueron lisadas en un buffer de lisis que contiene 50 mM de HEPES pH 7.4, 250 nM NaCl, 5 mM de EDTA, 0.1% NP-40, 10 mM NaF, 50 mM beta glicerol-fosfato (B6P), 1 mM Na3VO4 e inhibidores de proteasas (1X de complete libre de EDTA). Se determinó la concentración de proteína mediante la técnica de Bradford (Bio - rad, Hercules, CA, USA); 20 μg de proteína total fueron separadas en un gel de poliacrilamida (SDS - PAGE). Posteriormente, se transfirió a una membrana de PVDF (Immobilon-P, Millipore). La membrana fue bloqueda con leche descremada al 5% e PBS-Tween 0.05%. Los anticuerpos primarios utlizados fueron policlonales de conejo anti-PDGFRβ (Santa Cruz Biotechnology, Santa Cruz, CA) anti pPDGFRβ Y751 (Cell Signling Technology), y el anticuerpo monoclonal anti-β tubulina (Santa Cruz Biotechnology, Santa Cruz, CA) toda la noche a 4°C. A continuación se incubó con los correspondientes anticuerpos secundarios, los blots fueron revelados mediante el sistema ECL-plus.
Ensayos de proliferación. Para los ensayos de proliferación se sembraron 3,000 células por cm2 en placas de 24 pozos en RPMI con 10% SFB. Las células fueron fijadas a los días 0, 1, 3, 5 con glutaraldehído al 1.1% en PBS. La placa fue evaluada por técnica de cristal violeta, la prueba se realizó por triplicado. El análisis se realizó mediante prueba t de student.
Pruebas de migración. Para las pruebas de migración se cultivaron 8,000 células por cm2 con medio RPMI con 10% SFB, las células fueron incubadas durante 24 horas. Posteriormente, se realizó una lesión de monocapa con un objeto romo, realizándose un cambio de medio. La evaluación objetiva se llevó en un microscopio Olympus® ZG2144 (Olympus, Japón), documentándose a las horas 0, 12 y 24. El experimento se realizó por triplicado.
Como prueba adicional de migración, las líneas celulares MBCDF y MBCDF-cg11 en una concentración de 20,000 células en 600 μL, fueron sembradas en cámaras de Boyden, mantenidas en RPMI suplementado con 10% de suero fetal bovino (SFB), 1% de penicilina y estreptomicina a 37°C en una atmósfera de 5% de CO2 durante 8 horas. Las células fueron fijadas con glutaraldehído al 1.1% en PBS y se tiñeron con cristal violeta, fueron lavadas y posteriormente evaluadas al microscopio Olympus ZG2144 (Olympus, Japón).
Análisis de tumorigénesis. Los estudios en animales fueron realizados bajo el protocolo aprobado por el comité de ética de ensayos en animales del Instituto, con número de aprobación CINVA-13. Las células MBCDF y MBCDF-cg11 (1x106 en volumen de 0.1 ml) fueron inyectadas en forma subcutánea en el costado de ratones desnudos de 8 semanas de edad. Se realizó evaluación visual, peso y medición de las lesiones tumorales cada 48 horas, finalmente y posterior a la aplicación de eutanasia a los animales, se realizó la resección de la lesión, se llevaron a cabo: medición y peso de los tumores. El análisis de los datos se hizo mediante una prueba t de Student.
Resultados
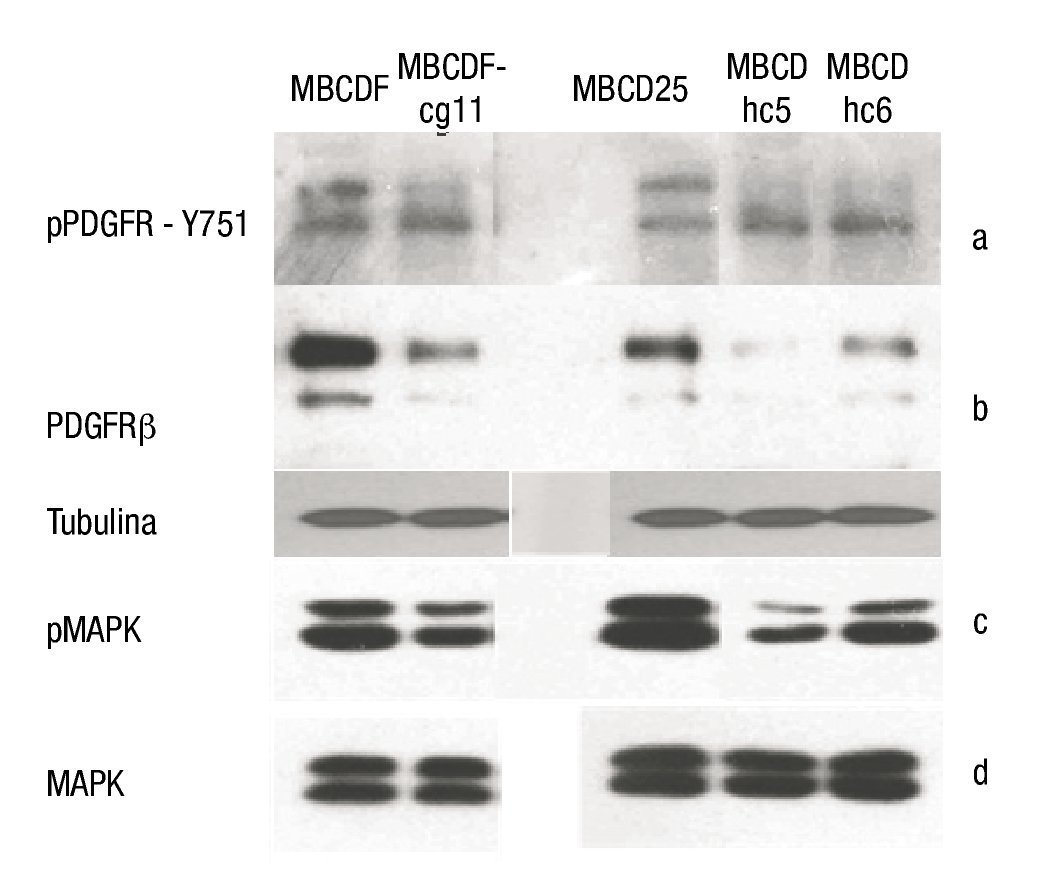
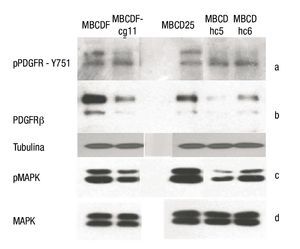
Silenciamiento de PDGFRβ en cultivos primarios de cáncer de mama: mediante la realización de WB se determinó la expresión de PDGFRβ en las líneas parentales (MBCDF y MBCD25), así como el descenso de la expresión del mismo en las líneas silenciadas con shRNA (MBCDF-cg11, MBCD-hc5, MBCD-hc6) (fig. 4a).
Figura 4. A) WB de la forma fosforilada del PDGFRβ en la Y751 de las líneas celulares. Se observa una disminución en la fosforilación en las líneas celulares silenciadas (MBCDF-cg11, MBCD -hc5 y MBCD-hc6). B) PDGFR total que muestra el apagamiento en las líneas silenciadas, la porción inferior muestra la expresión de tubulina como control de carga. C) Porción fosforilada de las MAPK. Se demuestra una disminución de su fosforilación en las líneas celulares silenciadas. D) MAPK totales, no se observa diferencias entre líneas celulares parentales y silenciadas.
Posteriormente, se realizó el análisis del estado de activación del receptor evaluando el grado de fosforilación de la tirosina 751 (Y751). Se observó un descenso en el grado de fosforilación en los cultivos donde el receptor fue silenciado (fig. 4b).
Posteriormente, se realizó el análisis del estado de activación del receptor evaluando el grado de fosforilación de la tirosina 751 (Y751). Se observó un descenso en el grado de fosforilación en los cultivos donde el receptor fue silenciado (fig. 4b).
En la evaluación de las vías de señalización de las MAPK's, se observó que no hubo modificación en las totales de las mismas, sin embargo, en la determinación de la porción fosforilada, se observó una disminución secundaria al silenciar el PDGFRβ (figs. 4c y 4d).
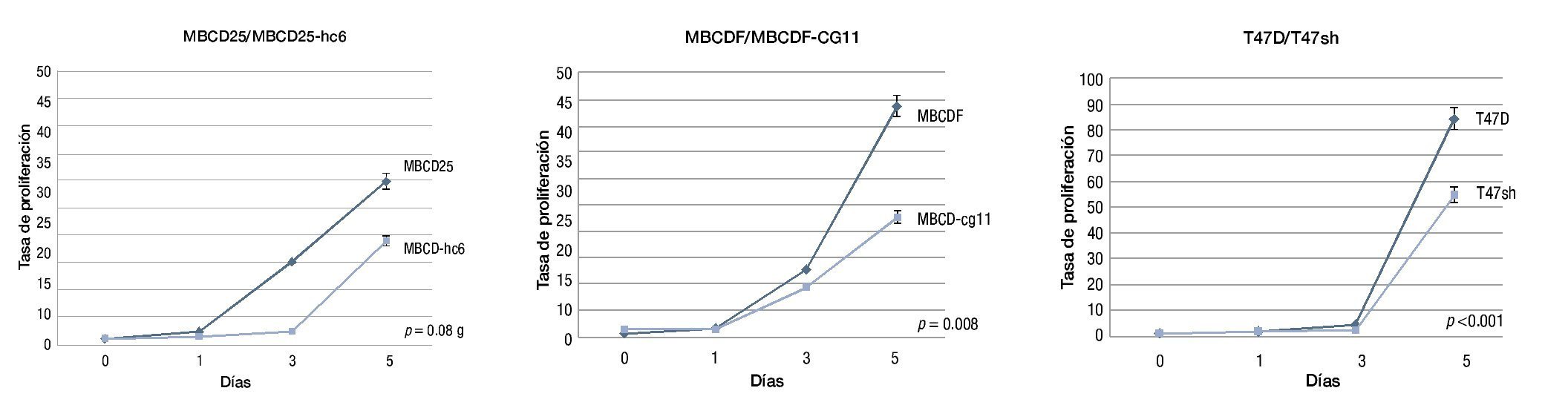
Mediante el ensayo de proliferación se encontró que las líneas con PDGFRβ+ presentaron una tasa superior a las líneas silenciadas, de forma particular, la línea MBCD25 mostró un incremento proliferativo de 1, 2.4, 14.9 y 29.8 veces, mientras que su shRNA, la MBCDhc6, presentó una tasa de 1, 1.4, 2.3 y 19 veces a los días 0, 1, 3 y 5 respectivamente (p=0.089).
Por su parte, la línea MBCDF, mostró una tasa proliferativa de 1, 1.7, 12.8 y 43.8 veces, mientras que su parte silenciada, la MBCDF-cg11, presentó una tasa de 1, 1.4, 9.6 y 22.7 veces en los días, 0, 1, 3 y 5 respectivamente (p=0.008).
La línea comercial T47D mostró una tasa de 1, 1.5, 4.5 y 84.4 veces, comparativamente con la silenciada, T47sh, en la que se observó una tasa proliferativa de 1, 1.6, 1.9 y 54, en los días 0, 1, 3 y 5 respectivamente (p<0.001) (fig. 5).
Figura 5. Tasas de proliferación de las líneas parentales en comparación con sus shRNA's, debido a que el resultado expresado en las gráficas es producto de varios experimentos independientes, se expresa como error estándar.
La migración celular evaluada mediante los ensayos de lesión en monocapa demostraron una mayor capacidad migratoria para las líneas MBCDF y MBCD25, en comparación con las líneas silenciadas: MBCDF-cg11 y MBCD-hc6, estas diferencias fueron notorias desde las 12 horas y el cierre de la herida de la monocapa a las 24 horas fue evidente en el caso de las líneas parentales, no así en las líneas con silen ciamiento de PDGFRβ (fig. 6).
Figura 6. A) Migración celular en líneas MBCD25/MBCD-hc5. B) Migración celular en líneas MBCD25/MBCD-hc6 y, C) migración celular en líal MBCDF/MCDF-cg11.
Finalmente, se determinó la capacidad tumorigénica en el modelo murino, evaluando distintas características de los tumores inducidos experimentalmente. En primer lugar, se documentó el tiempo de desarrollo tumoral. Se observó un tiempo de aparición temprano con las células parentales MBCDF (p) en comparación con la línea celular silenciada MBCDF-cg11 (sh) (tabla 2).
Discusión
La historia del PDGFR se asoció inicialmente al desarrollo de tejido muscular a nivel vascular. Sin embargo, los avances en el estudio de la Biología Molecular, particularmente en lo que se refiere a neoplasias malignas, ha dejado al descubierto este receptor como un elemento importante de conocer, entender y con un probable papel en la carcinogénesis.
La información publicada, demuestra que la presencia de PDGFR en tejido tumoral condiciona un comportamiento agresivo que se traduce en un peor pronóstico, sin embargo, esta evidencia parte de tumores no mamarios, particularmente de origen mesenquimatoso.
Los experimentos previamente realizados por nuestro grupo, demostraron la presencia de PDGFRβ en tumores mamarios, correlacionado con un comportamiento tumoral agresivo, sin embargo los estudios fueron comparados contra clonas células con diferentes fenotipos, quedando en duda si la biología tumoral descrita estaba asociada con este receptor. También nuestro grupo demostró que el silenciamiento del PDGFRβ mediante el uso de un shRNA, permite mantener las características generales de la célula exceptuando únicamente al receptor en cuestión, por lo que la evaluación del comportamiento asociado a este receptor es inmejorable.
La realización de este proyecto responde al esfuerzo de 3 años de trabajo sobre cultivos primarios de cáncer de mama, con la conformación de nuevas clonas estables a partir de los mismos, con lo que fue posible la caracterización del comportamiento de estas líneas celulares con expresión de PDGFRβ y su contraparte con silenciamiento del receptor: migración celular, tasa de proliferación, capacidad de invasividad y capacidad tumorigénica, entendida esta última como el comportamiento en un organismo vivo, bajo condiciones no controladas.
En este trabajo se observó que el PDGFRβ es un orquestador de las funciones biológicas que condicionan una mayor agresividad y empeoran el pronóstico en cáncer de mama.
En los experimentos de Western Blott de las líneas celulares documentamos el apagamiento exitoso del receptor, con disminución de la porción fosforilada y una consecuente disminución de la actividad de las MAPK's (fosforiladas), sin embargo, como era esperable, al realizar la cuantificación total de estas no observamos modificaciones, lo que nos llevó a realizar estudios in vitro e in vivo.
Las tasas proliferativas mostraron que las células con PDGFRβ tienen una velocidad de crecimiento mayor, casi duplicada, en relación con aquellas con silenciamiento de este receptor.
De llamar la atención es la capacidad migratoria asociada con este receptor. Así se observó una resolución de la herida de la monocapa a las 24 horas, precedida por la evidente migración celular sobre la misma en las horas previas, fenómeno no documentado en las líneas celulares en las que se silenció el receptor.
Igualmente, la aparición precoz de la lesión tumoral en el modelo animal, es importante de mencionar, debido a que como era de esperarse, la presencia del receptor, incrementa la capacidad tumorigénica.
Conclusión
El PDGFRβ en cultivos primarios de cáncer de mama incrementa la tasa de proliferación, la capacidad migratoria, y la tumorigénesis. Aumenta la tasa de crecimiento tumoral, acorta el tiempo de aparición de los tumores e incrementa también los diámetros y pesos tumorales en un modelo murino.
Esto plantea la posibilidad que el PDGFRβ pueda ser considerado en un futuro como un blanco terapéutico en cáncer de mama.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Instituto Nacional de Ciencias Médicas y de la Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Colonia Sección XVI, Delegación Tlalpan, C.P. 14100, México D.F., México.
Teléfono: 551425 9229.
Correo electrónico: borund@hotmail.com (Abdel Karim Dip-Borund).