Evaluar la utilidad diagnóstica del inmunofenotipo en el líquido cefalorraquídeo (LCR) en una cohorte de niños con leucemia linfoblástica aguda.
Material y métodosEstudio de prueba diagnóstica (transversal comparativo) que se llevó a cabo entre marzo de 2010 y enero de 2012 en el Hospital Infantil de México Federico Gómez.
ResultadosSe incluyeron 111 muestras de LCR para evaluación. Por citomorfología, 85 LCR se clasificaron como negativos (76.5%), de los cuales 3 fueron SNC2 y 82 SNC1; veintiséis líquidos fueron clasificados como positivos (SNC3, 23.5%). Para validar los resultados referidos de la citología se realizó un análisis interobservador, el cual arrojó un valor de 0.8466 (intervalo de confianza del 95%: 0.5526-1.0), en tanto que en el análisis intraobservador, el valor fue de 0.8780 (intervalo de confianza del 95%: 0.6432-1.0). La sensibilidad y la especificidad fueron de 76.92 y 87.06, respectivamente, el valor predictivo positivo fue de 64.52 y el valor predictivo negativo de 92.50; la razón de verosimilitud positiva fue de 5.94 y la negativa de 0.27.
ConclusionesEs necesario incluir la evaluación del LCR en los pacientes con leucemia linfoblástica aguda como una prueba paralela con el objeto de incrementarla sensibilidad y efectuar una correcta evaluación del paciente.
To assess the diagnostic usefulness of immunophenotyping in cerebrospinal fluid (CSF) in a cohort of children with acute lymphoblastic leukemia (ALL).
Material and MethodsA Diagnostic Test Study (cross-comparative) was conducted from March 2010 to January 2012 at the Hospital Infantil de México Federico Gómez (HIMFG).
ResultsOne-hundred and eleven CSF samples were included for assessment by cytomorphology. Eighty-five CSFs were classified as negative (76.5%), out of which 3 were CNS2, 82 CNS1, and 26 fluids were classified as positive (CNS3, 23.5%). In order to validate these cytology results, an inter-observer analysis was performed, which yielded a value of 0.8466 (95% CI: 0.5526-1.0), whereas in the intra-observer analysis, the value was 0.8780 (95% CI: 0.6432-1.0). Sensitivity and specificity were 76.92 and 87.06, respectively, the positive predictive value was 64.52, and the negative predictive value was 92.50; the positive likelihood ratio was 5.94, and the negative, 0.27.
ConclusionsInclusion of CSF evaluation is necessary in patients with ALL as a parallel test, in order to increase sensitivity, as well as to assess the patients properly.
La leucemia linfoblástica aguda (LLA) se define como una alteración citogenética que tiene como consecuencia la proliferación monoclonal maligna de células precursoras de estirpe linfoide. Es la neoplasia maligna más frecuente en la edad pediátrica, con una incidencia de entre 3 y 4 pacientes por cada 100,000 habitantes por año. La edad pico de presentación es entre los 2 y los 5 años1.
El diagnóstico de certeza se establece al encontrar más de un 25% de blastos con características linfoides en la médula ósea1,2.
Los niños con LLA son tratados por grupos de riesgo definidos por características clínicas y de laboratorio. La intensidad del tratamiento necesario para obtener desenlaces favorables varía entre los subconjuntos de niños con LLA3–6.
La presencia de leucemia en el sistema nervioso central (SNC) en el momento del diagnóstico tiene significado pronóstico. Los pacientes con diagnóstico por punción lumbar no traumática se pueden ubicar en una de las siguientes 3 categorías conforme a la cantidad de leucocitos/μl y la presencia o ausencia de blastos en la citocentrífuga:
- •
Sistema nervioso central 1: líquido cefalorraquídeo negativo a la presencia de blastos.
- •
Sistema nervioso central 2: líquido cefalorraquídeo con menos de 5 leucocitos/μl y citocentrífuga positiva a blastos.
- •
Sistema nervioso central 3: líquido cefalorraquídeo con 5 o más leucocitos/μl y citocentrífuga positiva a blastos.
En comparación con los pacientes clasificados como SNC1 o SNC2, los niños con LLA que presentan enfermedad del SNC, es decir, SNC3 en el momento del diagnóstico, corren un mayor riesgo de recaída tanto en el ámbito del SNC como sistémicamente7. La adversidad del pronóstico asociada al estadio SNC2, cuando tal es el caso, se puede superar mediante la aplicación de terapia intratecal más intensa, especialmente durante la fase de inducción7,8. Una punción lumbar traumática (≥ 10 eritrocitos/μl) que incluye blastos en el momento del diagnóstico parece relacionarse con un incremento en el riesgo de recaída en cuanto al SNC y predice un desenlace general más precario7,9,10.
La infiltración en el SNC es un hallazgo frecuente en las neoplasias hematológicas, con una incidencia superior al 25% en leucemias y linfomas11,12. En la evaluación inicial de los pacientes con LLA, el LCR debe ser examinado cuidadosamente y, dependiendo del grado de observación y la experiencia del observador, se pueden identificar blastos hasta en un tercio de los pacientes en el momento del diagnóstico, de los cuales la mayoría carece de síntomas neurológicos. El análisis citológico convencional ha demostrado ser de utilidad; sin embargo, el análisis de las células en el LCR, especialmente cuando el recuento celular es bajo, es más difícil de lo que en general se admite, y no siempre es concluyente. Independientemente del nivel de riesgo que se asigne al paciente, todos reciben tratamiento contra enfermedad no mensurable en el SNC debido a que la capacidad de la prueba de referencia resulta insuficiente para demostrar si los pacientes presentan infiltración en el SNC. Sin embargo, las modalidades terapéuticas varían en función del estado del SNC en el momento del diagnóstico. El compromiso del SNC en las LLA presenta una incidencia del 5 al 10%13.
En todos los centros de tratamiento, el diagnóstico de infiltración del SNC se define como la presencia de 5 o más leucocitos por milímetro cúbico de LCR con blastos presentes en una muestra citocentrifugada, o por la presencia de parálisis de pares craneales o de masa cerebral en estudios de imagen14,15.
La incidencia de infiltración del SNC en el momento del diagnóstico puede variar considerablemente dependiendo de los criterios diagnósticos empleados. Algunos de los factores que contribuyen a la dificultad para establecer el diagnóstico son las cuentas bajas de células presentes en las muestras de LCR y la dificultad para interpretar el significado de anomalías morfológicas con una escasa cantidad de células en el LCR en las preparaciones citocentrifugadas. El examen citomorfológico del LCR no demuestra las células malignas hasta en un 45% de los casos con infiltración meníngea11.
La demostración de la presencia de antígenos de superficie celular y desoxinucleotidil transferasa terminal (TdT) puede enriquecer la información disponible de la morfología celular y determinar si las células son o no de origen leucémico12,16.
El examen citológico del LCR es la prueba diagnóstica que se emplea para detectar la infiltración en el SNC por medio de microscopía óptica; desafortunadamente, esta técnica presenta bajos niveles de sensibilidad y especificidad.
Tanto la escasez de células en el LCR de pacientes con enfermedad de bajo grado como el aspecto inocente de las células neoplásicas pueden producir resultados negativos falsos. Por su lado, los falsos positivos resultan de la confusión de linfocitos atípicos por linfocitos reactivos; sin embargo, estos son poco frecuentes y por lo general son referidos como atípicos y sospechosos12.
Algunas de las moléculas de los anticuerpos monoclonales (CD) son específicas de ciertas líneas celulares, en tanto que otras son compartidas por varias células. En la actualidad, sabemos que no es fácil identificar subpoblaciones de linfocitos con base en su morfología macroscópica, pero se sabe que existen subpoblaciones de células que son distinguibles entre sí por los marcadores que expresan en la membrana nuclear, en el citoplasma y en la membrana celular. De manera global, existen 2 subpoblaciones de linfocitos, los linfocitos T y los linfocitos B, los cuales difieren en sus funciones y productos proteicos a pesar de que morfológicamente son similares16,17.
La citometría de flujo es un método objetivo y cuantitativo que permite identificar pequeñas poblaciones celulares con fenotipos conocidos. Metodológicamente, la citometría puede detectar células que constituyen hasta el 0.01% del total de la población linfocitaria, lo cual supera al examen citológico del LCR, la prueba de referencia, el cual posee baja sensibilidad y presenta una tasa de falsos negativos de entre un 20 y un 60%18,19. Esto debe tenerse en cuenta al examinar los leucocitos en el SNC, puesto que su cifra es baja en el LCR y en el parénquima cerebral incluso en condiciones normales, además de que son dependientes de la tasa de flujo del LCR20–22.
En un estudio para evaluar el valor del inmunofenotipo en el LCR de pacientes con linfomas en comparación con la citomorfología, se encontró que la citometría de flujo fue capaz de detectar poblaciones anormales en 11 de 42 pacientes (26%) frente a 4 de 42 (9.5%) con la citomorfología. La diferencia en el porcentaje de casos positivos fue estadísticamente significativa (X2=3.97; p=0.046). Por lo tanto, se concluyó que la citometría de flujo puede ofrecer un método único y no subjetivo para evidenciar la infiltración en el SNC, complementando a la citomorfología convencional12.
Homans et al. estudiaron el inmunofenotipo del LCR en niños con LLA y un grupo de control. Se obtuvieron 61 muestras de LCR de pacientes con LLA (se excluyeron 18 por contaminación y 10 por cantidades insuficientes de células viables). Se analizaron 33 muestras, de las cuales 6 mostraron anomalías: tres diagnósticas y 3 sospechosas, así como 27 sin alteraciones citomorfológicas identificables. El grupo de control estuvo constituido por 104 niños. El inmunofenotipo en el grupo de control mostró que la mayoría (73%) de los linfocitos en el LCR resultó positiva a CD2. En las muestras de niños con LLA, se registró una disminución ligera (62%) pero significativa del porcentaje de linfocitos con expresión de CD2 (62 vs. 73%, p=0.05 en los controles). El porcentaje de células CD10-positivas fue de entre el 50 y el 88% en las 3 muestras diagnósticas de infiltración en el SNC, frente a entre el 4 y el 9% en los pacientes con LCR sospechosos. Los pacientes con citología normal también mostraron un incremento en el porcentaje de células CD10-positivas (5.4%). Cuando se comparó la diferencia de las medias de positividad a CD10 entre los pacientes con citología normal en el momento del diagnóstico y el grupo de control, existió significancia (p=0.001).
En este estudio se definió la anormalidad como un contenido de células CD10-positivas 2 desviaciones estándar por encima de lo normal en la muestra (> 3% de células CD10-positivas por muestra). Empleando dicho criterio, 9 de 27 niños con LLA y LCR normal en el momento del diagnóstico exhibieron inmunofenotipos anormales frente a 4 de 104 pacientes en el grupo de control (p=0.001 x2). Estos resultados pueden verse alterados por células neurales que expresan CD10 o por la absorción de CD10 por los linfocitos normales. Para evitar esto, se estudió la presencia de CD10 y TdT nuclear. En 15 pacientes con LCR normal se encontró que la media de células TdT-positivas fue del 7.2 vs. 0.8% y que las proporciones de células que expresaban simultáneamente CD10 y TdT fueron del 6 versus 0.05% en 28 niños del grupo de control (p=.04)23.
Existen diversos estudios que han tratado de comparar el valor diagnóstico del inmunofenotipo por medio de citometría de flujo y citomorfología en la detección de infiltración en el SNC en neoplasias hematológicas de manera retrospectiva para observar también el desenlace. En uno de ellos se estudiaron 219 muestras de LCR evaluadas en el momento del diagnóstico. Se encontró que 48 pacientes mostraron un LCR positivo mediante cualquiera de las técnicas: diecinueve (32%) con citomorfología, 44 (73%) con citometría de flujo y 15 (25%) con ambos métodos. Fueron evaluados 4 pacientes con citomorfología positiva y citometría de flujo negativa y 2 de ellos experimentaron progresión de la enfermedad y fallecieron. En el grupo de los 24 pacientes con citometría de flujo positiva y citomorfología negativa, 10 sujetos presentaron enfermedad recurrente o progresiva. Cuando se evaluó la presencia de células sospechosas, la citomorfología resultó sospechosa en 16 pacientes, de los cuales 4 murieron por progresión de la enfermedad: uno en el SNC y 3 con diseminación sistémica. Cuando se evaluaron las recurrencias en 12 pacientes con un promedio de seguimiento de 144 días (30-322), todos ellos presentaron una citometría de flujo positiva, 4 con citomorfología positiva, 4 dudosas y 4 negativas. La sensibilidad de la citometría de flujo fue del 78%, en tanto que la especificidad fue del 84%24.
El empleo del inmunofenotipo mediante anticuerpos monoclonales diversos dirigidos contra antígenos de los linfocitos T y B es capaz de detectar células neoplásicas que pueden constituir un 0.2% del total de la población celular linfoide en el SNC. El inmunofenotipo posee una sensibilidad de entre el 46 y el 89% en la LLA, y su valor diagnóstico en el LCR es más de 2 veces el de la citomorfología24–26.
La sensibilidad de la citomorfología es de 0.27 frente a 0.58 de la reacción en cadena de la polimerasa de las inmunoglobulinas, en tanto que la especificidad es de 1 para la citomorfología y de 0.85 para la reacción en cadena de la polimerasa; en comparación con la citometría de flujo, esta posee una sensibilidad de 0.1 y una especificidad de 0.95. El empleo de las 3 pruebas en forma conjunta mejora la sensibilidad a 0.6727.
2Material y métodos2.1Objetivo generalEvaluar la utilidad diagnóstica del inmunofenotipo en el LCR en una cohorte de niños con LLA.
2.2HipótesisLa determinación del inmunofenotipo es una herramienta diagnóstica útil para detectar casos de infiltración en el SNC en pacientes con LLA.
2.3Diseño del estudio y selección de pacientesEstudio de prueba diagnóstica que se llevó a cabo de marzo de 2010 a enero de 2012 en el Hospital Infantil de México Federico Gómez. Se informó a los padres y/o tutores de los pacientes candidatos a la participación en el protocolo sobre las implicaciones del mismo y se incorporó a aquellos que aceptaron participar. El protocolo fue revisado y aceptado por el Comité de Investigación del Hospital Infantil de México Federico Gómez (clave de registro del protocolo: HIM 2010/034) y se obtuvo el consentimiento informado de cada uno de los responsables de los pacientes incluidos en el estudio, así como el consentimiento de los niños que requirieron una explicación para participar en la investigación.
- •
Criterios de inclusión: pacientes diagnosticados con LLA en el período de marzo de 2010 a enero de 2012. Pacientes sin tratamiento previo con quimioterapia, radioterapia o ambos. Pacientes menores de 18 años que aceptaran participar en el estudio.
- •
Criterios de exclusión: muestra de LCR hemorrágico con un contenido de más de un eritrocito por 100 en campo de alto poder en el estudio citomorfológico mediante preparación con citocentrífuga.
- •
Líquido cefalorraquídeo positivo: todos los LCR clasificados como SNC3.
- •
Líquido cefalorraquídeo negativo: todos los LCR clasificados como SNC1 y SNC2.
- •
Inmunofenotipo positivo en LCR: todos los LCR que en el estudio de inmunofenotipo expresan un 3% o más de CD10, TdT o ambos en la población celular.
- •
Inmunofenotipo negativo en LCR: todos los LCR que en el estudio de inmunofenotipo expresan menos de un 3% de CD10, TdT o ambos en la población celular.
La muestra del LCR se obtuvo en el momento de realizar los estudios para integrar el diagnóstico. Se tomaron 3 muestras en el momento de realizar la punción lumbar diagnóstica, cada una de al menos 1ml para estudios de citomorfología y de inmunofenotipo mediante citometría de flujo. El estudio del inmunofenotipo en LCR se mantuvo cegado al estudio por microscopía óptica (citomorfología).
3.2Citometría de flujoSe empleó el citómetro de flujo FACSCalibur para análisis de 6 subpoblaciones celulares, con 6 parámetros de lectura simultánea, donde 4 de estos son parámetros de fluorescencia (FL1, FL2, FL3, FL4). El sistema de electrónica y óptica con capacidad para una cuarta fluorescencia (FL4) incluye un segundo láser con diodo de emisión roja de 635nm. El módulo de discriminación de dobletes cuenta con la capacidad para medir altura, ancho y área de las células en cualquiera de los parámetros de fluorescencia (FL1, FL2, FL3, FL4).
También se utilizó una caja de perlas para calibración del instrumento (CaliBRITE Beads) para la inmunotipificación, y una caja de perlas para calibración del instrumento (DNA QC Particles); Estación de Trabajo para FACSCalibur (FACStation); Computadora Power Macintosh G3; CPU Power PC 750 de 300 Mhz con 64 MB de memoria DRAM, 2 MB VRAM, 512L level 2 caché, disco duro de 4.0 GB y manejador interno de CD ROM 123, Ethernet interconstruido y Thin-Coax Tranceiver, Monitor de color Multisynch de 17”, impresora de color, módem interno de 56K.
La cuantificación de células en LCR mediante citometría de flujo se realizó de la siguiente manera: se rotularon 6 tubos de polipropileno de fondo redondo de 5ml con tapón con los nombres de los anticuerpos monoclonales y el fluorocromo correspondiente: isotiocianato de fluoresceína (FITC) y ficoeritrina; se pipetearon 20 microlitros del anticuerpo monoclonal correspondiente a cada tubo (CD45 FITC/CD34 PE; CD3 FITC/CD34 PE; CD3 FITC/CD33 PE; CD19 FITC/CD10 PE, CD4 FITC/CD8 PE; anti-TdT FITC (BD Biosciencies, San José, CA 9531, EE. UU.), con excepción del tubo n.° 6. A continuación se añadieron 100 microlitros de LCR a cada uno de los tubos, se colocó el tapón a cada uno de ellos y se mezclaron en el vórtex. Posteriormente, se centrifugaron a 1,500 revoluciones por minuto en el centrifugador, se decantaron los tubos y se agregaron 500 microlitros de solución de paraformaldehído al 1%. Al tubo número 6 se le agregaron 500 microlitros de solución permeabilizante y 100 microlitros de LCR, se incubó a temperatura ambiente durante 10 minutos, se agregaron 2ml de amortiguador de fosfatos y se centrifugó a 1,500rpm. A continuación se agregaron 20 microlitros de anticuerpo monoclonal anti-TdT y se incubó durante 30 minutos en refrigeración y a oscuras. Posteriormente, se agregaron 20ml de amortiguador de fosfatos y se mezcló en el vórtex y se centrifugó durante 5 minutos a 1,500rpm. Después, se decantó el tubo y se agregaron 500 microlitros de paraformaldehído al 1%. Finalmente, las muestras se analizaron en el citómetro de flujo FACSCalibur de 4 colores.
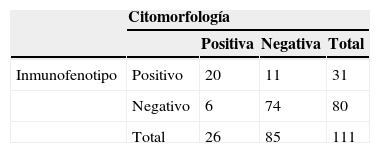
3.3Análisis estadísticoPara las variables cuantitativas de tipo continuo se calculó la media del número de leucocitos en el LCR por citología y el porcentaje de células CD10 y TdT de la muestra. Se evaluó la validez, la reproducibilidad y la seguridad de las pruebas. Dado que los resultados fueron dicotómicos, se clasificó a los pacientes en 4 grupos en una tabla de 2 3 2 (tabla 1). El análisis de la validez de la prueba se realizó calculando los valores de sensibilidad y especificidad de la prueba. La seguridad de la misma se determinó mediante el cálculo de los valores predictivos positivo y negativo. Asimismo, se evaluaron los cocientes de probabilidad o razones de verosimilitud positiva y negativa. Finalmente, se calculó el índice de concordancia kappa a fin de evaluar la variabilidad intraobservador e interobservador en el estudio citomorfológico del LCR.
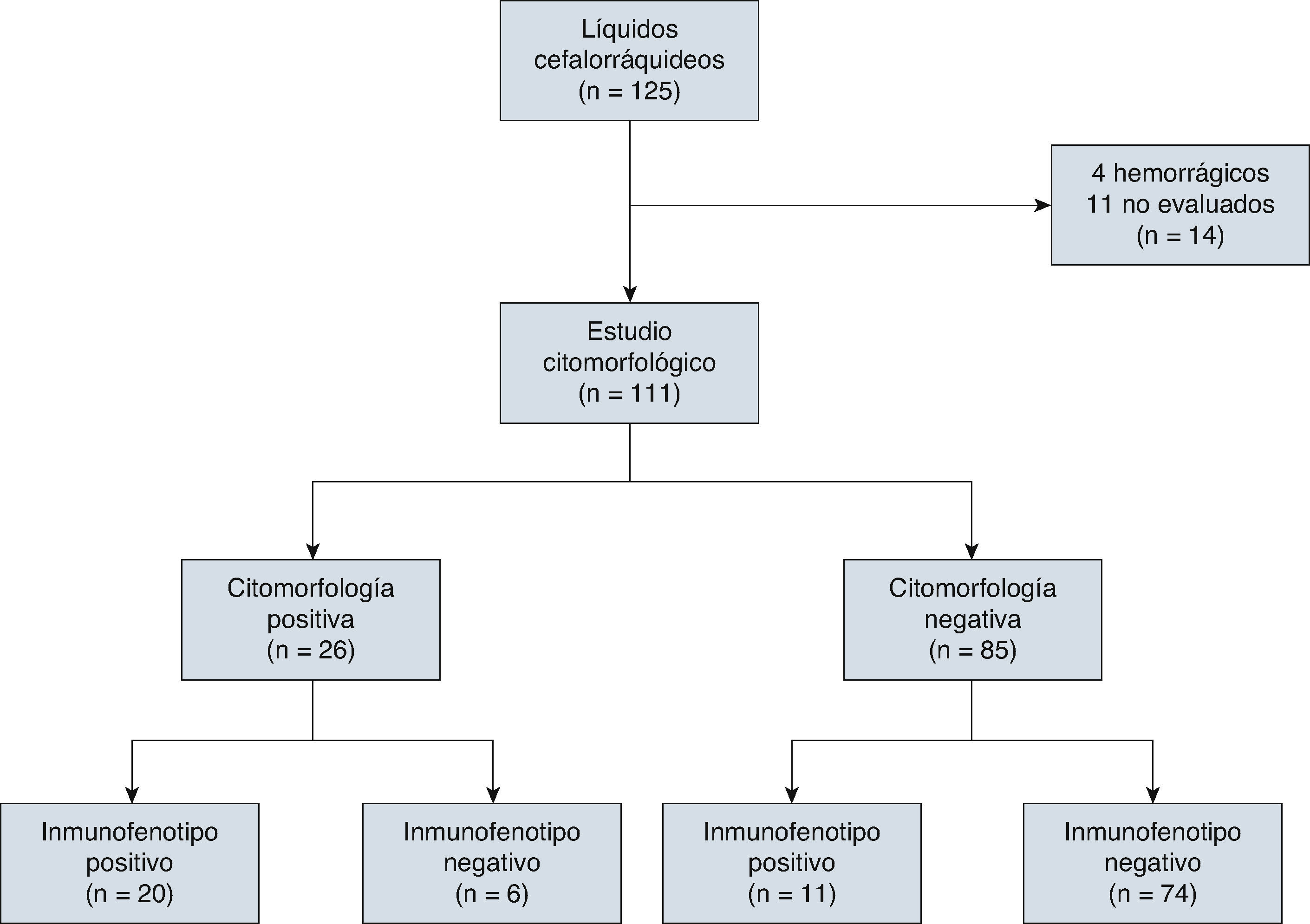
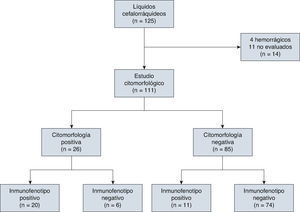
4ResultadosEn el estudio participaron 72 niños y 53 niñas de entre 0 y 17 años de edad (la media de edad en el momento del diagnóstico fue de 7.4 años) y se clasificaron conforme a los Criterios de Roma en el momento del diagnóstico (30 de alto riesgo y 95 de riesgo normal). De los 125 LCR de niños con LLA, 4 (3.2%) fueron LCR hemorrágicos y se excluyeron del análisis; otros 10 (8%) se excluyeron porque no se efectuó la evaluación en el tiempo establecido. Se analizaron en total 111 LCR (fig. 1).
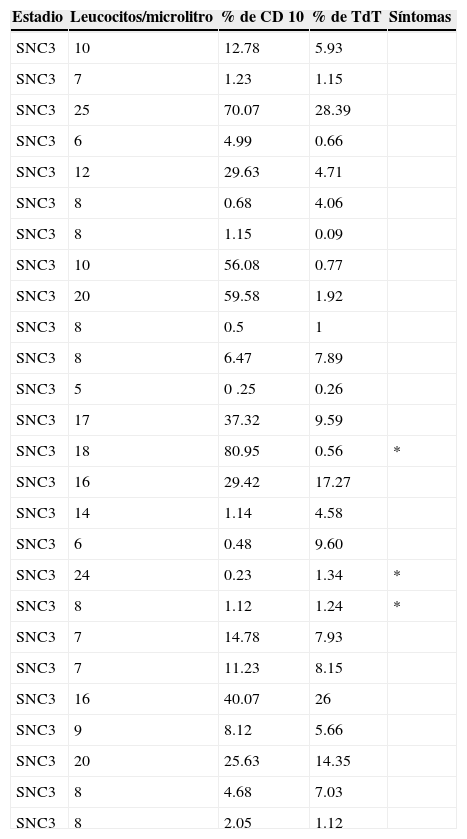
De los 111 LCR incluidos para evaluación por citomorfología, 85 se clasificaron como negativos (76.5%), de los cuales 3 fueron SNC2 y 82 SNC1; veintiséis líquidos fueron clasificados como positivos (SNC3, 23.5%; tabla 2).
Líquidos cefalorraquídeos positivos a infiltración en el estudio de citomorfología de pacientes con leucemia linfoblástica aguda
| Estadio | Leucocitos/microlitro | % de CD 10 | % de TdT | Síntomas |
|---|---|---|---|---|
| SNC3 | 10 | 12.78 | 5.93 | |
| SNC3 | 7 | 1.23 | 1.15 | |
| SNC3 | 25 | 70.07 | 28.39 | |
| SNC3 | 6 | 4.99 | 0.66 | |
| SNC3 | 12 | 29.63 | 4.71 | |
| SNC3 | 8 | 0.68 | 4.06 | |
| SNC3 | 8 | 1.15 | 0.09 | |
| SNC3 | 10 | 56.08 | 0.77 | |
| SNC3 | 20 | 59.58 | 1.92 | |
| SNC3 | 8 | 0.5 | 1 | |
| SNC3 | 8 | 6.47 | 7.89 | |
| SNC3 | 5 | 0 .25 | 0.26 | |
| SNC3 | 17 | 37.32 | 9.59 | |
| SNC3 | 18 | 80.95 | 0.56 | * |
| SNC3 | 16 | 29.42 | 17.27 | |
| SNC3 | 14 | 1.14 | 4.58 | |
| SNC3 | 6 | 0.48 | 9.60 | |
| SNC3 | 24 | 0.23 | 1.34 | * |
| SNC3 | 8 | 1.12 | 1.24 | * |
| SNC3 | 7 | 14.78 | 7.93 | |
| SNC3 | 7 | 11.23 | 8.15 | |
| SNC3 | 16 | 40.07 | 26 | |
| SNC3 | 9 | 8.12 | 5.66 | |
| SNC3 | 20 | 25.63 | 14.35 | |
| SNC3 | 8 | 4.68 | 7.03 | |
| SNC3 | 8 | 2.05 | 1.12 |
El número de leucocitos en el LCR fue de 2 a 25/μl, con una media de 9.24 leucocitos/ μl. De los pacientes con LCR positivo por citomorfología, 3 (11.5%) presentaron síntomas sugestivos de infiltración en el SNC; si esto se aplica a la totalidad de la población estudiada (n=125), el porcentaje es del 2.4%.
El inmunofenotipo resultó positivo en 31 pacientes, en tanto que la expresión de CD10 fue considerada positiva en 16 pacientes, con una media de expresión de CD10 del 15.44%. A su vez, el TdT se encontraba expresado en 15 LCR, con una media de expresión del 5.80%; en 14 LCR tanto CD10 como TdT se encontraban expresados (tablas 2 y 3).
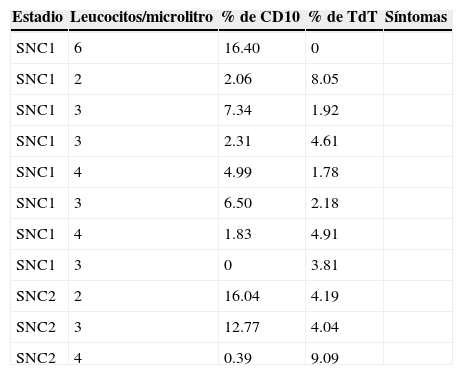
Líquidos cefalorraquídeos negativos por citomorfología y con inmunofenotipo positivo en el estudio
| Estadio | Leucocitos/microlitro | % de CD10 | % de TdT | Síntomas |
|---|---|---|---|---|
| SNC1 | 6 | 16.40 | 0 | |
| SNC1 | 2 | 2.06 | 8.05 | |
| SNC1 | 3 | 7.34 | 1.92 | |
| SNC1 | 3 | 2.31 | 4.61 | |
| SNC1 | 4 | 4.99 | 1.78 | |
| SNC1 | 3 | 6.50 | 2.18 | |
| SNC1 | 4 | 1.83 | 4.91 | |
| SNC1 | 3 | 0 | 3.81 | |
| SNC2 | 2 | 16.04 | 4.19 | |
| SNC2 | 3 | 12.77 | 4.04 | |
| SNC2 | 4 | 0.39 | 9.09 |
Para validar los resultados de la citología, se realizó un análisis de concordancia interobservador, el cual arrojó un valor de 0.8466 (intervalo de confianza [IC] del 95%: 0.5526-1.0), mientras que en el análisis de concordancia intraobservador, el valor fue de 0.8780 (IC del 95%: 0.6432-1.0).
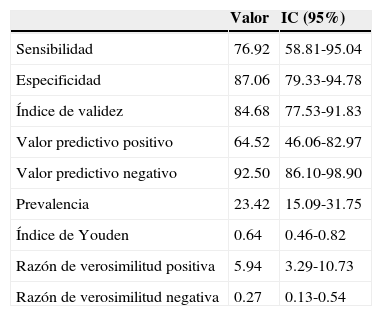
La sensibilidad y la especificidad fueron de 76.92 y 87.06, respectivamente. Por su lado, el valor predictivo positivo fue de 64.52 y el valor predictivo negativo de 92.50, en tanto que la razón de verosimilitud positiva fue de 5.94 y la negativa de 0.27 (tablas 1 y 4).
Resultados de la prueba diagnóstica relacionada con el inmunofenotipo
| Valor | IC (95%) | |
|---|---|---|
| Sensibilidad | 76.92 | 58.81-95.04 |
| Especificidad | 87.06 | 79.33-94.78 |
| Índice de validez | 84.68 | 77.53-91.83 |
| Valor predictivo positivo | 64.52 | 46.06-82.97 |
| Valor predictivo negativo | 92.50 | 86.10-98.90 |
| Prevalencia | 23.42 | 15.09-31.75 |
| Índice de Youden | 0.64 | 0.46-0.82 |
| Razón de verosimilitud positiva | 5.94 | 3.29-10.73 |
| Razón de verosimilitud negativa | 0.27 | 0.13-0.54 |
IC: intervalo de confianza.
La infiltración del SNC en los pacientes con LLA se mantiene como un reto para el diagnóstico y el tratamiento de los pacientes, puesto que se sabe que es un sitio en el cual la población celular se encuentra expuesta a menores concentraciones de los fármacos empleados en el tratamiento y que a pesar de que la terapia dirigida al SNC ha logrado disminuir el número de recaídas en este sitio santuario, prevalece el problema de que no se cuenta con un método exacto que permita detectar células leucémicas cuando se realiza la evaluación diagnóstica inicial debido a diversos factores. Entre dichos factores, uno se relaciona con la prueba diagnóstica empleada para la estadificación debido a que, aunque se trata de un estudio histológico, se le incluye dentro de las pruebas diagnósticas consideradas imperfectas.
Dadas estas dificultades, no es sorprendente la falta de consenso sobre la definición de leucemia en el SNC ni que la proporción de pacientes con enfermedad en el SNC en el momento del diagnóstico oscile entre el 1 y el 15% en los estudios, dependiendo de los criterios de evaluación empleados.
Debido a la significancia pronóstica y terapéutica atribuida al compromiso inicial de la LLA en el SNC, es de suma importancia poder contar con la capacidad para identificar con precisión el escaso número de células en el LCR. A pesar de que existen estudios que han demostrado la utilidad de examinar muestras de LCR para determinar las características citoquímicas o de los antígenos de superficie para detectar en forma temprana recaídas en cuanto al SNC, no se cuenta con criterios absolutos para el diagnóstico de infiltración en el SNC y todos los métodos convencionalmente aplicados presentan problemas asociados. La citología puede presentar problemas como la escasa fijación de las células, los artefactos y la consideración de la morfología atípica como evidencia no concluyente de actividad neoplásica, lo cual otros pueden interpretar como evidencia positiva.
De los resultados obtenidos, el más importante es el hallazgo de un mayor número de casos positivos por inmunofenotipo que con la prueba de referencia, es decir, la citología. Esto es un punto importante en cuanto a la prueba diagnóstica, puesto que la sensibilidad de la citometría (con inmunofenotipo) es más alta que la referida en la literatura con respecto a la prueba de referencia. En nuestro estudio, 26 casos padecen la enfermedad conforme a la prueba de referencia, y, en dicho grupo, 6 casos arrojaron resultados negativos conforme al inmunofenotipo por citometría de flujo. En contraste, se detectaron 11 casos en los que el LCR fue negativo, pero que exhibieron positividad a CD10 o TdT, lo cual indica que la citología sola puede no evaluar en forma adecuada la infiltración en el SNC por la LLA.
Algunos estudios han comprobado la superioridad del inmunofenotipo determinado mediante citometría de flujo para la detección de células anormales presentes en el SNC en comparación con la citomorfología; nuestros resultados coinciden con sus hallazgos, con una sensibilidad de la prueba de 76.92. En comparación con otros estudios, la sensibilidad alcanzada por la citometría de flujo se encuentra entre 0.27 y 0.78. A la luz de los resultados consignados en la literatura y los nuestros, consideramos que el estudio del inmunofenotipo en el LCR es una herramienta que debe considerarse en la evaluación del SNC en los pacientes con LLA. Debido a su capacidad para explorar poblaciones celulares a un nivel específico, puede ofrecer un método objetivo y único, puesto que permite combinar diferentes inmunofenotipos. Además, es un método sencillo, rápido y seguro; se puede disponer de los resultados en un lapso inferior a las 3 h y puede ayudar a mejorar la estratificación por pronóstico, además de que puede, incluso, ser un factor que permita reducir costos.
El valor predictivo negativo en nuestro estudio fue de 92.50, lo cual permite lograr una clasificación más adecuada en aquellos pacientes en quienes el líquido muestra presencia de células dudosas o que son clasificadas equivocadamente como positivas y dan lugar a estadificaciones erróneas. Finalmente, al evaluar los cocientes de probabilidad, los resultados de nuestro estudio exhibieron un cociente de probabilidad positivo de 5.94, el cual es aceptable puesto que se estima que cuando los valores son altos la prueba es de buena calidad. Por su lado, el cociente de probabilidad negativa fue de 0.27, lo cual también apoya la prueba dado que el valor es cercano al 0.
Sin embargo, consideramos que una de las principales debilidades que presenta el estudio estriba en que la población celular estudiada es muy amplia desde el punto de vista cuantitativo y en que los porcentajes de inmunofenotipos también lo son. En este estudio no tratamos de evaluar puntos de corte, puesto que existen estudios previos que ya han fijado el porcentaje en 3% con relación a CD10 y TdT. Es necesario incluir pacientes con niveles más bajos de celularidad en el estudio citomorfológico ya que esto permitiría mejorar la evaluación de la prueba examinada. Cuando se evaluó el LCR por medio de la prueba de referencia se encontró mayoritariamente una población celular incrementada que no implica problemas a la hora de la evaluación, puesto que la mayoría de los casos en los que puede existir el problema en cuanto al diagnóstico son aquellos con LCR en que las células son escasas.
6ConclusionesEs necesario incluir la evaluación del LCR de los pacientes con LLA como una prueba paralela con el objeto de incrementar la sensibilidad y efectuar una evaluación correcta del paciente.
En nuestro hospital, el cual es un centro de referencia nacional en el que son tratados pacientes con estas características y que además cuenta con la infraestructura, debe efectuarse en forma rutinaria.
En aquellos centros de tratamiento que no cuentan con la infraestructura necesaria, es conveniente realizar esta prueba en los casos en que se tengan LCR que susciten dudas.