En México, el cáncer y la obesidad infantil son problemas de salud pública. El pronóstico en el cáncer pediátrico ha sido vinculado a la desnutrición pero no a la obesidad, con probabilidades inferiores de supervivencia y superiores de recaída.
ObjetivoEvaluar las repercusiones de la obesidad en el pronóstico de supervivencia y recaída en niños con leucemia linfoblástica aguda (LLA).
Material y métodosIncluimos en una cohorte a niños con LLA. Evaluamos el estado nutricional al diagnóstico, conforme a los valores del IMC en niños, en busca de una asociación de la obesidad y otros factores con la recaída de la enfermedad y la supervivencia mediante curvas de Kaplan-Meier y regresión de Cox.
ResultadosEvaluamos a 161 pacientes, el 70% de ellos con obesidad y del género masculino; de estos, el 43% con LLA de muy alto riesgo. La obesidad incrementó el riesgo de recaída (OR: 3.6; IC del 95%: 1.7-7.6, p=0.001) y de muerte (OR: 3.4; IC del 95%: 1.51-7.48, p=0.002) y limitó la supervivencia a 77 meses a un 52%. Se obtuvo un exp β de 3.35 en la regresión de Cox en el caso de los pacientes con obesidad y leucemia de muy alto riesgo.
DiscusiónLa obesidad influye en el pronóstico de recaída y tiempo de supervivencia debido a un considerable incremento en la toxicidad y a que algunos factores de crecimiento inducen quimiorresistencia en las células neoplásicas. Los factores biológicos que influyen en el pronóstico de la enfermedad no pueden ser modificables; sin embargo, es indispensable establecer políticas de salud encaminadas a un diagnóstico temprano, así como a la prevención de la obesidad y el sobrepeso.
In Mexico, childhood cancer and obesity are public health problems. Malnutrition, but not obesity, has been associated with a lower probability of survival and increased risk of relapse.
ObjectiveTo assess the impact of obesity on the prognosis of survival and relapse in children with Acute Lymphoblastic Leukaemia (ALL).
Material and methodsChildren with ALL were included in a cohort. An assessment was made of the nutritional status at diagnosis, according to BMI values in children, searching for an association of obesity and other factors with disease relapse and survival using Kaplan-Meier curves and Cox regression.
ResultsA total of 161 patients were studied, of which 70% were males with obesity, and of these, 43% had very high risk ALL. Obesity increased the risk for relapse (OR: 3.6; 95% CI: 1.7-7.6, p=.001) and death (OR: 3.4; 95% CI: 1.51-7.48, p=.002), and limited 77-month survival to 52%. An Exp β of 3.35 was obtained in the Cox regression for patients with obesity and a very high risk leukaemia.
DiscussionObesity influences the prognosis of relapse and survival time, due to a considerable increase in toxicity and some growth factors that induce chemoresistance in neoplastic cells. Biological factors influencing the prognosis of the disease may not be modifiable; however, it is essential to establish health policies aimed at early diagnosis, as well as at obesity and overweight prevention.
La leucemia linfoblástica aguda (LLA) es la forma más común de cáncer en niños y es la primera causa de muerte por cáncer infantil1–4. El estado nutricional tiene gran relevancia en los niños con cáncer, debido a que tanto la obesidad como la desnutrición son consideradas factores de mal pronóstico5–11. En México, la prevalencia de obesidad en niños y adolescentes ha aumentado considerablemente12. La obesidad está relacionada con mayor incidencia y mortalidad por diversos tipos de cáncer en adultos13–15. Estudios previos en países desarrollados han demostrado que los niños y adultos obesos con leucemia presentan hasta un 30% más de riesgo de recaída que sus similares no obesos16–19. La obesidad en niños mayores de 10 años se asocia a un incremento en la recaída de la LLA de un 30 a un 50% y a un 35% más de propensión a sufrir un evento adverso grave inducido por medicamentos18,20–23. En países en vías de desarrollo como el nuestro, se ha reportado la influencia de la desnutrición en el pronóstico de los pacientes con LLA pero no de la obesidad9,10. Los mecanismos que condicionan el efecto de la obesidad sobre la LLA son quizás más complejos que solo las diferencias en la farmacocinética entre las personas obesas y las no obesas16. Durante el tratamiento de la LLA, se producen cambios en el estilo de vida, entre los que destaca una disminución en la actividad física que deriva en cambios en la composición corporal total, principalmente debido a un incremento en la proporción de tejido adiposo acumulado16,24. Por otro lado, se han reportado alteraciones endocrinas en pacientes con cáncer relacionadas con el metabolismo de los lípidos. Todo esto puede llevar al organismo a modificar la farmacocinética de los medicamentos antineoplásicos25,26. Estudios in vitro señalan que el exceso de tejido adiposo impide que las células malignas sean destruidas por la quimioterapia mediante diversos mecanismos intracelulares, genéticos y de las vías de comunicación entre la célula neoplásica y la adiposa. Algunos autores señalan que el tejido adiposo puede funcionar como un santuario para las células leucémicas, poniendo en riesgo la eficacia de fármacos como vincristina, L-asparaginasa y daunorrubicina16,26. Esto puede implicar que los fármacos, en realidad, no logren alcanzar la dosis terapéutica y que, en consecuencia, los resultados clínicos no sean los esperados. Además, este efecto de infradosis puede agravarse si se considera que los antineoplásicos generalmente tienen umbrales de dosis para impedir la toxicidad directa. Es decir, si la dosis calculada conforme a la superficie corporal del niño supera este umbral, los médicos no lo rebasan por el riesgo de toxicidad, lo cual suele ser sumamente importante en estos pacientes16,19,22. Conocer a fondo la relación entre el estado nutricional y el pronóstico de la enfermedad es fundamental para cualquier iniciativa encaminada a mejorar los resultados en nuestros pacientes.
Material y métodosSe diseñó un estudio de cohortes en el que se incluyeron los expedientes clínicos de pacientes de 2 a 16 años de edad diagnosticados con LLA, tratados en el periodo de marzo de 1999 a diciembre de 2012. Se excluyó del análisis a aquellos con seguimiento incompleto (abandono del tratamiento, traslado a otra unidad médica). Las variables evaluadas fueron la edad, el género, el estado nutricional mediante el índice de masa corporal (IMC) al momento del diagnóstico, considerando peso normal un IMC de entre 18 y 24.9kg/m2 (IMC entre los percentiles 5 y 85), desnutrición un IMC<18kg/m2 (IMC<percentil 5) y obesidad un IMC≥25kg/m2 (IMC≥ a percentil 95), para el género y la edad de conformidad con las tablas de la OMS27. Se utilizó una estratificación del riesgo de leucemia con base en la edad, la carga leucocitaria, enfermedad extramedular, infiltración al sistema nervioso central (SNC) e inmunofenotipo, de conformidad con los criterios de St. Jude28. Se consideró la presencia de recaída, el tipo de recaída de acuerdo con el tiempo de presentación (temprana o tardía), o con el sitio de recaída (aislada: SNC, médula ósea o testicular; o sistémica). Asimismo, se evaluaron las complicaciones asociadas al tratamiento, de conformidad con las recomendaciones de la OMS29,30, enfatizando el número de episodios de neutropenia febril, sepsis, pancreatitis, alteraciones metabólicas graves y toxicidad hematológica, hepática y renal. Se evaluó la supervivencia global y libre de enfermedad. Para el análisis estadístico, los datos se analizaron con medidas de tendencia central y de dispersión en el caso de las variables que así lo ameritaron. Se utilizó un análisis bivariante para determinar la influencia de la obesidad en el pronóstico de cada paciente. Se consideró influencia significativa una razón de momios (odds ratio [OR]) superior a 1.5 con un intervalo de confianza (IC) del 95% que no incluyera la unidad y se aplicó prueba de la χ2 con prueba exacta de Fisher para las variables que así lo ameritaron. La supervivencia global y libre de enfermedad se determinó por el método de Kaplan-Meier con la aplicación de la prueba de rangos logarítmicos (log-rank test). Se realizó un análisis de regresión de Cox con método de selección progresiva a fin de determinar el peso de la variable principal, así como de las otras variables, en el desenlace de recaída y muerte.
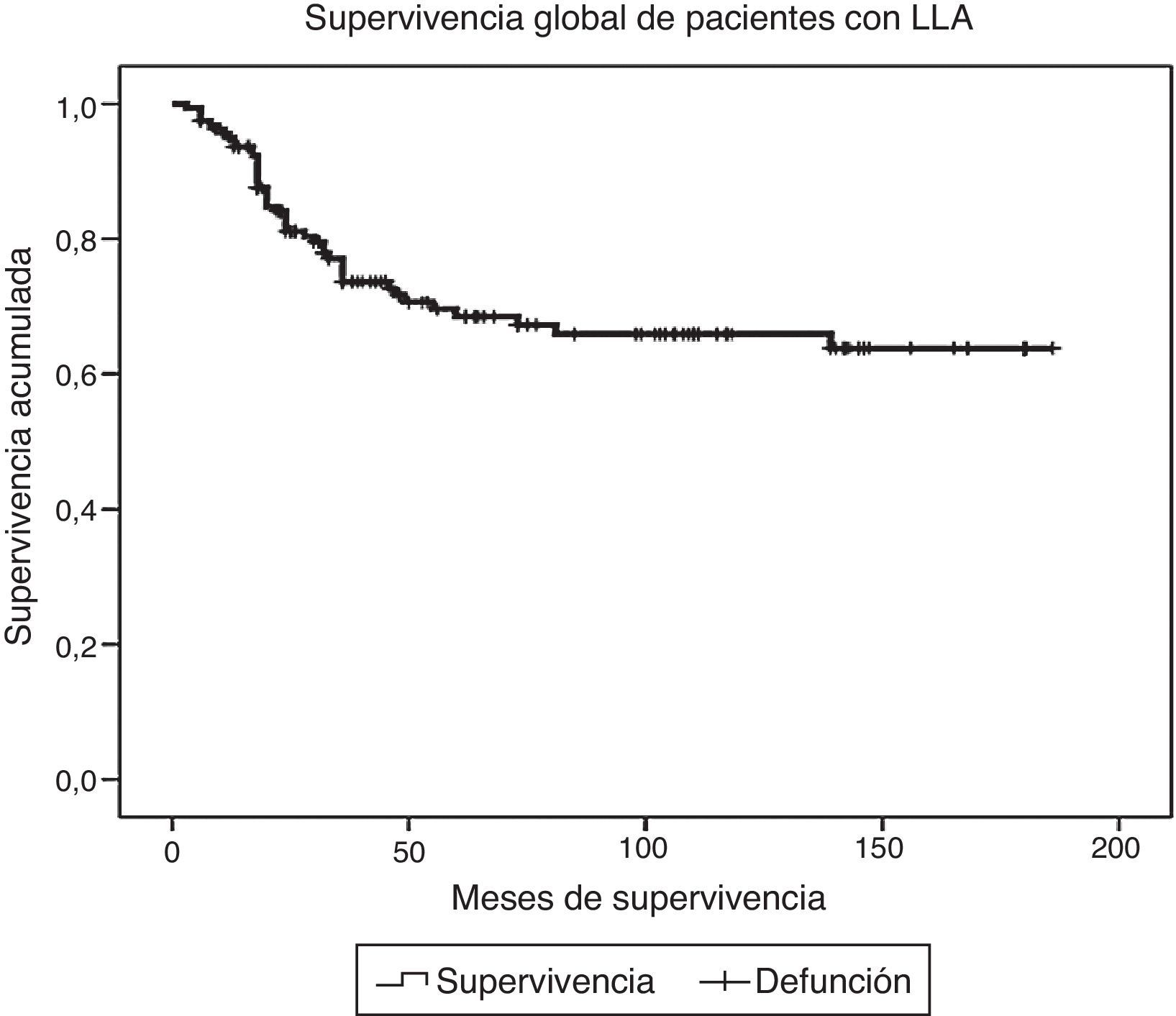
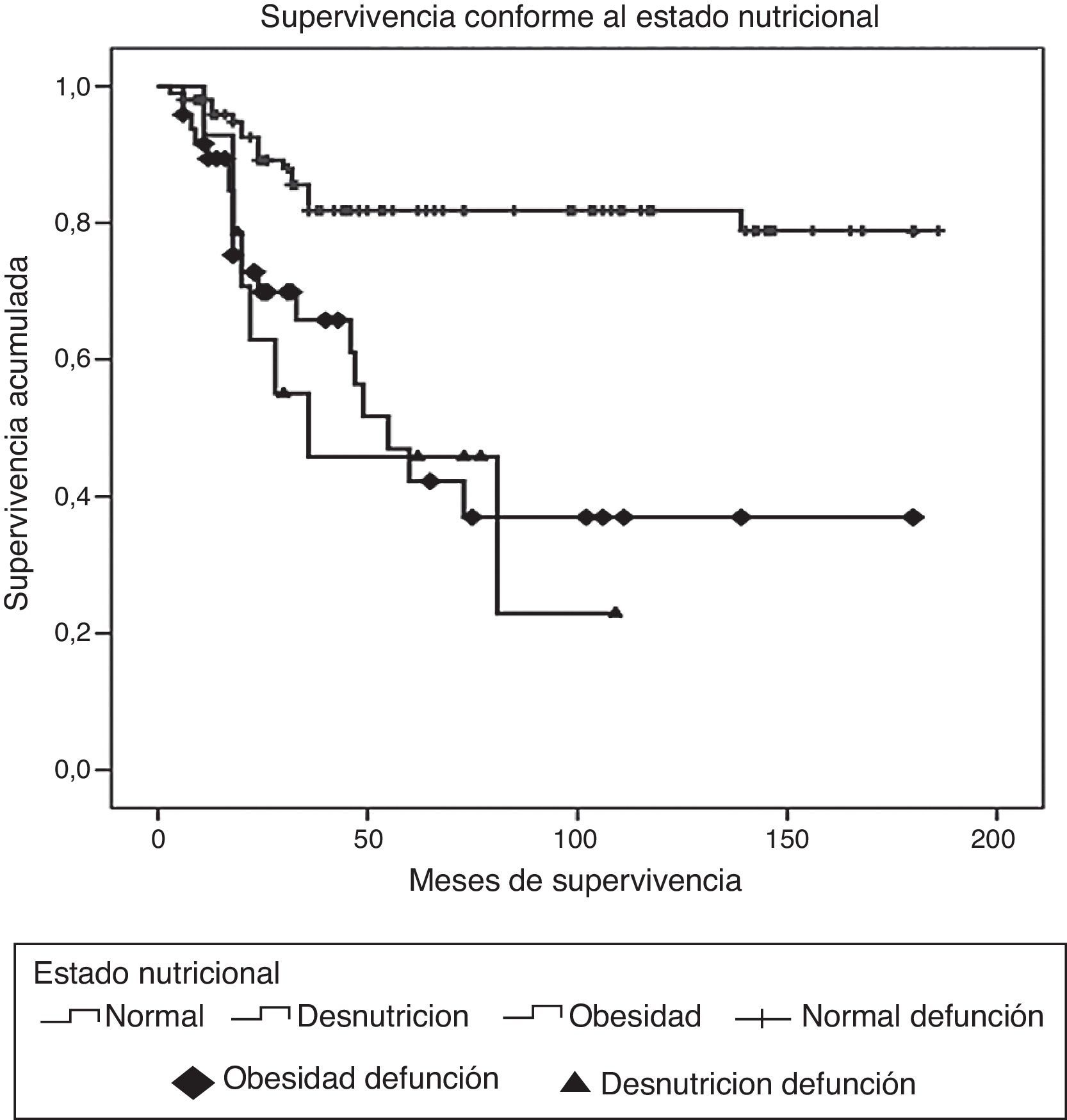
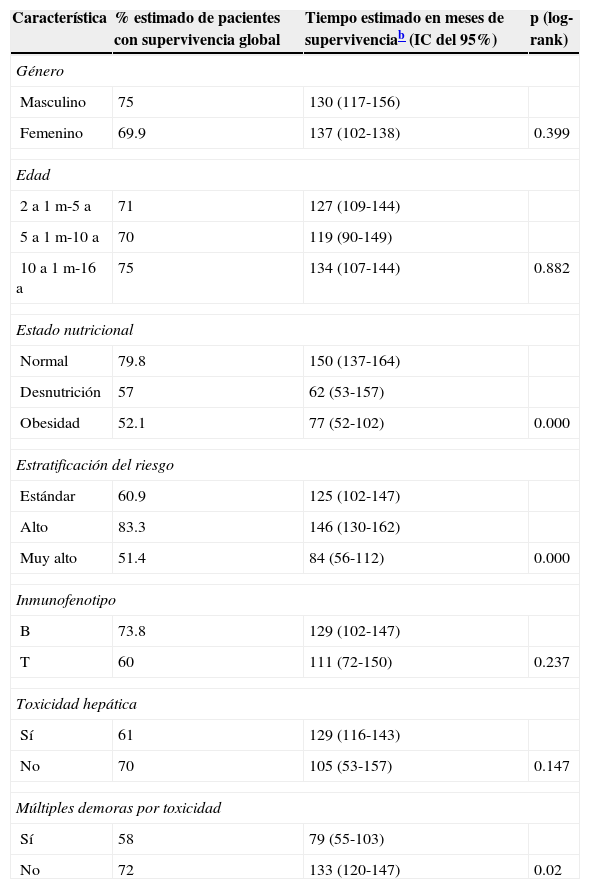
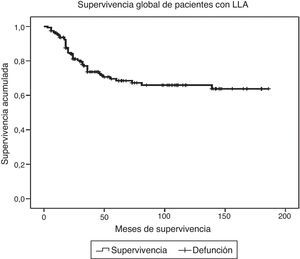
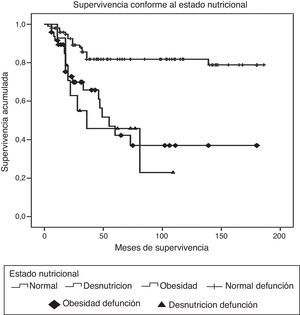
ResultadosDurante el periodo de estudio fueron diagnosticados y tratados 178 pacientes con LLA, 103 del género masculino y 75 del femenino. La edad mínima fue de 2 años y la máxima de 16, con una media de edad de 6.7±4 desviaciones estándar (DE). El estado nutricional al diagnóstico fue normal en el 60%, con algún grado de desnutrición en el 11%, entre los cuales en 10 fue de tipo constitucional; el 29% presentó obesidad y sobrepeso. Estos pacientes fueron estratificados de acuerdo con las características de la enfermedad en riesgo estándar (49; 27%), en alto riesgo (88; 49%) y en muy alto riesgo (41; 23%). El inmunofenotipo fue de células T en el 16% y de estirpe B en el 85%. Diecinueve pacientes cursaron con síndrome de lisis tumoral, de los cuales 10 eran obesos, 4 presentaban desnutrición y 5 eran de peso normal. El tratamiento de inducción a la remisión fue similar en todos los pacientes, con 4 fármacos más quimioterapia intratecal, dependiendo del estado inicial del SNC. Quince pacientes (8.4%) fallecieron tempranamente, 7 de ellos (50%) con desnutrición y 2 (13%) con obesidad. Las causas de defunción temprana fueron infecciosa en 8, metabólica en 2 y hemorrágica en 5 pacientes. En el análisis de supervivencia y recaída conforme al estado nutricional al momento del diagnóstico fueron incluidos 161 pacientes y se observaron los resultados que a continuación se describen. En cuanto al género, el 70% de los pacientes obesos fueron del género masculino, en tanto que el 79% de los pacientes con desnutrición fueron del género femenino. La distribución por grupo de edad mostró que el 37% de los pacientes con obesidad fue menor de 5 años, mientras que el 42% de los pacientes con desnutrición fue mayor de 10 años. De acuerdo con la estratificación de riesgo de LLA, 21 de 48 pacientes (43%) con obesidad tenían características de LLA de muy alto riesgo (hiperleucocitosis, alta carga tumoral) y 16 de alto riesgo; solo 11 fueron estratificados en riesgo estándar (23%). En cuanto al inmunofenotipo, la distribución fue similar a la de los pacientes con peso normal. El tratamiento se administró acorde con el periodo de ingreso: de 1999 a diciembre de 2004 se administraron protocolos del POG para leucemias T y St. Jude XIII para estirpe B de riesgo estándar y alto. A partir de enero de 2005 y hasta 2012, se utilizaron protocolos de St. Jude XV para riesgo estándar y alto, así como BFM90 para leucemias de muy alto riesgo. Observamos las siguientes diferencias en la evolución conforme al estado nutricional: prácticamente todos los pacientes obesos permanecieron con obesidad y 16 pacientes con sobrepeso evolucionaron a obesidad al término del tratamiento. Los pacientes con desnutrición permanecieron en dicho estado nutricional y un 30% de pacientes con peso normal evolucionó a obesidad al final del tratamiento. Evaluamos la influencia del estado nutricional en la toxicidad a órganos y sistemas, y observamos lo siguiente: 18 de 48 pacientes obesos presentaron transaminasemia en múltiples ocasiones, atribuida inicialmente a toxicidad por metotrexato, lo cual derivó en una demora en la administración de la quimioterapia, incluso desde la inducción a la remisión. A un paciente se le realizó una biopsia de hígado debido a que, además, presentó datos de disfunción hepática en distintas ocasiones; el estudio histopatológico reportó hígado graso. Un total de 20 de 48 pacientes obesos presentaron alteraciones metabólicas: 14 exhibieron hiperglucemia inducida por esteroides, una paciente comenzó con diabetes insulinodependiente durante la inducción y 8 pacientes desarrollaron síndrome metabólico que ameritó el uso de medicamentos para lograr el control metabólico durante todo el tratamiento. La toxicidad hematológica se asoció a toxicidad hepática persistente en 9 pacientes y dicha asociación fue estadísticamente significativa en la prueba de la χ2 con una p=0.01. El 55% de los pacientes con obesidad presentó 5 o más episodios de neutropenia febril que ameritaron hospitalización, así como el 58% de los pacientes con desnutrición, en comparación con el 23% de los pacientes con peso normal. No se observaron diferencias significativas en cuanto a la incidencia de pancreatitis en relación con el estado nutricional (15, 21 y 14%, respectivamente, para peso normal, desnutrición y obesidad). Asimismo, 20 de los 48 pacientes obesos presentaron múltiples demoras en el tratamiento debido a algún tipo de toxicidad (hepática y hematológica, principalmente) y requirieron reducción de la dosis de la quimioterapia hepatotóxica (metotrexato y mercaptopurina principalmente), en comparación con el 8 y 28% de los pacientes con peso normal y desnutrición, respectivamente. En la tabla 1 se muestran las características de la población conforme a su estado nutricional. La recaída se presentó en 49 casos, de los cuales 23 (46%) eran obesos vs. 20% de pacientes con desnutrición. El sitio más frecuente de recaída fue el SNC en 18 pacientes, la médula ósea en 26 (13 de ellos obesos), los testículos en 2 y sistémica en 3. En 10 pacientes obesos, la recaída se presentó tardíamente en la médula ósea y en forma temprana en 13. Al analizar los factores de riesgo de recaída observamos que la edad, el género, el inmunofenotipo y la toxicidad hepática no se relacionaron con la presencia de recaída; sin embargo, el estado nutricional mostró que tanto la desnutrición como la obesidad se asociaron a una mayor frecuencia de recaídas: el 20% en los pacientes con peso normal vs. el 42% en aquellos con desnutrición. El riesgo de recaída en los pacientes con obesidad fue de OR=3.6. (IC del 95%: 1.71-7.68, p=0.001). También observamos que los pacientes con más de 5 episodios de toxicidad hematológica presentaron mayor riesgo de recaída (OR=3.68; IC del 95%: 1.9-7, p<0.005). En la tabla 2 se muestran los resultados del análisis bivariante de recaída. La supervivencia en los pacientes con recaída fue del 30.6% a 26 meses (IC del 95%: 22-30) vs. 90% a 167 meses (156-177%) p < 0.001. Durante el periodo de estudio fallecieron 45 pacientes, de los cuales el 7.9% presentaba algún grado de desnutrición y el 37% mantenía un peso dentro de límites normales. La obesidad se asoció significativamente a un mayor riesgo de muerte: 41% (OR=3.4; IC de 95%: 1.58-7.48, p < 0.005). Las causas de muerte en los pacientes obesos fueron infección en 6 de 12 pacientes, hemorragia en 1 de 3 y progresión de la enfermedad en 13 de 30. Al analizar el tiempo de supervivencia mediante el método de Kaplan-Meier se obtuvieron los siguientes resultados: se estimó una supervivencia global para todos los pacientes del 72% a 131 meses (IC del 95%: 118-144) y una supervivencia libre de enfermedad del 69.6% a 127 meses (IC del 95%: 114-140) (fig. 1). Al evaluar los factores que influyeron en el periodo de supervivencia, observamos que el género, la edad, la toxicidad hepática por sí misma y el inmunofenotipo no mostraron diferencias estadísticamente significativas, en tanto que los pacientes con características de muy alto riesgo experimentaron índices más bajos de supervivencia. Al evaluar la influencia del estado nutricional en la supervivencia, observamos que tanto la desnutrición como la obesidad condicionaron índices más bajos de supervivencia: 52% a 77 meses (IC del 95%: 52-108) en los pacientes obesos, 57.1% a 62 meses (IC del 95%: 38-86) en los pacientes con desnutrición y 79.8% a 150 meses (IC del 95%: 137-169) en aquellos que mantuvieron su peso normal, siendo la diferencia estadísticamente significativa al aplicar la prueba de log-rank (p=0.000). En cuanto al número de episodios de toxicidad hematológica y demora en la administración de la quimioterapia, se observó que los pacientes con más de 5 episodios de toxicidad presentaron una supervivencia del 58% a 79 meses vs. el 72% a 133 meses en aquellos con menos de 5 episodios; estos resultados se muestran en la tabla 3. Finalmente, se efectuó un análisis de regresión de Cox con el método de cociente de verosimilitudes con selección progresiva con la intención de determinar el peso de cada una de las variables en el tiempo de supervivencia, observando un coeficiente exp β de 2.25 (IC del 95%: 0.76 a 5.58, p=0.152) para la obesidad por sí sola, y de 3.35 (IC del 95%: 1.52-7.37, p < 0.005) en los pacientes con obesidad más leucemia de muy alto riesgo (fig. 2).
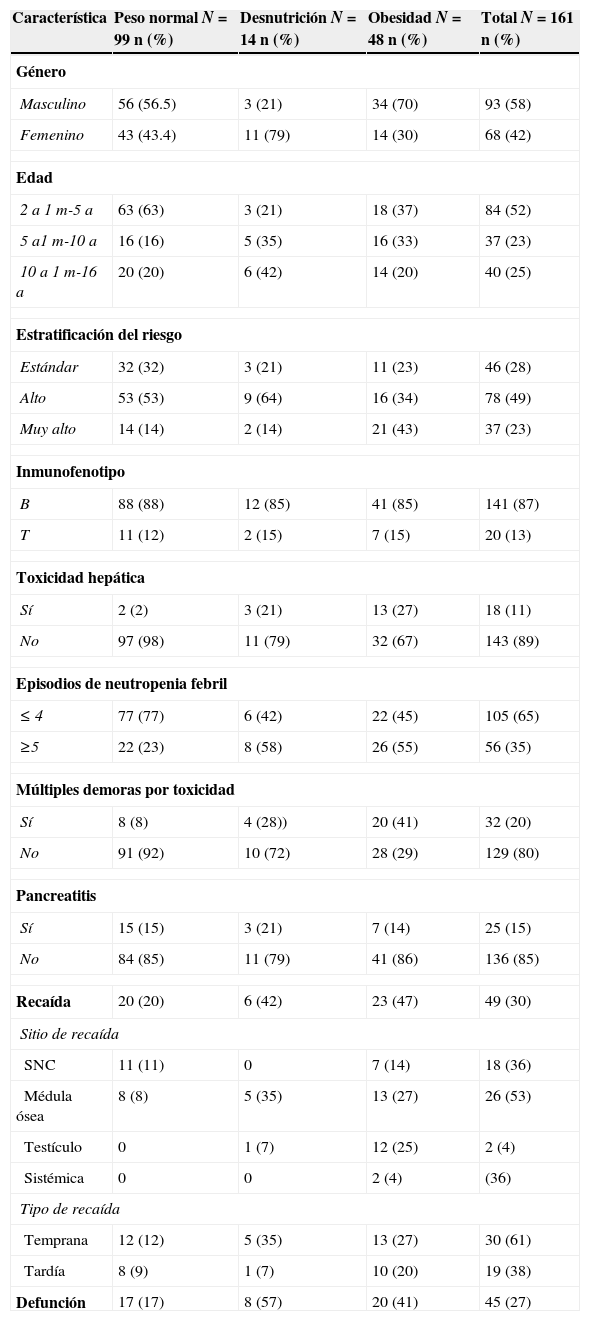
Características de pacientes tratados con leucemia linfoblástica aguda y su relación con el estado nutricional al diagnóstico*
| Característica | Peso normal N=99 n (%) | Desnutrición N=14 n (%) | Obesidad N=48 n (%) | Total N=161 n (%) |
|---|---|---|---|---|
| Género | ||||
| Masculino | 56 (56.5) | 3 (21) | 34 (70) | 93 (58) |
| Femenino | 43 (43.4) | 11 (79) | 14 (30) | 68 (42) |
| Edad | ||||
| 2 a 1 m-5 a | 63 (63) | 3 (21) | 18 (37) | 84 (52) |
| 5 a1 m-10 a | 16 (16) | 5 (35) | 16 (33) | 37 (23) |
| 10 a 1 m-16 a | 20 (20) | 6 (42) | 14 (20) | 40 (25) |
| Estratificación del riesgo | ||||
| Estándar | 32 (32) | 3 (21) | 11 (23) | 46 (28) |
| Alto | 53 (53) | 9 (64) | 16 (34) | 78 (49) |
| Muy alto | 14 (14) | 2 (14) | 21 (43) | 37 (23) |
| Inmunofenotipo | ||||
| B | 88 (88) | 12 (85) | 41 (85) | 141 (87) |
| T | 11 (12) | 2 (15) | 7 (15) | 20 (13) |
| Toxicidad hepática | ||||
| Sí | 2 (2) | 3 (21) | 13 (27) | 18 (11) |
| No | 97 (98) | 11 (79) | 32 (67) | 143 (89) |
| Episodios de neutropenia febril | ||||
| ≤ 4 | 77 (77) | 6 (42) | 22 (45) | 105 (65) |
| ≥5 | 22 (23) | 8 (58) | 26 (55) | 56 (35) |
| Múltiples demoras por toxicidad | ||||
| Sí | 8 (8) | 4 (28)) | 20 (41) | 32 (20) |
| No | 91 (92) | 10 (72) | 28 (29) | 129 (80) |
| Pancreatitis | ||||
| Sí | 15 (15) | 3 (21) | 7 (14) | 25 (15) |
| No | 84 (85) | 11 (79) | 41 (86) | 136 (85) |
| Recaída | 20 (20) | 6 (42) | 23 (47) | 49 (30) |
| Sitio de recaída | ||||
| SNC | 11 (11) | 0 | 7 (14) | 18 (36) |
| Médula ósea | 8 (8) | 5 (35) | 13 (27) | 26 (53) |
| Testículo | 0 | 1 (7) | 12 (25) | 2 (4) |
| Sistémica | 0 | 0 | 2 (4) | (36) |
| Tipo de recaída | ||||
| Temprana | 12 (12) | 5 (35) | 13 (27) | 30 (61) |
| Tardía | 8 (9) | 1 (7) | 10 (20) | 19 (38) |
| Defunción | 17 (17) | 8 (57) | 20 (41) | 45 (27) |
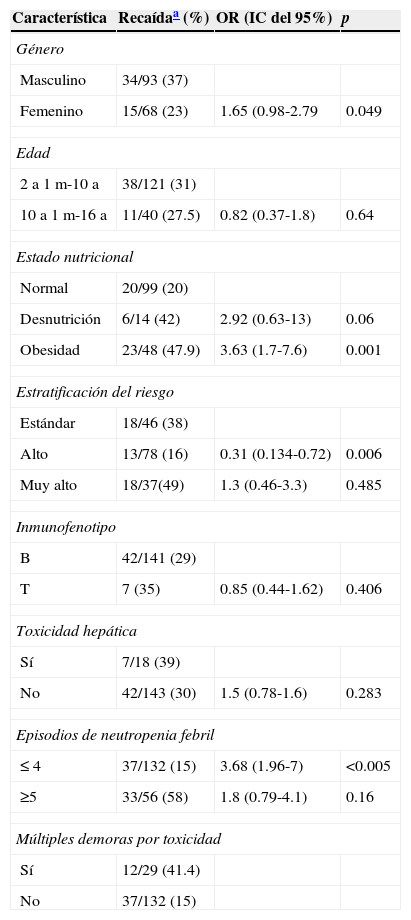
Factores relacionados con presencia de recaída
| Característica | Recaídaa (%) | OR (IC del 95%) | p |
|---|---|---|---|
| Género | |||
| Masculino | 34/93 (37) | ||
| Femenino | 15/68 (23) | 1.65 (0.98-2.79 | 0.049 |
| Edad | |||
| 2 a 1 m-10 a | 38/121 (31) | ||
| 10 a 1 m-16 a | 11/40 (27.5) | 0.82 (0.37-1.8) | 0.64 |
| Estado nutricional | |||
| Normal | 20/99 (20) | ||
| Desnutrición | 6/14 (42) | 2.92 (0.63-13) | 0.06 |
| Obesidad | 23/48 (47.9) | 3.63 (1.7-7.6) | 0.001 |
| Estratificación del riesgo | |||
| Estándar | 18/46 (38) | ||
| Alto | 13/78 (16) | 0.31 (0.134-0.72) | 0.006 |
| Muy alto | 18/37(49) | 1.3 (0.46-3.3) | 0.485 |
| Inmunofenotipo | |||
| B | 42/141 (29) | ||
| T | 7 (35) | 0.85 (0.44-1.62) | 0.406 |
| Toxicidad hepática | |||
| Sí | 7/18 (39) | ||
| No | 42/143 (30) | 1.5 (0.78-1.6) | 0.283 |
| Episodios de neutropenia febril | |||
| ≤ 4 | 37/132 (15) | 3.68 (1.96-7) | <0.005 |
| ≥5 | 33/56 (58) | 1.8 (0.79-4.1) | 0.16 |
| Múltiples demoras por toxicidad | |||
| Sí | 12/29 (41.4) | ||
| No | 37/132 (15) | ||
Factores relacionados con el tiempo de supervivencia en pacientes con leucemia linfoblástica agudaa
| Característica | % estimado de pacientes con supervivencia global | Tiempo estimado en meses de supervivenciab (IC del 95%) | p (log-rank) |
|---|---|---|---|
| Género | |||
| Masculino | 75 | 130 (117-156) | |
| Femenino | 69.9 | 137 (102-138) | 0.399 |
| Edad | |||
| 2 a 1 m-5 a | 71 | 127 (109-144) | |
| 5 a 1 m-10 a | 70 | 119 (90-149) | |
| 10 a 1 m-16 a | 75 | 134 (107-144) | 0.882 |
| Estado nutricional | |||
| Normal | 79.8 | 150 (137-164) | |
| Desnutrición | 57 | 62 (53-157) | |
| Obesidad | 52.1 | 77 (52-102) | 0.000 |
| Estratificación del riesgo | |||
| Estándar | 60.9 | 125 (102-147) | |
| Alto | 83.3 | 146 (130-162) | |
| Muy alto | 51.4 | 84 (56-112) | 0.000 |
| Inmunofenotipo | |||
| B | 73.8 | 129 (102-147) | |
| T | 60 | 111 (72-150) | 0.237 |
| Toxicidad hepática | |||
| Sí | 61 | 129 (116-143) | |
| No | 70 | 105 (53-157) | 0.147 |
| Múltiples demoras por toxicidad | |||
| Sí | 58 | 79 (55-103) | |
| No | 72 | 133 (120-147) | 0.02 |
La población en el presente estudio es limitada; sin embargo, el seguimiento prolongado de los pacientes permite hacer algunas inferencias en lo que a factores relacionados con el pronóstico se refiere. Nuestros pacientes no presentan una enfermedad biológicamente distinta a la de otros lugares del país y de otros países; sin embargo, sus condiciones son diferentes. En México, tanto el cáncer como la obesidad infantil son un problema de salud pública; el diagnóstico de LLA se establece tardíamente y la magnitud de la enfermedad obliga a estratificar en riesgo alto y muy alto, lo cual agrava el pronóstico a corto, mediano y largo plazo9,10,12. Los factores relacionados con el pronóstico han sido estudiados en nuestro medio y se ha demostrado la asociación entre factores socioeconómicos y la desnutrición y una mayor incidencia de muerte e índices más bajos de supervivencia; sin embargo, no se ha reportado la influencia de la obesidad en estos desenlaces7–10,12. En el presente estudio se destacan las repercusiones del estado nutricional en el pronóstico de recaída y tiempo de supervivencia, puesto que tanto en los pacientes con obesidad como en aquellos con desnutrición se incrementó el riesgo de recaída y disminuyó la supervivencia a largo plazo. Es posible que estos desenlaces estén relacionados con un incremento en la toxicidad del tratamiento, lo cual puede derivar en índices más elevados de morbilidad, demoras en la administración de la medicación y, consecuentemente, en un mayor número de recaídas, lo cual, además, indica desarrollo de resistencia de la neoplasia a los fármacos antineoplásicos, lo cual a su vez explica por qué la principal causa de muerte es la progresión de la enfermedad. Estudios previos realizados en Norteamérica en relación con la modificación del peso corporal en pacientes hispanos con LLA reportan que estos tienden a ver su IMC incrementado, independientemente del peso que presentaran al momento del diagnóstico, lo cual puede estar relacionado con una disminución importante de la actividad física y con el uso prolongado de esteroides, así como con factores genéticos raciales y malos hábitos de alimentación16–20. En nuestro estudio, el paciente con obesidad y sobrepeso al momento del diagnóstico persistió con obesidad hasta el momento de su desenlace. Asimismo, los pacientes con un estado nutricional normal evolucionaron hacia la obesidad durante el tratamiento. La obesidad por sí misma implica un estado de comorbilidad, probablemente asociada a la farmacocinética de algunos antineoplásicos lipofílicos como las antraciclinas y hepatotóxicos como metotrexato y mercaptopurina. Por otro lado, el hígado graso es una complicación de la obesidad que puede contribuir a incrementar la hepatotoxicidad17,22,23,31,32. En el presente estudio observamos que el paciente con obesidad y sobrepeso no solo presenta índices más elevados de mortalidad que el paciente con peso normal, sino que el intervalo de supervivencia se ve influido por la presencia de dichos factores, como lo reporta Butturini22. El pronóstico en los pacientes con LLA está relacionado con factores biológicos y genéticos que no son modificables2,4,6,8. No obstante, es prioritario implementar estrategias y políticas de salud encaminadas tanto al diagnóstico oportuno del cáncer como a la prevención y tratamiento de la obesidad infantil, dada la comorbilidad que representa no solo durante el tratamiento sino durante la vida adulta en aquellos que sobreviven. Es de vital importancia efectuar estudios de farmacocinética de los medicamentos antineoplásicos en nuestra población a fin de individualizar el tratamiento en los pacientes obesos y con sobrepeso, con el objeto de establecer dosis óptimas que permitan obtener el mejor resultado con la menor toxicidad posible y, por ende, disminuir la incidencia de recaídas y muerte e incrementar la supervivencia. Se ha demostrado una relación inversa entre el peso y los niveles plasmáticos de mercaptopurina y dactinomicina, así como una relación opuesta en el caso de las antraciclinas y busulfán33–36. Estudios recientes señalan la existencia de una relación compleja entre el cáncer y la obesidad, dado que factores de crecimiento como el factor de crecimiento seudoinsulínico-1, la leptina 24 y las interleucinas 6 y 8, así como el factor de crecimiento del endotelio vascular, son secretados directamente por las células adiposas y en los pacientes con síndrome metabólico pueden alterar el efecto y la toxicidad de la quimioterapia al incrementar la inflamación, la oxidación y la angiogénesis. Por otro lado, la hiperglucemia y los niveles elevados de insulina se han asociado a resistencia neoplásica en el cáncer de mama y la leucemia37. Esto podría explicar por qué en nuestro estudio observamos una carga leucocitaria y tumoral elevada en los pacientes obesos. Dado que la obesidad es ya endémica en nuestro medio, se requiere urgentemente del diseño de tratamientos individualizados basados en la farmacocinética de la quimioterapia que permitan administrar dosis óptimas para cada paciente en función de su estado nutricional, a fin de mejorar el pronóstico y disminuir la toxicidad, así como los costos relacionados con la atención y, además, mejorar la calidad de vida.
ConclusionesEn México, el cáncer y la obesidad infantil son problemas de salud pública, y la obesidad puede limitar el tiempo de supervivencia de los pacientes con LLA. Los factores biológicos no son modificables y se requieren con carácter urgente campañas dirigidas no solo a prevenir, sino también a tratar la obesidad infantil, así como estudios de farmacocinética en este tipo de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.