Introducción: Los tumores germinales de testículo representan el tumor sólido más frecuente en hombres entre los 20-35 años de edad. Es un modelo de neoplasia curable. Con el acceso al tratamiento adecuado se puede lograr alta tasa de curación aún en pacientes con enfermedad avanzada. Desafortunadamente, no todos los pacientes con esta enfermedad tienen acceso al tratamiento por dificultades económicas comprometiendo la oportunidad de curación.
Objetivo: Evaluar el impacto que tiene sobre el éxito del tratamiento, el apoyo por parte de Organizaciones No Gubernamentales en los pacientes con tumores germinales de testículo.
Resultados: Se incluyeron 100 pacientes con tumores germinales de testículo, de los cuales 96 fueron evaluables para los resultados (55 seminomas y 51 no seminomas). La adherencia terapéutica fue excelente. Únicamente el 3% de pacientes abandonaron su tratamiento en comparación con el 20%-30% que habitualmente lo hace en nuestra Institución por falta de recursos económicos. La supervivencia para el grupo total fue de 97%, 94%, 89% a 24, 36 y 48 meses, respectivamente.
Conclusiones: Con el apoyo para el tratamiento, la mayoría de los pacientes con tumores germinales de testículo pueden recibir el tratamiento adecuado, logrando alta tasa de curación aún en enfermedad avanzada, con la oportunidad de reintegrarlos a la vida económicamente activa y productiva de la sociedad.
Introduction: Germ cell tumors of testis are the most common solid tumors in men 20 to 35 years of age. It is considered a model of curable malignancy. With the access to the treatment, germ-cell tumors are curable even in the presence of metastatic disease. Unfortunately, many patients do not have the opportunity to receive any treatment because of personal economic problems compromising their curability.
Objective: To evaluate the impact of Non-Governmental Organizations support in the success of treatment in patients with testicular germ-cell tumors.
Results: One hundred patients with testicular germ-cell tumors were included; and 96 were evaluated (55 seminomas and 51 nonseminomas). The adherence was excellent. Only 3% of patients abandoned their treatment. This compare favorably with 20%-30% of patients usually abandon the treatment at our institution. The overall survival in the total group was 97%, 94%, and 89% at 24, 36, and 48 months respectively.
Conclusions: With appropriate and sufficient support, most patients could receive their treatment with high rates of curability even in disseminated disease.
Introducción
De los tumores primarios de testículo, aproximadamente el 95% se originan de las células germinales. Los tumores de células germinales son poco frecuentes constituyendo aproximadamente el 2% de todos los tumores que se presentan en el hombre. Sin embargo, es el tumor sólido más común en hombres entre los 20 y 35 años de edad1. Su incidencia va en aumento en algunos países. En Estados Unidos se calculan aproximadamente 8,000 nuevos casos detectados anualmente2. Se considera un modelo de neoplasia altamente curable aún en presencia de enfermedad avanzada. Es importante el progreso que se ha realizado en el tratamiento de los tumores germinales en la enfermedad avanzada con un sustancial incremento en la tasa de curación, de aproximadamente 25% a mediados de los años setenta, a más del 80% en la actualidad1,3-5. Esta tasa de curación se debe a la efectividad de la quimioterapia desde la introducción del cisplatino y a los avances en la cirugía. Ningún otro tumor sólido en etapas avanzadas tiene estos resultados.
La importancia de los tumores germinales radica precisamente en estos 2 aspectos; por un lado, es el tumor sólido más frecuente en individuos en etapas de la vida altamente productiva y en segundo, la probabilidad de curarlos y reintegrarlos a la vida productiva del país. El éxito depende en no retrasar el diagnóstico y en conducir adecuadamente el tratamiento.
El acceso a los tratamientos es un problema serio en algunos sistemas de salud que compromete la curación de los pacientes. El abandono del tratamiento por falta de recursos económicos se presenta en alto porcentaje aún en pacientes con tumores germinales de testículo, impidiendo así su curación. Ésta ha sido una dificultad mayúscula en nuestro Instituto durante muchos años, teniendo que recurrir a diferentes instancias para buscar apoyo que permita a los pacientes someterse a los tratamientos adecuados. Desafortunadamente, no siempre se consiguen los recursos necesarios disminuyendo la probabilidad de curación en estos pacientes.
El presente, es un estudio piloto que evalúa el impacto en los resultados de la adherencia terapéutica y la efectividad del tratamiento en pacientes con tumores germinales de testículo, incluidos en un programa de apoyo para su tratamiento por parte de Organizaciones No Gubernamentales.
Material y método
Se incluyeron 100 pacientes con diagnóstico de tumor de células germinales primario de testículo, tanto seminomas como no seminomas, cualquier etapa clínica, sin tratamiento previo. Con función hematológica, renal y hepática normales. Todos los pacientes firmaron consentimiento informado. Como tratamiento inicial se realizó orquiectomía radical del testículo afectado. La evaluación previa a la administración de quimioterapia incluyó examen físico; determinaciones de biometría hemática, química sanguínea, electrolitos séricos, pruebas de funcionamiento hepático, marcadores tumorales séricos (alfa-fetoproteína [AFP], fracción beta de gonadotrofina coriónica [FBGC], deshidrogenasa láctica [DHL]), así como radiografía de tórax, tomografía axial computarizada (TAC) de abdomen y pelvis. La TAC de tórax en caso de sospecha de metástasis pulmonares e imagen por resonancia magnética de cerebro en caso de sospecha de metástasis cerebrales. Se dio consejo a cerca de banco de semen.
Los pacientes con seminoma etapa clínica I se sometieron a quimioterapia adyuvante, con 1-2 ciclos de carboplatino a dosis de área bajo la curva (AUC) de 7. Los pacientes con seminoma metastásico, recibieron quimioterapia con esquema estándar de EP (etopósido y cisplatino), 4 ciclos administrados cada 3 semanas. Al finalizar el tratamiento con quimioterapia, se realizó TAC de los sitios afectados. Los pacientes con residual mayor de 3 cm posterior a la administración de quimioterapia, se sometieron a radioterapia.
Los pacientes con tumores no seminomatosos etapa clínica I se vigilaron posterior a la orquiectomía y únicamente en caso de recaída, se ofreció quimioterapia con esquema estándar de BEP (bleomicina, etopósido y cisplatino) 3-4 ciclos, administrados cada 3 semanas, de acuerdo al grupo de riesgo de la clasificación internacional en el momento de la recurrencia.
Los pacientes con tumores no seminomatosos metastásicos se sometieron a 3-4 ciclos de quimioterapia con esquema estándar de BEP, dependiendo del grupo de riesgo de acuerdo a la clasificación internacional. Durante el tratamiento la evaluación incluyó examen físico, determinaciones de biometría hemática, química sanguínea, AFP, FBGC, DHL previa a la administración de cada ciclo. Al final del tratamiento se realizó TAC. Los pacientes con tumores no seminomatosos que quedaron con lesiones residuales después de la administración de quimioterapia se sometieron a resección de las mismas. Los pacientes cuya resección completa mostró tumor viable residual en cualquier sitio, se sometieron a 2 ciclos de quimioterapia a base de TIP (paclitaxel, ifosfamida y cisplatino), a dosis estándar. Aquellos cuya resección de residual fue teratoma, ya no recibieron más quimioterapia.
La respuesta fue clasificada de la siguiente forma: Respuesta completa a quimioterapia: desaparición clínica, radiológica y bioquímica de toda evidencia de enfermedad o cuando todas las lesiones residuales, posterior a la quimioterapia sean resecadas y muestren necrosis, fibrosis o teratoma maduro.
Respuesta completa a quimioterapia más cirugía: respuesta bioquímica con marcadores tumorales negativos y resección de las lesiones residuales, posterior a la quimioterapia pero con tumor viable histológicamente.
Respuesta parcial con marcadores tumorales negativos: marcadores tumorales negativos pero con evidencia radiológica de enfermedad no resecable.
Progresión de la enfermedad: toda evidencia de progresión bioquímica o por imagen de la enfermedad.
El análisis de los datos se llevó a cabo con el paquete estadístico SPSS® versión 17.0. La descripción de la población fue mediante frecuencias y porcentajes. La supervivencia fue analizada mediante el método de Kaplan-Meier tomando en cuenta desde la fecha de la orquiectomía.
Resultados
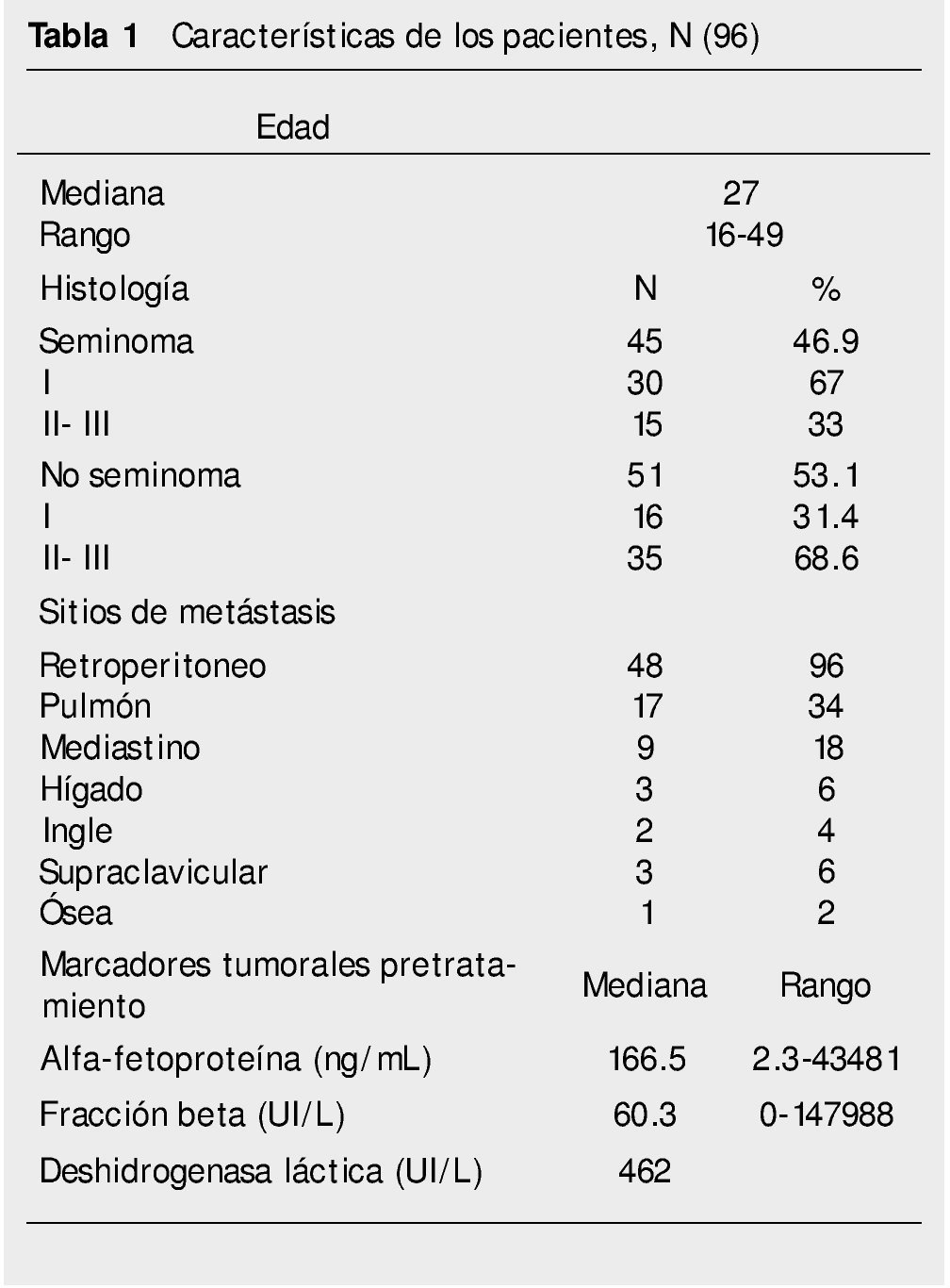
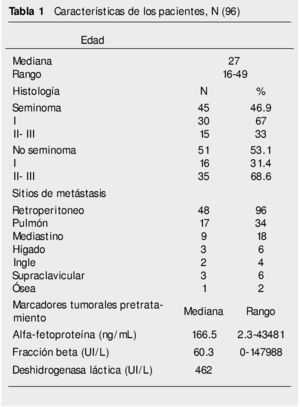
Se incluyeron 100 pacientes, del 14 de enero del 2010 al 02 de abril del 2011. Dos se excluyeron por no haber terminado tratamiento, otro se retiró del estudio y uno más por falla de escrutinio. Para el análisis se tomaron en cuenta 96 pacientes. En la tabla 1 se pueden apreciar las características clínicas de los pacientes. La mediana de edad fue de 27 años (rango 16-49 años). La mediana de seguimiento fue de 32 meses (rango 8-49 meses). Fueron 45 pacientes con tumores seminomas y 51 no seminomas. Los sitios más frecuentes de metástasis fueron retroperitoneo seguido de pulmón. La mediana de los niveles séricos de AFP fue de 166.5 ng/mL (rango 2.3-43,481), FBGC 60.3 UI/L (rango 0-147,988) y DHL 462 UI/L (rango 120-2,659).
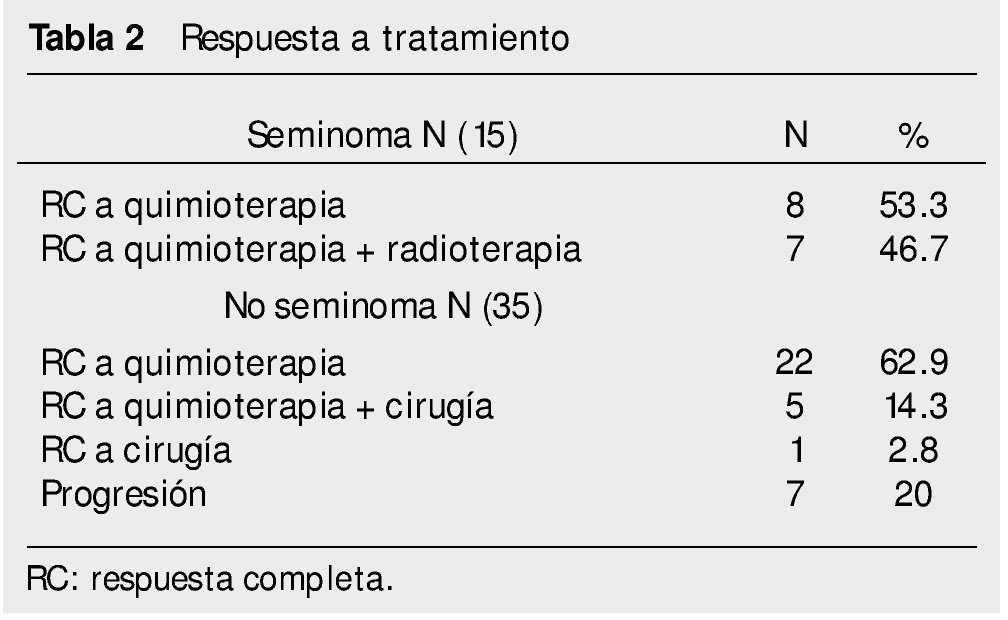
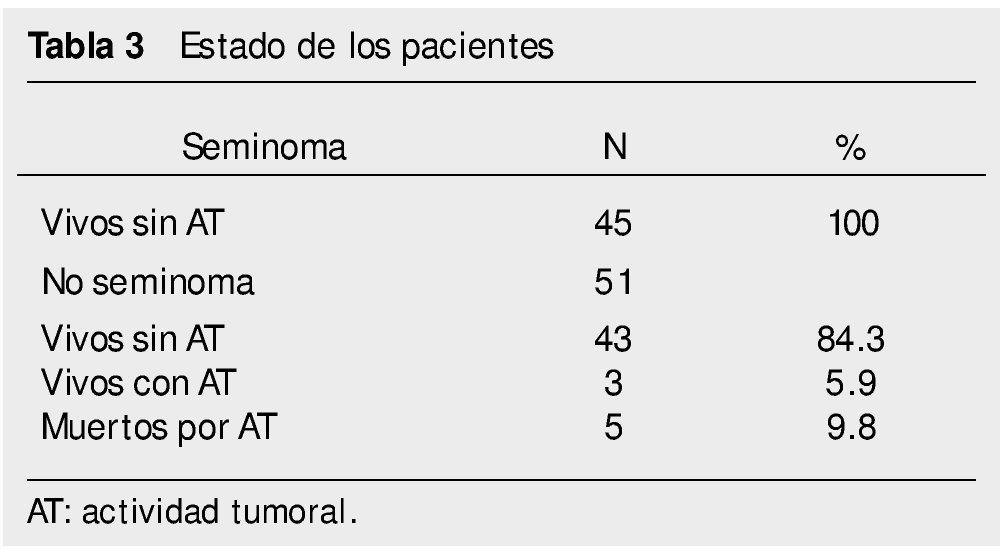
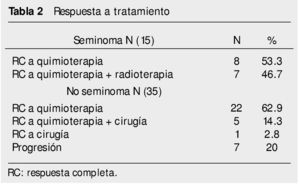
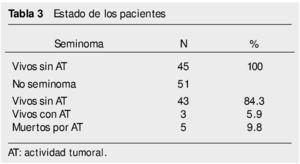
• Seminomas. Treinta pacientes estaban en etapa clínica I. Recibieron tratamiento con quimioterapia a base de un ciclo o 2 de carboplatino. Ninguno ha recaído y todos están vivos. Los seminomas metastásicos fueron en 15 pacientes. Se sometieron a 4 ciclos de quimioterapia con EP. De ellos, 8 tuvieron respuesta completa a quimioterapia. En 7 pacientes fue necesario tratamiento con radioterapia posterior a los 4 ciclos de EP por persistencia tumoral (tabla 2). Todos ellos alcanzaron respuesta completa posterior a la radioterapia. Un paciente que alcanzó respuesta completa con quimioterapia, recayó a los 5 meses en retroperitoneo. Se administró radioterapia como tratamiento de salvamento, alcanzando respuesta completa. Todos los pacientes están vivos (tabla 3).
• No seminomas. De estos pacientes, 16 fueron etapa clínica I y no recibieron tratamiento adyuvante. De ellos, recayeron 2 pacientes a los 24 y 29 meses de vigilancia. El primero recayó en pelvis y el segundo en retroperitoneo. Ambos recibieron quimioterapia con BEP alcanzado respuesta completa. Todos permanecen vivos sin datos de actividad tumoral. Treinta y cinco pacientes con tumores no seminomatosos se presentaron con enfermedad metastásica. Uno de ellos, con metástasis única en pulmón y márgenes tumorales negativos, se sometió a resección de la lesión con resultado histológico de teratoma maduro, por lo que no se administró quimioterapia. Los otros 34 pacientes recibieron quimioterapia con BEP. Veintidós tuvieron respuesta completa a quimioterapia; 5 respuesta completa a quimioterapia más cirugía; 7 pacientes con enfermedad estable o progresión (tablas 2 y 3). De los pacientes que progresaron, 4 fallecieron por actividad tumoral y 3 están vivos con actividad tumoral. De los pacientes que alcanzaron respuesta completa, 4 recayeron a los 7, 8, 14 y 17 meses de vigilancia. De estos, uno se rescató con quimioterapia de segunda línea con TIP, y 2 con pura cirugía cuyo resultado histológico de la lesión fue teratoma maduro; el otro paciente no logró rescatarse y falleció por actividad tumoral.
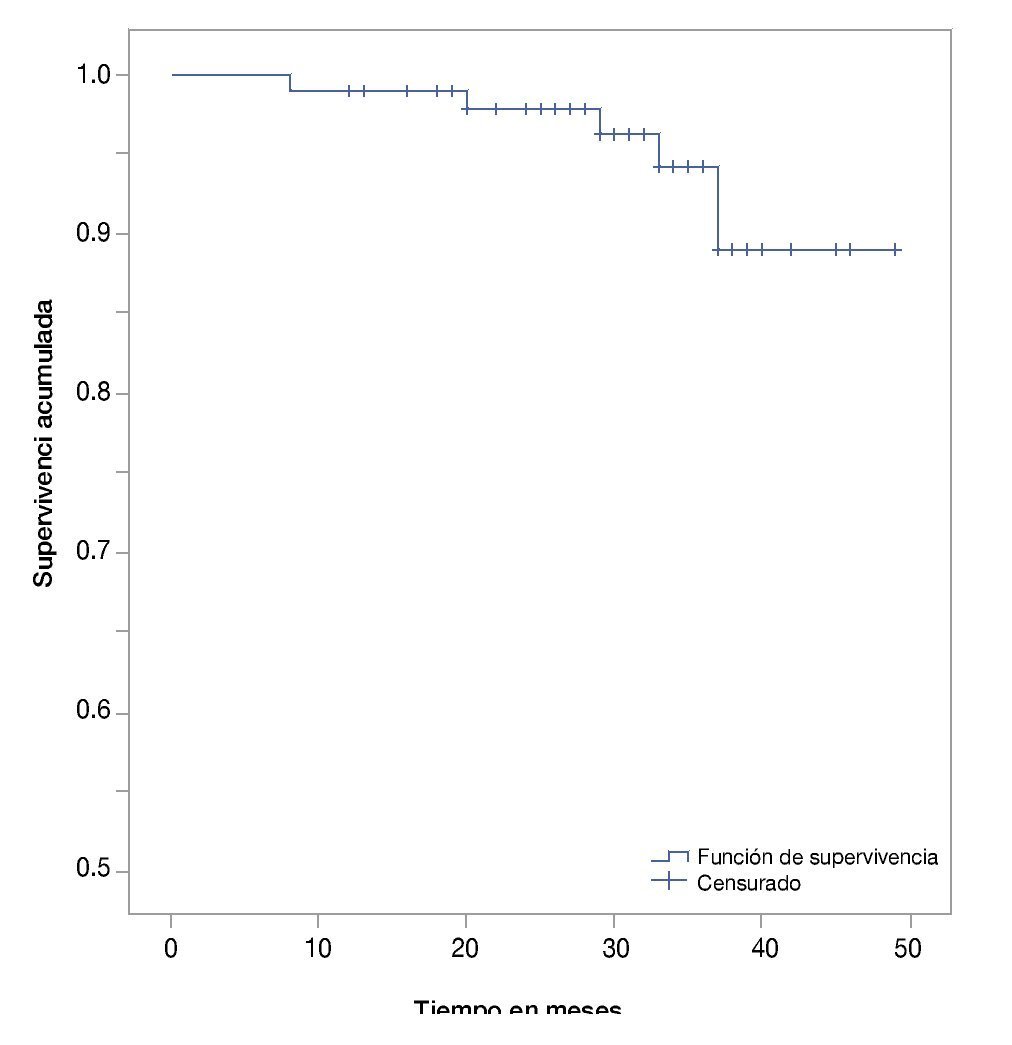
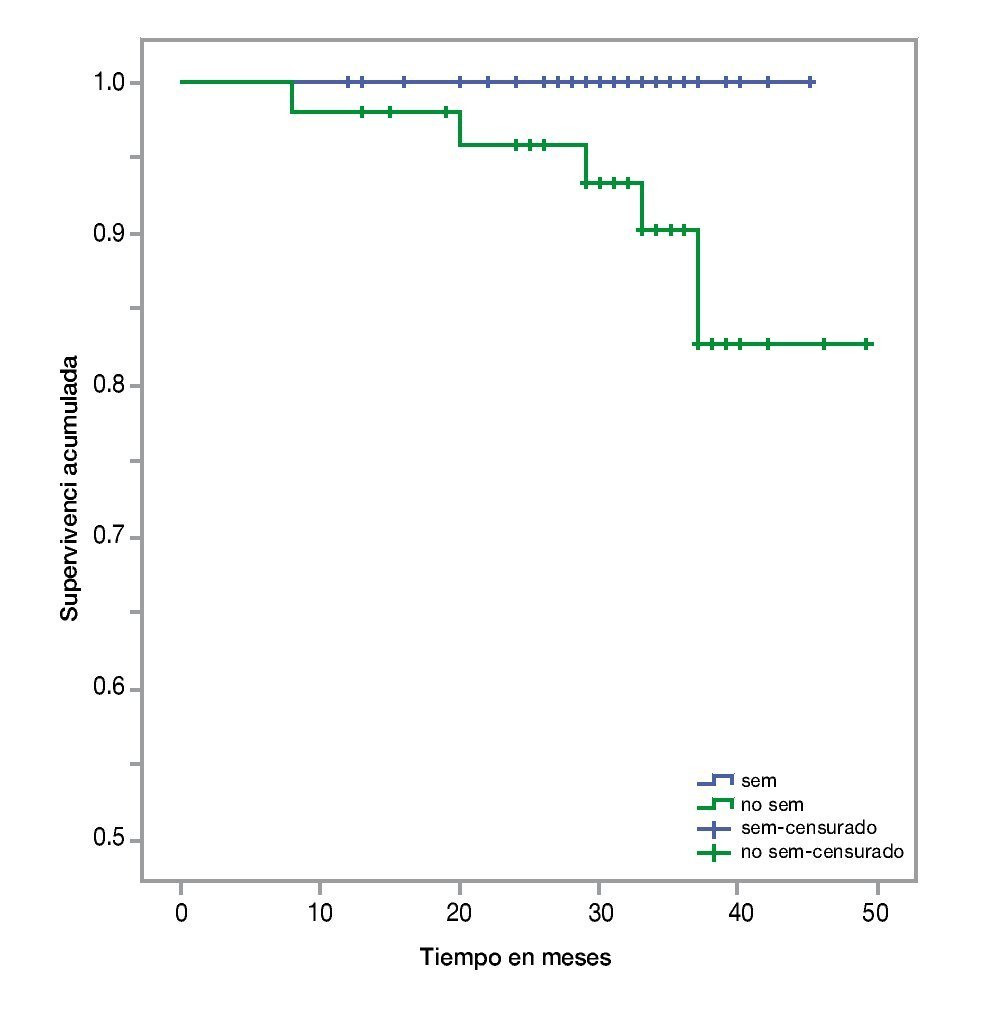
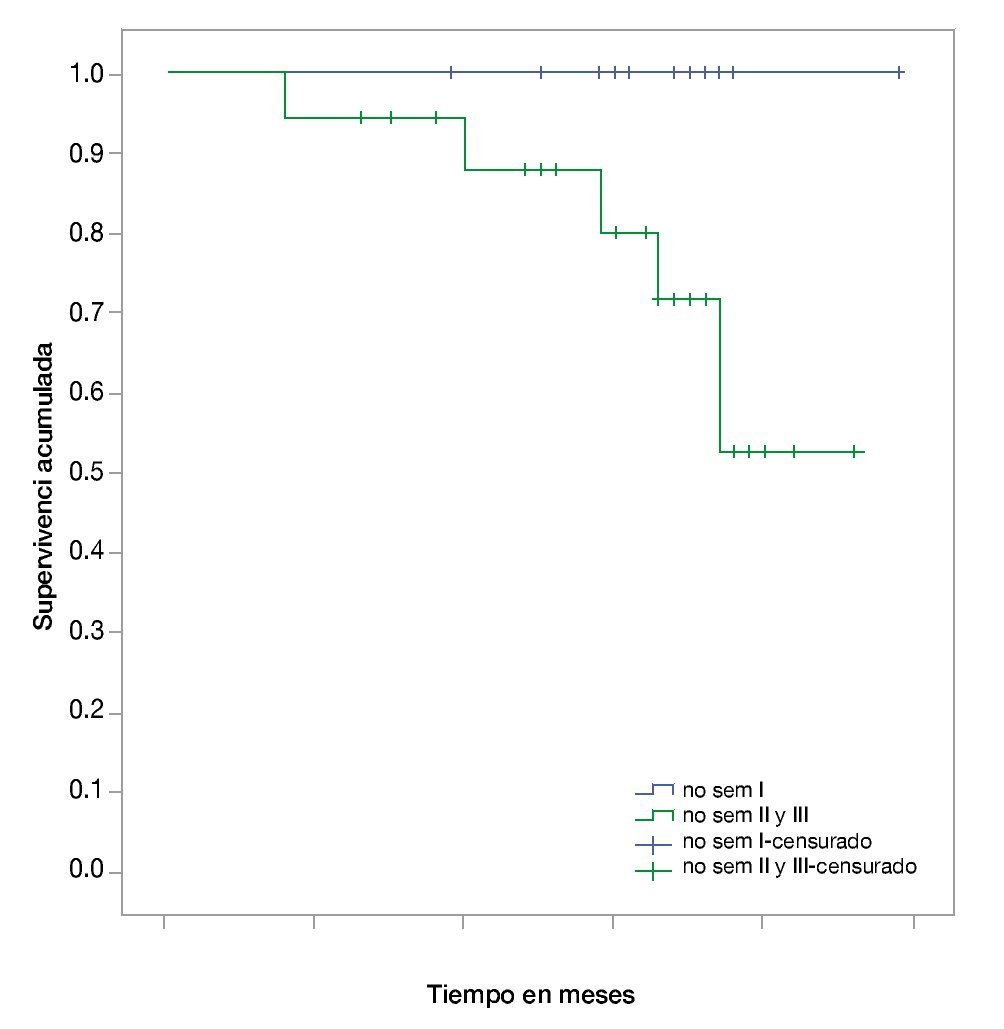
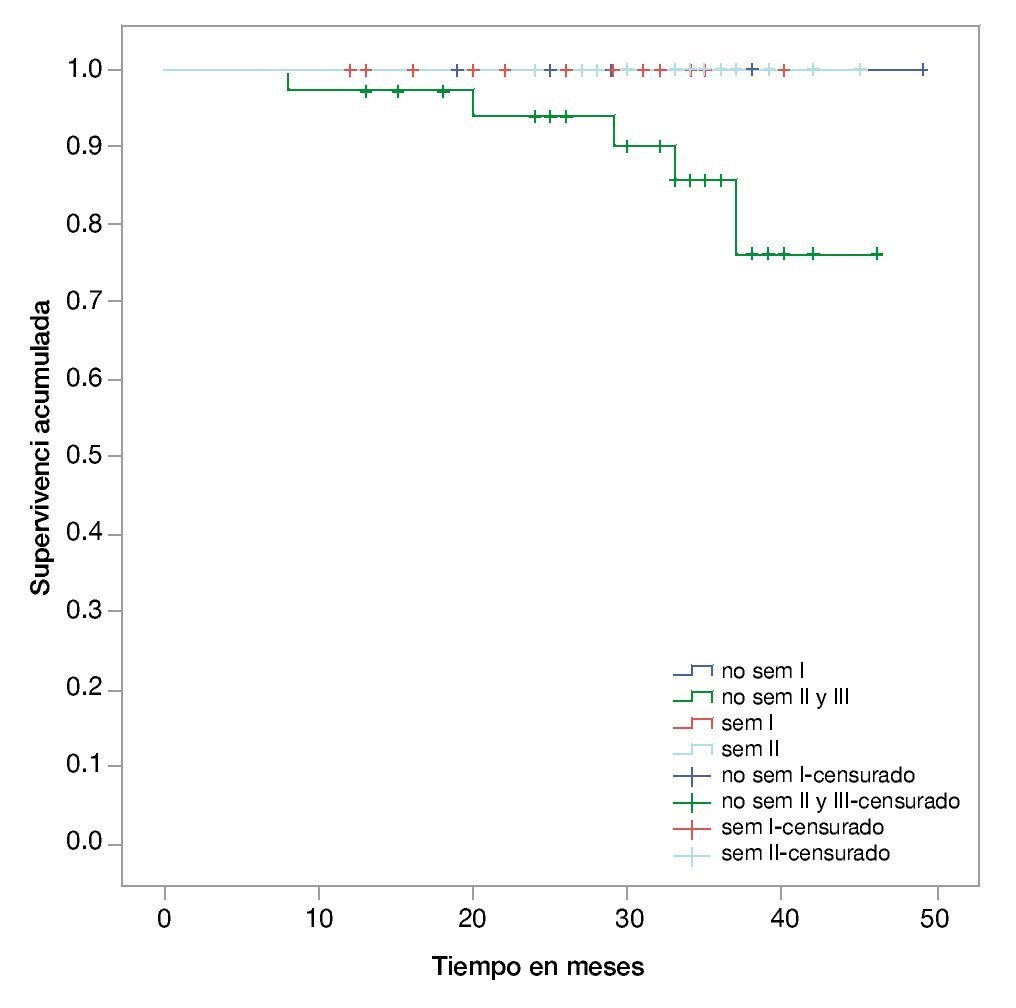
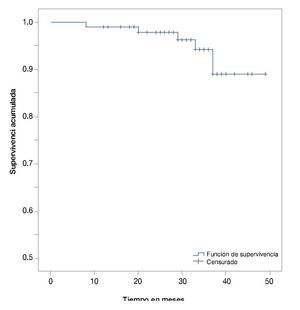
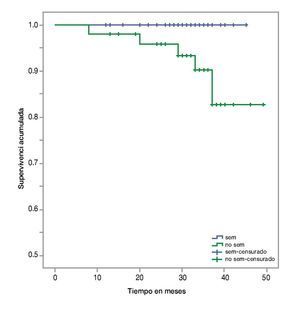
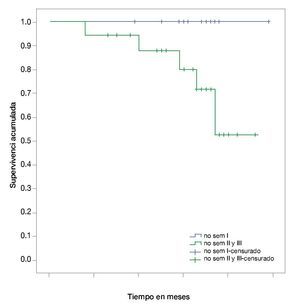
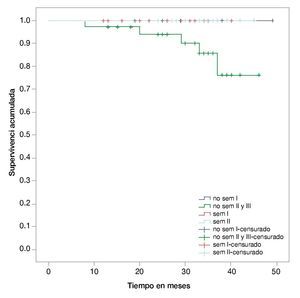
• Supervivencia. La supervivencia del grupo en total es de 97%, 94% y 89% a los 24, 36 y 48 meses, respectivamente (fig. 1). La supervivencia de los pacientes con seminomas es del 100%, en tanto que en los no seminomas es de 95%, 90% y 82% a los 24, 36 y 48 meses, respectivamente (fig. 2). La supervivencia de los pacientes con no seminomas etapa clínica I también es del 100%. El descenso en la curva de supervivencia en los pacientes con tumores no seminomas, se debe a los pacientes con etapa clínica II y III cuya supervivencia es de 93%, 85% y 76% a los 24, 36 y 48 meses, respectivamente (figs. 3 y 4). No se realizó un análisis estratificado de supervivencia de acuerdo al grupo pronóstico de la clasificación de la International Germ Cell Cancer Collaborative Group (IGCCG, por sus siglas en inglés) por el tamaño de la muestra, pero de los pacientes que fallecieron, uno pertenecía al grupo de pronóstico intermedio y los demás al grupo de pobre pronóstico.
Figura 1 Curva de Kaplan-Meier de supervivencia global.
Figura 2 Curva de Kaplan-Meier de supervivencia global por tipo histológico.
Figura 3 Curva de Kaplan-Meier de supervivencia en no seminomas por etapa clínica.
Figura 4 Curva de Kaplan-Meier de supervivencia global por tipo histológico y etapa clínica.
Conclusiones
El pronóstico de los pacientes con tumores germinales de testículo ha mejorado significativamente a partir del uso de la quimioterapia combinada basada en cisplatino. En la década de los setenta, sólo un 25% de los pacientes lograba supervivencia prolongada. En la actualidad, la tasa de curación es de aproximadamente 80% tomando en cuenta todas las etapas clínicas. En etapas tempranas, prácticamente el 100% de los pacientes pueden ser curados1,5-15. Aún en presencia de enfermedad metastásica es curable16-20. El IGCCG divide a los pacientes con enfermedad metastásica en 3 grupos con diferente tasa de supervivencia, la de 5 años para tumores no seminomatosos es de 92%, 80% y 48% para los grupos de buen, intermedio y pobre pronóstico, respectivamente. Para los tumores seminomatosos, la supervivencia a 5 años es de 86% y 72% para los grupos de buen e intermedio pronóstico, respectivamente. No hay grupo de pobre pronóstico en tumores seminomatosos21. Asimismo, existen probabilidades de curación en pacientes con enfermedad recurrente o resistente a la primera línea de tratamiento. Los tratamientos de rescate con esquemas de quimioterapia a dosis estándar o altas dosis con trasplante de células hematopoyéticas, conducen a altas tasas de respuesta con supervivencia prolongada. Con esta alternativa se puede alcanzar del 60% al 70% de respuestas completas, con 65% de pacientes con supervivencia prolongada17,22-26.
Las dosis altas de quimioterapia inicialmente se administraron en pacientes altamente tratados con pobre respuesta. Con el avance en las medidas de soporte y en los esquemas de altas dosis administradas como tercera o segunda línea, se logran respuestas completas alrededor del 50% y supervivencia prolongada en el 50%-60% de los pacientes27-33.
Durante muchos años, uno de los problemas fundamentales en nuestro sistema de salud ha sido el acceso a los medicamentos y tratamientos en pacientes con diferentes neoplasias, debido a problemas de índole económica por parte de los pacientes. Específicamente, en pacientes con tumores de células germinales de testículo, siendo una enfermedad potencialmente curable aún en etapas avanzadas, era una lástima ver el abandono del tratamiento por falta de recursos económicos, privándose así de las probabilidades de curación. En el Instituto Nacional de Cancerología, los tumores de células germinales de testículo constituyen la tercera neoplasia más frecuente después del cáncer de mama y de cuello uterino; siendo el tumor sólido más común en hombres.
Con la colaboración de Organizaciones No Gubernamentales se llevó a cabo este proyecto de apoyo a pacientes con tumores de células germinales de testículo, demostrando el impacto que tiene este tipo de ayuda en el éxito del tratamiento.
Los resultados demuestran en primer lugar que el abandono al tratamiento fue mínimo. Únicamente 3 pacientes (3.1%) lo abandonaron. Esto contrasta con el porcentaje de pacientes que abandonan su tratamiento por falta de recursos, que oscila alrededor del 25%-30% en nuestra Institución. Se logra así, que prácticamente todos los pacientes reciban el tratamiento planeado, lo cual repercute en el éxito del mismo. Esto se tradujo en excelente tasa de supervivencia del 89% a 4 años para el grupo total. La supervivencia en etapas tempranas es del 100% tanto en pacientes con seminomas como no seminomas. En los pacientes con no seminomas avanzados, el 80% de los pacientes están vivos a 48 meses.
Por su parte, el Gobierno Federal con la implementación del Seguro Popular con su Programa de Fondo de Protección Contra Gastos Catastróficos ha logrado incluir la atención gratuita de diferentes neoplasias en la población mexicana que no cuenta con seguridad social. A partir de enero del 2012 se incluyó en este programa a pacientes con tumores germinales de testículo, garantizando así su tratamiento y con ello la oportunidad de curación, lo cual ha sido un acierto importante ya que es una neoplasia curable en población económicamente activa y altamente productiva para el país.
Conflictos de interés
Los autores declaran no tener ningún conflicto de interés.
Financiamiento
La Fundación Rebeca de Alba proporcionó los recursos para el tratamiento de los pacientes. La empresa PISA proporcionó recursos para la recolección de datos y el análisis estadístico.
* Autor para correspondencia:
Departamento de Oncología Médica,
Instituto Nacional de Cancerología.
Av. San Fernando N° 22, Colonia Sección XVI,
C.P. 14080, México D.F., México.
Teléfono: (55) 5573 4749. Celular: (044) 5539770246.
Correo electrónico: jorge_martinezcedillo@yahoo.com.mx (Jorge Martínez-Cedillo).