Introducción: El tratamiento quirúrgico de los tumores de mama ha sufrido diversas modificaciones a lo largo del tiempo, pasando de ser un procedimiento agresivo y mutilante como la mastectomía clásica radical, hasta llegar a ser en nuestro presente una cirugía cada vez más conservadora, enfocada a disminuir el impacto psicológico que este padecimiento imprime a las pacientes.
Objetivos: dar a conocer mediante una revisión sistemática en la literatura médica mundial, el desarrollo que han sufrido las distintas técnicas quirúrgicas para el manejo de los tumores mamarios a lo largo del tiempo.
Métodos: Se llevó a cabo a través de una búsqueda en servidores de internet como Medline, Scielo, PubMed, entre otros; con la finalidad de localizar artículos médicos referentes a este tema.
Conclusiones: El tratamiento del cáncer de mama operable ha dejado de ser una cirugía radical, cruenta, mutilante, la cual existía como única opción de tratamiento, hasta convertirse en una cirugía cada vez más conservadora, realizado de una manera cosméticamente aceptable y que es equivalente a realizar una mastectomía en lo que respecta a recurrencia y supervivencia.
Introduction: Surgical treatment of breast tumors has undergone several modifications over time, from being an aggressive and mutilating procedure as classical radical mastectomy, to become a surgery in our present increasingly conservative, focused on decreasing the psychological impact that this condition prints to patients.
Objective: Introduce through a systematic review in the world medical literature, the development undergone by different surgical techniques for the management of breast tumors over time.
Methods: Was carried out through a search in Internet servers such as Medline, Scielo, PubMed, among others, in order to locate medical articles concerning this topic.
Conclusions: The treatment of operable breast cancer is no longer a radical surgery, bloody, mutilating, which existed as the only treatment option, into an increasingly conservative surgery, performed in a cosmetically acceptable and which is equivalent to performing mastectomy with respect to recurrence and survival.
Antecedentes históricos
El manejo quirúrgico de los tumores malignos de mama ha tenido una evolución espectacular a través del tiempo; iniciando desde tiempos remotos de nuestra historia desde simples incisiones y manejo con cataplasmas y otras sustancias, pasando asimismo por tratamientos radicales y mutilantes, con el consecuente impacto psicológico a la paciente, hasta llegar a la actualidad a ser un procedimiento quirúrgico cada vez más conservador, gracias a la complementación con terapia neoadyuvante y adyuvante de los medicamentos antineoplásicos y a la radioterapia. Por lo tanto, en este contexto surge la inquietud de realizar este artículo de revisión enfocándose al proceso evolutivo que ha tenido a lo largo del tiempo este tipo de manejo para los tumores malignos de mama.
Desde la antigüedad, se recurría a la cirugía cuando el aspecto y palpación de los tumores indicaban que una neoplasia no cedería su crecimiento con el uso de ungüentos y cataplasmas. La única alternativa era extirparla. Por lo tanto, la cirugía se volvió el abordaje terapéutico más común en cánceres de mama avanzados porque para muchos cirujanos esa era la única solución. La realización de quemaduras, cortes y ligaduras fueron los primeros procedimientos quirúrgicos que se emplearon para tratar de erradicar el cáncer de mama1.
Los datos médicos más antiguos que se conocen sobre la patología mamaria y su tratamiento, provienen del Antiguo Egipto. En específico el Papiro de Edwing Smith, encontrado en Tebas en 1862, que data de unos 1600 años a.C., es un rollo de unos 5 m, que contiene 48 casos dedicados a cirugía y con respecto a mama este habla sobre abscesos, traumatismos y heridas infectadas; siendo el nº 45 tal vez el registro más antiguo de patología mamaria, el cual documenta las instrucciones en torno a tumores sobre las mamas, e informa al explorador de que una mama con una tumoración caliente al tacto, es un caso que no tiene tratamiento. Normalmente éste se limitaba a los 2 únicos métodos disponibles por entonces, quemar la lesión con fuego o extirparla mediante instrumentos cortantes como erinas, cauterios, espéculos, sierras, lancetas, tijeras, cuchillos, pero sin anestesia. Permaneciendo estos métodos vigentes por más de 2000 años2-4.
Grecia clásica (450-136 a.C.)
Hipócrates 400 años a.C. habla de Karquinos o Karquinoma, y lo relaciona con el cese de la menstruación y dice que no debe tratarse porque acelera la muerte y que son de buen pronóstico los que curan con medicinas. Definió con claridad que los casos con cáncer mamario profundo era mejor no intervenirlos ya que su tratamiento conducía a la muerte, mientras que la omisión del mismo permitía una vida más prolongada. No dejó ningún documento donde se recomendara el tratamiento quirúrgico2.
Periodo greco-romano (150-500 d. C.)
Leónides. Médico del 1er siglo d.C., es considerado como el primero que efectuó una extirpación quirúrgica de la mama y lo hacía mediante una incisión de piel en la zona sana de la misma, luego iba aplicando el cauterio para cohibir la hemorragia, todo ello lo continuaba repitiendo hasta la extirpación completa de la mama. Como cuidados postoperatorios indicaba cataplasmas y dietas que evitaran las bebidas frías y los alimentos de difícil digestión2.
Aurelius Cornelius Celsus. 300 años a.C., enciclopedista y no médico, detalla en su tratado la primera descripción médica del cáncer, mencionando la mama como uno de los lugares de localización de una hinchazón irregular con zonas duras y blandas, dilataciones y tortuosidades venosas, con o sin ulceración2,5.
Tras Hipócrates el principal médico fue Galeno (131-201 d.C.), describió el cáncer de mama como una hinchazón con dilatación venosa parecida a la forma de las patas de un cangrejo. No menciona las metástasis o el proceso por el que acaecía la muerte. Creía que se producía un acúmulo de bilis negra (las 4 bilis de Hipócrates), y consideraba aconsejable para prevenirlo la práctica de purgas y sangrías. Además consideraba que la menstruación en mujeres de menos de 50 años debía en estos casos ser favorecida mediante baños calientes, ejercicio, masajes y proporcionaba medicamentos para provocarla. Al extirpar el tumor mediante una incisión circular, el cirujano debía ser consciente del peligro de hemorragia profusa por los grandes vasos, por otra parte aconsejaba permitir cierto grado de sangrado para permitir salir la sangre oscura, así como estrujar los vasos para vaciarlos del resto de sangre2.
Edad Media
Durante este periodo permaneció vigente la medicina hipocrática apoyada por las ideas de Galeno hasta la llegada del Renacimiento. En esta época, la medicina se conservó en los monasterios2.
Rhazes (860-932) y Haly Ben Abbas (994), indicaban la escisión quirúrgica del cáncer mamario, sólo si podía ser extirpado en su totalidad y si se podía cauterizar la herida2.
Abulcasis (1013-1106), nacido cerca de Córdoba, España, mantenía la teoría de que no debía quemarse el tumor directamente, sino que primero se le debía extraer la sangre y posteriormente hacer una incisión circular sobre el tejido sano, dejando sangrar la herida, sin hacer una ligadura rápida aunque si ejerciendo presión sobre el lecho operatorio y sólo en caso de sangrado de una arteria importante era cuando se debía ligar ésta2.
Renacimiento
Esta época se caracterizó por un espíritu crítico, observación libre y deseo por el saber. Las ciencias paramédicas avanzaron y la medicina resultó beneficiada.
Andrés vesalio (1514-1564), gran especialista en disección y uno de los primeros en romper con la tradición de Galeno, aplicó sus conocimientos a la cirugía efectuando amplias escisiones mamarias, utilizando las ligaduras en vez del cauterio1,2.
Ambrose Pare (1510-1590), afirmaba que los cánceres superficiales debían ser escindidos, pero se oponía a las grandes mutilaciones de mama, empleaba ligaduras en vez de utilizar el cauterio o el aceite hirviendo y usaba placas de plomo con las que comprimía la lesión para disminuir su aporte sanguíneo y así retrasar su crecimiento. Bartolomé Cabrol, consideraba que la mastectomía no era suficiente y que el pectoral subyacente debía ser extirpado. Miguel Servet (1509-1553), recomendaba la extirpación del músculo y de los ganglios axilares, esto condujo al desarrollo de la moderna mastectomía radical1,2.
Johannes Scultetus (1595-1645), cirujano alemán, que escribió su famoso libro armamentarium chirurgicum, practicaba la intervención mediante grandes ligaduras con enormes agujas traspasando la mama, así podía hacer tracción antes de utilizar el bisturí, posteriormente hacia hemostasia mediante cauterización2,6.
Siglo XVIII
En esta época, a partir de 1715, se separan los oficios de barbero y cirujano, John Hunter desarrolla la cirugía experimental y la patología quirúrgica2. Por un lado, Pieter Camper (1722-1789), describió los ganglios linfáticos de la cadena mamaria interna. Por otro, Paolo Mascagni (1752-1815), describió el drenaje linfático pectoral. Jean Louis Petit (1674-1758), recomendaba la amputación de la mama, con extirpación del pectoral y disección axilar; por primera vez se realiza la mastectomía radical.
Siglo XIX
A lo largo de este siglo se produjeron 2 grandes contribuciones a la cirugía mamaria: siendo la primera la introducción de la Anestesia en 1846 por William Morton y la segunda la introducción de los principios de la Antisepsia por Joseph Lister en 18672. Asimismo, se consideraba al cáncer de mama como una enfermedad locorregional, por tanto se debían realizar grandes cirugías locorregionales. El mayor empuje histórico al desarrollo y expansión del uso de la mastectomía en el tratamiento del cáncer de mama se lo debemos a Halsted y a Meyer, que en 1890 introdujeron la mastectomía radical como intervención reglada, con unas bases científicas para el tratamiento, con finalidad radical, del cáncer de mama.
Sir James Paget (1814-1899), en Londres, en 1874 publicó su tratado sobre "La Enfermedad de la Areola Mamaria que precede al Cáncer de la Glándula Mamaria". Donde comunica una mortalidad operatoria del 10% en 235 casos2.
Alfred-Armand-Louis-Marie Velpau (1795-1867) en Francia, publicó en 1854 su "Tratado sobre Enfermedades de la Mama", en el que refería haber asistido más de 1,000 tumores de mama. Comunica una mortalidad del 5%2,8. Benjamin Bell (1749-1806), era partidario de extirpar la mama incluso aunque el tumor fuera pequeño, pudiendo en esos casos respetar los pectorales y gran parte de la piel, pero siempre con disección axilar mediante incisión aparte, lo cual recuerda la cirugía conservadora de hoy2.
Joseph Lister (1827-1912), uno de los más respetados cirujanos de Inglaterra, consiguió implantar la pulverización de ácido carbólico con fines antisépticos y cauterizantes2,9.
William Steward Halsted (1852-1922), consideraba que la pieza debía extirparse rápido y en su totalidad, incluyendo el pectoral, era partidario de extender la intervención a la fosa supraclavicular y en 3 ocasiones persuadido por Harvey Cushing a explorar mediastino. Fue el primero que se apoyó en un fundamento científico y finalmente desarrolló la técnica que sería utilizada durante 100 años, la cual se basaba en: una amplia escisión de piel, extirpación del pectoral mayor, disección axilar y extirpación en bloque de todos los tejidos, con un amplio margen2. Así entonces, la mastectomía radical que consistía en retirar la mayor cantidad de tejido posible, fue la cirugía que predominó para tratar al cáncer de mama6,7,10.
Siglo XX
El siglo XX se caracterizó porque durante éste aparecieron la quimioterapia y la radioterapia, las cuales complementaban el abordaje quirúrgico. Así también se innovaron las técnicas quirúrgicas con el advenimiento de la cirugía reconstructiva y preservadora de mama2,11,12. Un avance importante fue el de Baclesse en Francia en 1960, quien propuso que la tumorectomía seguida de radioterapia en estadios tempranos, era tan buena como la técnica clásica de mastectomía radical. Asimismo, de Winter (1959) en Alemania, Porrit (1964) en Inglaterra y Peters (1967) en EuA, comunicaron resultados parecidos11,12.
Haagensen y Cooley en 1963, en la universidad de Columbia en New York, Owen Wangestein en la Universidad de Minesota y otros introducen la mastectomía suprarradical, dividiendo la clavícula y seccionando la primera costilla, extendiendo la disección a la fosa supraclavicular y mediastino superior, así como extirpación de la cadena mamaria interna, pero lógicamente esta técnica no ganó popularidad1,2. Jerome urban (1914-1991), cirujano de fama mundial, se graduó en la universidad de Columbia y desarrolló su carrera en el Sloan Kattering Center de Nueva York. Propuso la mastectomía radical ampliada para el cáncer de mama avanzado, técnica que hoy lleva su nombre y que ha dejado de utilizarse dadas las tendencias actuales en lo que a cirugía se refiere2,6.
En el Hospital Middlesex de Londres, Patey y dison publican un trabajo en el British Journal of Cancer, haciendo un sumario del tratamiento del cáncer de mama en ese momento e introducen la nueva técnica de la mastectomía radical modificada8,12.
Paul Erlich en 1898 aisló el primer agente alquilante y con él acuñó la palabra "Quimioterapia", produjo agentes alquilantes y desarrolló una sustancia conocida como mostaza nitrogenada. Durante el periodo inmediato análogos de las mostazas nitrogenadas como busulfán, ciclofosfamida, clorambucil, fenilalanina, fueron introducidos en el uso diario8.
En 1895, vicenz Czerny trasplantó un gran lipoma para reemplazar la mama extirpada por un proceso benigno. Posteriormente en 1896, Tansini en la universidad de Padua comunica la primera mastectomía radical con cirugía reconstructiva, utilizando un colgajo musculocutáneo del dorsal ancho. En 1963, Cronin y Gerow utilizan silicona9,12.
Charles Marie Gros (1910-1984), matemático, médico, radiólogo y cancerólogo; creó en 1960 en el Hospital universitario de Estrasburgo el primer Servicio del mundo dedicado al diagnóstico y tratamiento de las enfermedades mamarias. En 1976, creó la Sociedad Internacional de Senología9,12. Jean Marie Spitalier (1922-1990), fue pionero desde 1960 en el tratamiento conservador del cáncer de mama10,11.
Tipos de mastectomía e indicaciones
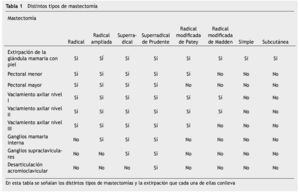
Dentro de las mastectomías existen distintas variaciones, de mayor o menor agresividad, en el tratamiento del cáncer de mama (tabla 1), siendo las siguientes13-15:
Mastectomía radical
Esta se conoce como mastectomía radical de Halsted y de Meyer, es la clásica mastectomía, y consiste en la extirpación de la glándula mamaria, ambos pectorales y vaciamiento axilar completo. Halsted comenzaba la intervención por la mama y terminaba en la axila; Meyer empezaba por el vaciamiento axilar y seguía con los pectorales para acabar con la mama. La incisión empleada era vertical, y los resultados estéticos eran pésimos. Este había sido el tratamiento quirúrgico estándar del cáncer de mama durante muchísimos años, hasta que fue reemplazado por la cirugía conservadora de mama13.
Mastectomía radical ampliada
A la mastectomía radical se asocia la extirpación de los ganglios de la mamaria interna, ya sea de forma discontinua o en bloque con la pared ósea torácica, la cual se refuerza con fascia lata o mallas. Prácticamente en desuso en la actualidad13,16,17.
Mastectomía superradical
A la mastectomía radical ampliada se le asocia la disección de los ganglios supraclaviculares, ya sea de forma discontinua o en mono bloque, extirpando parte de la clavícula y, de la primera y segunda costillas. No tiene indicaciones en la actualidad13.
Mastectomía superradical de prudente
A la cirugía superradical, se agrega una desarticulación interescapulotorácica del brazo homolateral. No tiene indicaciones en la actualidad13.
Mastectomía radical modificada
a. Mastectomía radical modificada de Patey. En esta técnica se extirpa la glándula mamaria con el pectoral menor y la fascia del pectoral mayor, con vaciamiento axilar completo.
b. Mastectomía radical modificada de Madden y Auchincloss. En esta técnica se extirpa la glándula mamaria sin pectorales, con vaciamiento axilar completo. La incisión empleada es horizontal, con lo cual se mejora el resultado cosmético13.
De todas las mastectomías, la mastectomía radical modificada es la que más indicaciones y más se realiza en la actualidad, ya sea en cualquiera de sus 2 variantes, siendo sus indicaciones fundamentales las siguientes13,18,19:
1. Tumores de más de 3 cm.
2. Tumores multifocales.
3. Algunos sarcomas sin invasión de pectorales.
4. Tumores en estadios I y II.
5. Tumores en estadio III como parte de un tratamiento multimodal.
6. Cáncer de mama durante el embarazo.
7. Recidiva tras cirugía conservadora.
8. Cáncer de mama en el varón.
Mastectomía simple
Consiste en la extirpación de la glándula mamaria, sin vaciamiento axilar, a través de una incisión generalmente horizontal. Este tipo de mastectomía tiene una indicación o finalidad más paliativa que curativa, es decir, de limpieza en la mayoría de las ocasiones. Está indicada en los siguientes casos13,20:
1. Lesiones multicéntricas de carcinoma canalicular in situ.
2. Cistosarcoma phyllodes y sarcomas invasivos, cuando no están fijos a pared torácica subyacente, fascia o músculo (metastatizan por vía hematógena).
3. Lesiones de mama poco frecuentes: melanoma, dermatofibrosarcoma protuberans, linfoma, actinomicosis, tuberculosis, absceso crónico, etc.
4. Debe ser valorada como profilaxis en pacientes de alto riesgo.
Mastectomía subcutánea
En este procedimiento quirúrgico, se extirpa la mayor parte de la glándula mamaria conservando la piel, pezón y areola, sin realizar vaciamiento axilar. Este tipo de mastectomía tiene 2 indicaciones fundamentales:
1. Mujeres de alto riesgo de desarrollar cáncer de mama.
2. Enfermedad mamaria benigna extensa, que pueda hacer confundir por sus hallazgos en la exploración física o mamográfica13.
Complicaciones de la mastectomía
Pueden surgir complicaciones durante o después de realizar una mastectomía, las más comunes son21,22:
• Complicaciones intraoperatorias
1. Lesiones vasculares. De las lesiones vasculares que pueden surgir a lo largo de una mastectomía, la lesión de la vena axilar, generalmente por tracción o arrancamiento de alguna de sus ramas, es la más frecuente, debido a que la disección axilar completa obliga a extirpar los ganglios a ese nivel.
2. Neumotórax. Se produce por perforación de la pleura parietal, complicación poco frecuente, que se resuelve con la colocación de un tubo de drenaje torácico y sutura.
3. Lesiones nerviosas. Durante la disección axilar se pueden producir lesiones nerviosas del nervio torácico largo o serrato, del toracodorsal o dorsal ancho, o incluso del plexo braquial, cuyas manifestaciones clínicas sensitivas y motoras aparecen posteriormente13.
• Complicaciones postoperatorias precoces
1. Anemia. Se produce sobre todo en aquellos casos de mamas irradiadas previamente y en las que se realiza una mastectomía radical.
2. Hematomas. Por hemorragia de un vaso y el fracaso del drenaje que hemos colocado, y que en algunos casos nos obliga a reintervenir a la paciente para vaciar el hematoma y realizar hemostasia si encontramos el origen de la hemorragia. Otras veces con un vendaje compresivo y punciones evacuadoras es suficiente.
3. Seromas. Es una de las complicaciones más frecuentes, y se produce como consecuencia de un mal funcionamiento de los drenes, mala hemostasia o gran movilización de la grasa axilar. Estos seromas se pueden solucionar con punción-aspiración y vendaje compresivo, aunque a veces es necesario colocar un nuevo drenaje aspirativo.
4. Dehiscencia de la herida. Por lo común se produce cuando al aproximar los colgajos éstos quedan a tensión, pudiendo llegar a necrosarse. Para evitar esta complicación los colgajos no deberán quedar nunca a tensión. Si se produce esta dehiscencia, habrá que esperar una cicatrización por segunda intención.
5. Infección de la herida. Es una complicación poco frecuente.
6. Flebitis y tromboflebitis de la vena axilar o subclavia. Es infrecuente.13
• Complicaciones postoperatorias tardías
1. Cicatrices queloides.
2. Contracturas y atrofias del pectoral mayor, por lesión del nervio torácico anterior.
3. Alteración en la movilidad del hombro. Puede llegarse a un "hombro congelado" por falta de movilidad del brazo y hombro, originando retracciones ligamentosas y tendinosas, y finalmente una fijación de la articulación.
4. Parestesias en la axila y parte medial del brazo.
5. Alteraciones en la columna vertebral como escoliosis, cifosis o contracturas cervicales, sobre todo en pacientes con mamas muy grandes.
6. Linfedema. Es la complicación tardía más frecuente de la mastectomía, como consecuencia de una alteración en el vaciado linfático a nivel axilar, producido por vaciamientos axilares completos generalmente asociados a radioterapia13.
Cirugía conservadora de mama y técnicas oncoplásticas
A través de las últimas décadas, la cirugía ha proporcionado a la mujer con cáncer de mama una mejora en el control locorregional de la enfermedad, una disminución en la agresividad técnica y una mejor percepción y valoración de su imagen corporal. Estos avances han sido posibles gracias al progreso en el conocimiento científico ya que, sin duda, ha permitido abandonar definitivamente el viejo concepto encaminado hacia un control desesperado de la enfermedad mediante técnicas mutilantes que poco o nada mejoraron la supervivencia y calidad de vida en estas enfermas23.
La cirugía conservadora persigue 2 finalidades: el control local de la enfermedad y un resultado estético satisfactorio para la mujer. No obstante, estos 2 objetivos entran en conflicto durante su realización, ya que el intento de mejorar el control local del tumor mediante resecciones más amplias conlleva un deterioro del resultado estético y, al contrario, un empeño en la mejora de la cosmética puede inducir la realización de pequeñas resecciones con un mayor riesgo de recaída local. Hay algunos factores de riesgo que incrementan el deterioro estético en la cirugía conservadora y, entre ellos, destacan una extirpación > 20% del volumen mamario, la resección en los cuadrantes inferiores o los efectos de la radioterapia postoperatoria23-25.
La selección de la técnica oncoplástica más apropiada para cada caso dependerá de la localización tumoral y de las características concretas de cada mama (tamaño y ptosis). Para lo cual se dispone de un grupo de técnicas que abarcan casi la totalidad de las localizaciones anatómicas y pueden ajustarse a los diferentes volúmenes mamarios.
Como norma general, se precisa un volumen mínimo para llevar a cabo la escisión tumoral y la remodelación mamaria, con lo cual excluye a la mayoría de las mujeres con una mama de tamaño pequeño23.
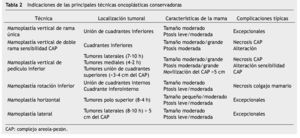
A continuación las técnicas oncoplásticas más utilizadas actualmente (tabla 2) en cirugía de mama son23:
Mamoplastía vertical de pedículo superior con rama única
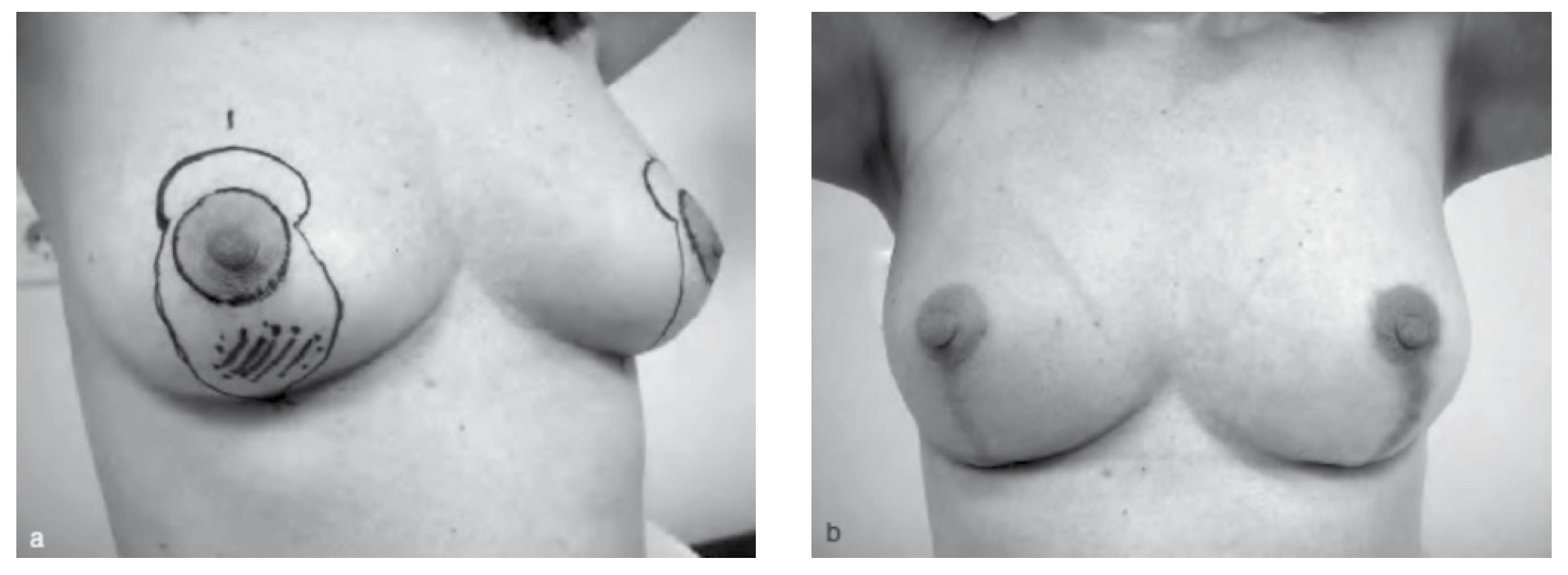
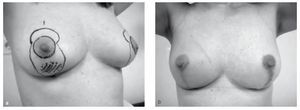
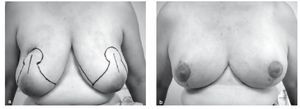
Ésta consiste en una exéresis de la parte media del polo inferior mamario a partir de un patrón vertical desde el complejo areola pezón (CAP) al surco submamario (fig. 1). Esta técnica estrecha las mamas y disminuye el tejido ptósico mamario mediante una resección inframamaria y central inferior, evitando la cicatriz lateral mediante el uso de una única incisión vertical. Se trata de una técnica apropiada para mamas pequeñas y medianas, así como para tumores localizados en la unión de los cuadrantes inferiores. La viabilidad del CAP se garantiza gracias al pedículo superior que proporciona la vascularización a través del plexo subdérmico y el tejido retroareolar23,26.
Figura 1 Mamoplastía vertical de rama única. A) Marcaje, B) resultado postoperatorio.
Mamoplastía vertical de pedículo superior con doble rama
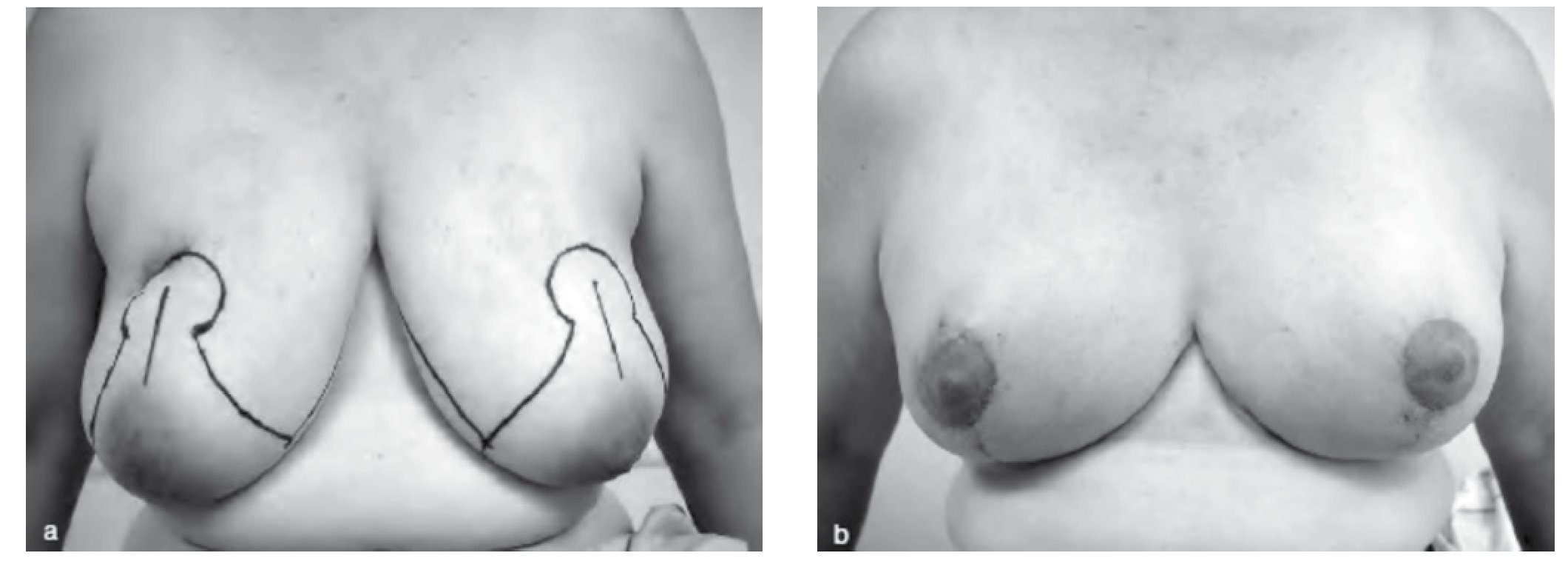
En esta técnica se realiza una resección del polo inferior mamario mediante un patrón horizontal basado en 2 ramas, vertical y horizontal (fig. 2). Se proporciona una reducción mamaria importante en pacientes con hipertrofia moderada, la cual la hace de elección para mejorar la radioterapia postoperatoria en mujeres con mamas voluminosas que optan por la conservación mamaria. Se utiliza en tumores del polo inferior mamario localizados desde la 4 a las 8 horas23.
Figura 2 Mamoplastía vertical de doble rama. A) Marcaje, B) resultado postoperatorio.
Mamoplastía vertical de pedículo inferior
Aquí se realiza una exéresis del polo inferior mamario en la que se preserva un pedículo vertical inferior que garantiza la irrigación del CAP. Durante la resección mamaria no sólo se abarca al patrón marcado sobre la piel sino que se extiende por debajo de las ramas verticales, al ser necesaria una disección en bisel para que el tejido alojado en ellas no se superponga al tejido del pedículo. Esta técnica es apropiada para mamas muy voluminosas y ptósicas que requieren grandes movilizaciones del CAP hacia su nueva localización. Idóneo para tumores situados en los cuadrantes lateral y medial del polo inferior mamario, en los cuadrantes lateral y medio del polo superior, así como en los situados en la unión de los cuadrantes superiores a pocos centímetros del CAP23,27.
Mamoplastía de rotación inferior
Este procedimiento quirúrgico consiste en la movilización y rotación de un colgajo constituido por la porción inferior y lateral de la mama que previamente ha sido despegado de la fascia del pectoral mayor. La vascularización de este colgajo se mantiene a partir del plexo superficial por el aporte de ramas toracoepigástricas. De elección para tumores situados en la unión de los cuadrantes internos, aunque también puede aplicarse a neoplasias situadas en el cuadrante ínfero-interno23,28.
Mamoplastía horizontal
Se realiza una exéresis en el polo superior mamario a partir de un patrón en "alas de murciélago", en el cual podrán englobarse tumores situados entre las 8 y 4 horas. El CAP mantiene su irrigación a partir del plexo superficial y profundo, lo que hace que esta técnica sea muy segura para la prevención de necrosis local. No debe movilizarse el CAP a menos de 15-16 cm de la referencia clavicular23,28.
Mamoplastía lateral
Consiste en una resección lateral de la mama a partir de un patrón que se extiende desde el CAP hasta la axila. Constituye una buena alternativa en tumores situados en la unión de los cuadrantes externos y que se encuentran alejados del CAP. La irrigación del CAP se mantiene por el plexo superficial y profundo, sin que haya riesgo de compromiso vascular23.
Ganglio centinela
Definición de ganglio centinela (GC): el o los ganglios del territorio linfático al que drena inicialmente el tumor primario y el cual tiene mayor probabilidad de albergar metástasis. Se considera como GC desde el punto de vista de la gammagrafía a aquel o aquellos que presentan migración desde el tumor mediante un canal linfático o, ante la no evidencia de dicho canal, aquel o aquellos que aparecen en uno o varios territorios de drenaje linfático. Se consideran GC secundarios a aquellos que presentan una captación del trazador con menor intensidad claramente diferenciada. Se considera como GC con el trazador isotópico, en el acto quirúrgico, aquel que presenta una actividad representativa y que está ubicado en el área preseleccionada gammagráficamente. Y se considera secundario aquel que tenga menos del 10% del de máxima actividad. Durante la intervención quirúrgica, se define como GC con el colorante todo ganglio que aparezca teñido de azul o al que fluye un conducto linfático azulado29-31.
Criterios de indicación
— Carcinomas infiltrantes de hasta 3 cm de diámetro máximo y es aceptable en pacientes T2 con axila negativa (clínica y ecográficamente ± punción aspiración con aguja fina).
— En tumores multifocales es posible realizarla, y en los multicéntricos sería aceptable aunque con evidencia limitada.
— En los casos de carcinoma intraductal extenso (+ 4 cm dm) y de alto grado y/o con comedonecrosis y/o en los que vayan a tratarse con mastectomía.
— Carcinoma de mama. En el varón se puede realizar al igual que en la mujer.
— La realización de una biopsia escisional previa no contraindica el procedimiento, siempre que no aparezcan criterios de exclusión y se realice antes de un mes.
— Es aceptable, con buen nivel de evidencia, previa a tratamiento sistémico primario con fines de rescate para cirugía conservadora.
— no existe evidencia para recomendar la BSGC en mujeres gestantes.
— En los casos de cirugía mamaria plástica de aumento o reducción previa no existe evidencia para recomendarlo30,31.
Criterios de exclusión o contraindicación
— La comprobación preoperatoria de afectación ganglionar mediante pruebas de imagen (ecografía) y, al menos, citología compatible con metástasis de carcinoma de las adenopatías sospechosas.
— La existencia de cirugía y/o radioterapia axilar previa.
— Carcinoma inflamatorio30.
Técnica del ganglio centinela
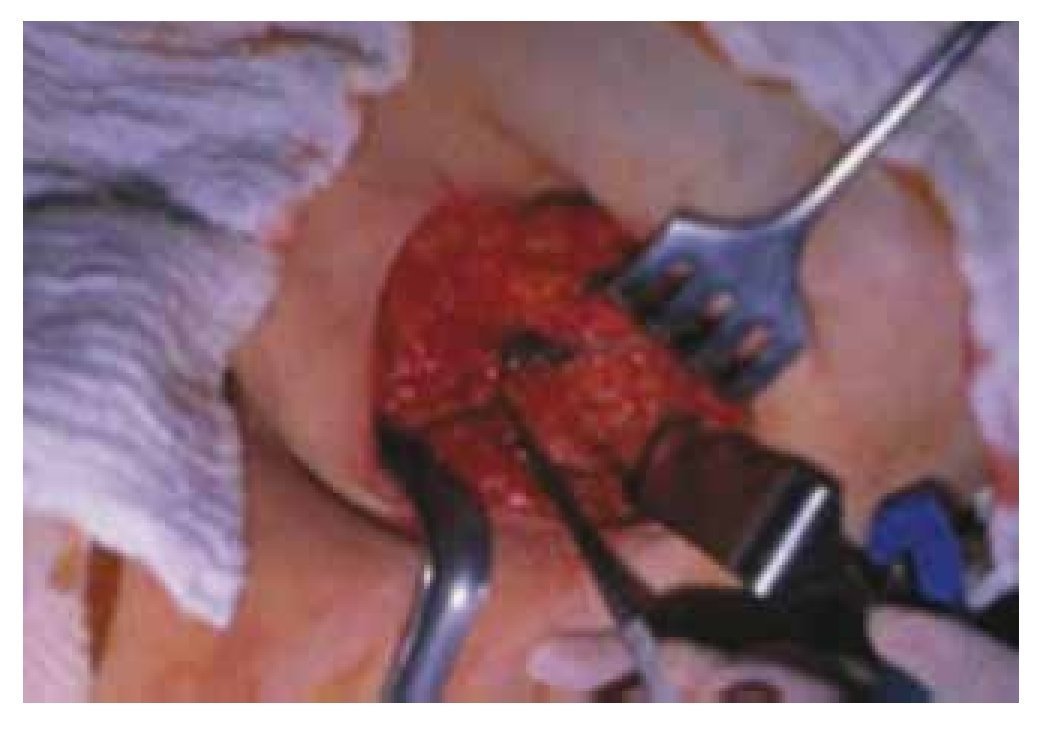
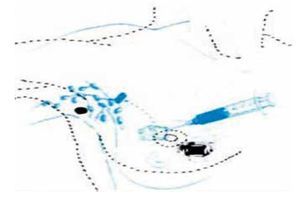
La técnica imprescindible incluye el uso de trazador isotópico como marcador del ganglio. Es aceptable utilizar la técnica mixta (trazador isotópico más colorante), sobre todo, en periodo de aprendizaje y en aquellos casos con dificultades de visualización en la linfogammagrafía preoperatorias. Se desaconseja la técnica con el uso exclusivo de colorante. Los trazadores isotópicos recomendables son la albúmina nanocoloide, el coloide de estaño y el sulfuro de renio. La actividad total administrada oscilará entre 0.5 y 3 mCi, inyectados entre las 2 y 24 horas antes de la cirugía. La localización anatómica de la inyección del trazador isotópico será, preferiblemente, intraperitumoral, pero también podría ser periareolar y/o subdérmica (figs. 3 y 4). Sería recomendable, e imprescindible en las lesiones no palpables y en la técnica de Sentinel Node and Occult Lesion Localization (SnOLL), tratar de realizar la inyección intraperitumoral del trazador de forma asistida por métodos de imagen (ecografía o estereotaxia). En los casos de lesiones no palpables sin posibilidad de asistencia con métodos de imagen, lesiones ya extirpadas o lesiones cercanas anatómicamente a la región axilar, sería posible y recomendable la inyección periareolar del trazador. Es imprescindible la realización preoperatoria de una linfogammagrafía en el periodo postinyección del trazador isotópico, con la finalidad de confirmar la migración y evidenciar drenajes extra axilares. Se debe realizar lo más cerca posible al momento de la intervención. En caso de no migración y no visualizar el drenaje, se recomienda la reinyección del trazador, el mismo día, con cualquiera de las técnicas citadas a tal efecto31,32.
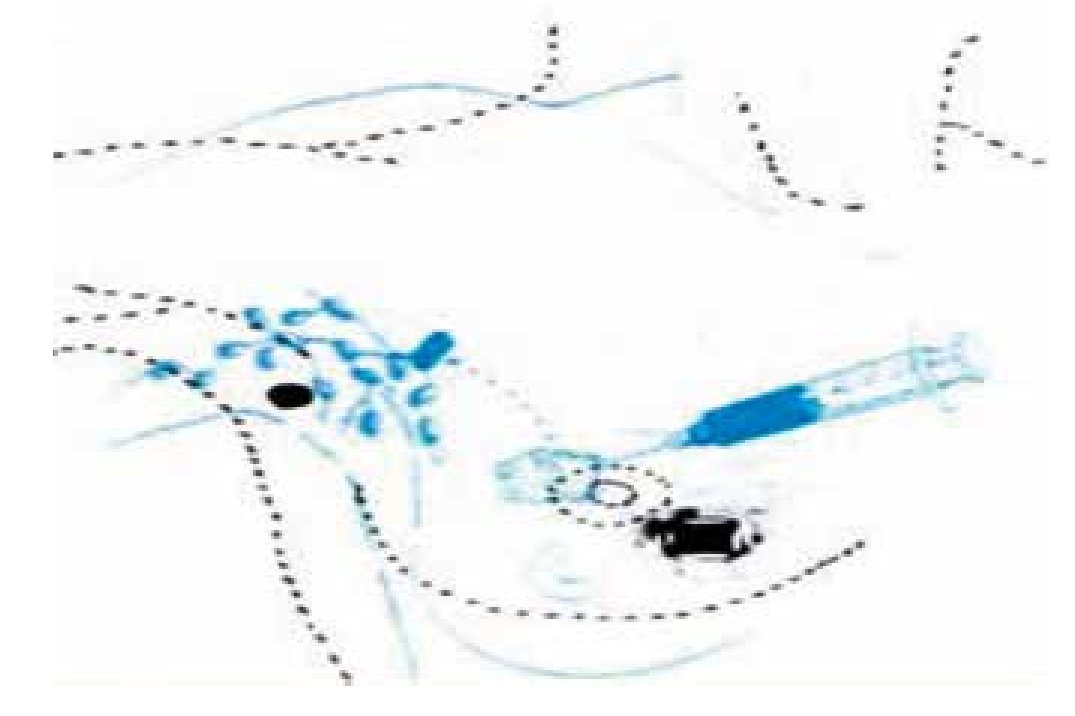
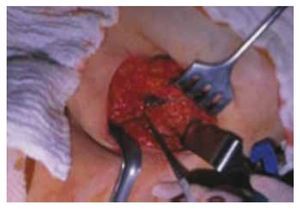
Figura 3 Infiltración peritumoral con isosulfán y visualización transoperatoria del ganglio centinela marcado en azul.
Figura 4 Identificación transoperatoria del ganglio centinela coloreado con azul patente.
Aspectos técnicos quirúrgicos
Cuando se utilice el colorante se recomienda el uso de azul de isosulfán, azul patente o azul de metileno. La dosis recomendada es de 2 mL y el momento de su inyección de 10 a 15 minutos antes de comenzar la intervención. La localización anatómica de la inyección del colorante seguirá los patrones descritos para el trazador isotópico. Es recomendable la aplicación de masaje tras la inyección del colorante. La intervención del ganglio centinela puede realizarse mediante anestesia general o bien bajo anestesia local o locorregional con sedación, como gesto quirúrgico independiente o de forma simultánea al tratamiento del tumor. En el uso del colorante, éste se debería inyectar con los pacientes bajo control anestésico y es recomendable la administración de antihistamínicos y corticoides como profilaxis de reacciones alérgicas. Se recomienda concluir la intervención del ganglio centinela con una exploración digital de la axila para descartar la existencia de adenopatías sospechosas palpables susceptibles de ser biopsiadas31,32.
La detección gammagráfica de GC en la cadena mamaria interna debe conllevar su biopsia, siempre que técnicamente sea factible. Ante la no migración del trazador a la axila, y sólo hacia la mamaria interna, se puede realizar la inyección con colorante, recomendando seguir la misma metodología de la inyección del isótopo; también es posible la realización de reinyección de trazador isotópico o el seguimiento clínico y con técnicas de imagen31,32.
Aspectos relacionados con el procesamiento y análisis de la pieza quirúrgica
Es aconsejable el análisis intraoperatorio del o los ganglios identificados como centinelas con la intención de aumentar la eficiencia de la técnica, realizando la linfadenectomía axilar en caso de ganglio axilar afecto y evitando, de esta forma, reintervenciones. Las técnicas más aconsejables para analizar de forma intraoperatoria el o los GC son mediante cortes por congelación, citología por raspado o impronta citológica. La inmunohistoquímica (IHQ) intraoperatoria es una técnica óptima pero no accesible o disponible en todos los Centros. El procesamiento intraoperatorio de la muestra implica realizar secciones a distintos niveles que permitan detectar metástasis de más de 2 mm. En el análisis definitivo post-operatorio de las muestras, se debe completar el estudio del GC mediante secciones, al menos cada 200 micras, realizando inmunohistoquímica si la técnica de hematoxilina & eosina (HE) es negativa para detectar enfermedad31,32.
Se define como ganglio positivo o afectado aquel que presenta células de características histopatológicas o IHQ de malignidad, matizando como:
— Metástasis: tamaño de más de 2 mm.
— Micrometástasis: tamaño de entre 0.2 a 2 mm.
— Células tumorales aisladas: tamaño de 0.2 mm o menos.
Conducta a seguir en caso de GC positivo
La confirmación de metástasis en GC axilares implica la linfadenectomía reglada axilar, con la terapia adyuvante posterior (quimioterapia, radioterapia y/u hormonoterapia) que se indique en función de las características de tumor primario, el tipo de cirugía realizada (conservadora o radical) y el análisis definitivo del material de linfadenectomía. La confirmación de micrometástasis en el/los GS axilar(es) implica igualmente la linfadenectomía, salvo en aquellos casos que se considere que pueden ser incluidos en ensayos clínicos específicos para el estudio de esta circunstancia. La aplicación de terapias adyuvantes (quimioterapia, radioterapia y/u hormonoterapia) vendrá dictada, fundamentalmente, por las características tumorales del tipo de cirugía realizada (conservadora o radical) y del resultado de la linfadenectomía en el caso de llevarse a cabo. No existe evidencia suficiente para el tratamiento sistémico de las pacientes con micrometástasis (HE o IHQ). Ante la afectación de GC de la mamaria interna y no afectación de GC axilar, se recomienda tratamiento adyuvante de la cadena mamaria interna (radioterapia), sin completar la linfadenectomía axilar31,32.
Ante la afectación del GC de la mamaria interna (en estudio diferido), sin haber drenaje axilar, se recomienda la posibilidad de seguimiento clínico y con técnicas de imagen, sin cirugía axilar. La existencia de células tumorales aisladas no implica la realización de algún procedimiento más31,32.
Conclusiones
Derivado de lo anterior, podemos observar que el tratamiento del cáncer de mama operable ha cambiado en las últimas décadas hacia procedimientos menos agresivos, a través de la cirugía conservadora de mama; la cual se define como la resección completa de tumor con un margen concéntrico de tejido sano, realizado de una manera cosméticamente aceptable y que en pacientes adecuadamente seleccionadas es equivalente a la mastectomía en términos de recurrencia y supervivencia. Realizándose este tipo de procedimiento en pacientes con tumores menores de 3 cm, siempre y cuando la relación mama-tumor sea favorable. Asimismo no se debe olvidar que la evaluación quirúrgica de los ganglios axilares forma parte rutinaria de este tipo de cirugía y esto puede llevarse a cabo a través de una disección radical de axila o mediante la técnica de GC.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
• Autor para correspondencia:
Servicio de Cirugía Oncológica,
Hospital Regional de Alta Especialidad de Ixtapaluca.
Carretera Federal México-Puebla, Km. 34.5,
C.P. 56530, Zoquiapan, Ixtapaluca, Méx., México.
Teléfono: 5972 9800, ext. 1265. Teléfono Celular: (044) 5541352169.
Correos electrónicos: crubeluis@gmail.com, crubeluis@yahoo.com.mx (Luis Cruz-Benítez).