Las guías de práctica clínica (GPC) basadas en evidencia contienen recomendaciones clínicas para asistir a los médicos, a los pacientes y, en general, a todos los tomadores de decisión para que de esta manera se mejore la calidad de la atención clínica.
Material y métodosRevisión narrativa. Describir los fundamentos de la metodología y protocolización de una GPC basada en evidencia.
ResultadosLas GPC contienen recomendaciones clínicas que fueron el resultado del trabajo sistematizado de un grupo de expertos metodológicos, expertos clínicos, representantes de pacientes y otros interesados en el desarrollo de la misma. Este protocolo permite al grupo de desarrollo de la guía establecer un marco general, plantearse preguntas clínicas relevantes de una manera estructurada, responderlas a través de revisiones sistemáticas de la literatura y redactar las recomendaciones clínicas específicas.
ConclusiónLas GPC ayudan a cerrar la brecha entre el conocimiento científico que se genera continuamente y la toma de decisiones clínicas, mejoran la calidad de la atención médica. Este es el tercer artículo de una serie de 3 artículos de revisión MBE con la finalidad de favorecer la realización de documentos basados en evidencia que apoyen la toma de decisiones clínicas en nuestro gremio y fortalecer el papel del mismo como líderes de opinión en el manejo de los padecimientos oncológicos en nuestro país y en el extranjero.
Evidence-Based Clinical Practice Guidelines (CPGs) contain recommendations to assist practitioners, patients and other health professionals in their clinical decisions in order to achieve better healthcare.
Material and methodsNarrative review. The purpose of this work is to describe the CPGs fundamentals and the steps to develop them.
ResultsCPGs contain recommendations result of a systematic work of a development group integrated by clinical and methodological experts, stakeholder and patients representatives. The protocol includes the scope, a list of clinical structured questions and systematic reviews to find, assess and extract evidence. An expert consensus panel methodology is also considered in order to integrated expertise to the existent scientific evidence.
ConclusionCPGs aim is to bridge the gap between scientific evidence and clinical decision-making through clinical recommendations systematically developed. This is the third document of a series of literature review that has been written to aware about the value of CPGs and the importance that clinical oncologists and researchers adopt and develop such documents in our country and worldwide.
La toma de decisiones en la práctica clínica es un proceso intelectual muy complejo, con interminables opciones diagnósticas, pronósticas y terapéuticas. La experiencia clínica lleva un proceso de aprendizaje e integración del conocimiento que requiere tiempo y que se va perfeccionando progresivamente hasta obtener las habilidades diagnósticas y terapéuticas para un mejor cuidado de los pacientes1-3. La experiencia clínica y la consulta con los pares y libros de texto han sido siempre una forma de adquirir esa capacidad clínica y de esta manera tomar decisiones clínicas con nuestros pacientes1. Sin embargo, es muy alta la posibilidad de que las recomendaciones estén sesgadas y de que se perpetúen prácticas clínicas de diagnóstico y tratamiento que ya han demostrado no ser eficaces, o que incluso ya han demostrado ser perjudiciales en el manejo de algún padecimiento. Una mejor atención clínica debería fundamentarse en la integración de la mejor evidencia científica disponible al responder preguntas de investigación concretas y estructuradas a través de protocolos explícitos que siguen el método científico, que son reproducibles y que además integran la investigación básica, la investigación clínica y la investigación centrada en los pacientes1.
La heterogeneidad en el tratamiento de los pacientes, aun entre especialistas de la misma institución y que han recibido entrenamientos similares, es muy grande. Esta situación deriva en una variabilidad muy amplia de criterios diagnósticos, terapéuticos y pronósticos, así como el uso poco eficiente de recursos, y finalmente un impacto negativo en la calidad de la atención clínica4.
Los modelos de tomas de decisiones nos han mostrado que una fuente recurrente de información para el médico en formación es la misma institución en donde va adquiriendo las capacidades clínicas, mismas que va perfeccionando con el tiempo y la práctica. La consulta de libros de texto y la opinión de sus pares es también una fuente importante de asistencia para la toma de decisiones de los clínicos. Sin embargo, aunque muy valiosa, la experiencia y las revisiones descriptivas contenidas en los libros de texto pueden contener sesgos importantes y pueden obstaculizar la incorporación de nuevas tecnologías en nuestra práctica clínica cotidiana. Cada año se publican más de 30,000 estudios clínicos controlados en todo el mundo, lo que hace imposible para el clínico mantenerse actualizado día a día5,6. Además de tener acceso a ese vasto mundo de información científica, es importante llevar a cabo la lectura crítica de los estudios publicados, debido a que no todos los comités editoriales de revistas revisadas por pares pueden hacer una evaluación metodológica exhaustiva para decidir si un estudio se publica o se rechaza, esto es, si la metodología es suficientemente robusta para poder confiar en las conclusiones del mismo. Esto favorece la publicación de estudios clínicos cuya metodología contiene un alto riesgo de sesgos que pueden llevar a que las conclusiones sean equivocadas7-9. Es por todo ello que desde hace casi 30años se ha trabajado en asistir a los médicos y pacientes, a los elaboradores de políticas públicas y a los proveedores de salud en su toma de decisiones8-11.
El profesor e investigador David Sackett, de la Universidad de McMaster, en Canadá, definió la medicina basada en evidencia (MBE) como «el uso concienzudo, explícito y juicioso de la mejor evidencia disponible para la toma de decisiones para el cuidado individual de los pacientes. La práctica de la MBE requiere la integración de la experiencia clínica individual con la mejor evidencia médica disponible obtenida de la investigación sistemática, y de los valores y circunstancias únicas de nuestro paciente»1,8. La MBE requiere, sin duda, herramientas que faciliten la incorporación de todo el conocimiento científico que va surgiendo a la toma de decisiones clínicas en nuestros pacientes. El médico británico A. Cochrane fundó lo que sería la piedra angular de la MBE al proponer el desarrollo de una base de datos donde los estudios clínicos controlados fueran clasificados para ser consultados por los clínicos en cualquier momento11. Estos documentos son las revisiones sistemáticas (RS) de la literatura, las cuales siguen protocolos explícitos, rigurosos y exhaustivos para identificar y evaluar de forma crítica la evidencia, así como sintetizar los estudios relevantes. Después de casi 4décadas de desarrollar una metodología que persigue la disminución de sesgo en las conclusiones, las RS de la literatura se han convertido en la piedra angular de la MBE1,12,13.
Al inicio de la década de los noventa se da un impulso clave a otro instrumento que se situará como pieza clave en la MBE, las guías de práctica clínica (GPC) basadas en evidencia. El reporte del Instituto Nacional de Medicina de Estados Unidos de Norteamérica (IOM, por sus siglas en inglés)11-13 define a las GPC como «recomendaciones desarrolladas sistemáticamente para asistir a los clínicos y a los pacientes en su toma de decisiones para una mejor calidad en la atención de la salud en condiciones específicas». La misión de las GPC es cerrar la brecha entre el conocimiento científico y la toma de decisiones por parte de profesionales de la salud y pacientes. Ayudar en los procesos de educación en salud, auxiliar en la medición de la calidad en la atención clínica, apoyar a los desarrolladores de políticas públicas y administradores para racionalizar el uso de recursos y decidir sobre las tecnologías en salud más costo-eficientes11. La metodología para el desarrollo de las GPC ha llevado un proceso evolutivo continuo, y diversos grupos de investigadores han colaborado permanentemente en una meta muy clara: contar con GPC en las cuales podamos confiar12.
Organizaciones y academias médicas en países desarrollados invierten una gran cantidad de esfuerzo y recursos humanos y económicos para generar una gran cantidad de documentos basados en evidencia cada año, e invierten una gran cantidad de recursos en su implementación y difusión. Por ello, los programas de consensos formales han sido gradualmente abandonados para dar paso al desarrollo de las GPC. Los consensos médicos, al no contar con la metodología para buscar y evaluar críticamente la literatura, pueden contener sesgos y dar recomendaciones equivocadas a los lectores, aunque reflejan muy bien la opinión de expertos en ese campo específico del conocimiento. Los consensos médicos no se consideran GPC al carecer de un desarrollo sistematizado, y los programas gubernamentales han sido cerrados11,12,14.
Distintas organizaciones internacionales han surgido con estos mismos propósitos: estandarizar la metodología para el desarrollo de GPC confiables y proponer estrategias de diseminación y apego a las mismas por parte del público usuario. La Red Internacional de Guías de Práctica Clínica (Guidelines International Network) surge en 2002 como una red de colaboración que actualmente comprende más de 100 organizaciones de 48 países que forman parte de la comunidad mundial para la mejor toma de decisiones a través del desarrollo, adaptación e implementación de GPC a nivel global. La Guidelines International Network trabaja colaborativamente en brindar herramientas educativas y el acceso a miles de documentos basados en evidencia15.
Las GPC requieren un protocolo bien establecido para su desarrollo. Requieren además que a la mejor evidencia disponible se le incorpore la mejor experiencia clínica, pero también los puntos de vista de los usuarios finales, entre los que se deben contemplar pacientes y sus cuidadores, administrativos, médicos, familiares, realizadores de políticas en salud, así como cualquier organización que se desarrolle en el campo de la atención médica13,15.
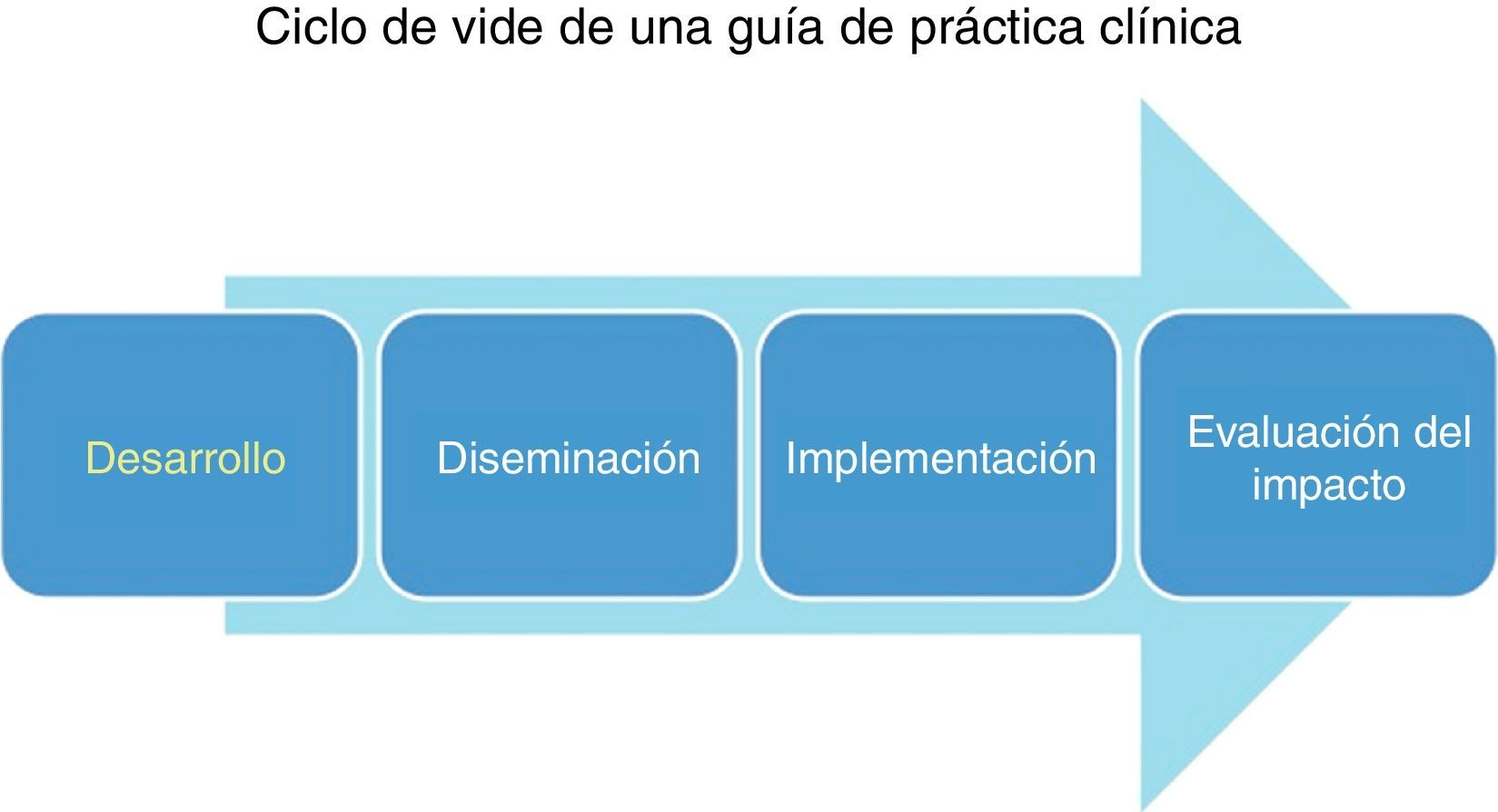
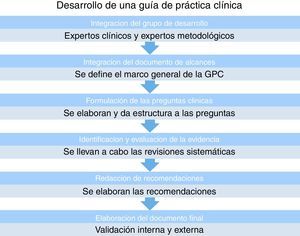
El ciclo de vida de una GPC no termina en el desarrollo de la misma, ya que es muy importante la estrategia y los programas que se implementen para su mejor diseminación e implementación. Es muy importante facilitar la adopción de la misma por parte de los tomadores de decisiones, y que finalmente la guía tenga una repercusión positiva en la calidad de la atención médica13 (fig. 1).
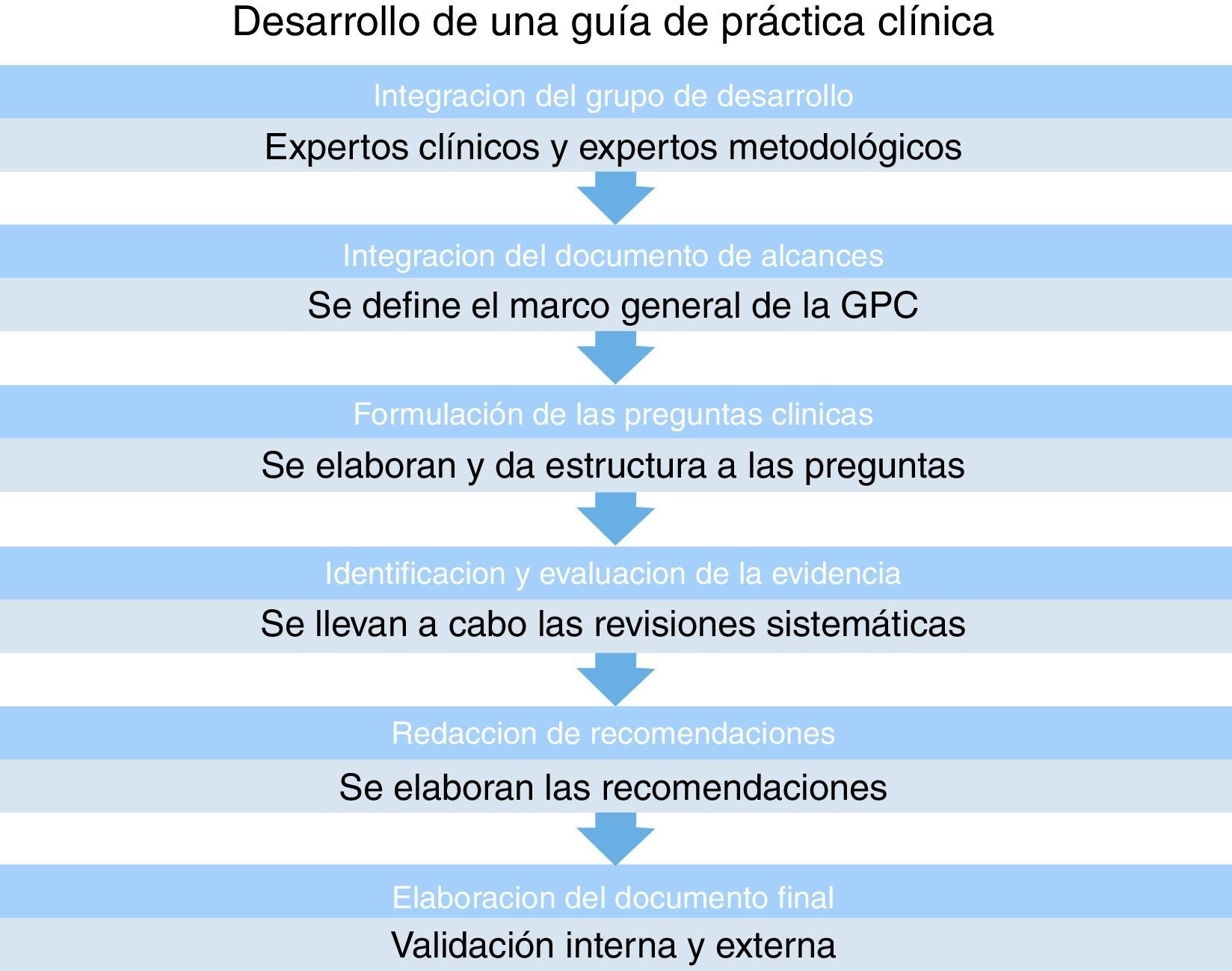
Metodología para el desarrollo de una guía de práctica clínica en la cual «podamos confiar»En la realización de una GPC debe participar un grupo multidisciplinario de expertos en metodología de la investigación, expertos clínicos con amplios conocimientos del tema, documentalistas, así como todo el personal relacionado con la atención de los pacientes, y los mismos pacientes16 (fig. 2).
Cuando se planea realizar una GPC, se debe seleccionar el tema de acuerdo a la pertinencia, magnitud, trascendencia y factibilidad que tiene para el grupo de clínicos, y sobre todo para el lugar en donde se considera aplicar. Esto debido a cubren una amplia gama de intervenciones sanitarias. La aplicación de sus recomendaciones en la práctica clínica hace necesario que sean de alta calidad y se realicen con una metodología rigurosa; por ello, y dada su importancia, el tiempo que se requiere para elaborar una GPC es de entre 18 y 24 meses16,17.
En su elaboración, es crucial definir los objetivos de la GPC, ya que de esto depende el enfoque que se le dará, además que facilita la elaboración de las preguntas clínicas que abordará la guía. En esta fase de elaboración se consulta con los profesionales expertos para definir el documento de alcance y los objetivos. Cuando ya se tiene definido esto, se elabora un documento en el que se deben plasmar los siguientes aspectos: justificación de la guía, a qué población va dirigida, y el tipo de ayuda para la práctica asistencial que se elaborará con la guía16.
Una pieza clave en el éxito es definir el grupo desarrollador, el cual debe estar constituido por un grupo multidisciplinario donde estén representadas todas las áreas profesionales involucradas, mejorando de esta forma la credibilidad y la aceptación de la guía entre los usuarios. Las personas que usualmente participan son: el líder, expertos en metodología, clínicos, pacientes o cuidadores, documentalista, colaboradores externos y un coordinador técnico.
Los pasos para su realización son:
- •
Definir claramente las preguntas de investigación. Es importante que las preguntas se encuentren en el marco del documento de alcances y se redacten de una manera estructurada. Se recomienda la estructura en formato PICO, que se refiere a Pacientes, Intervención, Comparador y Desenlaces (Outcome). Cuando el tema a investigar es pronóstico o prevalencia, la estructura de la pregunta de investigación debe ajustarse. Las respuestas a estas preguntas ayudará a los usuarios de la guía a tomar las diferentes decisiones que se plantean al tratar el objetivo que se identificó17,18.
- •
Decidir el tipo de estudio más adecuado. Se establece cuál es el mejor diseño de estudio de acuerdo al tema de interés en la GPC, y es habitual que sea una intervención, por lo que se establece que el ensayo clínico aleatorizado es el que tendrá menos probabilidad de sesgos y del que se obtendrá la información más confiable. Si se trata de una pregunta sobre diagnóstico, el estudio que se selecciona es prueba diagnóstica transversal o cohorte; para preguntas sobre pronóstico, estudios de cohorte y ensayos clínicos, y para preguntas sobre etiología, estudios de cohorte prospectivos o también estudios de casos y controles17,18.
- •
Búsqueda de la evidencia científica. Es deseable que un experto en búsqueda exhaustiva de la literatura conduzca la identificación de estudios posiblemente relevantes. La bibliografía deber ser identificada siguiendo una estrategia de búsqueda explícita, definiendo los límites y operadores lógicos. El equipo elaborador debe definir de forma precisa los criterios de inclusión y de exclusión de los estudios. De esta forma se pretende que el listado definitivo de artículos sea el más preciso y relevante posible para contestar cada pregunta. Es importante que el especialista en documentación colabore estrechamente con los clínicos, ya que la selección de los estudios responde a criterios clínicos y metodológicos. La revisión bibliográfica comienza con frecuencia por la localización de GPC relevantes que ya existan sobre el mismo tema. La búsqueda de revisiones sistemáticas y de estudios individuales debe realizarse en bases de datos como la Biblioteca Cochrane Plus, DARE, Medline, EMBASE, CINAHL, además de otras más específicas, según el tema de la guía19.
- •
Evaluación y síntesis de la evidencia. Para evaluar la evidencia científica se debe considerar la validez interna que se refiere al rigor de un estudio, para disminuir la presencia de sesgo. Los resultados no deben basarse únicamente en la presencia de una significancia estadística, sino también en la precisión (valorada mediante intervalos de confianza); además, deben considerarse los estimadores de efecto (por ejemplo, riesgo relativo) y la aplicabilidad, que se refiere a la medida en que los resultados del estudio se pueden aplicar a la guía19.
- •
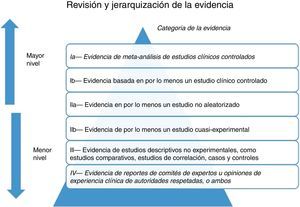
Evaluación crítica de los estudios. Existen diversas herramientas validadas internacionalmente para ayudarnos en la evaluación crítica de los estudios, las cuales son diferentes de acuerdo al diseño de este. Dado que el proceso conlleva cierta subjetividad, es recomendable que cada estudio sea evaluado de forma independiente al menos por 2 miembros del grupo. Si se producen diferencias importantes entre los 2 revisores, se debe discutir al menos con un tercer revisor para salir de controversia. El siguiente paso consiste en extraer los datos relevantes de los estudios cuyo sesgo se ha considerado bajo o moderado. Para sintetizar los estudios seleccionados se pueden emplear tablas de evidencia, que además de resumir las principales características y resultados de cada estudio, permiten compararlos entre sí. Las tablas de evidencia pueden incluir: descripción del estudio, características de los pacientes, intervenciones y comparadores, medidas de resultados y valoración general del estudio19 (fig. 3).
- •
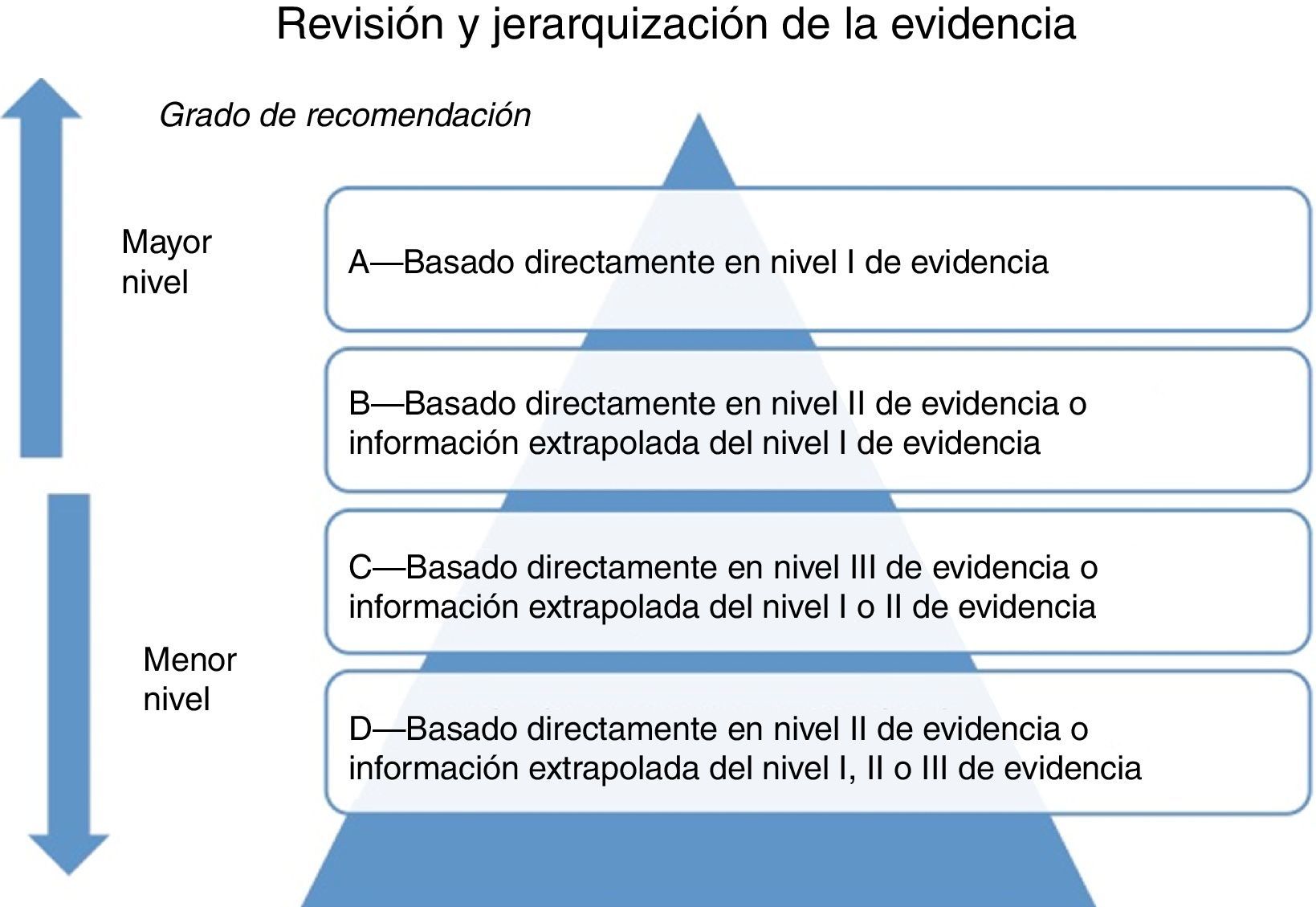
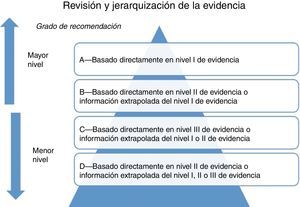
Formular las recomendaciones en función del nivel de la evidencia científica. El grupo elaborador debe evaluar objetivamente la calidad de la evidencia para soportar cierta recomendación y si incorporar alguna intervención o prueba diagnóstica traerá más beneficios que daños para el paciente. Esta decisión está influida por diversos factores, por lo que es una de las etapas más complicadas en la elaboración de la guía. Para formular recomendaciones es importante evaluar la calidad global de la evidencia científica y la graduación de la fuerza de las recomendaciones (fig. 4).La calidad de la evidencia científica es la confianza que se tienen en que el efecto que reflejan los estudios es cercano a la realidad. Es decir, la confianza en que la estimación de un efecto es adecuada para apoyar una recomendación. Mientras más alta sea la calidad de la evidencia, mayor será la confianza y menor la probabilidad de que estudios posteriores modifiquen el efecto observado20.Hay muchas clasificaciones desarrolladas para evaluar la calidad de la evidencia, y una de las más novedosas y que ha ganado aceptación es el sistema GRADE (Grading strength of recommendations and quality of evidence in clinical guidelines), el cual recomienda que se establezcan las variables de resultado de interés para las preguntas y se clasifique su importancia relativa con una escala del 1 al 9 (1-3 variables de resultado no importantes, 4-6 variables de resultado importantes pero no clave para la toma de decisiones, 7-9 variables de resultado clave para la toma de decisiones)21 (fig. 5).En el sistema GRADE la evaluación de la calidad se realiza para cada una de las variables de resultado. La calidad de la evidencia científica se cataloga como alta, moderada, baja y muy baja.Los aspectos que pueden disminuir la calidad son los siguientes: limitaciones en el diseño y la ejecución, resultados inconsistentes, ausencia de evidencia científica directa, imprecisión y sesgo de notificación.Los aspectos que pueden aumentar la calidad de los estudios son: efecto importante (asociación fuerte RR>2 o <0.5), la presencia de un gradiente dosis respuesta y situaciones donde los factores confusores podrían haber reducido la asociación observada.El sistema GRADE propone que las variables de resultado clave son las únicas que se tienen que tomar en cuenta para evaluar la calidad de forma global. La graduación de la fuerza de las recomendaciones es relativamente sencilla, ya que se consideran solo 2 categorías: recomendación fuerte y débil. En las recomendaciones fuertes se confía en que los efectos beneficiosos superan a los perjudiciales, es decir, que los daños superen a los beneficios. En una recomendación débil se concluye que los efectos benéficos de llevar a cabo la recomendación probablemente superan a los perjudiciales, aunque no es completamente seguro21.Los factores que se toman en cuenta para graduar las recomendaciones son: balance entre beneficios y riesgos, calidad de la evidencia científica, valores, y preferencias y costos.
Figura 4.Grados de recomendación de acuerdo a la calidad de la evidencia.
Adaptado de Shekelle et al.8. - •
Implementación de la guía. Se deben considerar algunos puntos que faciliten el empleo de la guía para la toma de decisiones clínicas; tienen importancia el formato de la guía, el lenguaje utilizado, la forma de redacción… Las guías muy extensas suelen ser desechadas por los lectores, por lo que el documento debe ser lo más sintético posible para favorecer una búsqueda rápida de información; además debe tener un formato ameno, incluyendo gráficos y algoritmos de apoyo para la toma de decisiones.
- •
Revisión externa. Es una etapa fundamental para asegurar la exactitud de las recomendaciones. Este proceso aumenta la validez externa de la guía y sus recomendaciones. Debe ser de carácter multidisciplinario y, dependiendo del tema de interés, incluir un amplio grupo de profesionales de los ámbitos relacionados. Además, es importante que participen pacientes o cuidadores con el objetivo de enriquecer la versión final de la guía.
Las GPC basadas en evidencia contienen recomendaciones clínicas que nos ayudan a tomar mejores decisiones clínicas con nuestros pacientes, ya que fueron elaboradas a través de protocolos explícitos y sistemáticos, y cumplen con los fundamentos de medicina basada en evidencia. Las GPC cierran la brecha entre el conocimiento científico y la práctica clínica cotidiana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.