El cáncer del cuello del útero es un problema importante de salud pública en nuestro país. El tratamiento del carcinoma cervicouterino (Ca. Cu.) depende de la etapa clínica. Las modalidades terapéuticas han sido cirugía, la radioterapia y el tratamiento combinado con radioterapia más quimioterapia.
ObjetivoInformar la experiencia del Instituto Regional del Tratamiento del Cáncer (IRTC) en pacientes con cáncer del cuello del útero, tratadas con radioterapia externa más braquiterapia con Iridio 192.
MétodoEs un estudio descriptivo, retrospectivo, de 32 pacientes con cáncer del cuello de la matriz tratadas con radioterapia externa con acelerador lineal, una dosis de 5,000cGy (técnica isocéntrica) más braquiterapia de alta tasa, una dosis de 2,100cGy en 3 sesiones; sin embargo, las pacientes con la etapa iA2 solo recibieron braquiterapia y tuvieron un seguimiento mínimo 2 años.
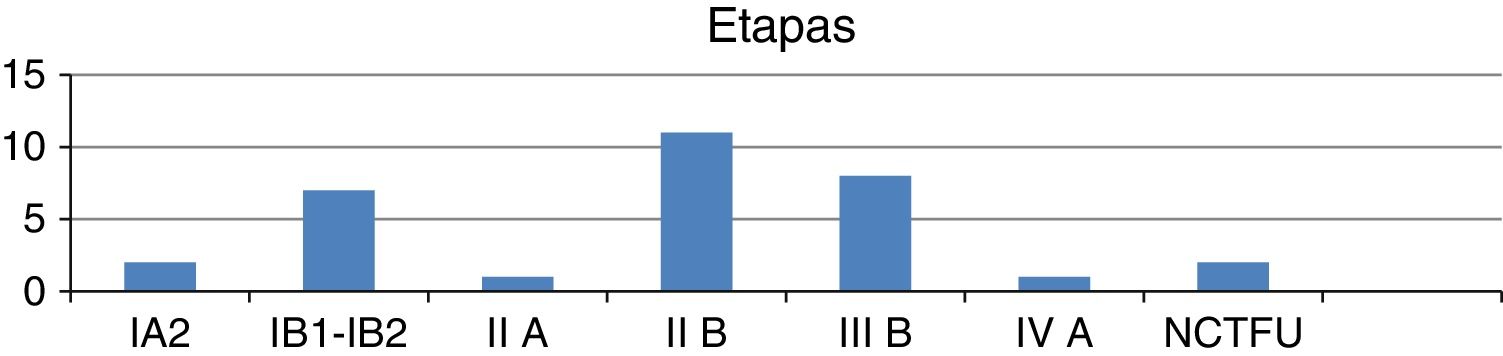
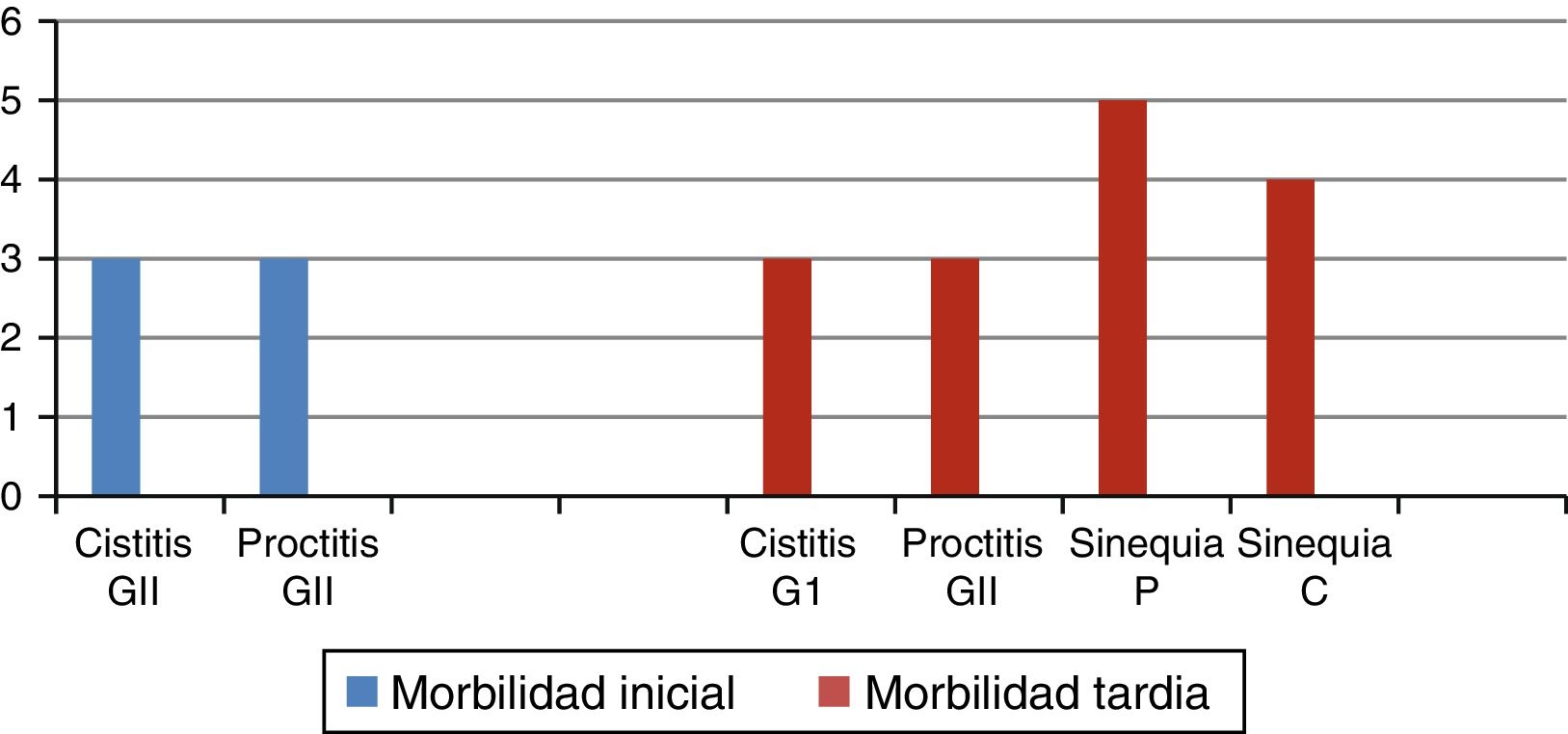
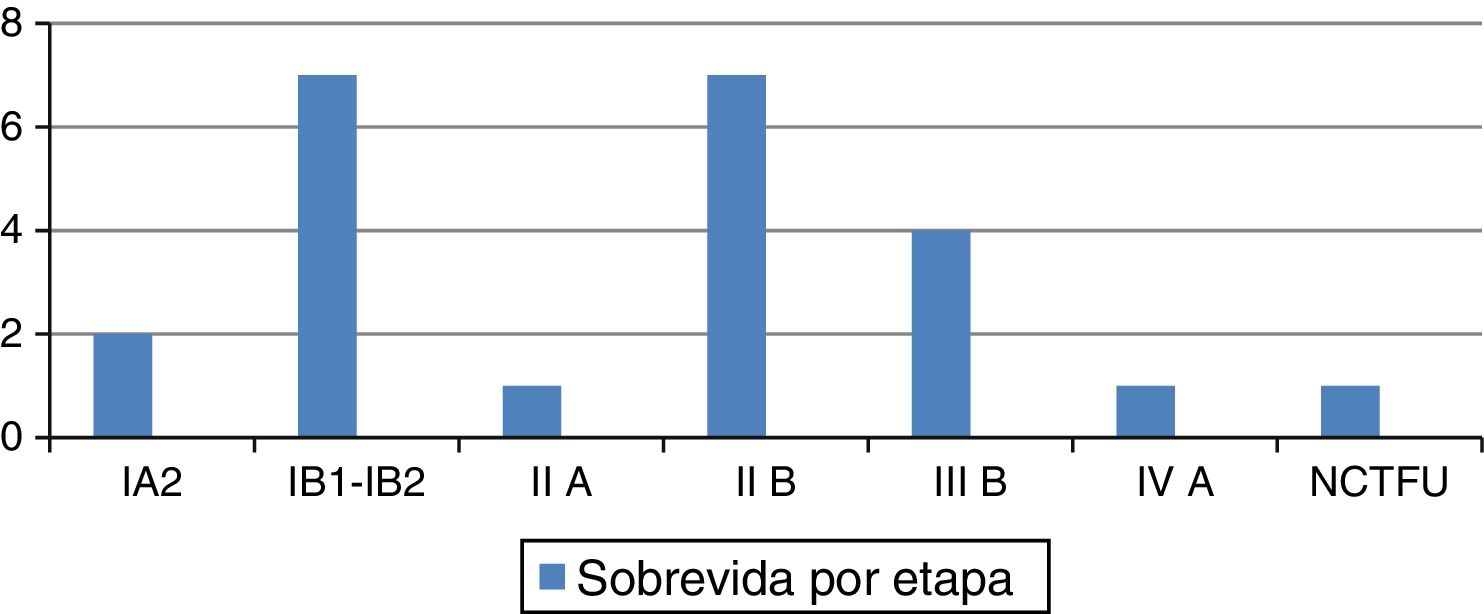
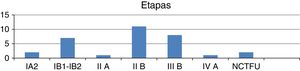
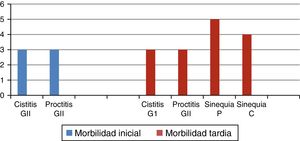
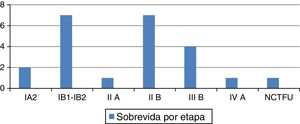
ResultadosEtapa iA2, 2 pacientes, etapa iB1 y iB2, 7 pacientes, etapa iiA, un paciente, etapa iiB, 11 pacientes, etapa iiiB, 8 pacientes, etapa ivA, un paciente, NCTFU, 2 pacientes, solamente 3 pacientes –2 en etapa iiB y una en etapa iiiB– recibieron quimioterapia concomitante. Morbilidad inicial: cistitis grado ii 3 pacientes, proctitis grado ii 3 pacientes; en lo que se refiere a la morbilidad tardía: proctitis grado ii 3 pacientes, cistitis grado i 3 pacientes, sinequia parcial 5 pacientes, sinequia completa 4 pacientes. La sobrevida sin AT, 23 pacientes, realizando el desglose: etapa iA2, iB1-iB2, iiA todas vivas, de la etapa iiB solo 7 pacientes, de la iiiB 4 pacientes, el ivA una viva, al igual que una de las NCTFU. En lo que se refiere a los MCAT, son 9 pacientes, distribuidos de la siguiente manera: 4 pacientes etapa iiB, 4 pacientes etapa iiiB y uno NCTFU.
ConclusiónEl control locorregional y la sobrevida son similares a lo informado en la literatura y con menor morbilidad.
Cervical uterine cancer (CUC) is an important public health problem in our country. The treatment of this cancer depends on the clinical stage. The therapeutic modalities used may be surgery, radiotherapy, and a combination of radiotherapy plus chemotherapy.
ObjectiveTo describe the experience of the Regional Institute of Cancer Treatment (RICT) in patients with cervical cancer treated with external radiotherapy plus brachytherapy with iridium 192.
MethodA descriptive, retrospective study was conducted on 32 patients with cervical uterine cancer treated by external radiotherapy with linear accelerator, a 5000 dose of cGy (isocentric technique) plus 2100 cGy with high dose rate (HDR) brachytherapy in 3 sessions. Patients with clinical stage IA2 were treated only with brachytherapy, with a minimum follow-up of 2 years.
ResultsThere were 2 patients in stage IA2, 7 in stage IB1-IB2, 1 patient in IIA, 11 patients in IIB, 8 in stage IIIB, 1 patient in stage IVA 1, and 2 patients unclassified. Only 3 patients (2 in stage IIB, and 1 in stage IIIB) were treated with concomitant chemotherapy. Immediate morbidity was grade II cystitis in 3 patients and grade III proctitis in 3 patients. The delayed morbidity included grade II proctitis in 3 patients, grade I cystitis in 3 patients, partial synechiae in 5 patients, and complete synechiae in 4 patients. Twenty-three patients survived with no tumour activity, which included, brachytherapy only in 2 in stage IA, 7 in IB1-IB2, 1 in IIA, 7 in stage IIB, 4 in stage IIIB, 1 in stage IVA, and 1 in unclassified. Of the 9 patients that died, 4 were in stage IIB, 4 in stage IIIB, and 1 unclassified.
ConclusionLocoregional control and survival are similar to those reported in the literature, but with less morbidity.
El cáncer cervicouterino es la enfermedad del tracto genital más frecuente en nuestro medio y representa la primera causa de morbimortalidad en mujeres1. Continúa como un problema importante de salud pública. El tratamiento del carcinoma cervicouterino depende de la etapa clínica; se acepta que reciban radioterapia (Rt) las etapas iA1 con invasión estromal mayor de 3mm e invasión linfovascular2 y el resto de las etapas de iB1-ivA del National Comprehensive Cancer Network version 1 20153. Las modalidades terapéuticas han sido la Rt externa, que otorgamos con acelerador lineal, y la braquiterapia con Iridio 192. Últimamente se ha determinado que el tratamiento combinado de Rt+quimioterapia ofrece mejores beneficios, ya que incrementa la tasa de control local del volumen irradiado(Eifel et al.4).
ObjetivoInformar la experiencia con el tratamiento con Rt externa con acelerador lineal y braquiterapia de alta tasa a dosis bajas en pacientes con cáncer cervicouterino.
Material y métodosTreinta y dos pacientes con un seguimiento mínimo de 2 años y máximo de 5 años, de una etapa iA2 a una etapa ivA. La Rt externa se dirige al volumen tumoral y a los sitios potenciales de infiltración tumoral; generalmente se utilizan 4 campos de tratamiento AP-PA y laterales (pelvis). El rango de dosis de Rt externa es de 50Gy, con una dosis por día de 2Gy, para un total de 5 semanas de tratamiento. Con la técnica isocéntrica.
Para la braquiterapia de alta tasa se utilizan fuentes de Iridio 192. La dosis liberada en unidad de tiempo es alta, usamos aplicadores Fletcher, se determina dosis a recto y vejiga, se prescriben a los puntos «A». Mediante un sistema de cómputo se realiza una adecuada distribución de la dosis prescrita a través de optimización, se obtiene una cobertura apropiada del volumen tumoral y una menor dosis a los órganos de riesgo5–10. El tamaño de la fracción y su número dependen de la dosis de Rt externa; si se utilizan dosis bajas de teleterapia debe darse un tamaño de fracción mayor y aumentar el número de fracciones. Los órganos de riesgo son recto y vejiga. La toxicidad en grados se determina mediante la siguiente escala según el Grupo Oncológico de Radioterapia Trotti11: proctitis grado 0: sin alteraciones; grado 1: incremento en la frecuencia de las evacuaciones, evacuaciones con sangrado ocasional; grado 2: incremento en la frecuencia de las evacuaciones, el sangrado requiere medicación; grado 3: evacuaciones numerosas que requieren aporte parenteral, o que por el sangrado rectal amerite transfusión de paquete globular; grado 4: perforación, sangrado o necrosis, precisa que se utilice cirugía; Cistitis-disuria grado 0: sin alteración; grado 1: síntomas moderados que no requieren manejo; grado 2: síntomas que se alivian con terapia; grado 3: fístula que requiere intervención quirúrgica; hematuria grado 3: cateterización, instrumentación o transfusión; grado 4: necrosis o ulceración profunda con manejo quirúrgico.
La utilización de quimioterapia en cáncer cervicouterino de forma concomitante o simultánea11–17 ofrece mejor resultado: el riesgo de recurrencia se reduce un 20%, motivado porque la quimioterapia es un radiosensibilizador, reduce el número de células tumorales, inhibe la reparación del daño subletal inducido por Rt, promueve la sincronización del ciclo celular en fases radiosensibles y reduce la fracción de células hipóxicas resistentes a la radiación.
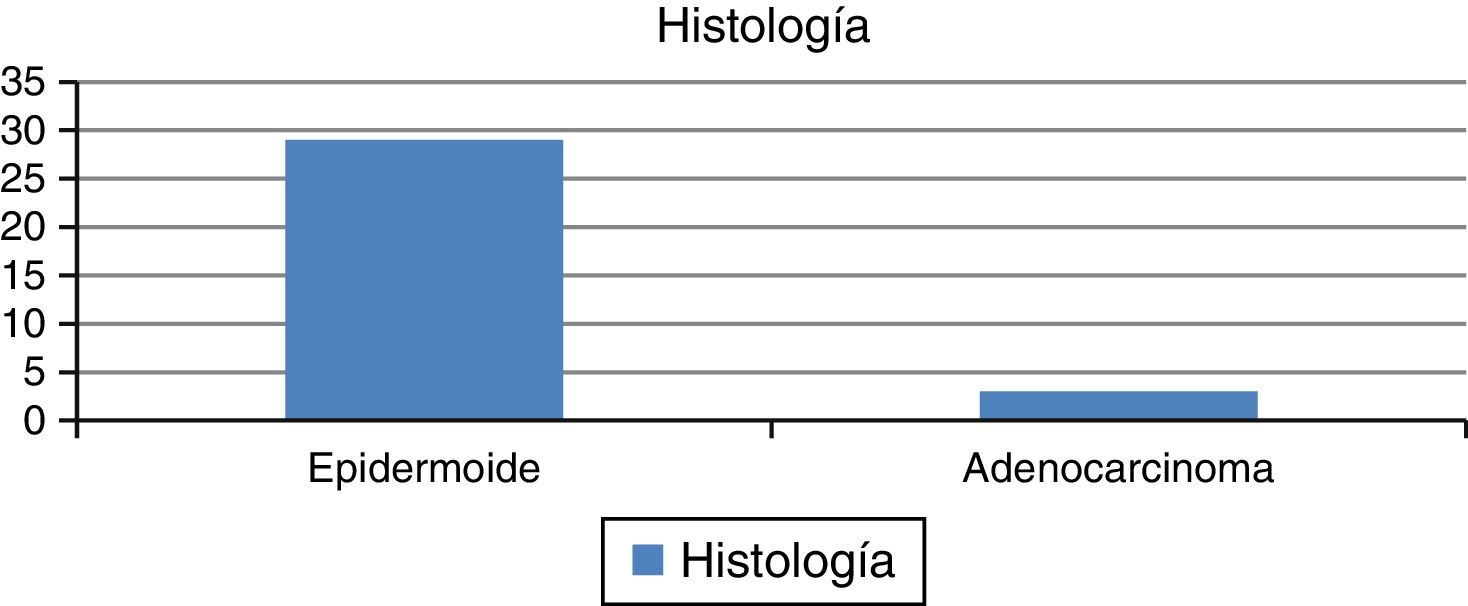
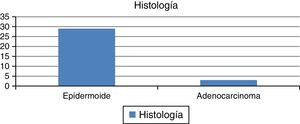
ResultadosTreinta y dos pacientes tuvieron un seguimiento mínimo de 2 años, de los cuales 29 tenían histología de carcinoma epidermoide y 3 de adenocarcinoma (fig. 1); por etapas: iA2, 2, iB1-iB2, 7, iiA 1, iiB 11, iiiB 8, ivA 1, NCTFU 2 (fig. 2).
Solamente 3 pacientes –2 en etapa iiB y una en etapa iiiB– recibieron quimioterapia concomitante; morbilidad inicial: cistitis grado ii 3 pacientes, proctitis grado ii 3 pacientes; en lo que se refiere a la morbilidad tardía: proctitis grado ii 3 pacientes, cistitis grado i 3 pacientes, sinequia parcial 5 pacientes, sinequia completa 4 pacientes (fig. 3).
La sobrevida sin AT: 23 pacientes; realizando el desglose, etapa i2,iB1-iB2, iiA todas vivas, de la etapa iiB solo 7, de la iiiB, 4, en el ivA una viva al igual que una de las NCTFU. En lo que se refiere a los MCAT, son 9 pacientes, distribuidos de la siguiente manera: 4 en etapa iiB, 4 en etapa iiiB y una en NCTFU (fig. 4).
DiscusiónLas estrategias de manejo con braquiterapia en lo que se refiere al tamaño de la fracción y su número depende de la dosis de Rt externa; si esta es de 50Gy se completa con braquiterapia, tratando de alcanzar la dosis de 80Gy en etapas iniciales, en avanzados hasta 85Gy de acuerdo con lo informado por diversos autores18–21. Los integrantes de la Sociedad Americana de Braquiterapia con experiencia en alta tasa, y apoyados en una revisión exhaustiva de la literatura8,10, Logsdon y Eifel7 y Viswanathan et al.9, recomiendan dosis del tratamiento combinado en etapas iniciales de 45Gy de Rt externa+5 o 6 aplicaciones de alta tasa, con una dosis en cada aplicación de 6 y/o 5Gy. En el IRTC usamos 50Gy, como Rt externa+3 aplicaciones de braquiterapia de 7Gy cada una.
En relación con etapas más avanzadas5, se recomienda 50.4Gy de Rt externa+6 aplicaciones de 6Gy cada una. Volviendo al trabajo del IRTC, no se cambió de estrategia de manejo. En la revisión de la literatura nacional encontramos el trabajo de Bautista et al.21, donde la media de la dosis de Rt externa de 49.9Gy (rango de 45 a 50) y la dosis de braquiterapia en la mayoría de las pacientes fueron 4 aplicaciones de 5.5Gy cada una, la media del seguimiento fue de 21 meses (7 a 50) y el porcentaje de vivas sin AT de 64.7%; la toxicidad crónica fue de 38.6%
Otra información que rescatamos fue la publicada por Romero et al.12, donde evaluaron la supervivencia, tolerancia y toxicidad con Rt pélvica sola vs. Rt y quimioterapia simultánea más braquiterapia (HDR vs. LDR) en 118 pacientes. Reportan que no encontraron diferencias estadísticamente significativas entre terapia combinada vs. Rt sola(p=0.952). La toxicidad es igual y tampoco encontraron diferencias entre HDR vs. LDR. Su media de seguimiento fue de 29 meses (7 a 67). Utilizaron 2 esquemas de fraccionamiento para la HDR, 3 de 7.5Gy o 4 de 5.2Gy.
La Sociedad Americana de Oncología Médica11 informa un metaanálisis que incluyó 18 estudios de 11 países, donde se demuestra mejoría de la sobrevida global y sobrevida libre de enfermedad cuando se utiliza la quimioterapia con la Rt; sin embargo, se cuestiona el beneficio limitado al riesgo de la enfermedad a distancia.
En nuestro país, ya desde 1990 Lira Puerto et al.15 informaron de la combinación de cisplatino+Rt vs. Rt sola, encontrando una diferencia a favor de la terapia combinada de un 33%. Así también lo informan Pearcey et al.17.
Cardenas et al.14 publicaron su experiencia de quimioterapia neoadyuvante en carcinoma cervicouterino etapa iiiB, encontrando mejor respuesta local; sin embargo, es pequeño el número de pacientes.
Dueñas-González et al.16 aplicaron en su estudio gencitabina+cisplatino de forma concomitante con la Rt externa, seguido de braquiterapia y quimioterapia adyuvante, vs. tratamiento convencional más cisplatino, mejorando la sobrevida; sin embargo, se presentó toxicidad grado 3 y 4, en este brazo más que en el convencional, con diferencia de una p significativa, incluyendo 2 muertes.
En lo que se refiere a la toxicidad, el estudio de Bautista et al.21 informa un 12% de aguda y un 38.5% de crónica; dicen que es igual a la que está informada en la literatura18–20,22–25). Romero et al.12 comentan que la toxicidad es igual.
El control local que obtuvimos está inmerso, en lo referido en la literatura, en etapa i de 88 a 93%, en etapa ii de 66 a 88% y en etapa iii de 48 a 63%.
En lo que respecta a la morbilidad tardía, tuvimos un 18%, que es baja, comparado con lo informado por Bautista et al.21 y Romero et al.12. Pero es alta con respecto a otros autores20,23–25.
La revisión de la literatura señala un mayor número de fracciones en etapas avanzadas, con especial atención en la morbilidad secundaria a nivel rectal y vesical18,22,23.
ConclusiónEl control locorregional y la sobrevida son similares a lo informado en la literatura y con menor morbilidad.
FinanciaciónLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.