La frecuencia del carcinoma de colon en México se ha incrementado, por lo que en la mayoría de los hospitales se reciben especímenes con esta neoplasia. Se requiere que los patólogos se integren en el equipo multidisciplinario que maneja esta enfermedad y, realicen evaluaciones sistemáticas y minuciosas de los especímenes quirúrgicos, obteniendo la información necesaria para estadificar e identificar factores pronósticos y predictivos, y de esa manera se puedan tomar decisiones terapéuticas adecuadas. En este artículo se hacen recomendaciones para el manejo de piezas quirúrgicas con carcinoma de colon.
The frequency of colon carcinoma in Mexico has increased so that in most hospitals specimens with this tumor are received. Pathologists are required to integrate in the multidisciplinary team managing this disease and make systematic and thorough evaluation of surgical specimens gathering accurate information for staging and to identify prognostic and predictive factors, and thus make appropriate therapeutic decisions. This article will make recommendations for the management of surgical specimens with colon carcinoma.
Introducción
En el mundo, el cáncer colorrectal ocupa el tercer lugar en frecuencia entre las neoplasias malignas, siendo la cuarta causa de muerte por cáncer1. En México, de los casos reportados en el 2006, esta neoplasia representa el 3.6% de las malignas en general, constituyendo el cáncer más común del tracto digestivo2-4. El diagnóstico tardío frecuentemente se presenta en algunas series hasta en el 85% de los pacientes en estadios III y IV al momento del diagnóstico5. A diferencia de lo que ocurre en países desarrollados en México, la tasa de mortalidad se ha incrementado.
Una medida para mejorar la sobrevida en carcinoma de colon es la identificación de pacientes que se beneficien con tratamientos adyuvantes y protocolos de manejo intensivos, a través de la evaluación de factores pronósticos y predictivos en éstos. En este sentido, el patólogo juega un papel trascendente ya que la determinación del estadio y la evaluación de factores pronósticos histológicos, los debe realizar al estudiar los especímenes de resección. Es por ello que el patólogo debe ser parte de un equipo multidisciplinario en el manejo de pacientes con carcinoma de colon, participando en la toma de decisiones en relación al tratamiento a través de la información emitida en el reporte histopatológico.
Como parte del equipo multidisciplinario, el patólogo por medio del informe histopatológico de los especímenes de resección confirma el diagnóstico emitido, se determina pronóstico, ayuda a la planeación de tratamiento subsecuente, da elementos para la evaluación de las prácticas de los integrantes del equipo (Cirugía, Radiología, Radioterapia, Oncología Médica, Patología), brinda información para tener un registro epidemiológico de cáncer y facilita la realización de estudios de investigación de calidad.
En este texto se dan recomendaciones para la evaluación e informe de piezas de resección quirúrgica con carcinoma de colon.
Anatomía del colon
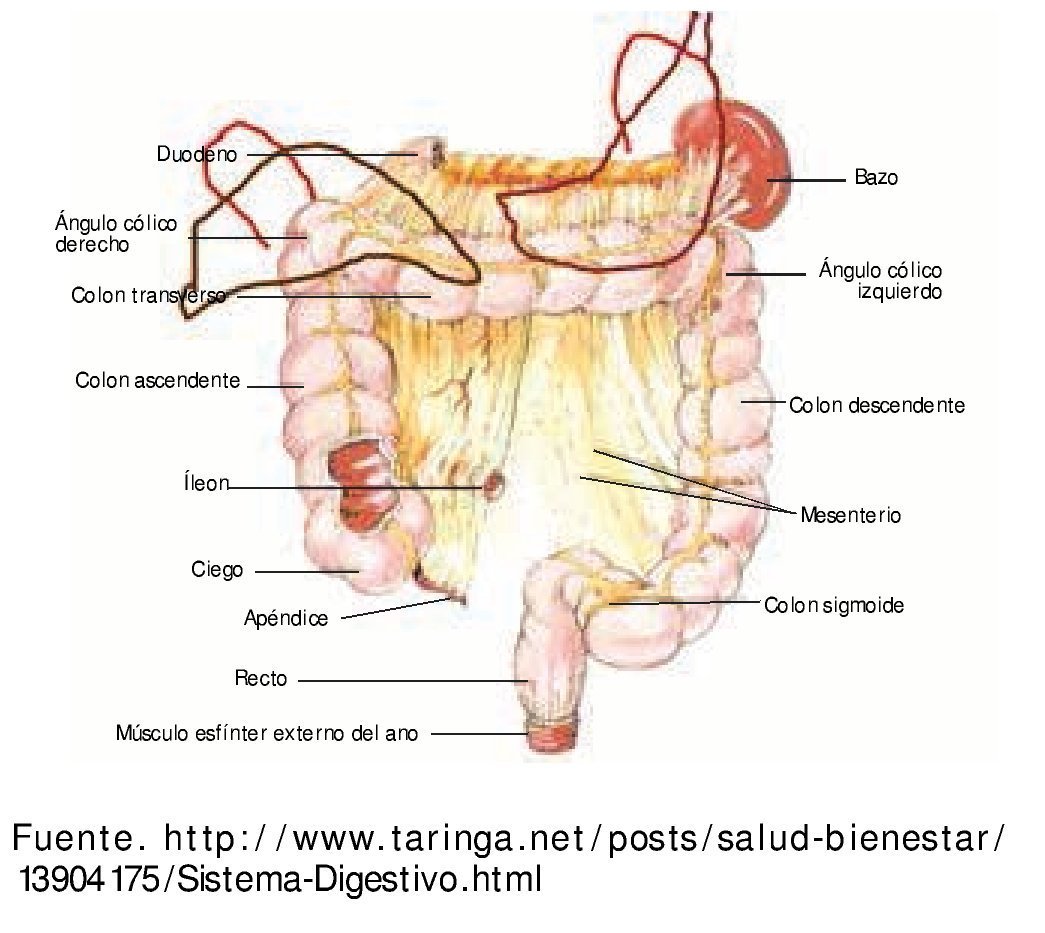
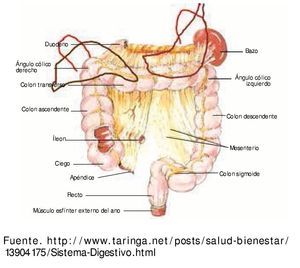
Se mencionarán algunos puntos relevantes que influyen en el manejo de piezas quirúrgicas y la relación del colon con estructuras vecinas, que de manera secundaria pueden ser infiltradas por una neoplasia primaria de colon6 (fig. 1).
Figura 1 Esquema de colon y sus relaciones con otros órganos. Riñón derecho, riñón izquierdo, bazo, estómago, páncreas, duodeno, hígado, uréteres.
El colon es el segmento de tubo digestivo comprendido entre la válvula ileocecal y el recto. Se distinguen 7 regiones sucesivas: ciego, colon ascendente, ángulo derecho, colon transverso, ángulo izquierdo, colon descendente y sigmoides.
• Ciego. Es la porción inicial del colon, tiene forma de balón abollonado, en su extremo proximal se une al íleon por la cara medial. La porción anterior se relaciona con músculos del abdomen, la mayoría de las veces a través del epiplón mayor. A través de la fascia posterior está relacionado con el músculo iliopsoas y el uréter.
• Colon ascendente. Es de menor calibre que el ciego y mide entre 10 y 15 cm de longitud. Por delante se relaciona con asas de intestino delgado, el epiplón mayor y la pared abdominal anterior. En la cara posterior a través de la fascia de Toldt está en contacto con la pared muscular posterior, el riñón y el uréter. En el ángulo derecho en su cara posterior a través de la fascia tiene relación con la segunda porción del duodeno y la cabeza del páncreas. En la superficie anterior está en contacto con la cara inferior del hígado.
• Colon transverso. Sus 2 tercios iniciales forman parte del colon derecho junto con el ciego y el colon ascendente. En el extremo derecho se relaciona por delante con la vesícula biliar y el hígado, y después con la pared anterior del abdomen a través del epiplón mayor. Por detrás se relaciona con el duodeno y el páncreas. En sus 2 tercios izquierdos se vincula con asas de yeyuno. Por su borde superior está en contacto con la curvatura mayor del estómago y después con el polo inferior del bazo. El ángulo izquierdo por arriba se relaciona con el bazo, por detrás con la cola del páncreas y el riñón. En la cara superior del mesocolon del transverso se inserta el epiplón mayor. Se puede diferenciar el omento del meso por su aspecto más granular y lobulado. La superficie del mesocolon cubierta por mesotelio es lisa y homogénea.
• Colon descendente. Es de menor calibre que el colon derecho y tiene abundantes apéndices epiploicos. Se apoya en la pared abdominal posterior siguiendo el borde lateral del riñón y el psoas. En su cara posterior está en contacto con vasos, músculos y el uréter; por delante con asas de intestino delgado, el borde lateral está relacionada con músculos de pared abdominal.
• Sigmoides. Tiene forma de asa, por delante en el segmento proximal está relacionada con vasos y el uréter izquierdo. La superficie externa del colon está recorrida por las tenias, que son la condensación de la capa muscular longitudinal externa.
Existen 3 tenias, la más aparente anterior y 2 posterolaterales. A nivel del sigmoides las tenias se reducen a 2, una anterior y una posterior.
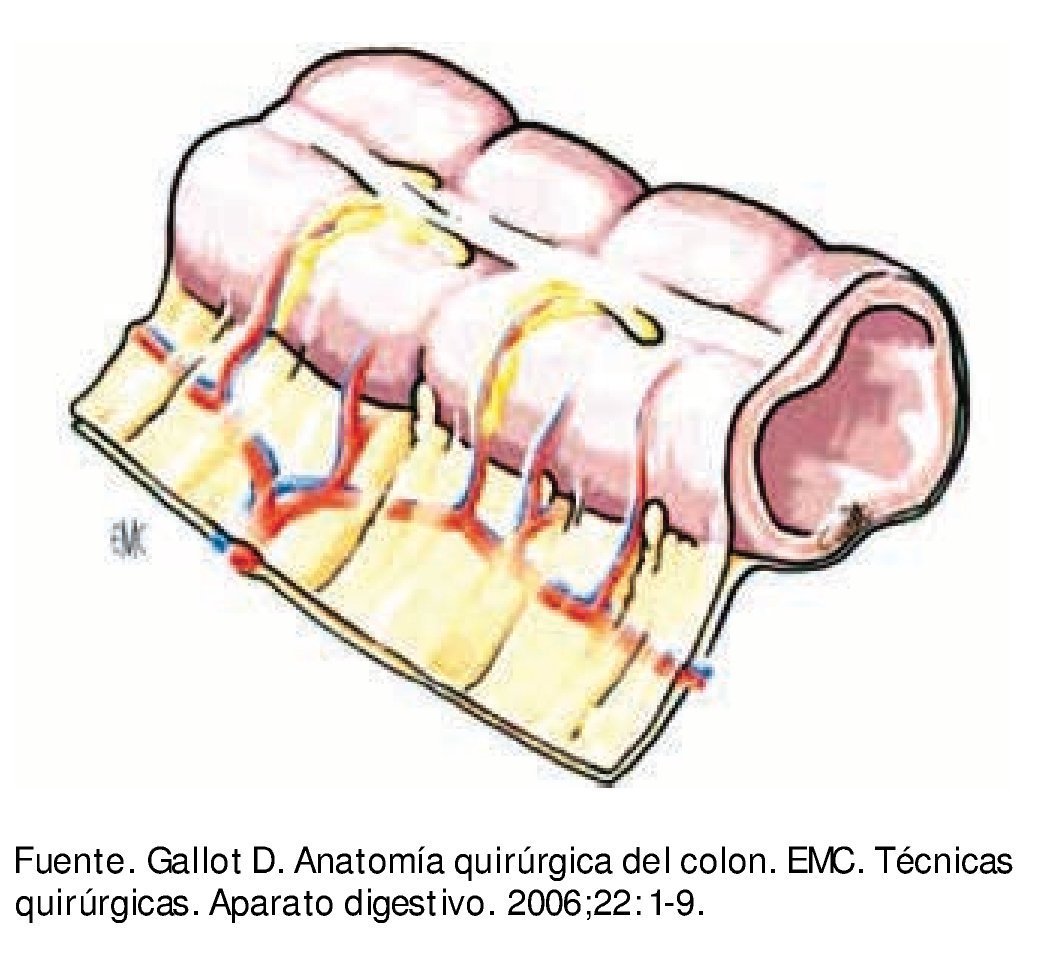
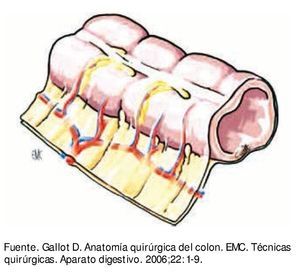
La superficie libre del colon está rodeada por serosa peritoneal. La superficie no peritonealizada está adherida al mesocolon que se inserta al retroperitoneo. El mesocolon está constituido por tejido adiposo que tiene inmersos vasos y ganglios linfáticos, éste a su vez está cubierto por mesotelio peritoneal (fig. 2). Dependiendo del segmento del colon es la extensión de la superficie peritonealizada y el volumen del mesocolon.
Figura 2 Pared de colon con meso, cubiertos ambos por peritoneo.
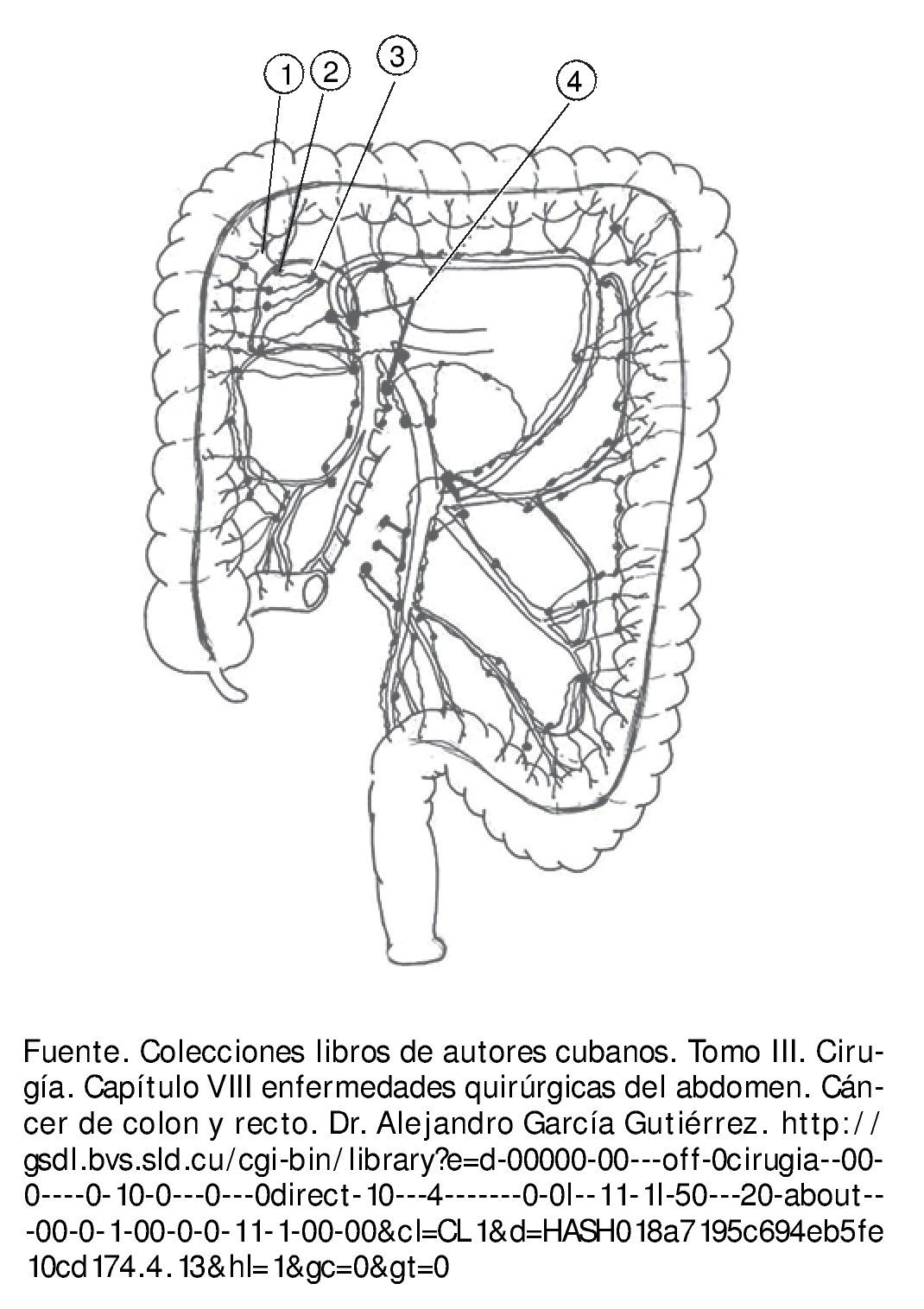
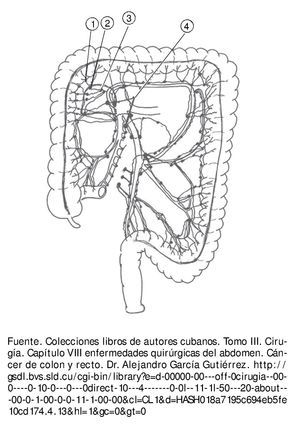
El drenaje linfático del colon se hace por los vasos linfáticos que transcurren entre las 2 hojas del meso. A ambos lados de estos se encuentran numerosos ganglios dispuestos en 4 grupos (fig. 3):
Figura 3 Ganglios lifnáticos: un ganglio epicólico, 2 ganglios paracólicos, 3 ganglios intermedios y 4 ganglios centrales.
1. Ganglios epicólicos. Situados en contacto con la pared del colon.
2. Ganglios paracólicos. Localizados a lo largo de la arteria marginal.
3. Ganglios intermedios. Agrupados a lo largo de los vasos sanguíneos radiales.
4. Ganglios centrales. Situados en las raíces de los troncos vasculares principales.
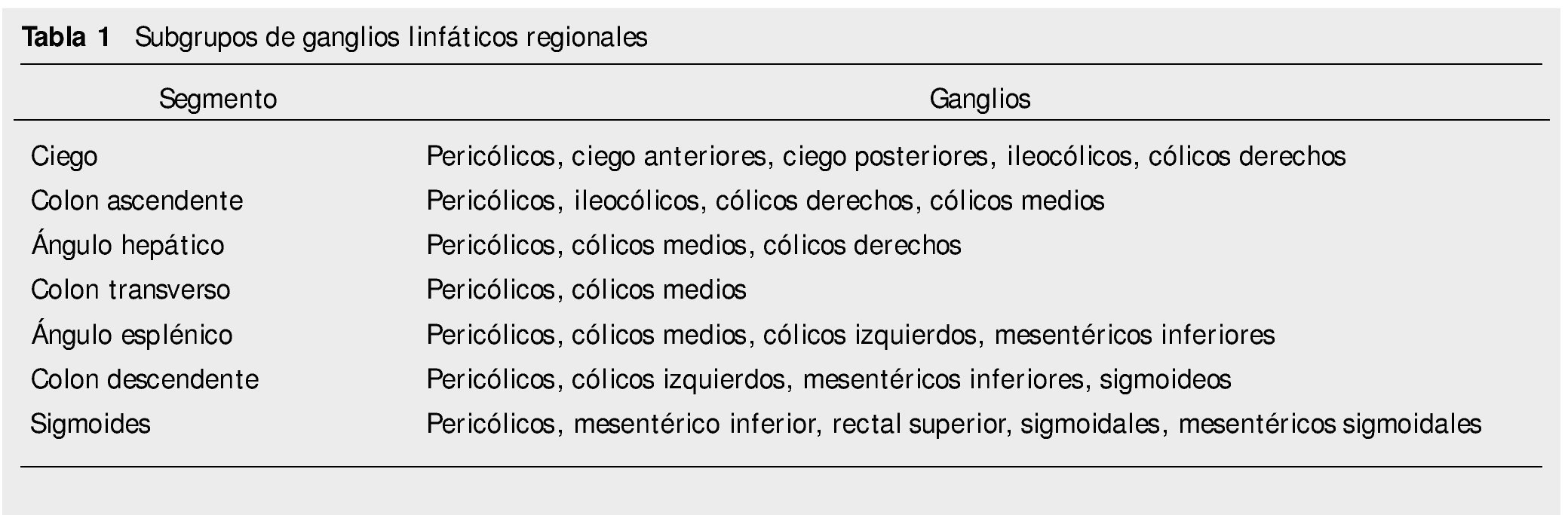
Los subgrupos de ganglios linfáticos regionales según los subsitios anatómicos de colon, se muestran en la tabla 1.
Información clínica requerida para la evaluación de los especímenes
Para un mejor abordaje de los especímenes y la integración de la información obtenida es conveniente se anote en la solicitud de estudio, la mayor cantidad de información clínica que incluya:
• Nombre del paciente.
• Edad del paciente.
• Sexo.
• Antecedentes familiares de carcinoma de colon.
• Antecedentes familiares de poliposis intestinal.
• Antecedente de poliposis intestinal.
• Antecedente de neoplasia no intestinal.
• Antecedente de enfermedad inflamatoria intestinal.
• Tiempo de evolución de la enfermedad.
• Hallazgos endoscópicos (si se cuenta con el estudio).
• Presencia de datos clínicos de obstrucción o perforación intestinal.
• Antecedente de cirugía intestinal previa y tipo de cirugía realizada.
• Antecedente de tratamiento médico neoadyuvante.
• Información de la neoplasia obtenida en estudios de imagen que indiquen localización, tamaño, infiltración a pared colónica o estructuras vecinas, ganglios sospechosos de metástasis.
• Tipo de cirugía realizada.
• Especímenes enviados (en caso necesario señalar estructuras con seda o esquema).
• Hallazgos quirúrgicos relevantes.
• Si la cirugía tiene objetivo curativo o paliativo.
Evaluación macroscópica del espécimen
Para una buena fijación y conservación de los especímenes quirúrgicos, estos deben ser colocados en formol al 10% lo más pronto posible. Se requiere entonces que pasen menos de 2 horas entre la resección y la inmersión del espécimen evaluado en formol (10 veces el volumen en relación a la pieza).
Al recibir el espécimen quirúrgico se debe identificar el tipo de resección y las estructuras enviadas. En caso de dudas en relación al mismo es conveniente acudir al cirujano para que las aclare, describa el tipo de resección, los órganos involucrados y explique la relación que tienen las estructuras enviadas.
Una resección oncológica óptima de colon requiere la escisión del segmento afectado y el mesocolon asociado. Se recomienda identificar el segmento de colon recibido, medir la longitud del mismo y el eje mayor distal y proximal. Es conveniente medir el mesocolon haciendo énfasis en el eje perpendicular a la pared del colon, ya que de manera indirecta indica si la resección fue parcial o completa.
Si se reciben estructuras u órganos diferentes al colon, estos deben medirse en sus 3 ejes y referir cómo se relacionan con la pared del colon.
En resecciones de colon transverso con frecuencia se recibe epiplón mayor adherido al borde superior del meso; se debe distinguir éste del mesocolon, medir y referir si se encuentra adherido a la pared libre del colon.
Hay que evaluar las características de la superficie externa del colon poniendo especial atención a zonas induradas, blanquecinas, opacas y hemorrágicas, ya que estos datos pueden indicar infiltración de la neoplasia a la superficie serosa. Se debe identificar si existen zonas de perforación y la relación que tienen con el área con tumor. Es conveniente entintar los bordes quirúrgicos distales, proximales y marginales más cercanos a la neoplasia7,8.
En colon ascendente y descendente los bordes marginales no peritonealizados son anchos y posterolaterales. El colon transverso y sigmoides tienen un borde marginal no peritonealizado más estrecho y una superficie peritonealizada más extensa.
El colon se abre por la tenia anterior, si la neoplasia compromete esta zona algunos patólogos cortan 1 a 2 cm por arriba y por debajo del tumor. Se puede realizar el corte a través del tumor si se tiene cuidado en no cortar áreas que indiquen sospecha de compromiso a la serosa. El espécimen se coloca en suficiente formol al 10% (por lo menos 10 veces el volumen del espécimen como se menciono anteriormente), durante 24 a 48 horas para la adecuada fijación. Posterior a esto, se realizan cortes transversales de 5 mm en promedio de la pared con tumor y mesocolon.
En la descripción macroscópica de la lesión se debe de anotar8:
• Tipo de resección.
• Medidas del espécimen.
• Localización de la neoplasia.
• Si existe evidencia macroscópica de perforación y la localización de ésta en relación a la neoplasia.
• Si hay cambios macroscópicos en la serosa.
• Tamaño del tumor.
• Distancia del tumor a los bordes quirúrgicos distal, proximal y marginal.
• Aspecto macroscópico del tumor (exofítico, ulcerado, polipoide, velloso, infiltrante).
• Porcentaje de la luz ocupado por la neoplasia en la zona afectada.
• Nivel de infiltración de la neoplasia en pared (macroscópico).
• Describir si existe diseminación proximal y/o distal de la neoplasia a través de la pared.
• Evidencia de infiltración a mesocolon.
• Determinar si existen conglomerados ganglionares con tumor y medirlos.
• Presencia de otras lesiones en pared de colon.
• En caso de recibir órganos y estructuras diferentes al colon y mesocolon, describir la relación de estos con la pared del colon y la neoplasia.
Muestreo de la neoplasia y pared de colon
Se recomienda la inclusión de por lo menos los siguientes cortes7:
a. De la neoplasia (el número depende del tamaño del tumor y compromiso a otros órganos, se recomiendan por lo menos 5) que permitan determinar:
— La mayor profundidad de invasión de la neoplasia.
— Si existe o no compromiso de la serosa (se recomiendan por lo menos 2 cortes de superficie serosa con sospecha de infiltración).
— Invasión a venas extramurales (se sospecha al observar líneas pálidas que emergen de la base del tumor).
— Compromiso a órganos o estructuras adyacentes
— Borde quirúrgico marginal más cercano (tomando en cuenta el borde más cercano a cualquier zona macroscópicamente con carcinoma, este puede ser del tumor primario, un ganglio con metástasis o un nódulo de carcinoma satélite en tejido pericolónico).
— Si la neoplasia se encuentra a menos de 3 cm de los bordes proximal y distal, es conveniente la inclusión de un corte del borde más cercano.
— Transición neoplasia pared no neoplásica.
— Nódulos satélites de aspecto neoplásico en tejido adiposo pericolónico.
— Pared colónica macroscópicamente sin alteraciones.
b. Cualquier otra lesión observada.
Disección de ganglios linfáticos
En el carcinoma de colon el número de ganglios con metástasis es relevante en el estadio asignado, se ha observado que pacientes con metástasis ganglionares se pueden beneficiar con tratamiento adyuvante; siendo el número de ganglios resecados así como la relación de ganglios con metástasis y ganglios resecados, factores pronósticos independientes9,10. Estas observaciones obligan al patólogo a realizar una búsqueda minuciosa y exhaustiva de los ganglios linfáticos resecados. Se acepta como un número mínimo de ganglios resecados 128, sin embargo el patólogo debe identificar el mayor número de ganglios posibles.
Son varios los factores que influyen en un número limitado de ganglios encontrados por el patólogo11, entre estos se incluyen: corte del mesenterio muy cerca a la pared colónica, resección parcial del mesocolon, resección limitada de la pared colónica, disección no en bloque de los ganglios, adherencia o infiltración al meso y colon por otros órganos, infiltración masiva al mesocolon por neoplasia, ya sea por extensión directa del tumor primario o por formación de conglomerados ganglionares. Es conveniente informar al cirujano las posibles razones de un número inadecuado de ganglios linfáticos evaluados.
Se debe hacer la búsqueda de los ganglios linfáticos pericólicos, paracólicos e intermedios. Se recomienda separar e incluir de manera independiente el ganglio más cercano al pedículo vascular del borde quirúrgico marginal (ganglio apical), ya que la presencia de metástasis en éste, es un factor de mal pronóstico para la sobrevida libre de enfermedad12.
En carcinomas que comprometen más de un subsitio por extensión longitudinal del mismo, se consideran ganglios linfáticos regionales aquellos que drenan todos los subsitios afectados. En casos de que los ganglios linfáticos regionales del tumor primario no tengan metástasis, pero aquellos que drenan el subsitio que ha sido invadido de manera secundaria si tengan neoplasia, los ganglios del subsitio afectado de manera secundaria se consideran los regionales y se utilizan para la estadificación de N13.
En caso de recibir colectomías o resecciones de más de un segmento es conveniente el separar los ganglios linfáticos resecados por subsitios de drenaje, ya que si hay metástasis a ganglios linfáticos no regionales, se consideran metástasis a distancia y se clasifican como M1.
Todos los ganglios linfáticos resecados deben de ser incluidos para su estudio, separando por subsitios si es el caso, e incluyendo de manera independiente el o los ganglios apicales disecados.
Los ganglios linfáticos situados muy cerca del borde quirúrgico marginal deberán ser incluidos de tal manera que se pueda determinar la distancia entre estos y el límite quirúrgico, en caso de que tengan metástasis.
Evaluación microscópica
Las características de la neoplasia y el espécimen que deben ser tomadas en cuenta en el análisis histológico son las siguientes7,8:
• Tipo histológico.
• Grado de diferenciación.
• Infiltración máxima de la neoplasia.
• Confirmación histológica de infiltración a la serosa.
• Identificación de grupos de células neoplásicas dispuestas en agregados que se separan del volumen mayor del tumor (budding).
• Presencia de invasión vascular intramural.
• Presencia de invasión venosa extramural.
• Presencia de invasión perineural.
• Presencia de infiltrado linfoide.
• Confirmación histológica del estado de los bordes quirúrgicos.
• Evaluación de nódulos neoplásicos discontinuos en tejido pericolónico.
• Estado de los ganglios linfáticos resecados.
• Cuando sea el caso, evaluación histológica de otros órganos enviados; determinar la relación que existe de éste con el colon (a través de adherencias fibrosas, inflamación, infiltración por neoplasia).
• Evaluación de otras lesiones (pólipos, divertículos, enfermedad inflamatoria crónica, etc.).
La clasificación del tipo histológico se hará de acuerdo a la Organización Mundial de la Salud (OMS)14:
• Adenocarcinoma usual.
• Adenocarcinoma mucinoso (con componente mayor del 50%).
• Adenocarcinoma con células en anillo de sello (componente en anillo de sello mayor del 50%).
• Carcinoma escamoso.
• Carcinoma adenoescamoso.
• Carcinoma medular.
• Carcinoma neuroendocrino de alto grado: De células grandes.
De células pequeñas.
• Indiferenciado.
• Otras variantes.
El adenocarcinoma usual es la variante más común, está formado por glándulas con epitelio cúbico alto o cilíndrico con necrosis central en la luz. Las variantes mucinosa, en anillo de sello y medular, se asocian con frecuencia a inestabilidad microsatélite15.
las otras variantes corresponden a carcinoma sarcomatoide, pleomórfico, de células claras, de células de Paneth y con componente de coriocarcioma.
En relación al grado histológico, el Colegio Americano de Patólogos sugiere se clasifiquen en 2 grados, alto y bajo grado, para disminuir la variabilidad interobservador.
Se considera compromiso a la serosa en las siguientes 3 situaciones16:
1. Presencia de células neoplásicas cerca de la serosa, asociadas a hiperplasia mesotelial y/o inflamación.
2. Presencia de células neoplásicas en contacto con células mesoteliales, asociadas a ulceración e infiltrado inflamatorio
3. Presencia de células neoplásicas libres en la superficie serosa.
Los nódulos neoplásicos discontinuos son cúmulos macroscópicos o microscópicos de células neoplásicas, en el área de drenaje linfático del tejido adiposo pericolónico de un carcinoma primario sin evidencia histológica de ganglio linfático residual en el nódulo. Este fenómeno puede representar extensión discontinua, invasión venosa o un ganglio linfático totalmente reemplazado. La presencia o ausencia de depósitos tumorales, independientemente de la etapa T, se estadifica como N1c sólo cuando no existen metástasis ganglionares13.
Informe histopatológico
En el reporte emitido por el patólogo como información mínima se debe incluir8:
• Tipo de resección recibida.
• localización de la neoplasia.
• Tamaño del tumor.
• Característica macroscópica de la neoplasia.
• Porcentaje de luz ocupado por la neoplasia.
• Si hay evidencia de perforación de pared intestinal y su relación con la neoplasia.
• Distancia de la neoplasia con bordes quirúrgicos (proximal, distal, marginal).
• Nivel mayor de infiltración de la neoplasia.
• Estado de la serosa en relación a la neoplasia.
• Evidencia de infiltración a otros órganos (si es el caso).
• Tipo histológico de la neoplasia.
• Grado de diferenciación. Referir si existe:
• Infiltración vascular intramural y/o extramural.
• Infiltración perineural.
• Infiltrado inflamatorio linfoide asociado a la neoplasia.
• Nódulos discontinuos de carcinoma en tejido pericolónico.
Estado de ganglios linfáticos pericolónicos:
• Número de ganglios resecados.
• Número de ganglios con metástasis.
• Estado del ganglio apical. Lesiones agregadas.
Biomarcadores no histopatológicos
Hoy en día, la determinación de biomarcadores no histológicos en carcinoma de colon permite conocer factores pronósticos y predictivos en respuesta a tratamiento adyuvante17.
De éstos, los que con mayor frecuencia se evalúan son: proteínas de reparación de DNA (MHl1, MSH2, MSH6, PMS2), inestabilidad microsatélite, determinación de mutaciones en genes RAS, BRAF, PIK3 y PTEN.
Conclusión
En la actualidad, en el área de la Oncología el patólogo tiene que integrarse a los equipos multidisciplinarios que manejan a los pacientes. En cáncer de colon una adecuada comunicación entre los miembros del equipo y un cuidadoso manejo de los especímenes, permiten la emisión de reportes histopatológicos que proporcionen la información necesaria para confirmar diagnóstico, estadificar la enfermedad, identificar factores pronósticos y predictivos, decidir manejo adyuvante, auditar a los servicios del equipo y proporcionar información para realizar estudios de investigación de calidad.
El Colegio Británico de Patólogos sugiere se realicen auditorías regulares de los informes histopatológicos emitidos, para comprobar que los resultados no sean tan diferentes a lo esperado18. Se recomienda tomar en cuenta el estándar de 3 características:
1. Evaluación de 12 ganglios linfáticos por espécimen.
2. Frecuencia de compromiso a la serosa, en por lo menos el 20% de los especímenes.
3. Frecuencia de invasión venosa extramural, en por lo menos el 25% de los especímenes.
En este artículo se dan recomendaciones de manejo de especímenes con carcinoma de colon, sin embargo cada una de las piezas recibidas debe ser estudiada de manera particular y hacer los ajustes pertinentes de acuerdo a los hallazgos, siempre tomando en cuenta que el propósito es dar la información necesaria para el tratamiento adecuado de los pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Unidad Médica de Alta Especialidad Hospital de Oncología Centro Médico Nacional Siglo XXI,
Instituto Mexicano de Seguro Social. Av. Cuauhtémoc N° 330,
Colonia Doctores, México D.F., México.
Teléfono: 5627 6900, ext. 22733.
Correo electrónico: alemantimora@yahoo.com.mx (Alejandra Mantilla-Morales).