La transición epitelio-mesénquima (TEM) es un proceso biológico en el que células epiteliales inmóviles y polarizadas se convierten en células mesenquimales con capacidad de migración. Este proceso produce cambios en el citoesqueleto de las células, siendo la pérdida de E-cadherina y la adquisición de N-cadherina, uno de los principales cambios bioquímicos que se dan en la TEM. En este estudio investigamos el papel del factor de crecimiento epidérmico (EGF) sobre la TEM inducida en líneas celulares y cultivos primarios de cáncer de mama.
MétodosPara este estudio se empleó la línea celular de cáncer de mama MCF-7 y los cultivos primarios MBCD25 y MBCDF. Se indujo la TEM mediante el tratamiento continuo con EGF. Se evaluó si las células habían sido inducidas a un fenotipo mesenquimatoso con EGF mediante la técnica de western blot, midiendo la fosforilación de STAT3, el nivel de STAT3, y la represión de los marcadores como E-cadherina, así como la expresión del factor de transcripción Snail.
ResultadosNuestros resultados demuestran que el tratamiento con EGF induce la fosforilación de STAT3 sin cambios en sus niveles totales en células MBCDF, MBCD25 y MCF-7. Asimismo, el tratamiento con EGF por 5 días induce una TEM, que se demostró por la pérdida de E-cadherina y la expresión de Snail.
ConclusiónEn los cultivos primarios MBCD25 y MBCDF, así como en la línea celular MCF-7, el EGF es capaz de inducir TEM y en consecuencia producir un fenotipo más agresivo de las células de cáncer de mama.
Epithelial-mesenchymal transition (EMT) is a biological process where immobile and polarised epithelial cells acquire mesenchymal characteristics with high migration. This process produces changes in the cytoskeleton of the tumour cells, with the loss of E-cadherin and the acquisition of N-cadherin being the main biochemical changes of the EMT. This study investigates the role of epidermal growth factor (EGF) on the EMT induction in breast cancer cell lines and primary cultures.
MethodsMCF-7 cell line and the primary cultures MBCDF and MBCD25 were used in this study. EMT was induced by continuous EGF treatment. Mesenchymal EGF-induced phenotype was evaluated by Western blot of the following markers: pSTAT3, STAT3, repression of E-cadherin, and expression of Snail.
ResultsOur results demonstrate that EGF treatment induced STAT3 phosphorylation without changes in STAT3 in MBCDF, MBCD25 and MCF-7. Additionally, EGF treatment induced EMT, as shown by the loss of E-cadherin and Snail expression after 5 days.
ConclusionEGF was able to induce EMT in primary breast cancer cell cultures, MBCDF, MBCD25, as well as MCF-7 cell line. These results suggest that EGF produces a putative aggressive phenotype.
En México, desde el 2006, el cáncer de mama ocupa el primer lugar como causa de muerte en mujeres por neoplasias malignas, desplazando de esta posición al cáncer cérvico-uterino. De acuerdo a las estadísticas de GLOBOCAN, aproximadamente el 60% de los casos se diagnostica en etapas avanzadas, para el año 2030, 24,326 mujeres serán diagnosticadas con cáncer de mama en México y 9,778 morirán debido a esta enfermedad1,2. Mediante ensayos genéticos el cáncer de mama ha sido clasificado en al menos 4 subtipos moleculares: luminal A, se caracteriza por la presencia de receptores estrogénicos (RE) y de progesterona (RP), ausencia de sobreexpresión de HER2 y un índice de proliferación Ki67<14%, se presenta en aproximadamente el 40% de los casos, estas pacientes por lo general tienen un buen pronóstico con una razón de riesgo para muerte de 1.16 (IC 95%: 0.47-2.85). Luminal B con un 20% de los casos y un pronóstico intermedio, se caracteriza por RE+, RP+, HER2− y Ki67>14% o cualquier Ki67 y HER2 sobreexpresado. Los catalogados como HER2 positivos con RE y RP negativos representan entre 10-15% de los casos y se considera de mal pronóstico. Basaloide, con una frecuencia del 15-20%, RE−, RP−, HER2−, expresión alta de Ki67, EGFR+, citoqueratina 5/6, 14 y 17 positivas, este último con un pronóstico desfavorable con una razón de riesgo para muerte de 12.41 (IC 95%: 5.82-26.49)3,4. A pesar de los avances en el diagnóstico y tratamiento, la recurrencia y la formación de metástasis son la principal causa de muerte en las pacientes con cáncer de mama. Los mecanismos responsables de la invasión y metástasis no están completamente entendidos; sin embargo, está claro que los carcinomas derivados de tejidos epiteliales progresan a grados patológicos más avanzados de malignidad con una invasión local y metástasis a distancia más frecuentemente4,5.
La metástasis es un proceso de múltiples etapas que pueden ser clasificadas en al menos 5 pasos secuenciales: 1) El desprendimiento y la migración de las células tumorales al tejido adyacente, 2) la invasión de las células tumorales en el torrente sanguíneo y el tejido linfático (intravasación), 3) la supervivencia en la circulación (resistencia a la anoikis), 4) la invasión y la penetración de las células tumorales fuera de la circulación sanguínea y linfática (extravasación) y 5) la colonización, proliferación y neovascularización de las células tumorales en sitios distantes6. En el fenómeno complejo de la diseminación de las células tumorales, uno de los primeros eventos importantes es la pérdida de la mayoría de las características epiteliales, a través de cambios drásticos en el citoesqueleto. Esta serie de eventos se conoce como transición epitelio-mesénquima (TEM), el cual es un proceso en el que las células epiteliales sufren cambios bioquímicos para transformarse en células mesenquimatosas, se pierden las uniones intercelulares y por lo tanto se vuelven alargadas y no polarizadas, lo que les permite moverse a través de la matriz extracelular, con lo cual generan un nuevo tejido con una polaridad diferente al epitelio que le dio origen7,8. La TEM no es un proceso exclusivo de las células tumorales, se ha descrito en 3 diferentes escenarios biológicos: la TEM tipo 1 está involucrada en la implantación del embrión, la embriogénesis y la organogénesis. La TEM tipo 2 está asociada a la cicatrización de heridas, regeneración tisular y fibrosis en órganos como el riñón; y la TEM tipo 3 es la que se encuentra implicada en la tumorigénesis, explicando la progresión de un carcinoma in situ a uno invasivo9, también se ha asociado con la resistencia a la apoptosis y a fármacos de quimioterapia10. El papel de la TEM en cáncer ya está bien establecido, y se asume que es un componente indispensable para la metástasis11. Una vez que las células tumorales alcanzaron el sitio de metástasis distante, retoman el fenotipo del tumor primario a través de un proceso llamado transición mesénquima-epitelio. Por lo tanto, los pasos de la TEM parecen ser reversibles, indicando la existencia de componentes dinámicos en la progresión tumoral12.
Se han descrito diversos marcadores implicados en la TEM; uno de los más estudiados es la disminución de la expresión de E-cadherina, proteína involucrada en uniones célula-célula, la cual baja sus niveles al mínimo, con un intercambio por N-cadherina. Existen otros marcadores que son regulados positivamente en la TEM como son: la vimentina, fibronectina, actina de músculo liso; factores de transcripción como Snail, Twist, Slug y ZEB; además de factores de crecimiento como el factor derivado de plaquetas (PDGF, del inglés, platelet-derived growth factor)13–16. Otras moléculas de adhesión célula-célula como las claudinas 3, 4, 7, α-catenina, γ-catenina y ocludinas son reguladas negativamente en células con fenotipo mesenquimatoso14,16. La pérdida de E-cadherina es uno de los marcadores principales de la TEM y cabe hacer notar que el gen de e-cadherina no sufre deleciones o mutaciones, solo se han encontrado cambios epigenéticos y transcripcionales que silencian la expresión de E-cadherina, lo cual le permite reexpresarse tanto en el tumor primario como en metástasis17. La TEM es un proceso dinámico que es activado por diversos estímulos del microambiente tumoral que incluyen factores de crecimiento, interacciones célula tumoral-estroma e hipoxia18. Dentro de las señales que activan la TEM se encuentran factores de crecimiento como el factor de crecimiento transformante β, el factor de crecimiento de los hepatocitos, el factor de crecimiento de fibroblastos, los factores de crecimiento similares a la insulina 1 y 2 y el factor de crecimiento epidérmico (EGF, del inglés epidermal growth factor)19.
Existe evidencia acerca de un supuesto papel del EGF y su receptor (EGFR) en procesos de metástasis en diferentes tumores20–22. La unión de EGF a su receptor induce diversas vías de señalización como son la activación de la proteína cinasa C-delta, las cinasas activadas por mitógenos, y fosfolipasa C-γ; estas vías facilitan la migración celular23,24. También se ha demostrado que la activación de EGFR induce la producción de metaloproteinasa 9, posiblemente a través de la vía de PI3K, que conduce a la migración celular25,26. Se ha demostrado que el tratamiento crónico con EGF en diversas líneas celulares de cáncer de mama, de pulmón de células no pequeñas y de próstata induce una regulación negativa de la E-cadherina y de las uniones de adhesión célula-célula27,28. La hiperactivación de EGFR también ha sido reportada en múltiples tumores como el de colon, mama, próstata, cabeza y cuello29. En modelos murinos de cáncer de mama in situ, se ha demostrado que la sobreexpresión de EGFR es suficiente para inducir la transformación celular de un epitelio mamario normal y puede volverse metastásico una vez que terminaron la TEM, la cual depende de la habilidad de EGFR de fosforilar al transductor de señales y activador de transcripción 3 (STAT3, del inglés, signal transducer and activator of transcription 3)30. Por otra parte, está ampliamente demostrado que el EGF induce la pérdida de E-cadherina en diversas líneas celulares de tumores de ovario, pulmón, y cabeza y cuello28,31–35.
Investigaciones recientes han establecido que STAT3 se encuentra constitutivamente activado en diversos tipos de cáncer y que desempeña un papel importante tanto en el desarrollo del tumor como en la metástasis36. STAT3 es un factor de transcripción que originalmente fue descrito como un transductor que llevaba las señales desde los receptores en la membrana de las células hasta el núcleo36. STAT3 se encuentra latente en el citoplasma y es activado mediante fosforilación en el residuo de tirosina 705 (Y705), lo que induce su dimerización y posterior translocación al núcleo, donde se une a secuencias específicas del ADN, con la consecuente transcripción de sus genes blanco36,37. La fosforilación de STAT3 está mediada por diversos receptores con actividad de tirosina cinasa intrínseca como son EGFR, VEGFR y PDGFR, y algunas cinasa de tirosina no receptores como c-Src, Abl; y receptores de citocinas como el IL-6R, el cual se encuentra asociado con la subunidad gp130 que está unida con las cinasas Janus, siendo esta última la que lleva a cabo la fosforilación de STAT336,38. La activación constitutiva de STAT3 es necesaria para mantener el fenotipo transformado en la mayoría de los tumores de mama, ovario, próstata, páncreas, tiroides, cabeza y cuello, melanoma, carcinoma hepático, renal, mieloma, linfomas y leucemias39. Se ha demostrado que STAT3 participa activamente en diversos procesos biológicos como es la proliferación celular, la migración, la angiogénesis, la invasión y la metástasis36. En años recientes, se ha visto que STAT3 es un importante inductor de la TEM mediada por factores como la IL-6 y el EGF32,34,40–42. Una de la principales funciones de STAT3 en la TEM es inducir la transcripción de los factores de transcripción (Snail, Slug, Twist, Zeb1/2) necesarios para la represión de los marcadores epiteliales como la E-cadherina y la inducción de los marcadores mesenquimales como la vimentina y la N-cadherina40.
Como ya se ha mencionado anteriormente, la metástasis es una de las principales causas de muerte de las pacientes con cáncer de mama, por lo cual, en los últimos años se ha intensificado la investigación acerca de los mecanismos de señalización de la TEM; un mejor entendimiento de este proceso permitirá el desarrollo de nuevas estrategias terapéuticas que puedan inhibir la transformación celular y el proceso de metástasis. Es de particular importancia reconocer el contexto fisiológico y la naturaleza dinámica del proceso de TEM para el desarrollo de nuevos fármacos que interfieran con esta.
Conocer los mecanismos moleculares responsables de la TEM permitirá tener posibles blancos terapéuticos que puedan inhibir dicho proceso; este es un abordaje atractivo que podría inhibir el crecimiento tumoral, reducir las metástasis y atenuar la resistencia a fármacos. Por lo cual, en el presente trabajo se estudió el papel del EGF sobre la TEM en un modelo de cultivos primarios de cáncer de mama (MBCDF y MBCD25) y la línea celular MCF-7, donde se estableció un modelo TEM inducida por EGF. Se midieron los efectos sobre la expresión de E-cadherina y el factor de transcripción Snail. Los resultados demuestran que en cultivos primarios y en la línea MCF-7 se induce la pérdida de E-cadherina.
Materiales y métodosReactivosEl EFG fue obtenido de PeproTech (RockyHill, NJ, EE. UU.). Se utilizaron los anticuerpos primarios contra E-cadherina, tubulina, p-STAT3 (Tyr705) y STAT3 de Santa Cruz Biotechnology (Santa Cruz Biotechnology, CA, EE. UU.), anti-Snail de Cell Signalling Technology (Cambridge, MA, EE. UU:). Anticuerpo secundario antirratón o antirconejo se adquirieron de Jackson ImmunoResearch (West Grove, PA, EE: UU.).
Cultivo celularLa línea celular humana MCF-7 se obtuvo de la ATCC®. Se utilizaron los cultivos primarios de cáncer de mama MBCDF y MBCD25 obtenidas a partir de biopsias de pacientes con cáncer de mama del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán (protocolo aprobado por el Comité de Ética del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, ref. 1549, BQO-008-06/9-1). Todos los cultivos fueron mantenidos en medio RPMI-1640 suplementado con un 10% de suero fetal bovino, antibiótico y antimicótico (Invitrogen Corporation, Camarillo, CA, EE. UU.) a 37°C en una atmósfera humidificada con un 5% de CO2.
Estimulación celularPara los ensayos de fosforilación de STAT3, las células MBCDF, MBCD25 y MCF-7 se sembraron a una densidad de 35,000 células/cm2 en platos de cultivo de 60mm mantenidas en medio RPMI-1640 suplementado con un 0.1% de suero fetal bovino durante 24h, las células se estimularon con EGF 10ng/ml por los siguientes tiempos: 0, 5, 15, 30 y 60min. Para los ensayos de inducción de TEM, las células MBCD25, MBCDF y MCF-7 se sembraron a una densidad de 150,000 células/plato de cultivo de 60mm (Corning®) y se estimularon con EFG 10ng/ml, al día 3 se readicionó EGF a la misma concentración. Se obtuvieron botones celulares los días 0, 1, 3 y 5.
Ensayo de inmunoblot (western blot)Las células fueron lisadas en un buffer que contiene HEPES 50mM (pH 7.4), EDTA 1mM, NaCl 250mM, nonidato P-40 1%, NaF 10mM, vanadato de sodio 1mM e inhibidores de proteasas (Complete, EDTA-free, Roche, Mannheim, Germany).; 25μg de proteína se sometieron a electroforesis en geles de poliacrilamida desnaturalizante (SDS-PAGE) y fueron transferidos a membrana Immobilon-P PVDF (Millipore Corp. Bedford, MA, EE. UU.). Las membranas fueron bloqueadas durante 60min con leche al 5% en PBS-Tween 0.05%. Posteriormente fueron incubadas con los correspondientes anticuerpos primarios tubulina, pSTAT3, STAT3, E-cadherina y Snail durante toda la noche a 4°C en agitación. Al día siguiente se incubaron por 60min con el anticuerpo secundario conjugado a HRP. La señal fue visualizada mediante quimioluminiscencia utilizando el kit Super Signal West Pico (Thermo, Rockford, IL, EE. UU.) y se expuso a una película radiográfica (Kodak, Rochester, NY, EE. UU.).
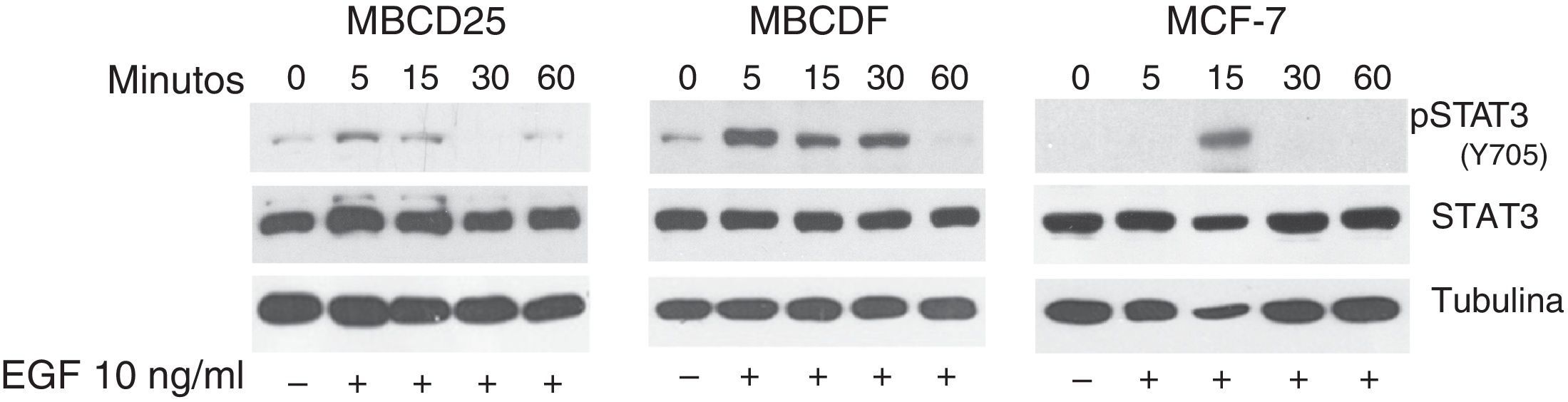
ResultadosEl factor de crecimiento epidérmico induce fosforilación de STAT3 en la Y705 en células de cáncer de mamaSe ha demostrado que la unión del EGF a su receptor induce la activación de STAT340. Para analizar si la estimulación con EGF induce la activación de STAT3 en células de cáncer de mama, estimulamos las células MBCDF, MBCD25 y MCF7 con este factor. La fosforilación de STAT3 (Y705) fue analizada por western blot (fig. 1). Nuestros resultados muestran que el tratamiento con EGF indujo la fosforilación de STAT3 con respecto al tiempo. Las células MBCDF, MBCD25 tienen un pico de activación a los 5min, mientras que en las MCF-7 se observó el máximo de activación a los 15min (fig. 1, panel superior). El tratamiento con EGF a estos tiempos no provocó cambios en la cantidad de STAT3 total (fig. 1, panel medio). Se utilizó un anticuerpo anti α-tubulina como control de carga (fig. 1, panel inferior). Estos resultados demuestran que la cinética de fosforilación de STAT3 (Y705) inducida por EGF es diferente para cada una de las células de cáncer de mama con un intervalo de 5-15 min tanto en cultivos primarios como en líneas celulares de cáncer de mama.
EGF induce fosforilación de STAT3 en las células de cáncer de mama MBCDF, MBCD25 y MCF-7. Las células de cáncer de mama MBCD25, MBCDF, y MCF-7 se trataron con EGF 10ng/ml a los tiempos 0, 5, 15, 30 y 60min. Se realizó western blot para analizar la fosforilación de pSTAT3 (Y705) usando anticuerpos fosfoespecíficos (panel superior). La cantidad total de STAT3 se analizó usando un anticuerpo anti-STAT3 (panel medio). Se utilizó un anticuerpo anti α-tubulina como control de carga de la proteína total (panel inferior).
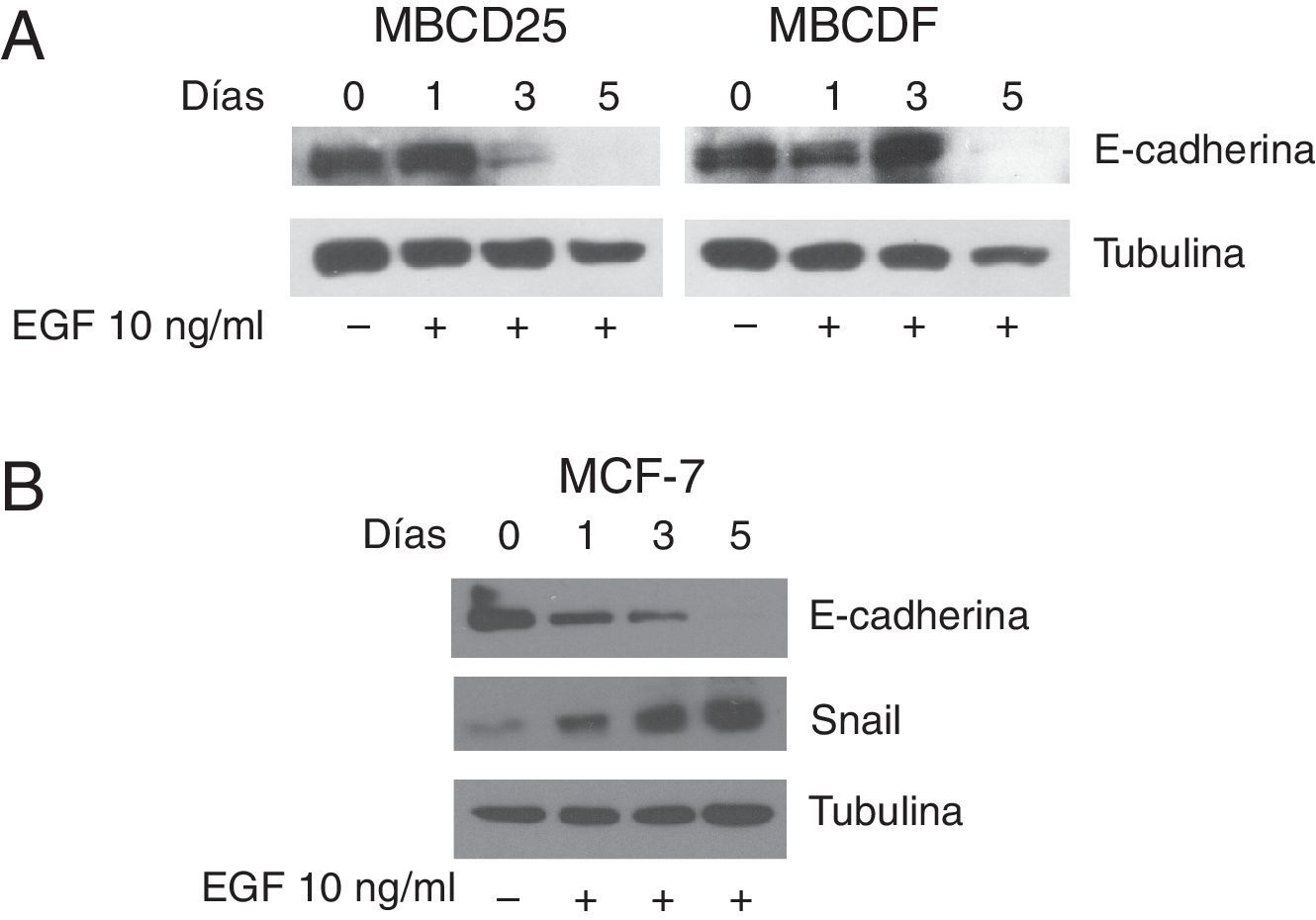
Una vez que demostramos que EGF fosforila a STAT3 en las células de cáncer de mama, analizamos si el tratamiento con EGF induce la TEM en las células MBCD25 y MBCDF. La TEM fue evaluada como la pérdida de E-cadherina mediante western blot. Nuestros resultados muestran que el tratamiento continuo con EGF por 5 días indujo una disminución de la expresión de E-cadherina con respecto al tiempo de tratamiento, siendo indetectable por este método al día 5. (fig. 2A, panel superior izquierdo y derecho). Un anticuerpo anti α-tubulina se utilizó como control de carga (fig. 2A, panel inferior izquierdo y derecho). Se realizó un experimento similar con la línea celular MCF-7, en el cual también se observa la pérdida de E-cadherina al día 5 (fig. 2B, panel superior). En estas células también se analizó el comportamiento del factor de transcripción Snail, el cual aumentó su expresión con respecto al tiempo de tratamiento con EGF (fig. 2B, panel medio). La α-tubulina se usó como control de carga (fig. 2B, panel inferior). Estos resultados muestran que el tratamiento con EGF induce la pérdida de E-cadherina en las células de cáncer de mama, por lo cual se considera que realizaron la TEM. Esto se ve mejor sustentado en las células MCF-7 en donde, además de la pérdida de E-cadherina mediada por EGF, hay un incremento de Snail que es el encargado de reprimir la expresión de E-cadherina.
EGF induce la pérdida de expresión de E-cadherina y aumento de la expresión de Snail en células MBCDF, MBCD25 y MCF-7. A. Las células de cáncer de mama MBCD25 y MBCDF se trataron con EGF 10ng/ml a los días 0 y 3. Se realizó western blot para analizar la expresión de E-cadherina (panel superior). Un anticuerpo anti α-tubulina fue utilizado como control de carga de la proteína total (panel inferior). B. La línea celular MCF-7 se trató con EGF 10ng/ml los días 0 y 3. Se realizó western blot para analizar la expresión de E-cadherina (panel superior) así como para analizar la expresión de Snail (panel medio). El anticuerpo anti-α-tubulina fue utilizado como control de carga de la proteína total (panel inferior).
En el presente trabajo estudiamos el papel del EGF sobre la TEM en líneas celulares y cultivos primarios de cáncer de mama. En primer lugar analizamos la activación de STAT3 mediada por EGF en células de cáncer de mama MBCD25, MBCDF y MCF-7. Nuestros datos mostraron que en las células de cáncer de mama STAT3 se activa con cinéticas diferentes para cada tipo de cultivo celular utilizado. Posteriormente, en el mismo panel de células se estudió la inhibición de la expresión de E-cadherina, así como la inducción del factor de transcripción Snail mediada por EGF. Los resultados mostraron que el EGF induce la pérdida de E-cadherina con un concomitante aumento de Snail, lo que indica que las células se indujeron a una TEM.
La TEM se caracteriza por cambios bioquímicos en el citoesqueleto de las células y uno de los principales marcadores de la TEM es la pérdida de E-cadherina, un marcador epitelial, que funciona para mantener la adhesión célula-célula en los tejidos epiteliales. Una vez que las células perdieron la E-cadherina, este es un evento que indica que las células experimentaron una TEM. En nuestro modelo, el EGF induce una pérdida de E-cadherina como ya está previamente reportado tanto para el cáncer de mama como para otros tipos de cáncer28,31–35. La pérdida de E-cadherina está mediada por una acción represora de factores de transcripción como Snail, Twist y Slug, los cuales son inducidos por la acción de STAT340,42. En nuestro sistema, Snail incrementó sus niveles por acción de EGF, y como ya habíamos demostrado, el EGF activó a STAT3, lo cual probablemente indujo la transcripción de Snail y este a su vez reprimió la expresión de E-cadherina. Estos resultados indican que el EGF induce un fenotipo más agresivo en cultivos primarios y líneas celulares de cáncer de mama. Los datos del presente trabajo implican que en el microambiente tumoral del cáncer de mama con presencia de EGF se puede inducir la TEM, lo que se traduciría en un mayor potencial de metástasis.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.