Introducción: La leucemia aguda linfoblástica (LAL) es el cáncer infantil más frecuente. La prueba de citometría de flujo (CF) identifica linfoblastos residuales conocidos como enfermedad mínima residual (EMR).
Objetivo: Identificar tempranamente la EMR en la semana 5, en niños con diagnóstico de LAL por CF.
Material y métodos: Incluimos 35 niños con LAL, clasificados por factores pronósticos, se evaluó la remisión clínica y presencia de linfoblastos residuales en la semana 5 de quimioterapia de inducción, por CF con 4 fluorocromos. Se consideró EMR positiva > 0.01% células mononucleares (CMN) y EMR negativa < 0.01% CMN. Se analizó por prueba t de Student y ji cuadrada; un valor de p<0.05 fue significativo en el programa NCSS® versión 7.
Resultados: Reportamos 35 niños con LAL evaluados por CF, de los cuales 5 se consideraron con EMR positiva en la semana 5 de tratamiento, con una media de edad de 9.95 ± 6.04 años, el conteo de leucocitos de diagnóstico fue µ=135.226 mm3, la mayor proporción (91%) correspondió a LAL de linaje B, con cariotipo normal en 3 de 4 niños, un 70% de pacientes presentaron índice de DNA ≤ 1. La prueba de EMR por CF fue positiva en 14.3% de niños, en aparente remisión clínica y citomorfológica de sus médulas óseas.
Conclusión: La CF permite un monitoreo más preciso de la remisión inmunológica de LAL en niños.
Introduction: Acute lymphoblastic leukemia (ALL) is the most commonly diagnosed cancer in children. The flow cytometry test (FC) identifies the amount of residual malignant cells; this determines the minimal residual disease (MRD).
Objective: Early identification of EMR in 5 weeks in children with ALL by FC.
Material and methods: The sample included 35 children with ALL, classified by prognostic factors; clinical remission and residual lymphoblast were evaluated in the 5 weeks of induction chemotherapy with 4 fluorochromes by FC. MRD was considered positive when > 0.01% mononuclear cell (MNC) and negative MRD < 0.01% (MNC). Differences were compared by Student's t test and Chi-square, p<0.05 was significant in the program NCSS® version 7.
Results: We assessed 35 children with ALL by FC. Five children were considered positive, with a mean age of 9.95 ± 6.04 years, the mean of leukocyte were µ=135.226 mm3 at diagnosis. The most proportion about 91% corresponds to B leukemia, only 2 children had normal karyotype and 70% of patients had index of DNA ≤ 1. The MRD test was positive in 14.3% of children in apparent clinical remission and cytomorphology of their bone marrow samples.
Conclusion: CF allows more accurate monitoring of remission in children with ALL in children.
Introducción
La leucemia aguda linfoblástica (LAL) representa el cáncer infantil más frecuente, constituye aproximadamente 40% de los casos nuevos, con una incidencia anual de 4 casos por cada 100,000 habitantes.
La citometría de flujo (CF) es una técnica de análisis celular que mide las características inmunofenotípicas que poseen las células al pasar a través de un rayo de luz. Cuando se diagnostica LAL, el número logarítmico de células leucémicas se acerca a 1 x 1012. Estando en remisión clínica, es decir, sin datos evidentes de la enfermedad, puede existir hasta 1 x 1010 células malignas microscópicamente en el paciente, esta cantidad residual de células malignas no detectable por técnicas de rutina se define como enfermedad mínima residual (EMR)1.
La CF y la biología molecular son las técnicas más empleadas para cuantificar la EMR en LAL; en particular, la CF ha demostrado una sensibilidad de detección ≤ 104 células linfoblásticas, mostradas por inmunofenotipos aberrantes2, su elevada sensibilidad determina importancia pronóstica cuando la EMR registra valores < 1%, estudios clínicos han demostrado que resultados de EMR > 1% al final del tratamiento de inducción predicen recaída en un 70% a 100%, por el contrario cuando esta prueba es negativa se asocia con un 2%-10% de recaída3,4. Es así que la técnica de CF es utilizada de rutina para identificar leucemia residual, su resultado define con más precisión la remisión y respuesta al tratamiento inicial.
Presentamos los resultados de un estudio cuyo propósito central es cuantificar la EMR, mediante inmunofenotipificación por CF, en pacientes pediátricos con LAL que recibieron quimioterapia de inducción a la remisión.
Material y métodos
Pacientes
Se realizó un estudio durante 18 meses, en pacientes de 0 a 18 años de edad con LAL. Se utilizó para diagnóstico el criterio de más de 25% de células blásticas en médula ósea, clasificadas como L1, L2 y L3 de acuerdo a los criterios de la Federación Franco-Americana-Británica (FAB)5. Los pacientes se clasificaron de acuerdo a los factores pronósticos internacionales de la LAL. Se incluyeron niños con: inmunofenotipo, índice de DNA, citogenética, estudio de médula ósea en remisión en la semana 5 de tratamiento (células malignas < 5% en médula ósea = M1); y hematopoyesis eficaz. Se excluyeron pacientes con régimen de quimioterapia previo, LAL en recaída o condición refractaria, reporte inadecuado de EMR y tratamiento de quimioterapia de inducción incompleto. Se solicitó consentimiento informado, los cuales fueron autorizados por el tutor. El proyecto fue avalado por el Comité de Ética de la Institución.
Protocolo de tratamiento y criterio de respuesta
Todos los niños recibieron el protocolo de quimioterapia de inducción, el cual consistió en prednisona a 40 mg/m2SC por 5 semanas y una dosis de quimioterapia intratecal. En el día 8, la fase de inducción con quimioterapia se llevó a cabo bajo el siguiente esquema: vincristina 2 mg/m2SC intravenosa (IV) semanal por 4 dosis, L-asparginasa 6,000 UI/m2SC intramuscular (IM) por 6 dosis y doxorrubicina 30 mg/m2SC IV en la semana 4. El estudio de aspirado de médula ósea fue analizado para determinar EMR en la semana 5 posterior a la inducción, basado en el reporte de inmunofenotipo inicial, se contaron mínimo 100,000 células mononucleares (CMN), buscando inmunofenotipos aberrantes persistentes, con 4 fluorocromos isotiocianato de fluoresceína (FITC): An- ti-CD13, CD33, CD10, TdT (Dako Cytomation, Copenhagen, Dinamarca); Anti-CD38, CD58, CD21, CD66c (Beckman Coulter, Fullerton, Ca, EUA); Anti-CD22, CD45, CD15 (Beckton Dickinson, BD, San José, Ca, EUA); Ficoeritrina (PE): Anti-CD10 (Dako Cytomation); Anti-CD56 (BeckmanCoulter); Anti-NG2 (Beckman Coulter); proteína clorofila peridinina (PerCP): Anti-CD34; Aloficocianina (APC): Anti-CD19 (Beckton). Procesados de acuerdo a estándares de CF y analizados mediante el citómetro BD FACSCaliburTM, con análisis celular basado en el software Cell Quest®.
Se consideró EMR negativa cuando se detectó una cantidad < 0.01% y EMR positiva con una cantidad > 0.01% de CMN, con expresión de antígenos aberrantes.
Análisis estadístico
Se analizaron las diferencias clínicas y biológicas entre EMR positiva y negativa, por prueba t de Student y ji cuadrada. Valores de p<0.05 fueron considerados significativos. Se utilizó para análisis el programa NCSS® versión 7.
Resultados
Se incluyeron 35 niños, de éstos 65.4% fueron hombres y 34.6% mujeres (p=0.063). La edad estuvo entre uno y 9 años (68.6%), un 31.4% tenía más de 10 años. La edad promedio de los casos EMR positiva fue de 9.95 ± 6.04 años, mientras la de los niños con EMR negativa fue de 8.49 ± 4.65 años (p=0.0208). Al clasificar a los pacientes de acuerdo al reporte de la EMR, se observó que 5 pacientes (14.3%) fueron EMR positiva y 29 (82.8%) reportaron EMR negativa. Uno de los pacientes no pudo ser clasificado por muestra inadecuada.
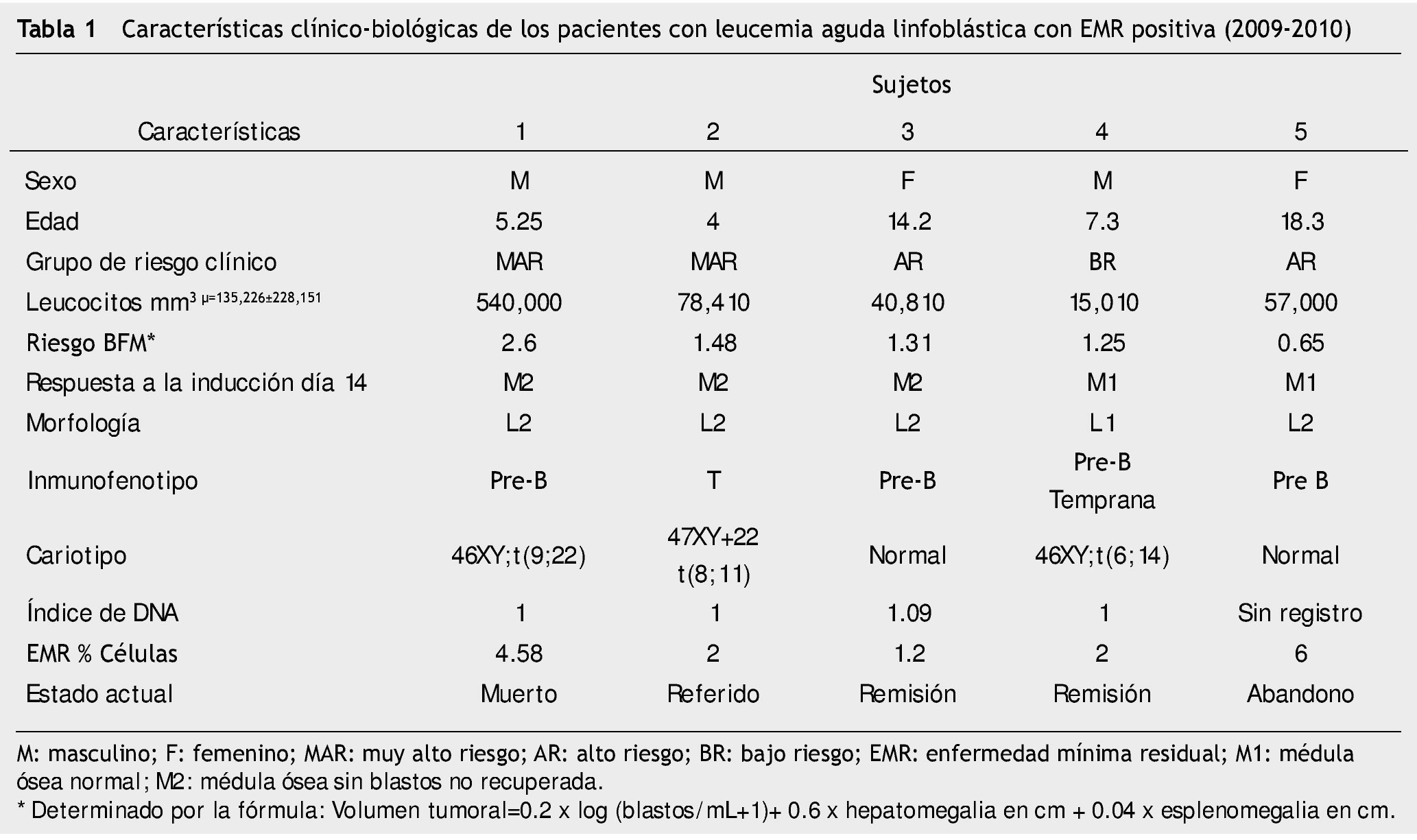
En la tabla 1 se resume los hallazgos clínicos más significativos de los niños que tuvieron EMR positiva.
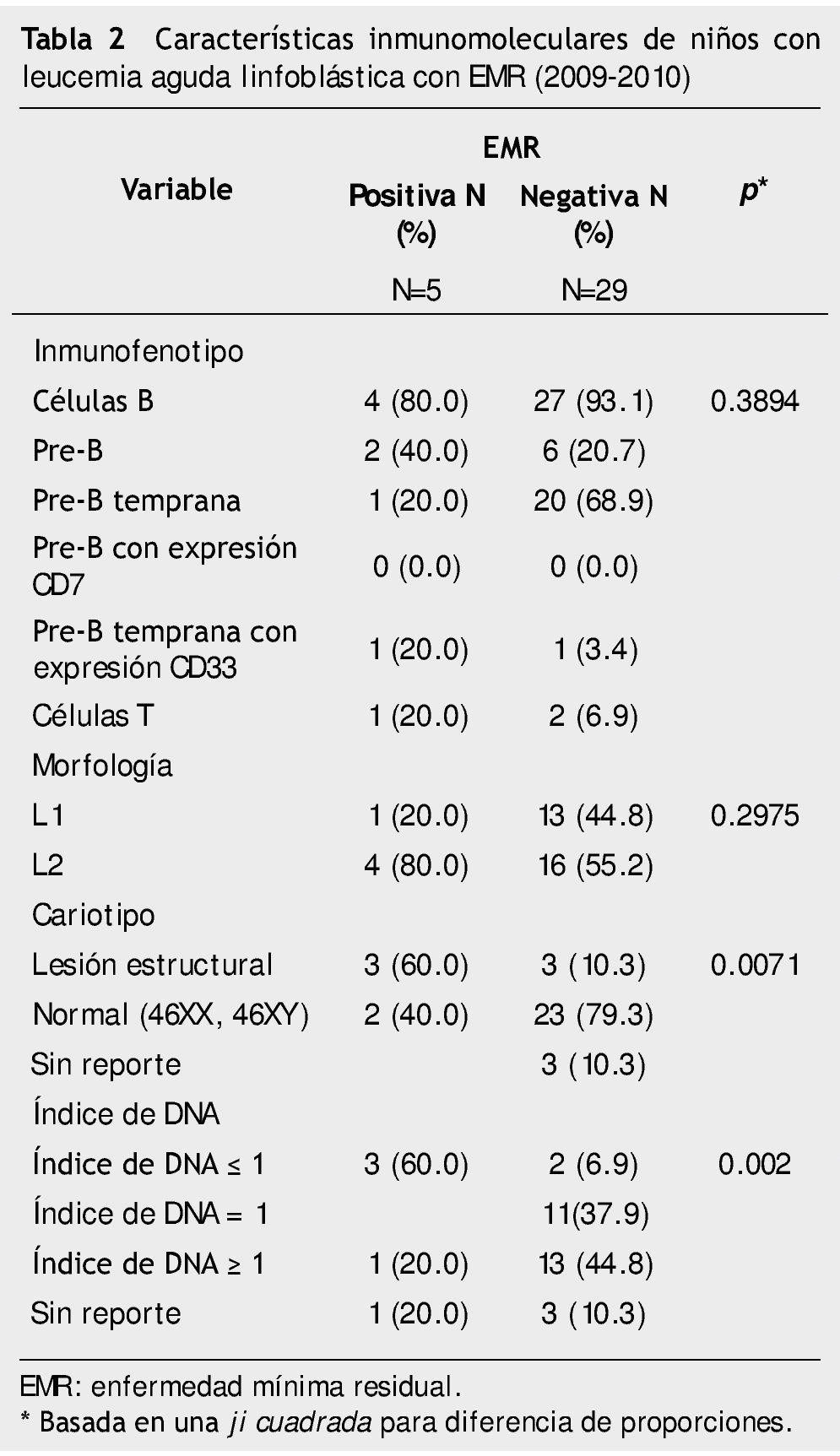
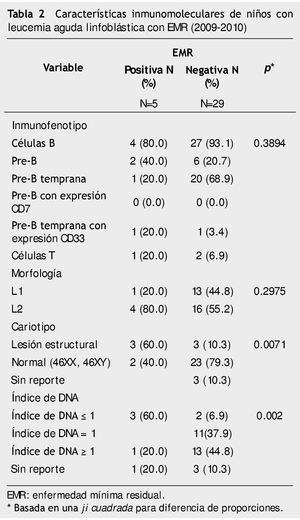
Se obtuvieron resultados de EMR positiva en un 51.7%, éstos cumplían criterios de bajo riesgo clínico, seguidos por 34.5% con clasificación de alto riesgo. La evaluación de las características clínicas considerando el resultado de la EMR, no determinó diferencias en cuanto al inmunofenotipo ni la morfología, pero si en el cariotipo (p=0.0071) y en el índice de DNA (p=0.002). En el caso del cariotipo hubo una mayor proporción (60% vs. 10%) de lesiones estructurales en los individuos con EMR positiva, así un mayor porcentaje (60%) de pacientes EMR positiva tuvieron índice < 1 (tabla 2).
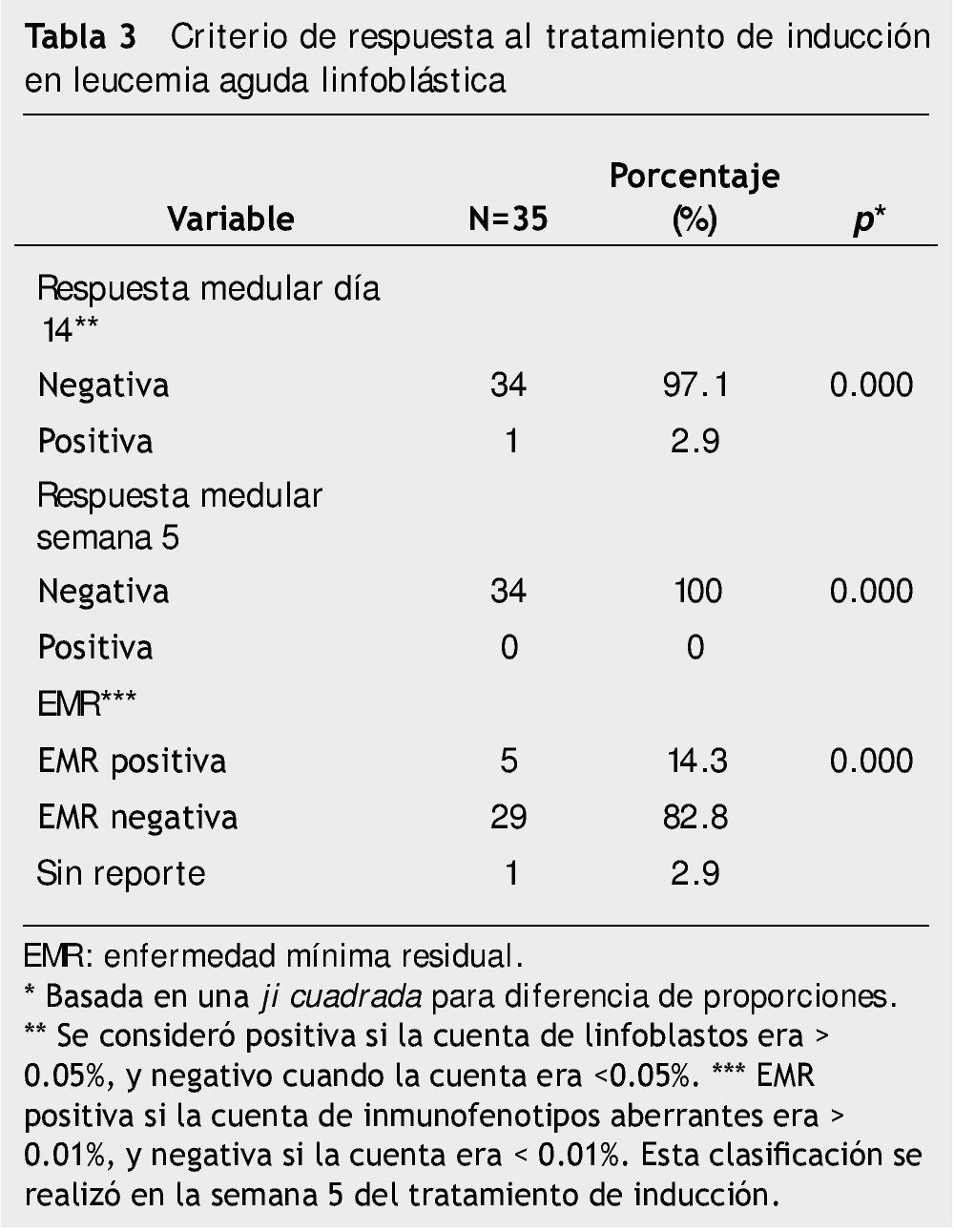
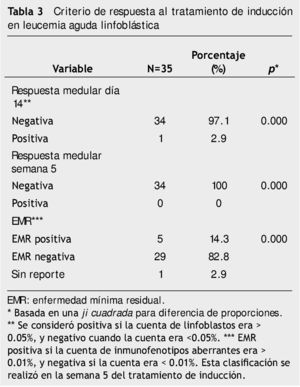
La tabla 3 describe el criterio de respuesta terapéutica de todos los pacientes. Se observó que 34 niños (97%) tuvieron una respuesta medular en el día 14, adecuada para el tratamiento de inducción; además, en la semana 5 por citomorfología del aspirado de médula ósea en 100% de los niños no se detectó actividad leucémica. A pesar de una remisión citomorfológica de las médulas óseas, únicamente 83% de los pacientes estaba libre de actividad leucémica cuando fueron evaluados por CF a la semana 5 de tratamiento. De esta forma se demostró una prueba de EMR positiva en 5 pacientes (14.3%), realizada por el análisis de CF con 4 fluorocromos con una p≤0.000.
Discusión
Los hallazgos de este estudio corroboran que la CF es una prueba útil para identificar EMR en niños con LAL al término de la terapia de inducción, tal como ha sido demostrado en otros países6-9, esto sugieren la conveniencia de su uso sistemático en hospitales similares al del estudio, donde la CF no es empleada rutinariamente como prueba pronóstica.
El valor de la CF para detectar EMR ha sido ya demostrado independientemente de la técnica con que se realice la prueba, el resultado de la CF complementa adecuadamente a los factores pronóstico clínicos como los que fueron empleados en este estudio, las mejoras en su validez, confiabilidad, simplicidad y costo-beneficio han incrementado su capacidad como predictor independiente de recaída clínica2 y como instrumento discriminatorio para ajustar los protocolos de manejo terapéutico10.
La variabilidad de los criterios clínicos pronósticos en pacientes con LAL son usados en conjunto para pronosticar recaídas, sin embargo, ninguno de ellos de forma individual posee la suficiente validez para pronosticar recaídas clínicas. En este contexto, observamos que la CF nos ayudó a identificar 5 pacientes con EMR positiva, que tenían elevada cantidad de células leucémicas residuales, que estaban en remisión clínica completa después de la terapia de inducción. Lo que muestra que los factores pronóstico clínicos aunque buenos, no son suficientes para predecir en forma temprana respuesta al tratamiento o posibles recaídas en pacientes con LAL. Esto indicaría que la determinación de EMR mediante CF apoya positivamente al terapeuta en la decisión de elegir el esquema de tratamiento o reforzar los seleccionados.
Los niños con estudio de EMR positiva tuvieron una edad promedio (9.95 años) mayor a los niños con EMR negativa, en general los pacientes con criterio de alto riesgo por edad pueden favorecer resultados de EMR positiva11. Tres niños tuvieron EMR positiva con cuentas leucocitarias < 50,000 mm3, lo que sugeriría un pronóstico favorable al tratamiento de inducción11. La prueba de CF detectó EMR positiva en 4 de 5 niños, los cuales tenían presencia de índices de DNA menores de 1.16 por CF. A este respecto se ha reportado que un índice de DNA < 1.16 tiene peor pronóstico, que los niños con índices entre 1.16 a 1.612,13.
Por otro lado, parece que la detección de EMR al final de la inducción es un factor pronóstico independiente para predecir recaída clínica de LAL, y su capacidad predictiva es excelente cuando se encuentran valores negativos, pues se han identificado recaídas entre el 70% a 100% de los pacientes con EMR positiva, mientras que EMR negativa ha reportado 2% a 10% de recaídas3,4.
Los procedimientos técnicos para detectar EMR en pacientes con leucemia aguda han avanzado considerablemente y se han convertido en una herramienta confiable para correlacionar la situación clínica y la respuesta al tratamiento. La técnica permite diferenciar leucemia residual, lo cual permite inferir la probabilidad de recaída en pacientes con EMR detectable, esto justifica decisiones clínicas para intensificar o modificar los esquemas de tratamiento8,14,15. Los criterios de riesgo y el estudio de médula ósea en la actualidad tienen limitada sensibilidad al término del tratamiento de inducción, pero son la forma tradicional para diagnosticar recaída en hospitales donde no hay evaluación por citometría14.
Conclusiones
La CF es una técnica útil y necesaria para evaluar con más precisión la remisión clínica en la LAL mediante la detección de EMR, la cual favorece decisiones terapéuticas.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Agradecimiento
Nuestro especial agradecimiento a la Agrupación para Niños Leucémicos y Afectados de Cáncer A.C. (ANLAC), por su apoyo y colaboración financiera para la realización de prueba del estudio de la enfermedad mínima residual (EMR) que requirió este estudio.
* Autor para correspondencia:
Reforma N° 355 Norte, Colonia Ley 57,
C.P. 83100, Hermosillo, Son., México.
Teléfono: (66) 2289 0600. Celular: (66) 2124 0038. Fax: (66) 2289 0606.
Correo electrónico: homero_rendon@yahoo.com.mx (Homero Rendón-García).