El cáncer de riñón es una neoplasia conocida como carcinoma de células renales (CCR), o adenocarcinoma renal y constituye 85% de todos los tumores primarios malignos del riñón.1 Afecta más a los hombres que a las mujeres (en una proporción de 2 a 1), su incidencia aumenta con la edad y alcanza su pico máximo entre los 60 y 80 años.2 A nivel mundial, la tasa anual estandarizada de incidencia para CCR varía entre 1.2 y 7.2 casos por cada 100 mil mujeres y entre 2.5 y 15.3 casos por cada 100 mil hombres.3 Dentro de los factores de riesgo conocidos para desarrollar cáncer renal se encuentran el tabaquismo, sobrepeso, una dieta pobre en vegetales, hipertensión arterial, antecedentes familiares y factores de exposición ambiental u ocupacional.2-4 Debido a la escasa manifestación de síntomas, casi la mitad de los pacientes son diagnosticados de manera incidental cuando se efectúa una revisión por causas no relacionadas.5 Como consecuencia, aproximadamente 30% de los casos ya presenta metástasis al momento del diagnóstico y más de la mitad de los pacientes tratados por enfermedad localizada eventualmente experimentará una recaída.1,2,5 La carga económica impuesta por el CCR es cuantiosa. Tan sólo en el año 2005, los Estados Unidos destinaron alrededor de cuatro mil millones de dólares a la atención médica de esta entidad, mientras que las pérdidas de productividad alcanzaron 334 millones de dólares.6
Las opciones de tratamiento para el CCR metastásico (CCRm) han evolucionado dramáticamente durante los últimos años. Hasta hace poco, interleucina-2 (IL-2) e interferón-α (IFN-α) representaban las alternativas de terapia estándar.7,8 Los resultados obtenidos con estos dos agentes son relativamente modestos y a menudo se acompañan de niveles sustanciales de toxicidad.9-12 Bevacizumab (Avastin®, F. Hoffmann La Roche Inc., Basilea, Suiza) es un anticuerpo monoclonal humanizado que inhibe el factor de crecimiento del endotelio vascular (FCEV), un mediador clave en la angiogénesis tumoral.13,14 Sunitinib (Sutent®, Pfizer Inc., Nueva York, Estados Unidos de América) es un inhibidor de la proliferación de las células tumorales y de la angiogénesis.15 Tanto bevacizumab (en combinación con IFN-α2a) como sunitinib han sido aprobados por la Administración de Alimentos y Medicamentos de Estados Unidos de América y por la Agencia Europea de Medicamentos (FDA y EMEA, por sus siglas en idioma inglés, respectivamente) para el tratamiento de CCRm.16-19 La indicación terapéutica de bevacizumab se sustenta primordialmente en los resultados de dos ensayos clínicos multicéntricos, con asignación aleatoria y a doble-ciego, controlados con IFN-α2a más placebo.20,21
El estudio AVOREN demostró que bevacizumab más IFN-α2a, prolonga significativamente la mediana de supervivencia libre de progresión (SLP: 10.2 Vs. 5.4 meses, razón de riesgo (HR): 0.63; p = 0.0001) e incrementa la tasa de respuesta global objetiva (RGO: 31 vs. 13%; p = 0.0001).20 Otro estudio fase III, conducido en Estados Unidos, confirmó los beneficios significativos en SLP y en RGO provistos por bevacizumab.21 Por su parte, la aprobación de sunitinib se basa en un estudio abierto en el que los pacientes tratados con este agente oral mostraron una mejora significativa en la tasa de RGO (31 vs. 6%; p<0.001) y en la mediana de SLP (11.0 vs. 5.0 meses), al ser comparados con el grupo que recibió IFN-α2a.22 La HR actualizada de SLP con sunitinib vs. IFN-α2a es de 0.539 (p <0.001).23
Los resultados de estos estudios fase III sugieren que la eficacia de bevacizumab más IFN-α2a es comparable a la de sunitinib en el tratamiento de primera línea de CCRm.20,22-26 La evidencia clínica también sugiere que ambos esquemas de tratamiento presentan perfiles de tolerabilidad distintos con respecto al tipo, grado y frecuencia de eventos adversos (EA) que experimentan los pacientes.20-26 La ocurrencia de EA afecta considerablemente la calidad de vida y a menudo se vuelve necesario reducir las dosis para contrarrestar los efectos negativos de los agentes, situación que limita potencialmente su eficacia terapéutica e incluso puede ameritar suspensión definitiva de los mismos.7,27,28 Asimismo, la atención médica de los EA moderados y graves genera una demanda adicional de servicios de salud e incrementa los costos.26 Actualmente, se desconoce el impacto económico inducido por la presencia de EA en el tratamiento de CCRm en nuestro país. El objetivo del presente estudio fue determinar el costo relacionado con el manejo de los principales EA de grado 3/4 en pacientes con CCRm y comparar los costos esperados por este concepto en la terapia combinada de bevacizumab e IFN-α2a y en la monoterapia con sunitinib, desde la perspectiva del sistema público de salud en México.
¿MÉTODOS
Se desarrolló un modelo analítico de decisión lineal en Microsoft Excel® (Microsoft Corp., Redmon, WA, USA) y en TreeAge Pro Suite 2009® (TreeAge Software Inc., Williamstown, MA, USA) para calcular y comparar los costos esperados por el manejo de los principales EA de grado 3/4 con bevacizumab e IFN-α2a y con sunitinib en el tratamiento de primera línea de CCRm, de acuerdo con la práctica clínica habitual de las instituciones del sistema público de salud en México. El modelo se encuentra integrado por 52 variables.
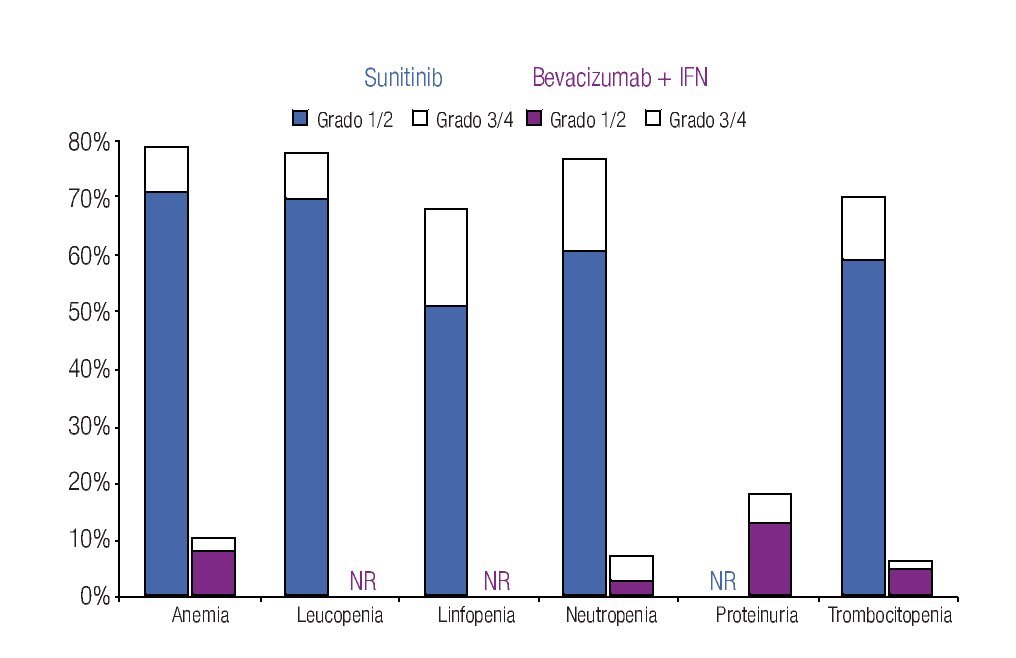
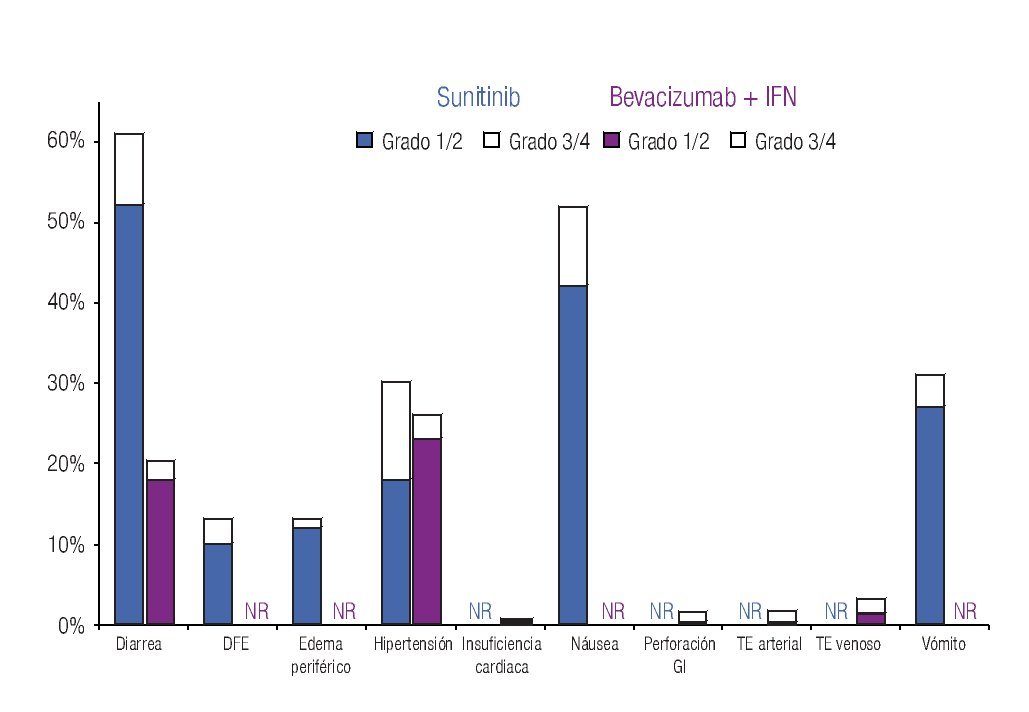
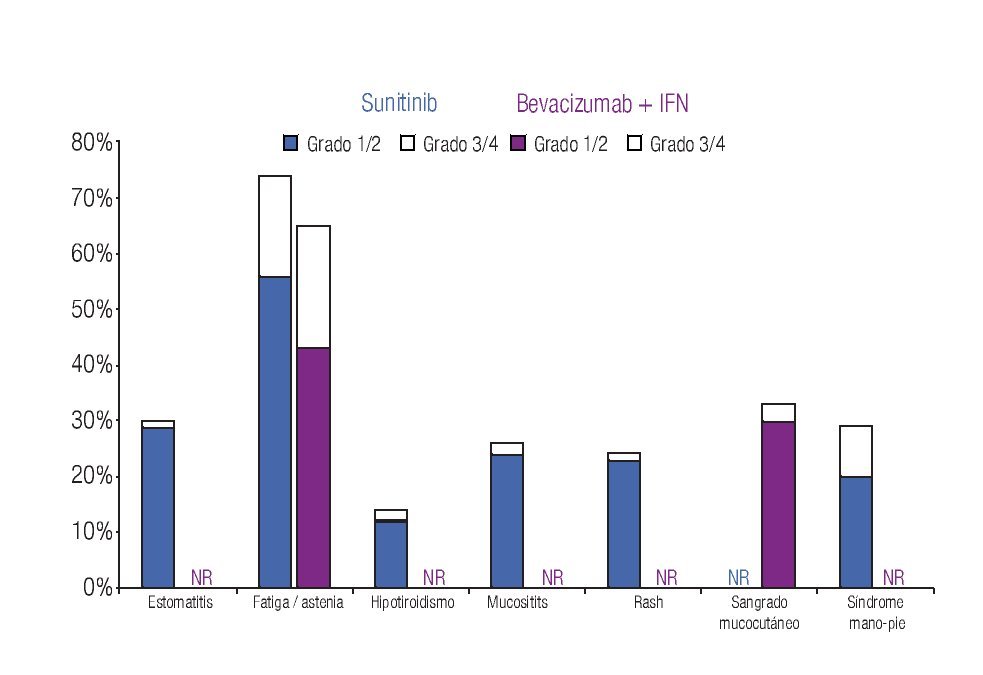
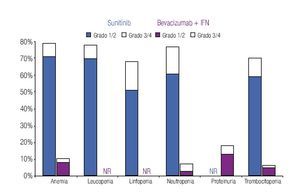
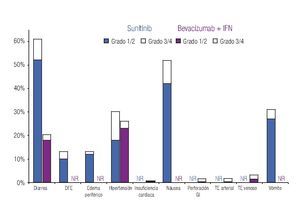
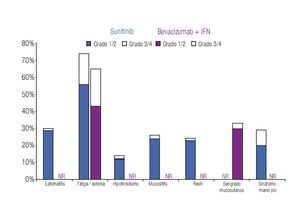
Incidencia de eventos adversos: El modelo incluye los datos de incidencia de los principales EA reportados en los dos ensayos clínicos fase III más importantes que se han llevado a cabo hasta el momento en la indicación terapéutica de interés.20,23 Los eventos se clasificaron en tres grandes grupos: anormalidades de laboratorio (Figura 1), EA gastrointestinales y cardiovasculares (Figura 2) y EA dermatológicos y sistémicos (Figura 3). Debido a que la gran mayoría de los costos asociados con el manejo de EA proviene del desarrollo de eventos de grado 3/4,26 se decidió realizar el análisis tomando en consideración únicamente los eventos más graves. El criterio para seleccionar los EA fue que éstos resultaran potencialmente costeables desde la perspectiva del sistema público de salud en México. Por falta de información precisa acerca de la incidencia de depresión en los pacientes con sunitinib,22,23 se decidió excluir del análisis a este evento.
Figura 1. Frecuencia y severidad de las principales anormalidades de laboratorio en pacientes con carcinoma de células renales metastásico tratados con bevacizumab más IFN o con sunitinib (Escudier y colaboradores, 2007; Motzer y colaboradores, 2009). IFN: interferón-α2a; NR: no informado.
Figura 2. Frecuencia y severidad de los principales eventos adversos gastrointestinales y cardiovasculares en pacientes con carcinoma de células renales metastásico tratados con bevacizumab más IFN o con sunitinib (Escudier y colaboradores, 2007; Motzer y colaboradores, 2009). IFN: interferón-α2a; DFE: disminución de la fracción de eyección; GI: gastrointestinal; TE: tromboembolismo; NR: no informado
Figura 3. Frecuencia y severidad de los principales eventos adversos dermatológicos y sistémicos en pacientes con carcinoma de células renales metastásico tratados con bevacizumab más IFN o con sunitinib (Escudier y colaboradores, 2007; Motzer y colaboradores, 2009). IFN: interferón-α2a; NR: no informado.
Datos de costos: El cálculo de costos se efectuó mediante la suma producto de los recursos médicos utilizados para la atención de cada EA de grado 3/4 y sus respectivos costos unitarios. La frecuencia y tipo de cada recurso médico, así como la proporción de pacientes que lo requiere, fueron determinadas con base en una serie de 46 entrevistas con 11 médicos de distintas especialidades (oncología, hematología, gastroenterología, cardiología y cirugía), que pertenecen o han tenido experiencia en hospitales del Instituto Mexicano del Seguro Social (IMSS), Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE) y de la Secretaría de Salud. Conforme a la perspectiva del estudio, sólo se calcularon los costos directos de atención médica.
Los datos sobre uso de recursos médicos para cada EA de grado 3/4 fueron recolectados en un formato diseñado especialmente para esta investigación. El formato consta de seis secciones: (i) consultas médicas (servicio de urgencias, medicina familiar y especialidad); (ii) exámenes de imagenología (estudios de gabinete); (iii) exámenes de laboratorio; (iv) terapia farmacológica (nombre genérico del medicamento, dosis empleada, vía de administración, frecuencia y duración del tratamiento); (v) hospitalización, diferenciando entre estancia en sala común y en unidad de terapia intensiva; y, (vi) procedimientos quirúrgicos y no quirúrgicos.
La información sobre costos unitarios procede de fuentes oficiales. Para los costos de medicamentos, se consultaron el portal de transparencia del IMSS29 y el Sistema Electrónico de Contrataciones Gubernamentales (Compranet),30 mientras que los costos unitarios de los servicios médicos se obtuvieron del listado publicado por el IMSS en el Diario Oficial de la Federación (tercer nivel de atención médica)31 y de las cuotas de recuperación para el nivel socioeconómico número seis en el Hospital General Dr. Manuel Gea González, de la Secretaría de Salud.32 Todos los costos fueron calculados y se expresan en moneda nacional (pesos mexicanos) del año 2009.
Puesto que la neutropenia puede presentarse con o sin fiebre, fue necesario calcular el costo promedio ponderado para este evento. El cálculo incluyó la proporción de casos y el costo cuando la neutropenia es febril y la proporción de casos y el costo asociado cuando la neutropenia no viene acompañada de fiebre. De acuerdo con los datos de Motzer y colaboradores (2007), 4.44% (2/45) de los casos de neutropenia ocurridos en el grupo de sunitinib fue de tipo febril.22 Esta cifra se utilizó para calcular los costos en ambos grupos de comparación. El costo de neutropenia sin fiebre se calculó como parte de las entrevistas a expertos; el costo de tratamiento de neutropenia febril fue obtenido de un artículo publicado en México,33 cuyo valor se actualizó de 2008 a 2009 empleando el mismo factor utilizado por el IMSS.31
Análisis estadístico: La incidencia de EA de grado 3/4 en cada una de las tres categorías de eventos analizadas, según terapia dirigida, se comparó mediante la prueba exacta de Fisher para diferencia de proporciones. El cálculo del valor esperado durante el caso base contempla la estimación puntual de la incidencia de cada EA de grado 3/4 y el promedio de costos de tratamiento para cada evento. Una vez que el caso base fue analizado, se realizó un exhaustivo proceso de análisis de sensibilidad. El análisis determinístico consistió de una serie de análisis de sensibilidad de tipo escenario, donde se evaluó el efecto de utilizar los valores extremos de la incidencia de los EA de grado 3/4 y de los costos de tratamiento. Estos valores extremos se conformaron con los límites superior e inferior del intervalo de confianza a 95% para la incidencia de cada evento y con el costo máximo y mínimo, éstos últimos definidos como el valor de costos para el caso base ± una variación de 15%. Las pruebas estadísticas y las estimaciones puntuales e intervalos de confianza para la incidencia de EA de grado 3/4 se desarrollaron en el software estadístico Stata versión 9 (StataCorp LP, College Station, TX, USA). Los intervalos de confianza fueron generados con el método exacto de la distribución binomial. Posteriormente, se diseñó un diagrama de tornado, el cual consiste en un conjunto de análisis de sensibilidad univariados, cuyos resultados se grafican en barras horizontales que son apiladas en orden conforme a su longitud, siendo las más amplias representativas de los parámetros que generan mayor impacto en el cálculo de la diferencia de costos esperados por manejo de EA de grado 3/4. Para el análisis de sensibilidad probabilístico se generaron 10 000 simulaciones de Monte Carlo de segundo orden. De acuerdo con las recomendaciones de Briggs y colaboradores, se asumió una distribución de probabilidad beta para la incidencia de EA y una distribución de probabilidad gamma para los costos por manejo de los mismos.34
Los parámetros de la distribución beta para la incidencia de EA de grado 3/4 con bevacizumab e IFN-α2a fueron obtenidos directamente de las cifras reportadas por los autores del ensayo clínico.20 En el caso de sunitinib, los parámetros se obtuvieron de forma indirecta mediante un proceso de aproximación, utilizando las medias y desviaciones estándar calculadas empíricamente en el software estadístico. Los parámetros de la distribución gamma también se determinaron siguiendo un proceso de aproximación, al considerar para cada parámetro el valor promedio de costos y asumir una desviación estándar igual a 10% de ese valor.34
¿ RESULTADOS
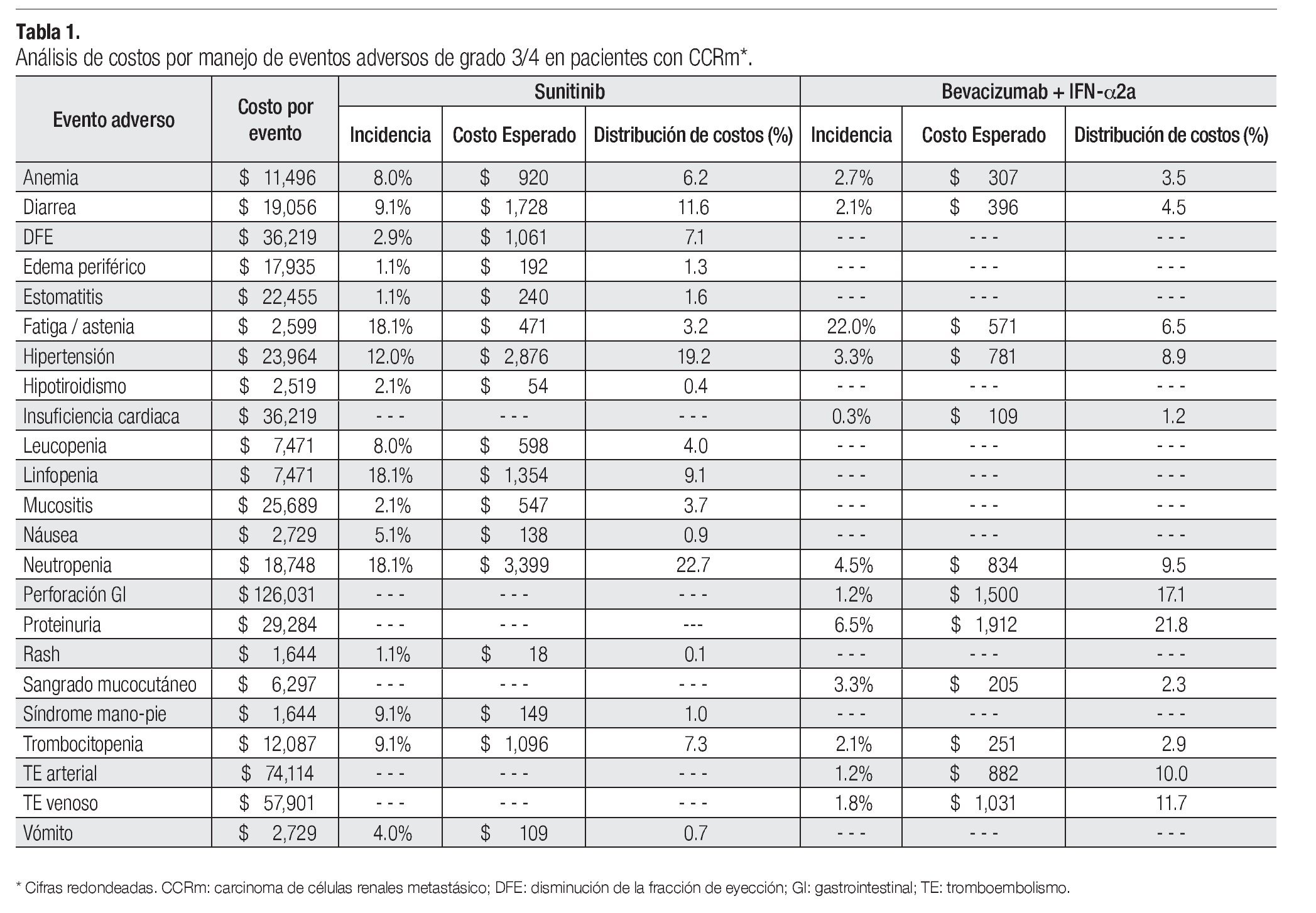
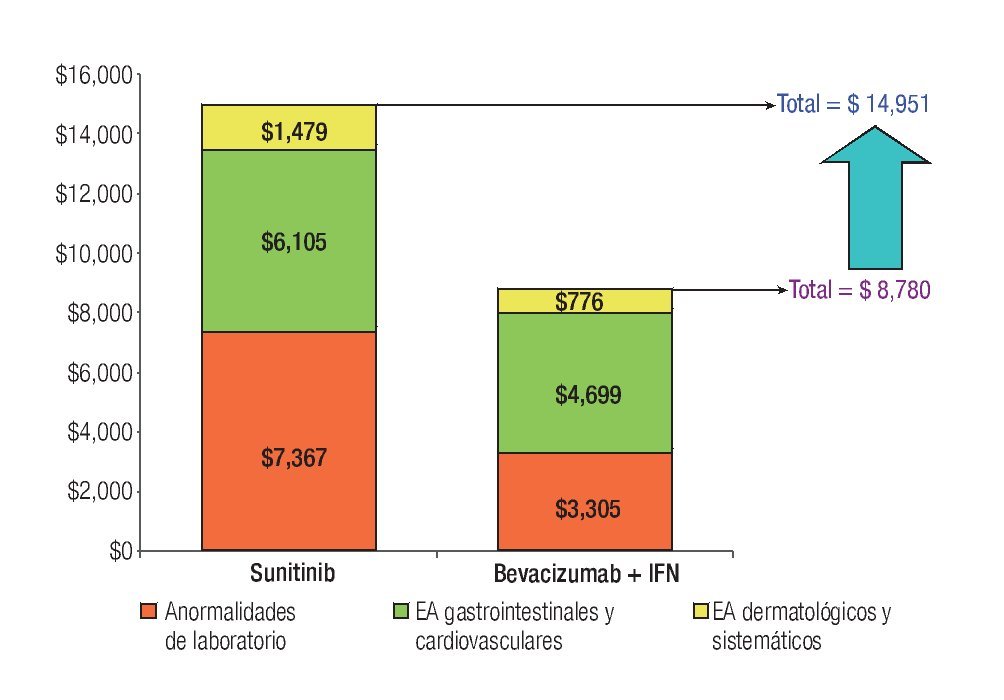
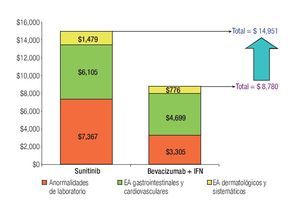
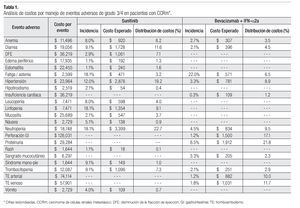
La Tabla 1 presenta los costos promedio por evento y la incidencia puntual de EA de grado 3/4 con sunitinib y con la combinación de bevacizumab e IFN-α2a, así como el costo esperado por paciente para cada evento y la distribución porcentual de los costos totales esperados, según terapia dirigida. La incidencia de EA de grado 3/4 resultó significativamente más alta con sunitinib que con bevacizumab e IFN-α2a. Lo anterior fue cierto para las tres categorías de eventos que se evaluaron: anormalidades de laboratorio (61.3% vs. 15.7%; p = 0.0000), EA gastrointestinales y cardiovasculares (34.1% vs. 9.8%; p = 0.0000) y EA dermatológicos y sistémicos (33.6% vs. 25.2%; p = 0.0142). Asimismo, en las tres categorías analizadas el gasto por manejo de EA de grado 3/4 resultó mayor con sunitinib que con bevacizumab más IFN-α2a (Figura 4). De esta forma, los costos totales esperados por manejo de EA de grado 3/4 en pacientes con CCRm son considerablemente más elevados cuando se administra sunitinib ($14 951 por paciente) que cuando la terapia consiste en la combinación de bevacizumab e IFN-α2a ($8780 por paciente). El gasto adicional con sunitinib fue estimado en $6171 por paciente, cifra que equivale a un aumento de 70.3% con respecto al valor esperado para la combinación de bevacizumab e IFN-α2a. Visto de otra forma, los ahorros potenciales con la terapia combinada representan una disminución de 41.3% con relación a la monoterapia de sunitinib en los costos asociados con el manejo de eventos adversos de grado 3/4.
Figura 4. Comparación de costos esperados por manejo de EA de grado 3/4 en pacientes con carcinoma de células renales metastásico. EA: eventos adversos; IFN: interferón-α2a.
Aproximadamente, la mitad de los costos directos médicos por manejo de EA de grado 3/4 en pacientes con CCRm que reciben sunitinib corresponde a la categoría de anormalidades de laboratorio; los EA de tipo gastrointestinal o cardiovascular ocupan el segundo lugar con 41% y los EA dermatológicos y sistémicos representaron una décima parte del total. Los principales inductores del costo fueron neutropenia, hipertensión, diarrea, linfopenia, trombocitopenia, disminución de la fracción de eyección y anemia, quienes en conjunto fueron responsables del 83% del costo total por manejo de EA de grado 3/4 con este agente. La distribución porcentual de costos por manejo de EA de grado 3/4 con la combinación de bevacizumab e IFN-α2a fue 54% para los EA gastrointestinales y cardiovasculares, 37% para las anormalidades de laboratorio y 9% para los EA dermatológicos y sistémicos. Proteinuria, perforación gastrointestinal, tromboembolismo venoso o arterial, neutropenia, hipertensión y fatiga/astenia constituyen los principales inductores del costo del manejo de EA de grado 3/4 para la terapia combinada de bevacizumab e IFN-α2a, siendo responsables del 86% del costo total esperado por este rubro (Tabla 1 y Figura 4).
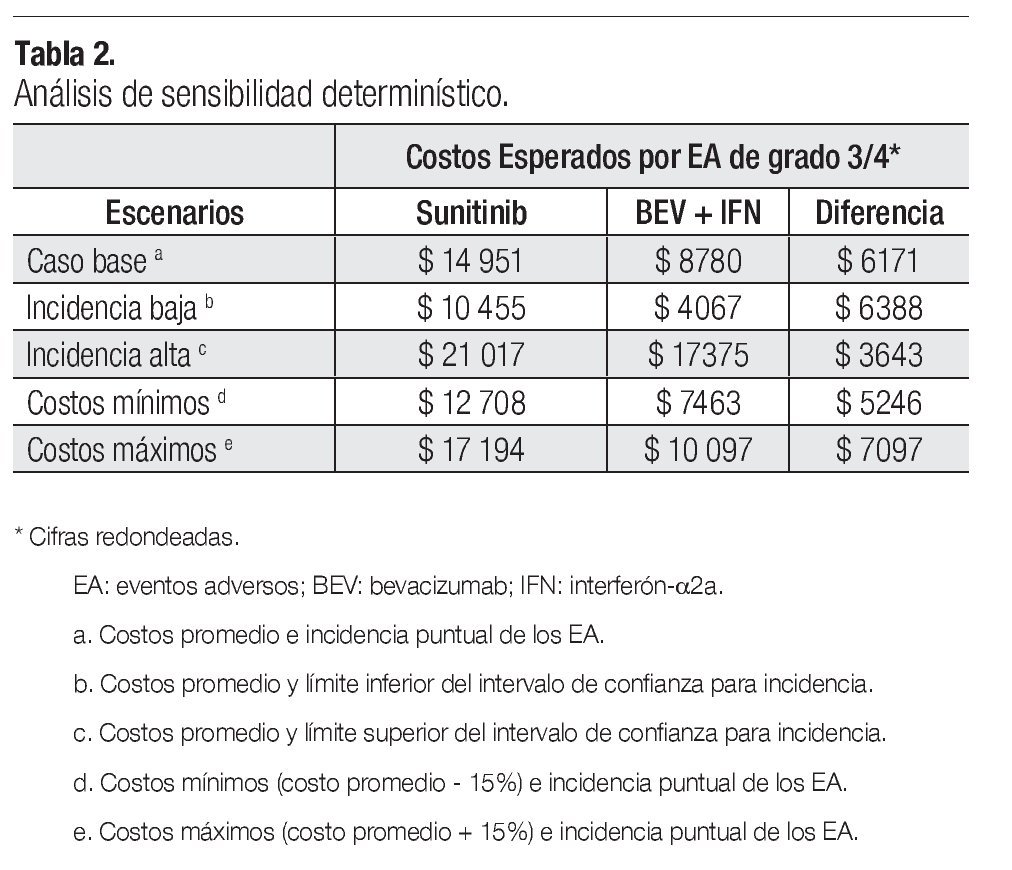
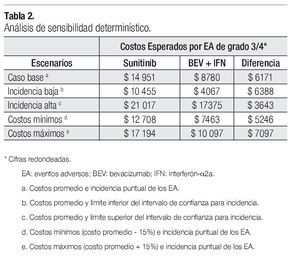
La Tabla 2 presenta los resultados del análisis de sensibilidad determinístico. En los cuatro escenarios que se generan al utilizar como parámetros del modelo valores extremos de incidencia y de costos, el valor esperado del costo total por manejo de EA de grado 3/4 fue más alto para sunitinib que para la combinación de bevacizumab e IFN-α2a, con una diferencia que oscila entre $3643 y $7097 por paciente.
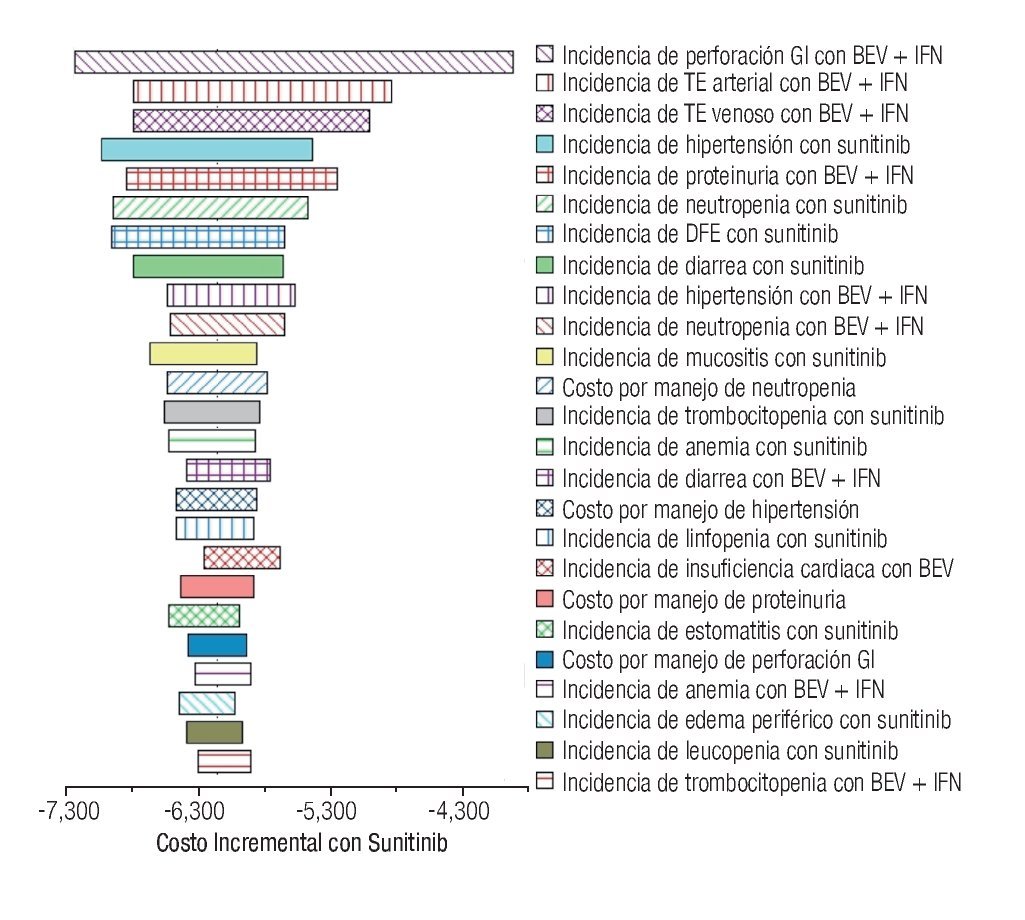
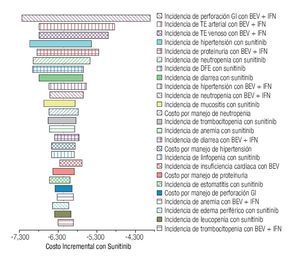
La Figura 5 despliega el diagrama de tornado. Para mayor claridad, se muestran únicamente los 25 parámetros que más influyeron en los resultados del modelo. Considerando un rango de variabilidad plausible, ningún parámetro -de forma individual- tuvo la capacidad de revertir la conclusión de que la monoterapia de sunitinib se asocia con mayores costos por manejo de EA de grado 3/4 en pacientes con CCRm.
Figura 5. Diagrama de tornado. EA: eventos adversos; BEV: bevacizumab; IFN: interferón-α2a; GI: gastrointestinal; TE: tromboembolismo; DFE: disminución de la fracción de eyección.
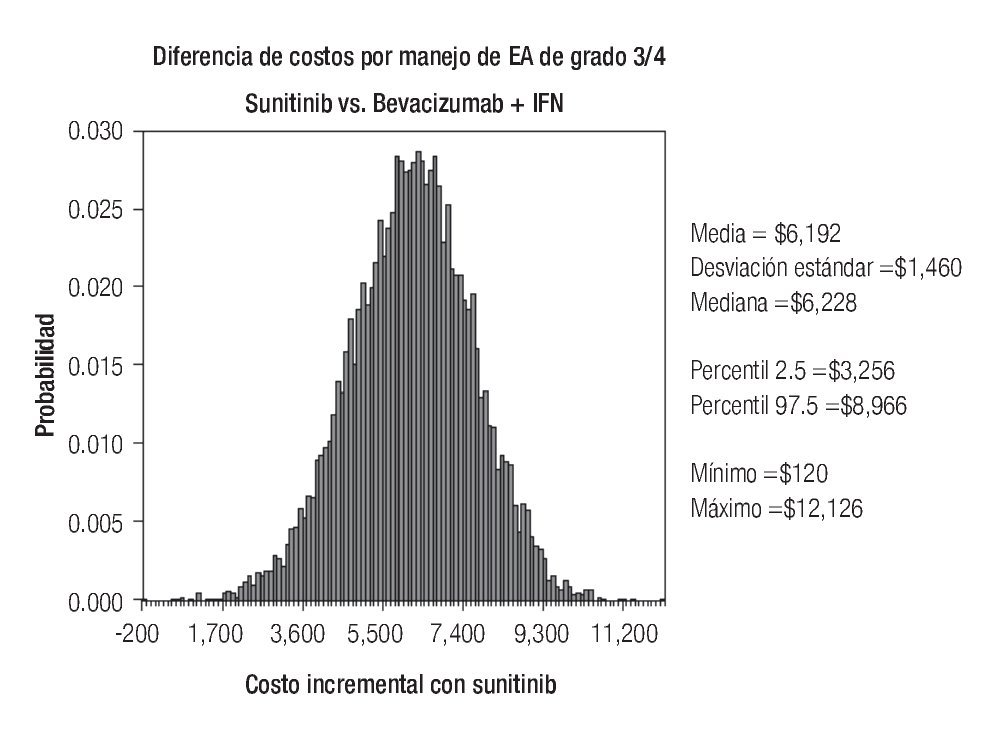
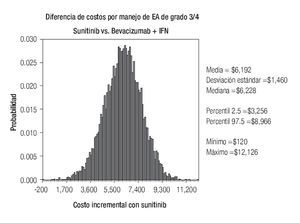
De acuerdo con los resultados del análisis de sensibilidad probabilístico, los costos esperados por manejo de EA de grado 3/4 con sunitinib y con la combinación de bevacizumab e IFN-α2a fueron estimados en $14 942 y $8750 respectivamente, dando lugar a un ahorro de $6192 por paciente en este rubro a favor de la terapia combinada (Figura 6). En aproximadamente 90% de las diez mil simulaciones generadas, el ahorro con bevacizumab más IFN-α2a superó los $4300 por paciente, y sólo en una de ellas el costo con sunitinib resultó más bajo que la terapia combinada.
Figura 6. Análisis de sensibilidad probabilístico. EA: eventos adversos; IFN: interferón-α2a
¿ DISCUSIÓN
Durante los últimos años, el desarrollo de terapias dirigidas ha abierto nuevas posibilidades en el ámbito de la oncología. Bevacizumab (en combinación con IFN-α2a) y sunitinib han mostrado resultados alentadores como primera línea de tratamiento en pacientes con CCRm. Dentro de los factores que deben valorarse al momento de seleccionar un régimen terapéutico destacan la eficacia, seguridad, tolerabilidad, facilidad de manejo de los EA, impacto en calidad de vida, costos asociados con la terapia y costos del manejo de los efectos indeseables.26,35 La evidencia que se desprende de los estudios pivotales con estos regímenes es que su eficacia es similar.20,22,23 Dos artículos publicados recientemente proponen que existe cierta ventaja a favor de sunitinib en SLP.36,37 Sin embargo, dichos estudios incluyeron en su análisis de eficacia los resultados del ensayo clínico CALGB 90206,21 un estudio abierto que no reportó los datos confirmados de manera independiente y que fue llevado a cabo en centros con experiencia limitada en el uso de IFN-α2a.26 Más aún, la proporción de pacientes con pronóstico favorable en el estudio pivotal de sunitinib22-23 fue más alta que en el estudio pivotal de bevacizumab e IFN-α2a20 y que en el ensayo clínico CALGB 9020621 (38% vs. 27% y 26%, respectivamente), por lo que los resultados de las comparaciones indirectas deben ser tomados con cautela.36,37 Considerando lo anterior, diversos autores sugieren que la eficacia de bevacizumab más IFN-α2a y de la monoterapia con sunitinib resulta comparable.24-26,35
Los perfiles de tolerabilidad de sunitinib y de bevacizumab e IFN-α2a difieren de manera sustantiva.13,20-23,25,26 Los resultados del presente estudio muestran que aproximadamente la mitad de los EA de grado 3/4 considerados para el análisis de sunitinib corresponde a anormalidades de laboratorio, mientras que la otra mitad se divide exactamente entre la categoría de EA gastrointestinales y cardiovasculares y la categoría de EA dermatológicos y sistémicos. En cambio, la mitad de los EA de grado 3/4 incluidos en el análisis de bevacizumab e IFN-α2a pertenecen a la categoría de EA dermatológicos o sistémicos; este tipo de eventos son considerados los menos graves y se asocian con menores costos al ser comparados con las otras categorías. Una posible explicación de la diferencia en los perfiles de tolerabilidad observada tiene que ver con los mecanismos de acción de los agentes. Los EA comúnmente asociados con bevacizumab parecen relacionarse directamente con la inhibición precisa de la señalización del FCEV. En contraste, sunitinib es un inhibidor multi-objetivo de la quinasa que ha demostrado tener actividad en contra de diferentes trayectorias de señalización celular, por lo que el tratamiento con sunitinib se asocia con toxicidades específicas y no específicas del FCEV.26
Una parte de los EA observados con la combinación de bevacizumab e IFN-α2a se considera una consecuencia del tratamiento con este último agente. Por ejemplo, en los estudios con pacientes que recibieron monoterapia de bevacizumab no se identificó neutropenia.25 Así, presumiblemente se puede mejorar la tolerabilidad de la terapia combinada si se reduce la dosis de IFN-α2a. Melichar y colaboradores mostraron que la reducción de la dosis de IFN-α2a de nueve a seis o incluso a tres millones de unidades internacionales permitió a los pacientes que desarrollaron toxicidad atribuible a dicho agente durante el estudio AVOREN continuar con la terapia, manteniendo un manejo adecuado de los EA y, más importante aún, sin afectar la eficacia del tratamiento antineoplásico.38 En el periodo de seis semanas posterior a la reducción de dosis de IFN-α2a, la incidencia de EA de grado 3/4 disminuyó considerablemente comparado con las seis semanas previas (44% vs. 18% en el grupo de bevacizumab y 41% vs. 10% en el grupo de placebo).38 La mayoría de los EA con sunitinib puede controlarse reduciendo la dosis diaria que se administra.27 Sin embargo, la evidencia indica que tanto la SLP como la tasa de RGO con sunitinib se relacionan directamente con la magnitud de exposición al fármaco.39,40 Ante la presencia de EA de grado 3/4 con sunitinib es frecuente la necesidad de ajuste de dosis o suspensión temporal del medicamento, situación que puede limitar su eficacia terapéutica.27,41,42 La proporción de pacientes con al menos una reducción de dosis ocasionada por el tratamiento de EA emergentes durante los estudios pivotales fue notablemente más alta con sunitinib que con bevacizumab e IFN-α2a (32% vs. 13%). De igual forma, la proporción de pacientes que experimentó una suspensión temporal de la terapia por EA fue mayor con sunitinib (38% vs. 21%). Para medianas de duración del tratamiento de seis y 9.7 meses respectivamente, la tasa de discontinuación por EA con sunitinib duplica la de bevacizumab e IFN-α2a (8% vs. 4%).27 Cuando la mediana de duración del tratamiento con sunitinib alcanzó los 11 meses, aproximadamente uno de cada cinco pacientes asignados a este agente oral había abandonado el tratamiento como consecuencia de EA intolerables.23
La incidencia y tipo de EA repercute en los costos de tratamiento. En el presente estudio, los costos esperados por manejo de EA de grado 3/4 fueron considerablemente (70.3%) más elevados con sunitinib que con bevacizumab e IFN-α2a. La diferencia ($6171 por paciente) significa ahorros potenciales de 41.3% en este rubro si se sustituye la monoterapia de sunitinib por la terapia combinada de bevacizumab e IFN-α2a. Estos resultados son consistentes con lo reportado previamente en la literatura.26,43 La técnica Delphi fue utilizada para determinar el uso de recursos asociado con la atención médica de EA de grado 3/4 en pacientes con CCRm en España e Italia. Considerando la incidencia reportada en los estudios pivotales, la diferencia de costos (ahorro porcentual) en el manejo de EA de grado 3/4 fue estimada en 372 euros (40%) por paciente en España y en 489 euros (55%) por paciente en Italia, ambos a favor de la combinación de bevacizumab e IFN-α2a.26,43 Otros análisis, donde los costos por evento se sustentaron en fuentes de información más elaborada, tales como grupos relacionados con el diagnóstico (GRD), catálogos y bases de datos oficiales, además de literatura publicada, ofrecen resultados similares. Los ahorros potenciales con bevacizumab e IFN-α2a en lugar de sunitinib fueron calculados en 418 (23%), 671 (45%) y 972 (38%) euros por paciente en Alemania, el Reino Unido y Francia, respectivamente.26 La capacidad para mejorar la tolerabilidad al tratamiento combinado de bevacizumab e IFN-α2a, al reducir las dosis de este último agente sin comprometer la eficacia del régimen, permitiría reducir aún más los costos de tratamiento.44
No obstante las diferencias en las fuentes de información empleadas para su cálculo, la composición porcentual de los costos en nuestro estudio resulta comparable con los resultados de otras publicaciones.26,43 Las anormalidades de laboratorio son los EA de grado 3/4 más frecuentes con sunitinib y el tratamiento de las toxicidades hematológicas representó prácticamente la mitad de los costos esperados por manejo de EA de grado 3/4 con este agente en México. Las toxicidades hematológicas generan un impacto económico sustancial y disminuyen la calidad de vida de los pacientes y cuidadores.28,45 Aunque con menores costos asociados, otros EA que se presentan con cierta regularidad con sunitinib son percibidos normalmente como problemáticos. Por ejemplo, el síndrome mano-pie suele manifestarse de tres a cuatro semanas después de iniciada la terapia y ocurre primordialmente en los puntos de presión de las manos y pies, dificultando tareas básicas como caminar y desarrollar actividades manuales.26,27 Diarrea, náusea, vómito y mucositis son otros eventos que interfieren con la cotidianeidad, generan incomodidades y pueden ocasionar situaciones embarazosas. Además, estos eventos podrían alterar el plan nutricional de los pacientes, mismo que de por sí ya se encuentra comprometido.26 En nuestro estudio, proteinuria fue el EA de grado 3/4 que más peso tuvo en los costos esperados por este rubro en la terapia combinada de bevacizumab e IFN-α2a, siendo responsable de 21.8% del total. Esta proporción coincide con los datos obtenidos en el Reino Unido, donde proteinuria también fue el principal inductor de costos para dicho régimen.26 A nivel individual, sin duda que perforación gastrointestinal constituye el EA potencialmente más grave y costoso. A pesar de su baja incidencia (1.19%), la perforación gastrointestinal fue el evento con el segundo costo esperado más alto para bevacizumab e IFN-α2a en México, mientras que en España se ubicó en el primer lugar y en Italia ocupó el tercer sitio.26,43 Tromboembolismo arterial o venoso, hipertensión arterial, neutropenia y fatiga/astenia fueron los otros eventos que tuvieron mayor impacto en los costos totales esperados por manejo de EA de grado 3/4 con bevacizumab e IFN-α2a en México. Si bien es cierto que eventos como perforación gastrointestinal y tromboembolismo son potencialmente letales, es importante señalar que únicamente 3 casos de defunción, ocurridos entre un total de 337 pacientes asignados a la combinación de bevacizumab e IFN-α2a (<1%) se clasificaron como posiblemente relacionadas con bevacizumab.20
Nuestro estudio presenta varias limitaciones que vale la pena comentar. En primer lugar, se analizaron exclusivamente los EA que los investigadores y el grupo de expertos consideraron costeables desde la perspectiva del sistema público de salud en México. Así, un total de 23 eventos fueron evaluados. En el análisis de costos para Italia se siguió un criterio similar. Nosotros incluimos todos los 19 EA del estudio italiano y agregamos cuatro eventos más. De acuerdo con los datos presentados por Mickisch y colaboradores (2010), los evento que no incorporamos en el análisis representan una proporción mínima en el costo total esperado y su efecto en costos parece similar entre los dos regímenes.26 Es probable que la mayoría de los gastos asociados con el tratamiento de eventos tales como dolor de cabeza y síndromes semejantes a influenza sean absorbidos directamente por los pacientes y sus familias (como gasto de bolsillo) y no por las instituciones. Una segunda limitación consiste en que el análisis contempla únicamente los costos de los EA de grado 3/4. Como se mencionó con anterioridad, y al igual que en los casos de España e Italia, se decidió excluir del análisis a los EA de grado 1/2 debido a que los reportes en el Reino Unido, Alemania y Francia indicaron que la mayor parte del costo esperado corresponde a los eventos graves.26,43 Un criterio adicional que tomamos en cuenta fue la dificultad para establecer el porcentaje de pacientes con eventos leves y moderados que realmente acude en busca de atención médica. En este sentido, las cifras de costos esperados que se muestran en nuestro estudio deben verse como una estimación conservadora. En el estudio de Mickisch y colaboradores (2010), los costos esperados por manejo de EA de grado 3/4 representaron entre 61 y 93% de los costos esperados por los EA de todos los grados en el grupo de bevacizumab e IFN-α2a y entre 51% y 86% en el grupo de sunitinib.26 El incluir los eventos de todos los grados habría incrementado la diferencia absoluta a favor de la terapia con bevacizumab. Los ahorros para EA graves y para todos los eventos, expresados en términos porcentuales, permanecieron casi inalterados en el Reino Unido y Alemania, mientras que en Francia la diferencia a favor de bevacizumab e IFN-α2a se incrementó de 38% para los EA de grado 3/4 hasta 62% cuando se incluyeron todos los grados.26
Otras limitaciones del estudio se relacionan con las fuentes de información utilizadas y con la naturaleza del propio modelo analítico de decisión lineal. Los datos de incidencia provienen de dos ensayos clínicos, que si bien son parecidos en cuanto a diseño y duración del tratamiento, tal vez no sean lo suficientemente representativos del tipo y frecuencia de EA observados durante la práctica clínica diaria. Un estudio reciente sugiere que las incidencias de EA de grado 3/4 con terapias orales de inhibidores de quinasa (sunitinib y sorafenib) en CCR avanzado reportadas inicialmente en la literatura pueden estar subestimadas.41 Por otro lado, el haber calculado los costos por evento con base en una serie de entrevistas a expertos pudiera verse también como una limitación del estudio. No obstante, los patrones y la distribución de costos obtenida durante esta investigación resultan comparables con otros estudios que han empleado fuentes de información para costos más estandarizadas.26 El modelo no permite establecer si la diferencia de costos entre ambos regímenes resulta estadísticamente significativa, aunque una disminución de alrededor de 40% en los costos esperados por manejo de EA de grado 3/4 a favor de bevacizumab e IFN-α2a puede considerarse de importancia y es consistente con lo publicado en la literatura.26,43 Sería ideal contar con un estudio prospectivo o con datos más sólidos de farmacovigilancia y de costos para poder confirmar los hallazgos reportados hasta ahora, así como identificar nuevas líneas de investigación. Finalmente, es importante destacar que el presente estudio constituye un análisis de costos enfocado exclusivamente al manejo de EA y que esta categoría de costos representa sólo una porción del costo total asociado con el tratamiento antineoplásico con terapias dirigidas. Una evaluación completa de farmacoeconomía requiere que los costos de las terapias y de la atención de sus efectos indeseables sean considerados en conjunto con parámetros clínicos de eficacia y calidad de vida.
A manera de conclusión, este estudio sugiere que la diferencia en los mecanismos de acción entre sunitinib y bevacizumab e IFN-α2a tiene repercusiones en el tipo y frecuencia de los EA observados en el tratamiento de primera línea de CCRm. El perfil de tolerabilidad más favorable de la combinación de bevacizumab e IFN-α2a permite que los costos esperados por manejo de EA de grado 3/4 sean considerablemente más bajos con este régimen que cuando se administra sunitinib. Esta característica, en combinación con otros factores, debe ser tomada en cuenta al momento de decidir el esquema terapéutico más adecuado. El tratamiento óptimo con estos agentes requiere llevar a cabo un monitoreo proactivo que permita actuar de manera oportuna para reducir los costos y los efectos negativos de los EA y maximizar la efectividad en beneficio de los pacientes y las instituciones de salud.
¿ AGRADECIMIENTOS
Los autores agradecen enormemente a los doctores Dan Green Renner, Juan Alejandro Silva, Mario Pérez, Ricardo Villalobos Valencia, Víctor Manuel Vázquez Rivera, Guadalupe Cervantes Sánchez, Laura Torrecillas Torres, Carlos Alberto Ronquillo Carreón, Luis Martín Loarca Piña, Juan Manuel Blancas Valencia y Mauricio López Meneses por su valiosa contribución al estudio.
¿ DECLARACIÓN DE CONFLICTO DE INTERÉS
Esta investigación se realizó con el apoyo financiero de Productos Roche, S.A. de C.V., compañía que manufactura Avastin® (bevacizumab). Los autores declaran que no tienen ningún interés competente más allá que el de haber recibido el patrocinio por parte de Productos Roche, S.A. de C.V. y que el análisis de la información y la redacción del artículo se realizaron bajo total autonomía.
Correspondencia: Fernando Carlos Rivera.
Insurgentes Sur N° 598 Piso 2-204 Mza. Col. Del Valle. Del. Benito Juárez, 03100. México, D.F. Teléfono: (55) 5523 0931.
Correo electrónico:fernando.carlos@racsalud.com