¿ INTRODUCCIÓN
En el mundo, durante 2002 se registraron más de 1,179,000 casos nuevos de cáncer pulmonar, la mayoría se diagnosticó en hombres, de los que fallecieron 848,000 en el mismo año.1 El Registro Histopatológico de Neoplasias en México del 2003 detectó 4609 muertes en hombres y 2141 en mujeres a causa de neoplasias originadas a nivel pulmonar.2 Un estudio reciente mostró que los estados de Baja California, Sonora, Chihuahua, Sinaloa, Nuevo León y Tampico tienen el más alto índice de mortalidad anual por cáncer pulmonar, ajustado por edad.3
En México, la gran mayoría de los casos con cáncer se atienden en instituciones gubernamentales (Instituto Mexicano del Seguro Social, Secretaría de Salud, Instituto de Seguridad Social al Servicio de los Trabajadores del Estado) y cerca del 4% son atendidos a nivel privado. Un análisis de tendencias acerca de la mortalidad por cáncer pulmonar reportó que ésta aumentó 91% entre hombres y 47.9% en mujeres, cuando se comparó la mortalidad observada de 1970 a 1974 y la de 1995 a 1999.4 Recientemente, se ha informado que el cáncer pulmonar induce 11.5% de las muertes por cáncer en México, con una tasa de 6.5 por 100 mil habitantes.3
El cáncer de células no pequeñas (NSCLC), representa 80 a 85% de los casos de cáncer pulmonar, en este grupo se integran diferentes variedades histológicas, cada una con características clínicas distintas. Los factores considerados con potencial para determinar el pronóstico de los pacientes afectados por NSCLC, son la etapa clínica al diagnóstico y el estado físico funcional de los pacientes, no obstante, diversos estudios han detectado cambios en el comportamiento clínico y la supervivencia entre pacientes jóvenes y mayores de edad, fumadores y no fumadores, géneros, estirpes histológicas; sin embargo, el acercamiento terapéutico depende de la etapa clínica y no necesariamente de la variedad histológica.
La contraparte del NSCLC es el cáncer pulmonar de células pequeñas (SCLC), el cual genera entre 15 y 20% de la totalidad de los casos, en Estados Unidos para el año 2008, se estiman 215 mil nuevos casos con cáncer pulmonar, de los cuales 15% serán del tipo SCLC.4 Esta neoplasia comparte características morfológicas, estructurales, inmunohistoquímicas y moleculares con los tumores neuroendocrinos; no obstante, tiene características distintivas.5 Este cáncer se presenta con mayor frecuencia entre fumadores6,7 y un porcentaje mayoritario se registra en individuos mayores de 70 años. El SCLC se caracteriza por su rápido doblaje celular, alta fracción de crecimiento y metastagenicidad,5 lo que le confiere un carácter agresivo. Se ha informado que entre 60 y 65% de los casos son diagnosticados en etapa metastásica donde la expectativa de supervivencia sin tratamiento, es de 2 a 4 meses.8,9 Esta neoplasia es altamente quimiosensible, por lo que la quimioterapia es considerada como la piedra angular del tratamiento; el índice de respuesta observado en enfermedad limitada es de 70 a 80% y de 60 a 70% en enfermedad extensa,10 mientras que la mediana de supervivencia es de 12 a 16 meses y de 7 a 11 meses con enfermedad limitada y extensa, respectivamente.11 Sin embargo, una proporción pequeña de pacientes con enfermedad limitada (7 a 15%) puede sobrevivir 5 años,12 no obstante, se ha reportado un aumento en la mediana de supervivencia de 12 a 17 meses.13 Diversos factores pronóstico han sido estudiados en SCLC, entre ellos el estado físico funcional, la etapa clínica, el sitio anatómico de metástasis, nivel sérico de deshidrogenasa láctica, antígeno carcinoembrionario, enolasa neuronal-específica, cromogranina A; sin embargo, el valor pronóstico de estos parámetros es controvertido.9
La edad al diagnóstico ha sido considerada como un factor pronóstico, un análisis de 96 pacientes determinó que esta variedad representaba 21% de los casos, 28% de ellos se identificó en menores de 65 años y se observó que conforme aumentó la edad la proporción de pacientes que no recibía tratamiento era mayor;14 sin embargo, otros estudios no han detectado relación entre la edad al diagnóstico y la supervivencia.15 La edad es un factor que influye en la toma de decisiones al momento de planear un tratamiento. Brown,14 detectó que 41% de los pacientes mayores de 75 años con SCLC, recibieron quimioterapia comparado con 64% de aquellos entre 65 y 74 años y 79% en menores de 65 años. Cottin et al.,16 en su estudio informaron que la mayoría eran pacientes con SCLC, tenían mal estado general y edad avanzada.
El objetivo de este estudio fue determinar y comparar las características clínicas, el comportamiento, la respuesta terapéutica y la supervivencia global, en pacientes con SCLC, en relación con la edad al momento del diagnóstico.
¿ PACIENTES Y MÉTODOS
A partir de una base de datos para pacientes con cáncer pulmonar, construida del 1 de enero de 1993 al 31 de diciembre del 2007, se seleccionaron los pacientes con diagnóstico confirmado, citológica o histológicamente, de cáncer pulmonar de células pequeñas que fueron atendidos al menos en una ocasión y/o tratados por nuestro grupo. Otros criterios de inclusión fueron pacientes de cualquier edad, sin distinción de género. Se excluyeron aquellos casos con diagnóstico de nódulo pulmonar solitario, carcinoma primario desconocido, carcinoma neuroendocrino de células grandes, carcinoides y neoplasias primarias distintas al carcinoma pulmonar.
Cada caso se valoró en forma retrospectiva y, a partir de los registros clínicos, se obtuvieron los datos de: género, edad al diagnóstico, historia familiar de neoplasias, comorbilidad, tabaquismo, ECOG, variedad histológica (de acuerdo con la clasificación internacional de la OMS), etapa clínica (de acuerdo a la clasificación TNM de la AJCC), sintomatología, tiempo transcurrido entre el inicio de los síntomas y la realización del diagnóstico, sitios de metástasis al diagnóstico, nivel sérico de hemoglobina, conteo plaquetario, nivel sérico de deshidrogenasa láctica y albúmina iniciales, tratamiento empleado por etapa clínica, tipo de quimioterapia utilizada. Además, en los casos con etapa IIIB o IV tratados con quimioterapia, se evaluó la respuesta terapéutica de acuerdo con los criterios de la OMS, y la supervivencia global, la cual fue considerada como el tiempo de vida transcurrido desde el diagnóstico del cáncer pulmonar y hasta la fecha de la muerte o de la última visita.
Las variables en estudio fueron analizadas y comparadas en dos grupos de edad que se crearon arbitrariamente con la intención de determinar el comportamiento clínico y la supervivencia global de acuerdo con la edad del paciente al momento del diagnóstico. Los grupos etáreos construidos fueron: 1) < 60 años y 2) > 60 años.
Para analizar las variables del estudio se utilizaron los métodos de la estadística descriptiva (mediana, promedio, desviación estándar) y de acuerdo con el tipo de variable se emplearon las pruebas de X2, Kruskall-Wallis, ANOVA, t de Student-no pareada. La supervivencia se analizó a través del método de Kaplan-Meier.
¿ RESULTADOS
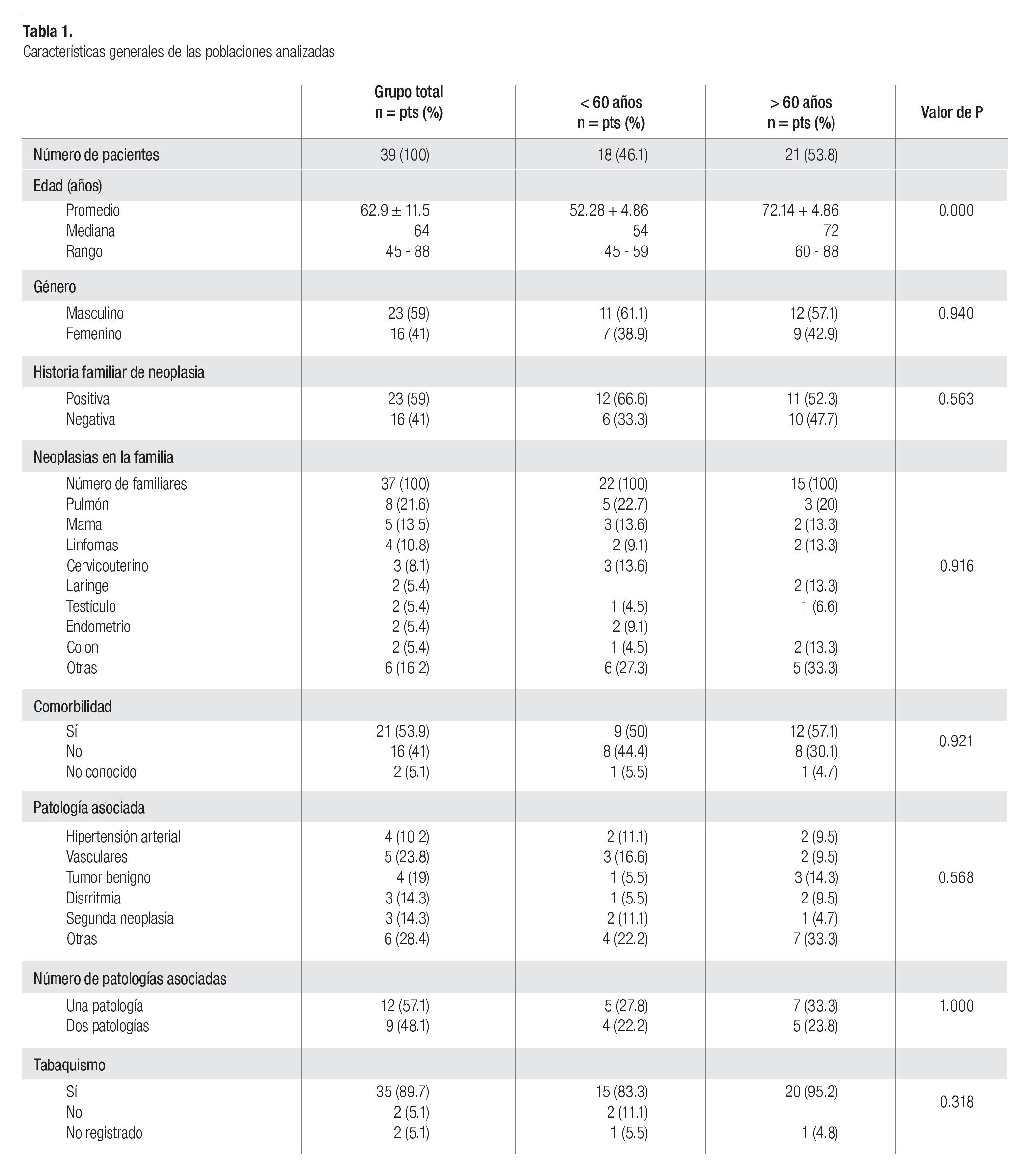
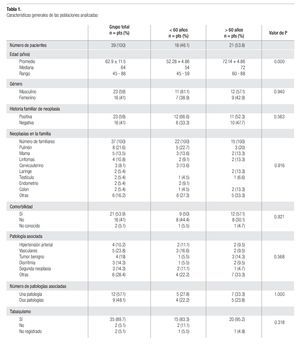
En los 15 años que comprendió la base de datos, se registraron 222 casos de cáncer pulmonar, de los cuales 39 fueron catalogados como células pequeñas (17.5%); la mediana de edad al momento del diagnóstico fue de 64 años, rango 45 a 88; se detectaron 18 casos (46.1%) en pacientes menores y 21 (53.8%) en mayores de 60 años (p = 0.000). La Tabla 1 muestra las características generales de la población analizada, donde se observa que este tipo de cáncer predominó en los hombres (59%), un porcentaje similar tuvo antecedentes familiares de neoplasia, siendo las más frecuentes el cáncer pulmonar (21.6%) y mamario (13.5%). La mayoría de los pacientes tuvo comorbilidad asociada, las alteraciones vasculares fueron las más comunes (23.8%), seguidas de los tumores benignos (19%), disrritmias (14.3%) y segundas neoplasias (14.3%), 57% de la población tuvo una sola patología asociada. Treinta y cinco pacientes fueron fumadores (89.7%). Sin embargo, en ninguno de estos parámetros se observó diferencia estadística cuando se analizaron los subgrupos de pacientes menores y mayores de 60 años (p > 0.05).
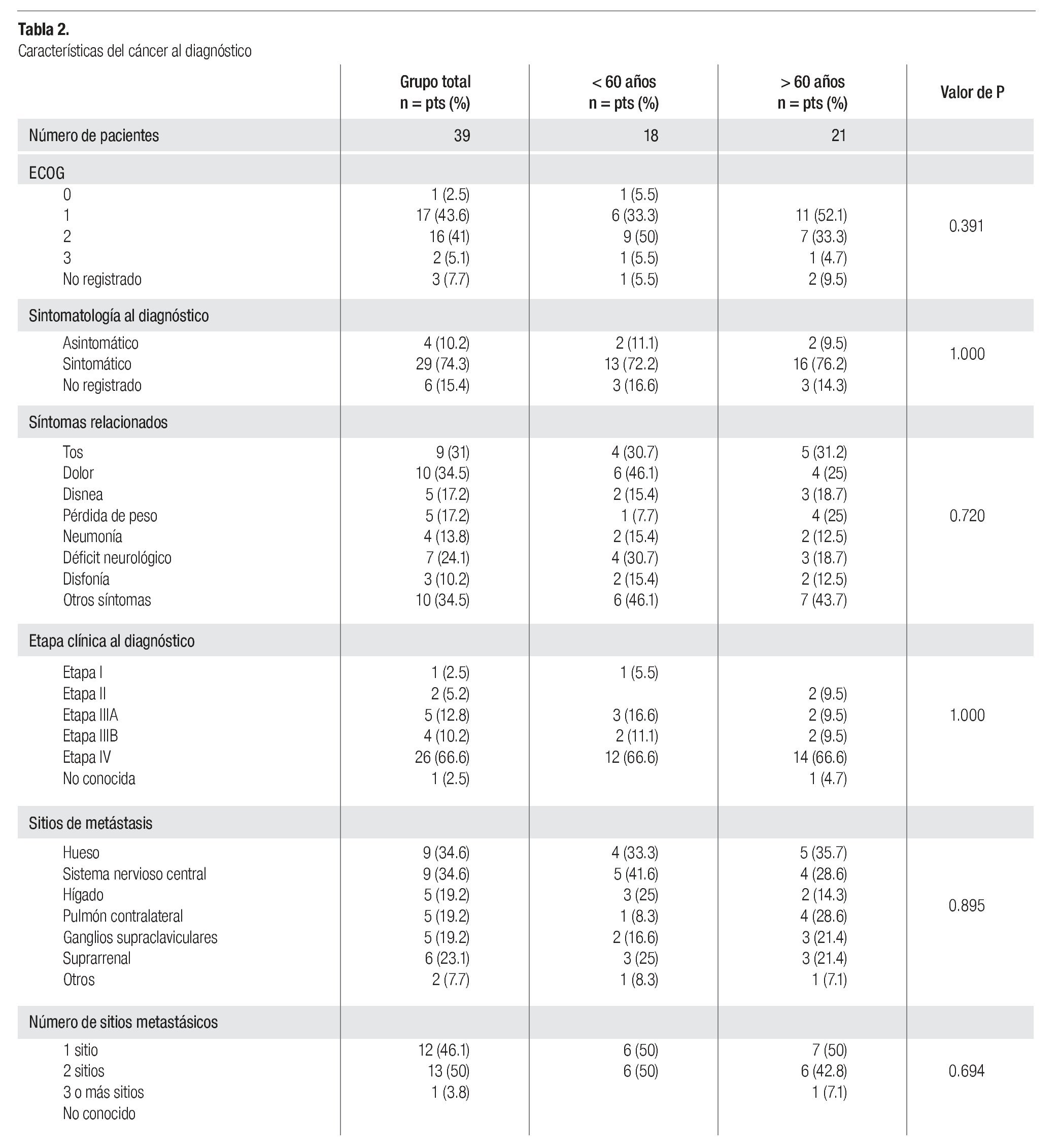
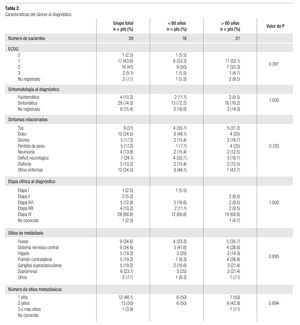
La Tabla 2 integra el estado funcional, sintomatología y características de la neoplasia al diagnóstico. La mayoría de los pacientes fueron catalogados con ECOG 1-2 (84.6%); 29 pacientes (74.3%) eran sintomáticos al diagnóstico y sólo 4 (10.2%) estaban asintomáticos; el síntoma más frecuente fue el dolor torácico u óseo (34.5%), seguido de tos (31%), alteraciones neurológicas (24.1%) así como disnea (17.2%) y pérdida de peso (17.2%). En un paciente con alteraciones neurológicas se identificó un síndrome cerebeloso paraneoplásico, mediado por anticuerpos antiHu. Las etapas clínicas IIIB y IV fueron las principales, con 4 (10.2%) y 26 casos (66.6%), respectivamente. Entre los 26 casos con etapa IV al diagnóstico, los sitios de metástasis fueron a nivel de hueso (34.6%), cerebro (34.6%) y glándulas suprarrenales (23.1%); además, 13 de los 26 casos (50%) tenían al menos dos sitios de actividad metastásica.
En el grupo de pacientes < 60 años predominó el ECOG 2 (50% vs. 33.3%), dolor (46.1% vs. 25%), alteraciones neurológicas (30.7% vs. 18.7%), metástasis cerebrales (41.6% vs. 28.6%) y hepáticas (25% vs. 14.3%); mientras que en el grupo > 60 años fue frecuente la pérdida de peso (7.7% vs. 25%) y la afectación del pulmón contralateral (8.3% vs 28.6%); sin embargo, ninguna de estas variables mostró diferencia estadística (p > 0.05).
Se obtuvo el nivel sérico de hemoglobina y conteo plaquetario (al diagnóstico) en 26 casos, la mediana de hemoglobina fue de 15, rango 10.6 a 18.6 g/dL, sólo un paciente (3.8%) tuvo hemoglobina menor a 11 g/dL; la mediana plaquetaria fue 260 mil/mm3, rango 85 a 690, 2 pacientes (7.7%) tuvieron cifras superiores a 450 mil y uno (3.8%) menor de 150 mil. La albúmina se determinó en 13 pacientes, la mediana fue de 4.0 g/L, rango 2.7 a 5.2, dos pacientes (15.4%) tuvieron nivel sérico inferior a 3.5 g/L. La deshidrogenasa láctica se determinó en 17 pacientes, mediana 238.6 U/dL, rango 111 a 830, tres (17.6%) tuvieron niveles por arriba de 250 U/L. En pocos pacientes se determinó, por método inmunohistoquímico, el estado de sinaptofisina (7 casos); AE1/AE3 (en 5) y cromogranina A (en 6); el resultado de estas pruebas fue positivo en 6/7 para sinaptofisina (85.7%), 4/5 en AE1/ AE3 (80%) y 4/6 para cromogranina A (66.6%).
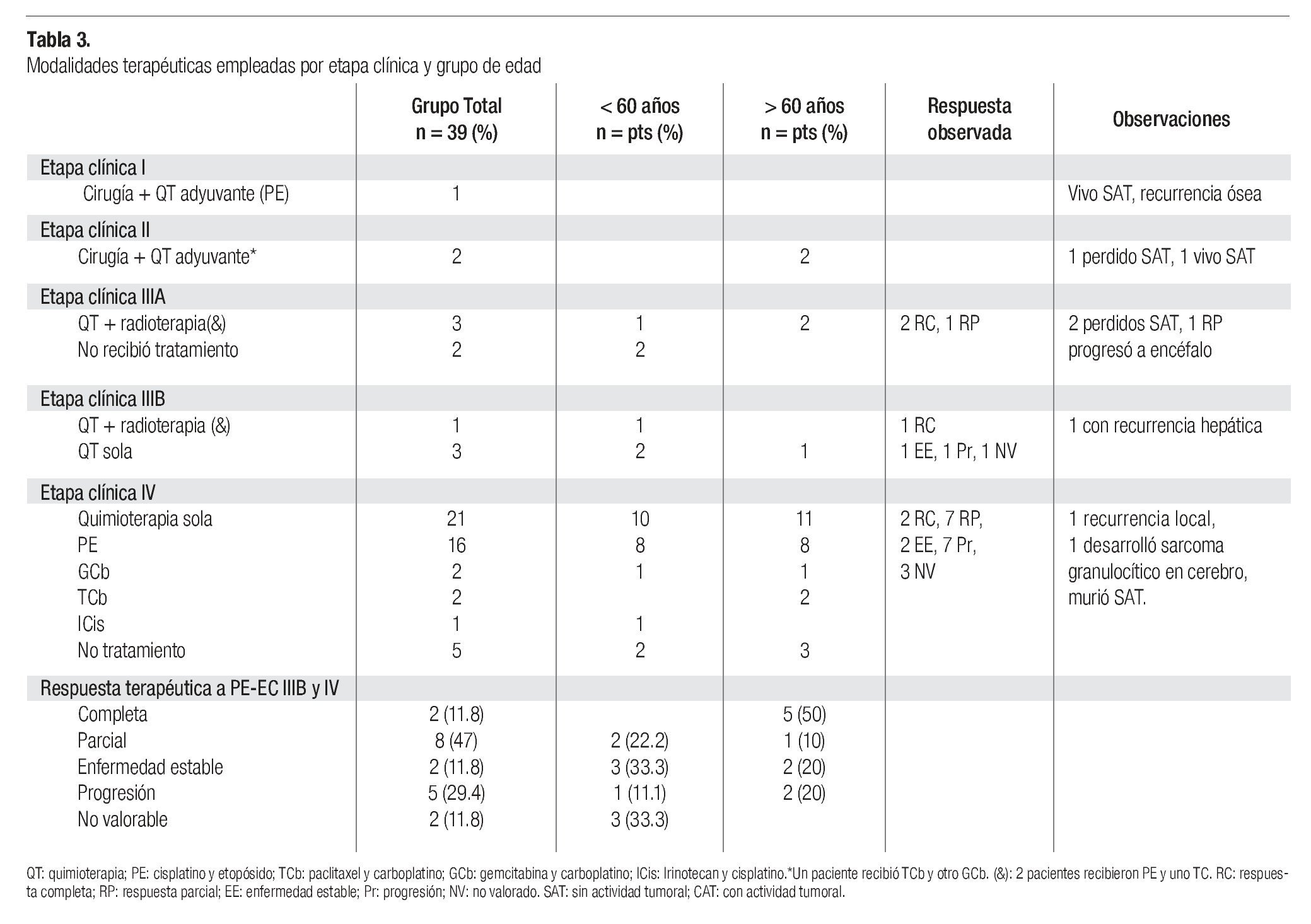
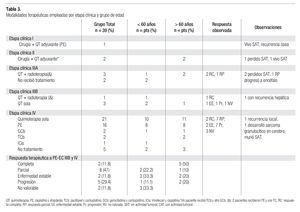
Las modalidades terapéuticas empleadas, para cada etapa clínica y grupo de pacientes se muestran en la Tabla 3. El paciente con etapa I fue tratado con lobectomía y 6 ciclos de quimioterapia adyuvante; tuvo intervalo libre de enfermedad de 10 meses y recurrió en hueso, recibió radioterapia en la región dorsal seguida de 6 ciclos de gemcitabina e irinotecan, cursó con respuesta completa. Los dos pacientes con etapa II fueron tratados con resección quirúrgica, uno recibió 1 ciclo de paclitaxel/ carboplatino adyuvante y se suspendió por toxicidad neurológica, tuvo seguimiento de 12 meses, el otro paciente recibió radioterapia y 6 ciclos de gemcitabina/carboplatino adyuvante. De los cinco casos con etapa IIIA, dos no regresaron a consulta, los tres restantes fueron tratados con quimioterapia y radioterapia, 2 con respuesta completa y uno parcial, los dos con respuesta completa se perdieron de seguimiento y el otro murió a los 14 meses por progresión de la neoplasia.
En los cuatro casos con etapa IIIB, uno tratado con quimio y radioterapia tuvo respuesta completa sostenida por 12 meses y recurrió a nivel óseo y hepático, falleció después de 22 meses de seguimiento; los otros 3 pacientes recibieron quimioterapia, uno sólo 2 ciclos y falleció sin haberse evaluado la respuesta al tratamiento, uno tuvo enfermedad estable, por lo que recibió una segunda línea y el otro progresó, recibió otras 2 líneas distintas de tratamiento mostrando progresión sistémica; ambos fallecieron a los 10 y 11 meses, respectivamente. De los 26 pacientes en etapa IV, 5 no recibieron tratamiento y los otros 21 fueron tratados con quimioterapia; se detectaron 2 con respuesta completa (11.1%), 7 parciales (38.9%), 2 con estabilidad y 7 con progresión de la neoplasia, 3 casos no fueron valorables (en uno la terapia se suspendió por sangrado de tubo digestivo severo y no se reinició, otro fue tratado en otro hospital y uno más falleció poco tiempo después de haber aplicado el primer ciclo, la muerte se atribuyó a los efectos directos de la neoplasia). De los nueve que tuvieron metástasis cerebrales al diagnóstico sólo 5 se trataron con radioterapia a holocráneo. El paciente con etapa clínica desconocido no regresó a consulta.
En los 19 pacientes con etapa IIIB y IV, tratados con etopósido y análogos del platino, la mediana de ciclos aplicados fue de 4, rango 1 a 8; de los 19 pacientes 2 no fueron evaluables. Entre los 17 pacientes restantes detectamos respuesta completa en 2 (11.8%), parcial en 8 (47%), estabilidad 2 (11.8%), progresión 5 (29.4%), índice de respuesta (58.8%); la mediana de duración de respuesta fue de 2 meses, rango 1 a 36 y el tiempo a la progresión fue 4.7 meses, rango 0.7 a 36 meses. En los otros 5 pacientes tratados con esquemas diferentes a platino/etopósido se observaron 2 respuestas completas (40%), uno con estabilidad y 2 con progresión, índice de respuesta 40%. El tiempo libre a la progresión fue 5.4 meses, rango 0.7 a 12 meses. No se observó diferencia entre la respuesta terapéutica y los grupos de edad.
La evolución de los pacientes en etapa I-II, así como en quienes tuvieron una respuesta completa con etapas IIIA-IV, se muestra en la Tabla 3. Dieciocho de los 23 pacientes tratados con etapa IIIA-IV recibieron una segunda línea de quimioterapia (65.2%) y 7 de los 23 (30.4%) una tercera línea de tratamiento, los esquemas de tratamiento en segunda y tercera línea resultaron diversos, pero las combinaciones fueron las más frecuentes; no obstante, no se observó ninguna respuesta completa o parcial, en la segunda o tercera línea.
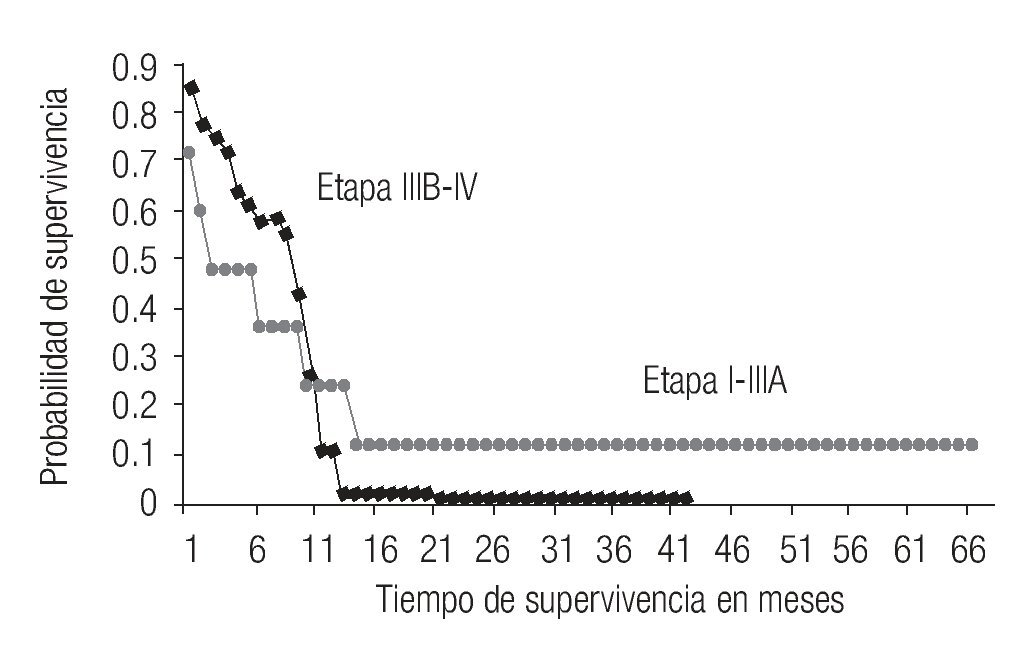
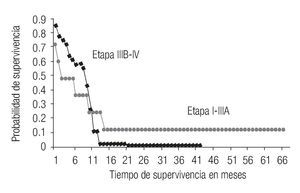
En los 39 pacientes, la supervivencia global fue de 11 meses, rango 2 a 67; en aquellos con etapa IIIB y IV tratados con etopósido y análogos del platino fue de 10.5 meses y 11.5 para quienes recibieron otros esquemas de tratamiento. De los tres pacientes con etapa IIIA que recibieron tratamiento la supervivencia en cada uno fue de 7, 3 y 15 meses; en los dos casos con etapa II fue de 11 y 61 meses, mientras que en el caso con etapa I fue de 67 meses (Figura 1).
Figura 1. Curva de Kaplan-Meier para supervivencia global
En relación con los posibles factores pronóstico para la supervivencia, se analizó la diferencia de sobrevida para los menores y mayores de 60 años (p = 0.194), ECOG 0-1 vs. > 2 (p = 0.209), género (p = 0.119), mayores y menores de 70 años (p = 0.842), metástasis cerebrales al diagnóstico (p = 0.734) ninguno de ellos mostró diferencia estadística. Sin embargo, observamos en aquellos con etapas I-IIIA mediana de supervivencia global 11 meses, rango 2 a 67, mientras que en los pacientes con etapa IIIB y IV fue de 10.5 meses, rango 2 a 42, p = 0.047.
¿ DISCUSIÓN
En nuestro análisis observamos que la mayoría de los pacientes con SCLC se presentan en hombres, mayores de 60 años, con historia de tabaquismo, sintomáticos al momento del diagnóstico (el dolor torácico u óseo son los más frecuentes), con etapas avanzadas y bajo estado físico funcional. No tuvieron valor pronóstico para supervivencia tanto la edad al diagnóstico ni otros parámetros clínicos; solamente las etapas clínicas IIIB y IV se relacionaron con menor tiempo de supervivencia. La edad tampoco se asoció con el índice de respuesta terapéutica.
Nuestra observación negativa acerca del valor pronóstico de edad también ha sido informada en otros estudios.17-19 No obstante, ensayos con mayor población diseñados para evaluar la capacidad pronóstica de diversos parámetros en relación con la supervivencia, han mostrado que la edad puede ser un factor importante en SCLC. El estudio del South West Oncology Group,11 enroló a 2580 pacientes con enfermedad limitada y avanzada; para la fase limitada el análisis multivariado de Cox mostró al estado funcional SWOG 0-1, edad < 70 años, género femenino y raza blanca como los principales determinantes de la supervivencia; un subanálisis con 508 pacientes agregó el nivel de normal de deshidrogenasa láctica y ausencia de derrame pleural como determinantes de la sobrevida. Para la enfermedad extensa, se analizaron 1192 casos donde se detectó que la calificación del estado físico SWOG 0-1 (p = 0.00005, HR 1.5), edad < 70 años (p = 0.006, HR 1.3) y DHL normal (p = 0.0006, HR 1.9) como los factores de pronóstico más importantes. Otro ensayo20 sobre los predictores de la supervivencia, realizado en 424 pacientes menores y 450 mayores de 60 años, detectó cifras de supervivencia de 42 y 36 semanas, respectivamente; en ese análisis multivariado y de regresión múltiple los autores consideraron a la edad mayor a 60 años como importante factor pronóstico de supervivencia. Por otra parte, un análisis de 516 pacientes notó que la edad mayor a 60 años y la pérdida de peso fueron factores predictores de pobre respuesta terapéutica,21 pero otros reportes no han confirmado el valor predictivo de la edad. Sui et al.,15 incluyeron a 88 pacientes mayores de 70 años en quienes el índice de respuesta fue comparable con el grupo de menores de 70 años, 78% vs. 82%, aunque hubo una tendencia a mayor proporción de respuestas completas entre los menores de 70 años (53% vs. 43%), la edad no fue un factor pronóstico de la supervivencia, p = 0.14.
Nuestro estudio posee características que lo fortalecen en algunas áreas, ya que incorpora el criterio terapéutico de un solo grupo oncológico, por lo que la indicación de las formas de tratamiento resultan ser homogéneas en la mayoría de los casos. Otra característica importante de este estudio es que el análisis se enfoca únicamente al cáncer pulmonar de células pequeñas, a diferencia de otros reportes donde se han incluido poblaciones heterogéneas. Además, nosotros realizamos un extenso análisis de las características clínicas por grupos de edad que permite un mejor entendimiento del comportamiento clínico de SCLC en los distintos grupos etáreos. Sin embargo, nuestro estudio tiene limitaciones que son inherentes a todo ensayo retrospectivo; comparado con otros estudios internacionales y nacionales, se incluyó un pequeño número de pacientes en ambos grupos de edad y fueron muy pocos los pacientes que se detectaron en las etapas I y II. El sistema de estadificación empleado en nuestro estudio (TNM-AJCC), podría influir en los resultados, ya que la mayoría de los estudios reportan sus observaciones en pacientes con enfermedad limitada o extensa: La clasificación mencionada fue propuesta por el Veterans Administration Lung Cancer Group, donde los casos con enfermedad limitada tienen involucro de un solo hemitórax dentro de un campo de radiación, mientras que la enfermedad extensa se define por la presencia de metástasis a distancia, en general, los pacientes con afectación de los ganglios mediastinales contralaterales, supraclaviculares, derrame pericárdico o derrame pleural son excluidos de estudios clínicos,8 ninguno de los pacientes en etapa IIIB registrados en este análisis tuvieron derrame pleural, por lo que pueden ser clasificados en etapa localizada, cuando analizamos la sobrevida con enfermedad localizada o avanzada tampoco observamos diferencias (p = 0.121).
Además, el punto de corte de los grupos etáreos se consideró a los 60 años, y ha sido variable en otros reportes internacionales donde se ha recorrido el punto a 65, 70 e incluso 80 años. Entonces, hasta ahora no ha sido definido con claridad el punto de corte de edad para diferenciar a los pacientes de edad avanzada y jóvenes.10,22
En nuestro estudio tampoco detectamos valor pronóstico de supervivencia cuando analizamos las subpoblaciones de pacientes menores y mayores de 70 años. Distintos ensayos han reportado sus resultados distinguiendo las diferencias observadas en los mayores de 70 años. En pacientes que fueron tratados con CAV o PE, Siu et al.,15 reportaron que los mayores de 70 años recibieron menor dosis de cisplatino (70% vs. 82%) y etopósido (73% vs. 84%); además, sólo 46% de ellos toleraron los 6 ciclos programados de CAV. Por su parte, el grupo español de cáncer pulmonar, realizó un análisis retrospectivo en 402 pacientes con SCLC, 338 menores y 74 mayores de 70 años, tratados con 2 esquemas de quimioterapia, cisplatino-etopósido o cisplatino-epirrubicina, no se detectaron diferencias en el índice de respuesta terapéutico; sin embargo, la supervivencia fue mayor entre los menores de 70 años, 47 vs. 43 semanas, así como el tiempo a la progresión, 36 vs. 32 semanas. Los mayores de 70 años tuvieron mayor frecuencia de fiebre y neutropenia (4.6% vs. 8.8%, p = 0.01) y menor dosis de cisplatino (487 mg/ mg vs. 437 mg/m2, p = 0.03),23 resultados que han sido reproducidos por otro grupo.24 Larive et al.,25 informaron que los mayores de 70 no toleran adecuadamente la quimioterapia aun cuando la combinación incluya al carboplatino. Yau T et al.,24 mostraron que la mayoría de los pacientes de edad avanzada tienen ECOG 2 y pocos pueden recibir radioterapia a mediastino y a cerebro. Para estos pacientes con edad avanzada se ha propuesto utilizar el carboplatino combinado con etopósido, combinación que es aceptada como la terapia estándar en dichos casos o con mal estado físico funcional, el índice de respuesta que se obtiene ha sido reportado entre 66 a 71%, sin embargo, la trombocitopenia grado 3 y 4 se presenta en 32 y 53%, respectivamente, mientras que la leucopenia se presenta en 45 a 54%, respectivamente.26 El estudio de Yao et al.,24 no observó diferencia de sobrevida en relación al uso de cisplatino-carboplatino en 361 pacientes mayores de 70 años con SCLC. En un estudio comparativo, 110 pacientes fueron asignados a recibir carboplatino AUC 5 en día 1 o cisplatino 25 mg/m2 en días 1, 2 y 3 más etopósido 80 mg/m2 en días 1, 2 y 3; no se observó diferencia en el índice de respuestas (73%) ni en la supervivencia y la toxicidad hematológica y no hematológica grados 3 y 4 fue similar en ambos grupos, excepto por mayor trombocitopenia en el brazo de carboplatino (56% vs. 16%).27 Nuevos medicamentos han sido explorados en SCLC avanzado como topotecan, paclitaxel, irinotecan, pemetrexed, los cuales han mostrado resultados prometedores con índices de respuesta similares a 80% como primera línea de tratamiento y con efectos tóxicos no mayores.9,28-30
En nuestro análisis, notamos que 57% de los pacientes mayores de 60 años cursan con comorbilidad. Generalmente, las poblaciones de pacientes geriátricos han sido excluidas de los estudios clínicos por la presencia de enfermedades concomitantes, menor función de órganos que pueden alterar la depuración de los fármacos, reducida tolerancia medular a los agentes mielosupresores, la actitud de los pacientes a los tratamientos intensivos y su disminuida expectativa de supervivencia global.10,31 El estado físico funcional ha sido considerado uno de los factores predictores de supervivencia más importantes, en un estudio de 13 pacientes con ECOG 3 o 4, se observó supervivencia de 11.2 meses en aquellos que mejora el ECOG con el tratamiento, mientras que la sobrevida fue de 2 meses cuando éste no mejoró,32 por lo que se sugirió no tratar a los pacientes con ECOG 4.
Ante la necesidad de contar con elementos de juicio con valor pronóstico, que permitan identificar aquellos pacientes con mejores expectativas de supervivencia y para fundamentar las decisiones terapéuticas, se han estudiado otros parámetros en orden a valorar su capacidad pronóstica. En este trabajo el género, el estado físico funcional, la edad mayor a 70 años y la presencia de metástasis cerebrales no mostraron capacidad pronóstica en relación con la supervivencia, otros estudios han reportado resultados similares.33 En nuestro estudio, no pudimos valorar con precisión la capacidad pronóstica de la hemoglobina, conteo plaquetario, nivel sérico de albúmina y deshidrogenasa láctica, expresión de cromogranina A, sinaptofisina o enolasa neuronal-específica (mediante inmunohistoquímica), ya que estas variables fueron inicialmente estimadas en pocos pacientes. Un índice pronóstico sugerido por Maestu et al.,34 muestra que los pacientes con buen pronóstico tienen supervivencia a 2 años (16.2%), mediano (2.5%) y pobre pronóstico (0%); los criterios para formar cada grupo fueron: DHL > 225 U/L, albúmina < 3.4 g/dL, neutrófilos > 7.5 x 10/L, enfermedad extensa, ECOG > 1, a cada variable se le asignó 1 punto, el grupo de buen pronóstico tiene puntaje de 0-1, intermedio 2 a 3, y pobre pronóstico 4 a 5 puntos.35 Por otra parte, se ha informado que los pacientes con SCLC cursan con bajos niveles de interleucina 1(IL-2), interferón a, g, factor de necrosis tumoral a; un análisis de 58 pacientes determinó que el nivel sérico de IL-2 (< 1550 pg/mL), tiene influencia en la supervivencia, p = 0.018.36
La cromogranina A, una glucoproteína de 49 kDa, contenida en los gránulos secretorios de células neuroendocrinas ha sido considerada un factor pronóstico en SCLC; se ha reportado que 37% de los pacientes con SCLC tiene niveles séricos elevados en quienes se ha estimado menor tiempo de supervivencia, 49 vs. 28 semanas.37 El c-kit, o proteína C117, ha sido analizada como factor pronóstico en un grupo de 60 pacientes, donde se documentó que se expresa en 40% de los casos, mientras que las mutaciones del gen c-kit fueron detectadas en 8.3%, principalmente en el exón 9 y 11; sin embargo, no se observó correlación entre la expresión del c-kit y otros factores clínicos ni la supervivencia global.38 Otros autores han investigado la expresión de diversos factores biológicos (en SCLC), como son: p53, bcl-2 y ki67; en un estudio de 67 pacientes a pesar de una expresión elevada 62, 70 y 49%, respectivamente, no se detectó asociación con la supervivencia.39 En un estudio de 436 pacientes con SCLC el análisis multivariado mostró que los factores más importantes en el pronóstico de pacientes con enfermedad limitada son bajo ECOG (p = 0.0001), anemia (p = 0.0002), leucocitosis (p = 0.0008) y niveles elevados de enolasa neuronal-específica (p = 0.0002); mientas que aquellos con enfermedad extensa lo fueron bajo ECOG (p = 0.0001), pérdida de peso (p = 0.0006), DHL (0.0001), número de metástasis (p = 0.013), metástasis hepáticas y/o cerebrales (p = 0.030 y 0.0002, respectivamente).12
Finalmente, en nuestro estudio tuvimos un paciente menor de 60 años con SCLC avanzado que mostró respuesta completa al recibir quimioterapia con cisplatino y etopósido; después de 36 meses libre de recurrencia desarrolló un síndrome mielodisplásico con sarcoma granulocítico cerebral y falleció por dicha causa. Es imprescindible recordar que la búsqueda de factores pronóstico no sólo estriba en determinar poblaciones con expectativas adversas de supervivencia, sino detectar grupos vulnerables a los efectos secundarios implícitos a los distintos agentes antitumorales. En la literatura se ha informado que un pequeño porcentaje de los pacientes con SCLC logran sobrevivir a un plazo de 2 años, 16% con enfermedad limitada y 4% con enfermedad extensa; las leucemias agudas y síndromes mielodisplásicos pueden presentarse, particularmente, en aquellos que fueron tratados con alquilantes o nitrosureas; se ha estimado que el riesgo de desarrollar mielodisplasia es de 14% a 3-4 años a partir del inicio de la quimioterapia,40,41 también se ha reportado que los pacientes que sobreviven más de 30 meses, cursan con secuelas del tratamiento inicial como son: cefalea, pérdida de la memoria y audición, fatiga, disminución mental y neuropatía periférica; además, 12.9% desarrollan segundos primarios.
¿ CONCLUSIONES
En nuestro estudio, la edad al diagnóstico del cáncer pulmonar de células pequeñas no es un factor pronóstico de la supervivencia, ni de la respuesta a quimioterapia con etopósido y análogos del platino. El estado físico funcional, género y presencia de metástasis cerebrales tampoco tienen capacidad para pronosticar la supervivencia. Las etapas clínicas avanzadas (IIIB y IV) son el único factor pronóstico de la supervivencia en pacientes con carcinoma pulmonar de células pequeñas. La edad al diagnóstico no debe ser considerada como el único elemento para decidir la modalidad para tratar a aquellos enfermos con SCLC.
Correspondencia:
Dr. J. Alberto Serrano-Olvera.
Departamento de Oncología Médica. Centro Médico ABC; México D.F. Torre médica II-Edificio Donald McKenzie, Sur 136 # 116-2c, Col. las Américas, México D.F. C.P. 01120.
Correo electrónico: serranoolvera@yahoo.com.mx