Aproximadamente el 25% de los pacientes se presentan con cáncer de células renales metastásico (CCRm) al momento del diagnóstico. Los inhibidores con actividad cinasa multitirosina han revolucionado el tratamiento del CCRm desplazando la terapia con citocinas. El sunitinib, inhibidor de la tirosina cinasa, ha mostrado eficacia en términos de supervivencia libre de progresión y supervivencia global, con tasas de respuesta completa de alrededor del 3%. Presentamos la remisión histológica completa posterior de sunitinib en CCRm.
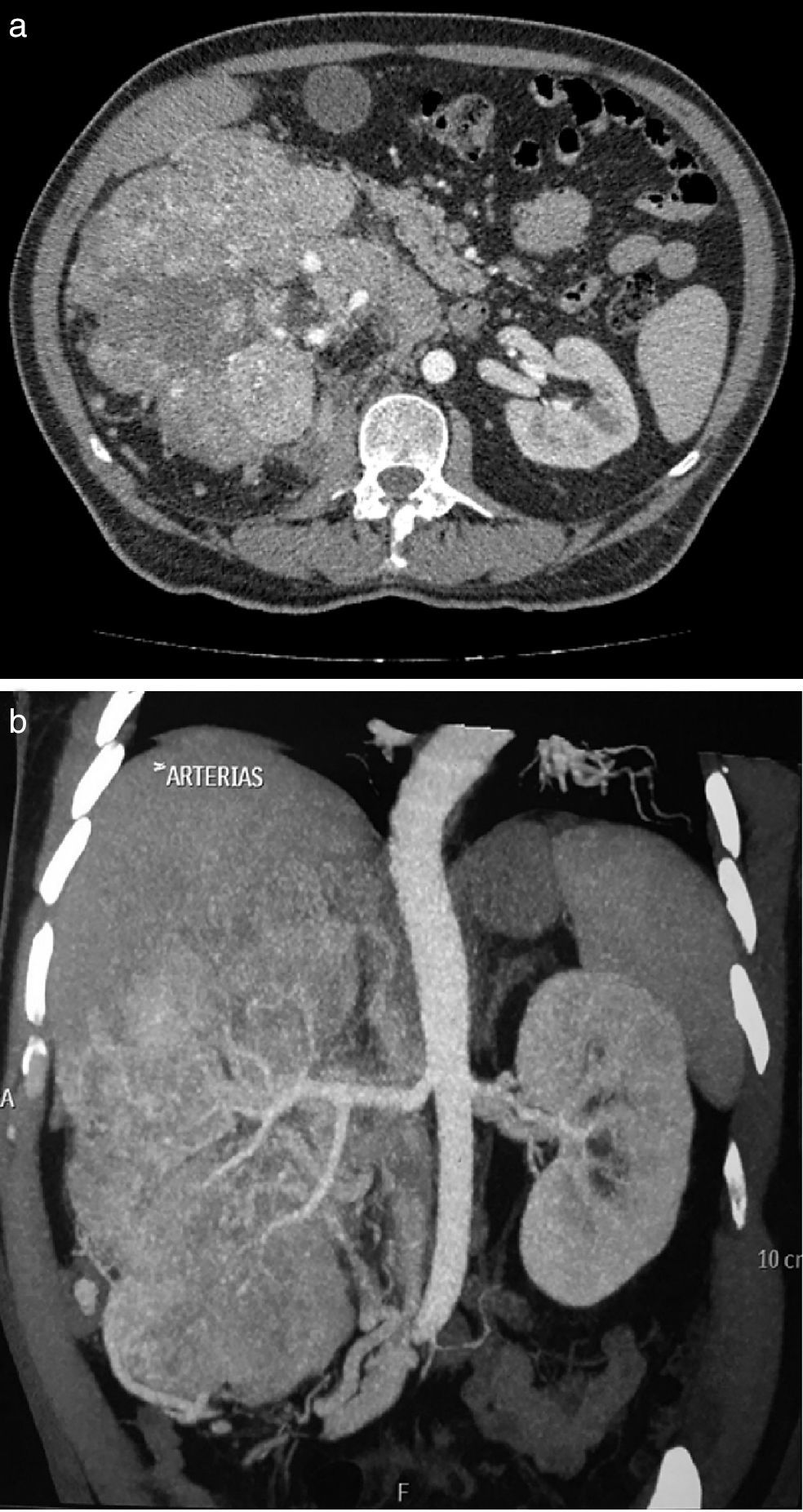
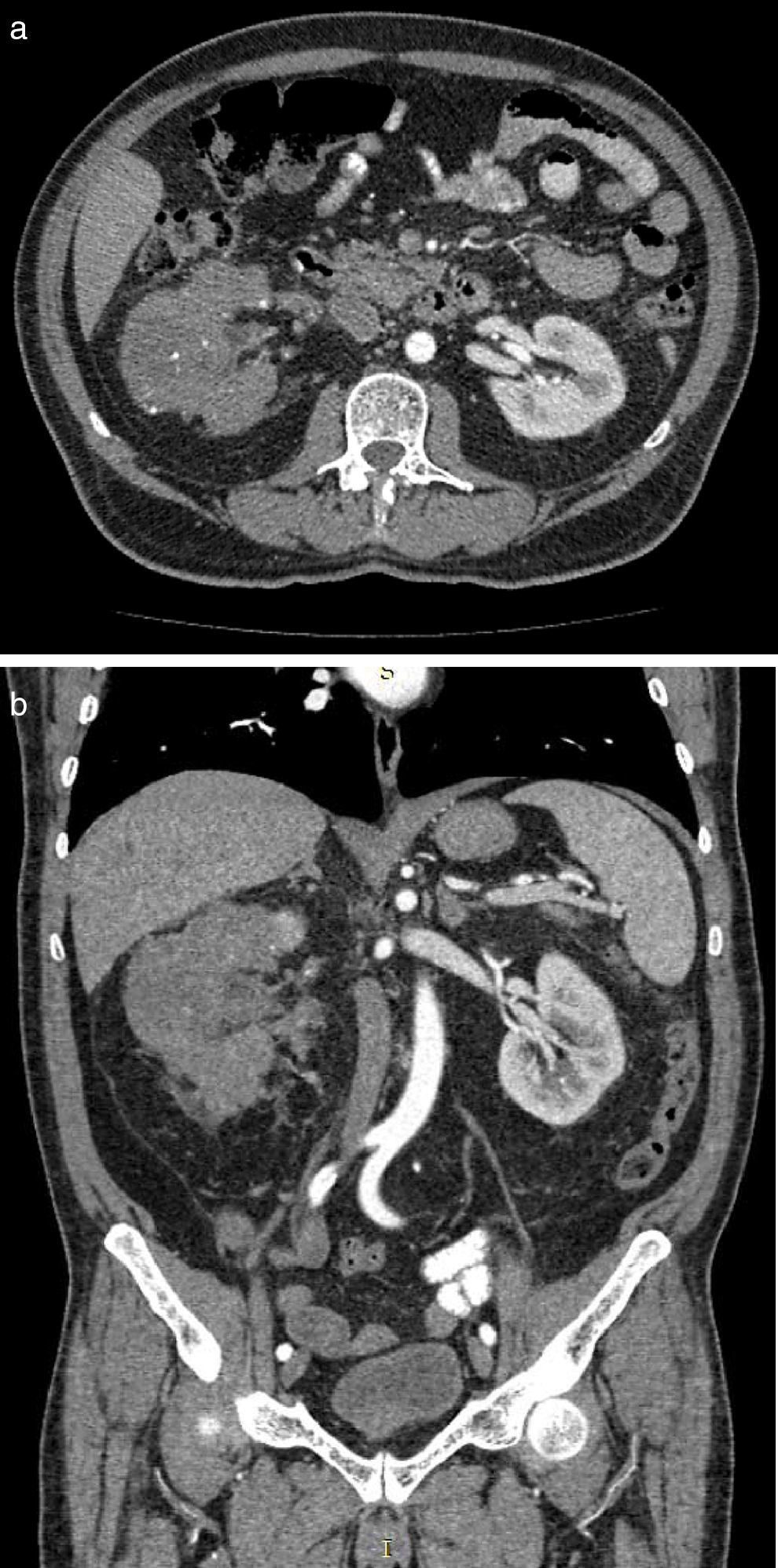
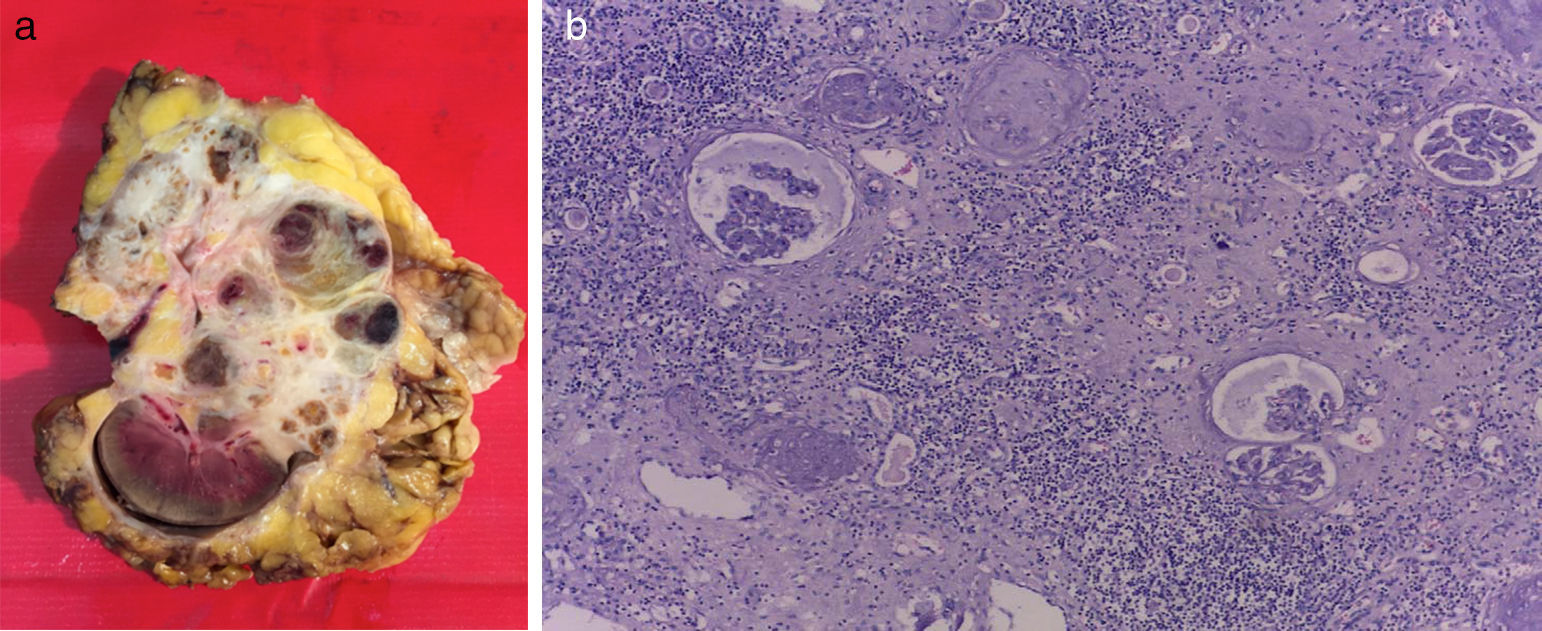
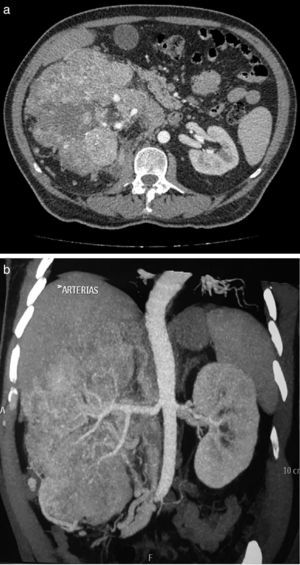
Masculino 65 años, hipertenso, inicia en 2013 con pérdida ponderal de peso, dolor en hipocondrio derecho, y aumento de volumen abdominal ipsilateral; hallazgo tomográfico tumor en riñón derecho de 24×13.8×10cm, realce 98UH, conglomerado ganglionar perihiliar; tórax con imagen única heterogénea con centro hiperdenso en segmento apical del pulmón izquierdo. Biopsia renal percutánea con reporte de carcinoma de células renales Fuhrman I. Inicia sunitinib 50mg vo/24h, 4 semanas, descansando 2 semanas, 3 ciclos. Al termino la tomografía muestra tumor de 10.2×8.1×5.1cm hipodenso en centro, calcificaciones periféricas, realce difuso, tórax sin lesiones. Se realiza nefrectomía radical derecha con reporte histopatológico de infiltrado inflamatorio, necrosis, sin evidencia de tumor.
Actualmente la integración de cirugía y terapia sistémica representa la mejor opción de tratamiento para muchos pacientes con enfermedad avanzada.
El tratamiento del CCRm se ha revolucionado a partir de la era de la terapia blanco, con respuestas parciales de hasta un 30-40%, y respuesta completa en casos aislados. La terapia neoadyuvante ha demostrado disminuir el tamaño tumoral y permitir la cirugía posterior en pacientes seleccionados.
Approximately 25% of with renal cell carcinoma have already reached the metastatic phase of disease (mRCC) at the time of diagnosis. Multi-targeted tyrosine kinase inhibitors have revolutionised the treatment of mRCC, replacing cytokine therapy. Sunitinib, a tyrosine kinase inhibitor has shown to be effective in terms of progression free survival and overall survival, with complete response rates of around 3%. A case is presented of a complete histological response after sunitinib in mRCC.
A 65 year-old hypertensive man, who in 2013 began with a considerable loss of weight, pain in the right hypochondrium, and an increase in ipsilateral abdominal volume. The computed tomography found a tumour of 24×13.8×10cm in the right kidney, with 98HU enhancement and a peri-hilar lymph node conglomerate. The thorax showed a single heterogeneous image with a hyperdense centre in the apical segment of the left lung. The percutaneous renal biopsy reported a Fuhrman grade I renal cell carcinoma. Sunitinib was started at 50mg orally every 24hours for 4 weeks, resting for 2 weeks, for 3 cycles. At the end of the treatment the tomography showed a tumour of 10.2×8.1×5.1cm hyperdense in the centre, peripheral calcifications, diffuse enhancement, and the thorax with no lesions. A right radical nephrectomy was performed, with the histopathology reporting an inflammatory infiltrate, necrosis, and with no evidence of a tumour.
The combination of surgery and systemic therapy is currently the best treatment option for many patients with advanced disease.
The treatment of mRCC has been revolutionised from the era of blanket therapy, with up to 30% - 40% partial responses, and a complete response in isolated cases. Neoadjuvant therapy has been shown to decrease tumour size and enables surgery to be performed in selected patients.
Aproximadamente el 25% de los pacientes se presentan con cáncer de células renales metastásico (CCRm) al momento del diagnóstico1; históricamente, el pronóstico de estos pacientes era pobre debido a la radiosensibilidad y quimiosensibilidad2. Investigaciones acerca del comportamiento biológico y genético del cáncer renal han conducido a la identificación de 2 principales cascadas de señalización que tienen un papel fundamental en el desarrollo de la enfermedad: vía de von Hippel-Lindau/factor inducible por hipoxia y la vía diana de rapamicina en células de mamífero (mTOR)3,4. Diversos agentes terapéuticos se han desarrollado, incluyendo inhibidores de receptores con actividad cinasa multitirosina, y han revolucionado el tratamiento del CCRm, desplazando la terapia de citocinas como el estándar de cuidado en la práctica clínica. El sunitinib es un inhibidor de la tirosina cinasa con múltiples blancos, que ha mostrado eficacia en términos de supervivencia libre de progresión y supervivencia global en el marco de un ensayo clínico aleatorizado comparado con el interferón, con tasas de respuesta completa de alrededor del 3%5.
En este trabajo presentamos la remisión clínica e histológica completa después de sunitinib como tratamiento neoadyuvante en un CCRm.
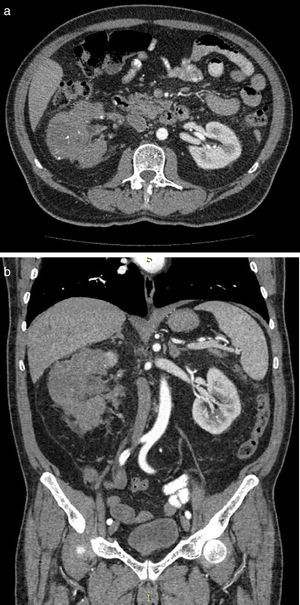
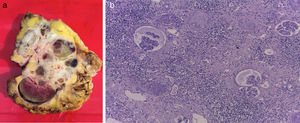
Presentación de casoSe trata de paciente masculino de 65 años de edad, con antecedente de hipertensión arterial sistémica controlada, que inicia su padecimiento en julio de 2013 con pérdida de peso 8kg en 2 meses, dolor intermitente en hipocondrio derecho, y aumento de volumen en hemiabdomen derecho, niega hematuria; se solicita tomografía computada, con hallazgo de riñón derecho con pérdida de la arquitectura en su totalidad, por presencia de un tumor de 24×13.8×10cm, con realce a la aplicación de medio de contraste hasta 98UH, invasión de grasa perirrenal hacia polo superior, conglomerado ganglionar perihiliar voluminoso, e imagen sugestiva de trombo en vena renal derecha, y cava infradiafragmática (fig. 1 a y b). La tomografía computada de tórax muestra imagen única heterogénea con centro hiperdenso en segmento apical en pulmón izquierdo. Debido a las características tomográficas del tumor (volumen tumoral, relación estructuras vitales, conglomerado ganglionar voluminoso perihiliar) se decide realizar biopsia renal percutánea, con reporte histopatológico de carcinoma de células renales Fuhrman I. Grupo de riesgo pronóstico según MSKCC intermedio1, inicia en noviembre de 2014 terapia con sunitinib 50mg vo/24h por 4 semanas, descanso de 2 semanas, administrado durante 3 ciclos. Al término del tratamiento la tomografía computada de control muestra en riñón derecho tumor que abarca el 95% del riñón, de 10.2×8.1×5.1cm bordes irregulares, hipodenso en su centro, calcificaciones periféricas, con realce mínimo de forma difusa 40UH, infiltración de grasa perirrenal, regresión completa de trombo en vena renal y vena cava (fig. 2 a y b). En tórax sin evidencia de lesiones en segmento apical de pulmón izquierdo. Con respuesta parcial de acuerdo a los criterios de RECIST 1.1 y respuesta favorable de acuerdo a criterios de MASS; se realiza en julio de 2015 nefrectomía radical derecha, a través de abordaje en línea media, con sangrado transoperatorio de 800cc, con tumor renal que involucra totalidad de unidad renal de 12×8×7cm, áreas de necrosis, fibrosis perihiliar y pararrenal, arteria trombosada, no se identifica trombo tumoral en vena vaca ni vena renal. El estudio histopatológico de la pieza muestra infiltrado inflamatorio, necrosis, sin evidencia de tumor viable (fig. 3 a y b).
Los agentes antiangiogénicos han demostrado una mayor actividad, en términos de supervivencia libre de progresión, en comparación con la inmunoterapia, concretamente cuando se compara con interferón6. Sin embargo, no se ha demostrado un aumento relevante en la respuesta completa del cáncer renal metastásico con el uso de estos agentes. El porcentaje de respuesta total en la era de la terapia blanco molecular es un evento raro7. El porcentaje de pacientes que experimentan una respuesta completa utilizando sunitinib, sorafenib, pazopanib y bevacizumal es menor del 3%6,8–10. Se han publicado varios reportes de series de casos acerca de la respuesta completa en pacientes con cáncer renal metastásico, sin embargo estos representan una minoría, logrando estos resultados mediante la integración de cirugía, radioterapia, o ambos. Robert et al. reportaron el primer caso de respuesta histológica completa posterior a sunitinib como terapia neoadyuvante en un carcinoma de células renales T3b, posterior a 2 ciclos de tratamiento con sunitinib; observaron un 35% de regresión del tumor renal y una estabilidad del trombo en vena cava, administrando 5 ciclos más a dosis bajas con posterior nefrectomía radical, reportando en la pieza quirúrgica necrosis sin evidencia de tumor viable11. En un análisis retrospectivo reciente, Albiges et al. reportaron la mayor serie de pacientes con cáncer renal metastásico que experimentaron respuesta completa durante el tratamiento con inhibidores de tirosina cinasa ya sea solo o en combinación con tratamiento local; reportan una mayor tasa de recaída en pacientes que interrumpieron el tratamiento posterior a una respuesta completa en comparación con los pacientes que no suspendieron el tratamiento o que continuaron con ciclos adicionales12. Otro análisis retrospectivo de 266 pacientes tratados con inhibidores de tirosina cinasa realizado por Johannsen et al. informó una respuesta completa alcanzada usando solo la terapia médica en el 1.8% de los casos y con el uso de inhibidores de tirosina cinasa y cirugía en el 4.5% de los casos13. En la actualidad, la integración de la cirugía y la terapia sistémica representan la mejor opción de tratamiento para muchos pacientes con enfermedad avanzada. Con 2 meses de seguimiento, nuestro paciente actualmente está libre de recurrencia.
ConclusionesEl tratamiento del CCRm se ha revolucionado a partir de la era de la terapia blanco, con respuestas parciales de hasta un 30-40%, y mejoría en supervivencia libre de progresión y supervivencia global; con respuesta completa en casos aislados.
Si bien la nefrectomía citorreductora es un estándar actual de tratamiento para mejorar la supervivencia en pacientes seleccionados con CCRm, la terapia blanco neoadyuvante ha demostrado disminuir el tamaño tumoral y permitir la cirugía posterior en pacientes seleccionados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.