¿ INTRODUCCIÓN
El cáncer de próstata es la segunda neoplasia más frecuente en el hombre adulto. Se considera que en 2007 se presentaron 782,600 casos nuevos con 254,000 defunciones a nivel mundial y en Estados Unidos 218,890 casos con 27,050 decesos, lo que representa la sexta causa de muerte por cáncer en varones en el mundo y la segunda en la Unión Americana. En México, la mortalidad se ha incrementado en las últimas dos décadas y actualmente constituye la principal causa de muerte por cáncer en el hombre adulto.
Conforme avanza la edad, la incidencia aumenta en forma significativa. La supervivencia general ha mejorado en los últimos 30 años. En los últimos cinco años, la supervivencia para la enfermedad localizada fue de 100% y para la enfermedad metastásica 33%. Aproximadamente 70% de los cánceres de próstata se diagnostican en varones mayores de 65 años y de éstos, 90% se diagnostican en etapa local y/o regional.
Actualmente, la supervivencia general calculada a 10 y 15 años es de 92 y 61%, respectivamente. Esta mejoría se atribuye al diagnóstico temprano asociado con el uso rutinario del antígeno prostático específico, de la exploración digital-rectal y a algunos avances en el tratamiento. En este contexto, se han definido mejor las indicaciones y beneficios de los diferentes tratamientos disponibles como son la cirugía, la radioterapia, el bloqueo androgénico, la quimioterapia y los bifosfonatos. Asimismo, están en marcha estudios aleatorizados para demostrar la utilidad de nuevos fármacos y regímenes de tratamiento sistémico, incluyendo a las terapias blanco.1-7 La carcinogénesis, los factores de riesgo, la detección oportuna, el abordaje diagnóstico, así como la clasificación clínica e histológica del cáncer de próstata han sido revisados recientemente.8 El presente trabajo intenta revisar los lineamientos actuales y las indicaciones de las diferentes modalidades de tratamiento del cáncer de próstata en la era de la terapia multimodal.
¿ TERAPIA MULTIMODAL: CIRUGÍA
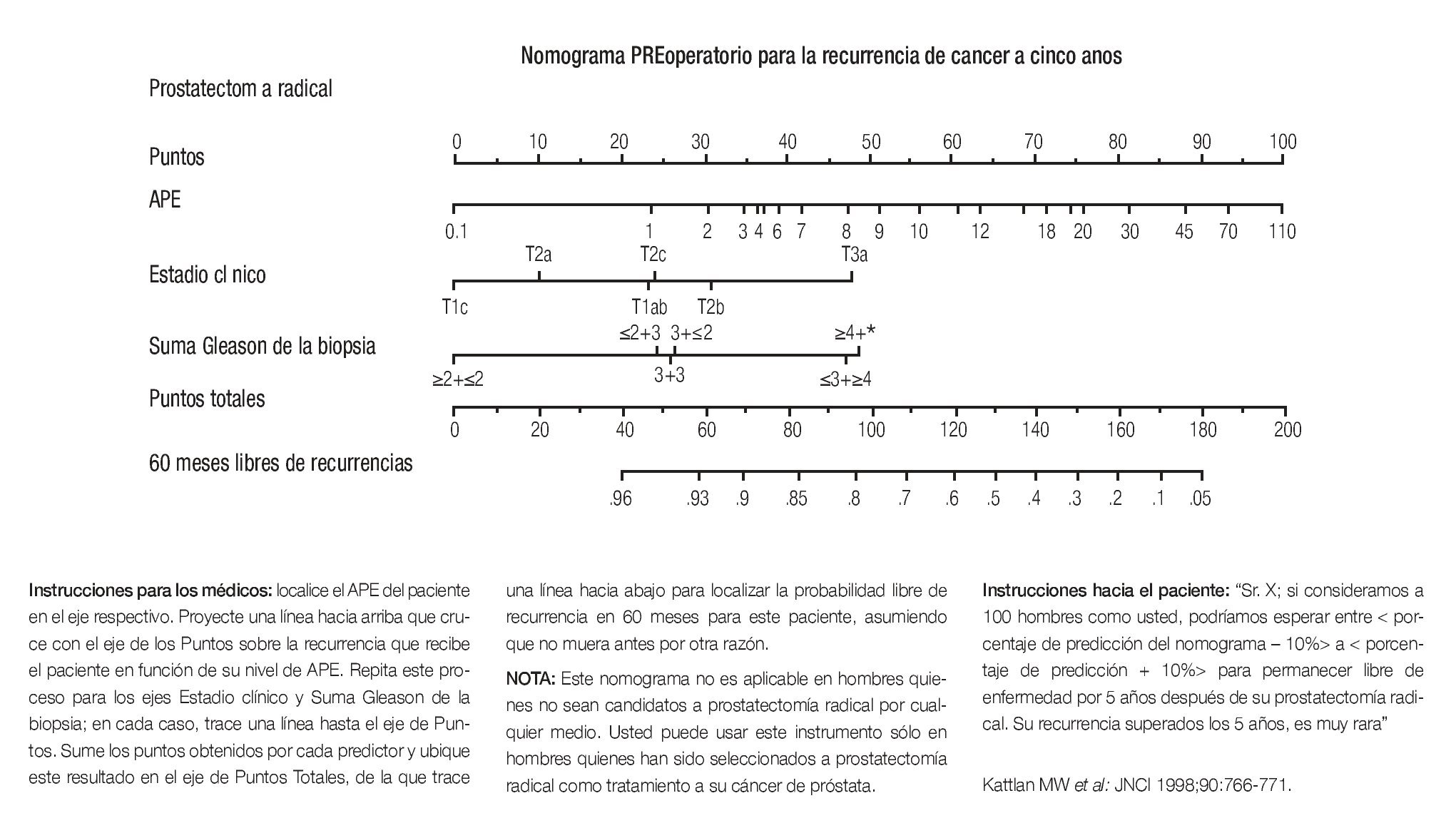
El tratamiento y pronóstico de los pacientes con cáncer de la próstata se encuentran en función directa de la etapa. Para la enfermedad temprana, la determinación del nivel sérico de antígeno prostático específico (APE), el ultrasonido transrectal, la resonancia magnética endorrectal y la resonancia magnética espectroscópica son de gran utilidad para determinar la localización del tumor, la presencia o no de invasión extraprostática, de las vesículas seminales y/o metástasis ganglionares. Estos factores, además del grado histológico en la escala de Gleason, nos ayudan a determinar qué pacientes son candidatos a prostatectomía radical.9-11 Hoy día, los mejores candidatos son pacientes con una expectativa de vida de 10 años o más, con tumor no palpable, confinado a la próstata y de grado bajo o intermedio.12 La prostatectomía radical ha evolucionado en la última década, de tal forma que se puede realizar con la técnica tradicional abdominal abierta, por vía laparoscópica trans o extraperitoneal e inclusive, asistida por robótica. Esta cirugía debe realizarse por especialistas entrenados en el tratamiento del cáncer de próstata y la mejor técnica será aquella en la que el cirujano tenga mayor experiencia. En centros oncológicos con recursos para realizar cirugía de invasión mínima y robótica, los resultados comparados con los de la cirugía abierta son similares en cuanto a complicaciones, secuelas funcionales y eficacia terapéutica, no obstante como es obvio, se requiere de una curva de aprendizaje.13-17 Las complicaciones más frecuentes de la prostatectomía radical en manos expertas son: disfunción eréctil, la cual ha disminuido gracias a la preservación neurovascular. Quinlan y cols., reportaron que 68% de los 503 pacientes que fueron potentes previo a la cirugía, mantuvieron la potencia en forma postoperatoria. Los factores asociados a conservar una función eréctil normal fueron: paciente joven, estadio clínicopatológico temprano y neuropreservación. En 24 a 48 meses, 80% de los pacientes con disfunción eréctil postoperatoria recuperan la potencia, en ocasiones con apoyo de inhibidores de la fosfodiesterasa como sildenafil o vardenafil, en pacientes adecuadamente seleccionados. Otra complicación frecuente es la incontinencia urinaria, la cual ha sido reportada en centros con experiencia en un rango de 15 a 20%. Los factores asociados para conservar la continencia urinaria son: paciente joven, preservación de ambos paquetes neurovasculares, ausencia de estenosis en la anastomosis, preservación de una longitud uretral funcional, eversión del cuello vesical y un volumen prostático pequeño. Otra más es la fuga de la anastomosis uretrovesical, la cual se presenta hasta en 13% de los casos y la estenosis de la misma en 0.5 a 2% después de prostatectomía radical laparoscópica o perineal y hasta en 17% después de cirugía radical retropúbica. Otras complicaciones menos habituales son: lesión ureteral, lesión intestinal, trombosis venosa y hemorragia. La mortalidad operatoria es de aproximadamente 0.5%.18-23 La integración de variables clínicopatológicas nos ayudan a determinar si la enfermedad se encuentra en el grupo de bajo, intermedio o alto riesgo. Los factores más importantes a considerar son el grado del T, el nivel sérico preoperatorio del APE y el grado de acuerdo con la escala de Gleason. Nuevos métodos para evaluar preoperatoriamente el riesgo de encontrar ganglios positivos, invasión a las vesículas seminales e invasión extracapsular, se han conjuntado en forma de nomogramas y pueden predecir con alta seguridad qué pacientes son los mejores candidatos a cirugía y el índice de falla clínica después de prostatectomía radical.24-26 (Imagen 1.)
Imagen 1. Nomograma para predecir en forma preoperatoria la recurrencia del cáncer de próstata a 5 años
¿ CIRUGÍA PALIATIVA
En pacientes con enfermedad avanzada una complicación frecuente es la obstrucción urinaria. En estos casos, la resección transuretral paliativa es una opción viable, ya que mejora la calidad de vida, con mínima morbilidad y mejoría significativa de los síntomas. La enfermedad ósea está presente en 90% de los pacientes con cáncer de próstata metastásico; 1-12% de estos pacientes pueden desarrollar compresión medular, la cual es una urgencia oncológica con alto riesgo de secuelas funcionales graves y disminución de la supervivencia. La cirugía descompresiva seguida de radioterapia ha demostrado mejores resultados que la radioterapia sola, no obstante, algunos pacientes no son candidatos a este procedimiento debido a su mal pronóstico y a comorbilidades asociadas con su enfermedad y edad.27-31
¿ RADIOTERAPIA
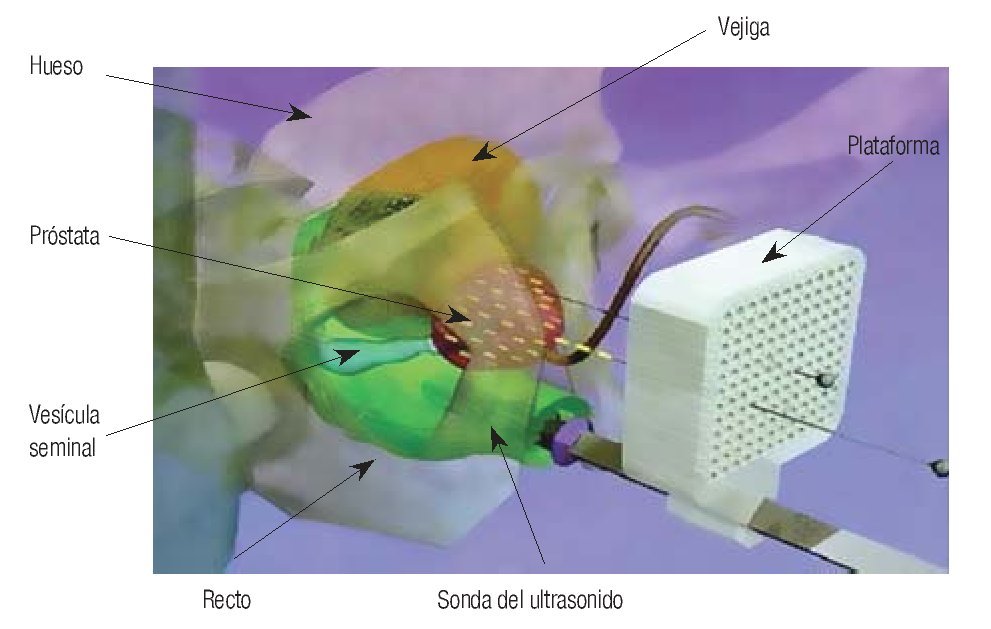
El tratamiento más adecuado para el cáncer confinado a la próstata, aún es motivo de controversia. Los resultados con radioterapia externa, conformacional tridimensional, braquiterapia o prostatectomía radical han sido similares en la mayoría de la series, con seguimiento hasta de 15 años o mayor. La braquiterapia es una alternativa atractiva en enfermedad temprana, ya que puede administrarse en una sola sesión, en forma ambulatoria, con riesgo de morbilidad menor que con radioterapia externa y/o conformacional. Es aconsejable para pacientes con tumores T1-2, con Gleason menor de 7, sin evidencia de metástasis ganglionares y con APE menor de 15 ng, no candidatos a prostatectomía radical. Para pacientes mayores de 65 años, constituye la mejor opción terapéutica (Imagen 2).
Imagen 2. Braquiterapia
En tumores localmente avanzados se prefiere la radioterapia conformacional o la radioterapia externa con dosis mayores a las convencionales, combinada con bloqueo androgénico total, con resultaros similares a los obtenidos con cirugía más terapia hormonal. Dentro de las complicaciones asociadas a la radioterapia externa se encuentran los síntomas urinarios irritativos y obstructivos, mismos que se presentan en aproximadamente un tercio de los pacientes que han recibido una dosis mayor a 70 Gy, en especial en aquellos con un volumen prostático pre-tratamiento mayor a 43 cm3, estas complicaciones suelen presentarse 2 a 3 semanas después de haber iniciado la terapia. En forma tardía puede presentarse la formación de telangiectasias vesicales, microcisto, hematuria y estenosis ureteral, esta última hasta en 10% de los pacientes. También se presentan con frecuencia manifestaciones de morbilidad digestiva como son diarrea, formación de adherencias intestinales y más frecuentemente tenesmo rectal (20%) y rectorragia (9%). Cerca de 50% de los varones tratados con radioterapia externa pueden presentar disfunción eréctil. Un tercio de ellos se benefician con inhibidores de la fosfodiesterasa. En un estudio reciente, las complicaciones dentro de los primeros 30 días a partir del inicio del tratamiento se observaron en 6.5% de 7661 pacientes. Las más comunes fueron genitourinarias (5%), cardiovasculares (1%) e intestinales (0.6%) y se observó una relación directamente proporcional con la edad del paciente. La mortalidad en este grupo fue de 0.1%. Las complicaciones asociadas a braquiterapia se presentan en cerca de la mitad de los pacientes. Las más frecuentes son las urinarias (33.8%), las digestivas (21%) y la disfunción eréctil (16.7%). La mayoría de ellas se resolvieron con tratamiento conservador y sólo requirieron de procedimientos invasivos 10.3, 0.8 y 4%, respectivamente. Dos técnicas desarrolladas en años recientes son la radioterapia conformacional y la radioterapia de intensidad modulada guiada por imagen. Estas modernas técnicas han permitido incrementar la dosis de radiación al lecho tumoral en aproximadamente 10% al mismo tiempo que se disminuye la exposición de los tejidos sanos, con lo que se ha disminuido significativamente la frecuencia de complicaciones.32-47
¿ RADIOTERAPIA PALIATIVA
En pacientes con enfermedad metastásica o con recurrencia irresecable, la radioterapia paliativa juega un papel importante en el control del dolor. En presencia de metástasis óseas, puede utilizarse radioterapia externa con posibilidades de respuesta objetiva alrededor de 80%. El tratamiento habitual consiste en administrar 30 Gy en 10 fracciones. Recientemente Hartsell y cols., publicaron un estudio prospectivo, aleatorizado en el que compararon la eficacia de administrar el tratamiento habitual vs. 8 Gy en una sola fracción en pacientes con metástasis óseas sintomáticas. Las respuestas completas y parciales fueron de 15 y 50% vs. 18 y 48%, respectivamente. La incidencia de fractura patológica fue de 5 y 4%. La necesidad de retratamiento fue superior en el brazo de 8 Gy (18%) vs. 9% en el de 30 Gy. (p menor de 0.001). Los autores recomiendan el tratamiento en una sola fracción, ya que en caso de requerirse retratamiento éste es simple y efectivo. Otra arma terapéutica en estos casos es la radioterapia interna intravenosa con radionúclidos. El tratamiento con samario-153 ha logrado control del dolor hasta en 72% de los pacientes tratados, con una duración de respuesta de aproximadamente 3 meses y con la ventaja de poder administrar nuevamente el tratamiento en caso necesario. Finalmente, el uso de quimioterapia concomitante con radionúclidos, específicamente samario (153Sm-EDTMP) en pacientes con metástasis óseas de cáncer de próstata refractario a tratamiento hormonal parece mejorar la supervivencia, sin toxicidades aditivas. Se requiere de una evaluación prospectiva que confirme estos hallazgos.48-53
¿ TERAPIA HORMONAL
La primera evidencia de que el cáncer de próstata es sensible a manipulación hormonal, fue publicada por Huggins y cols., en 1941. Ellos encontraron respuesta en el tumor y sus metástasis, así como una disminución de los niveles de fosfatasa ácida después de orquiectomía bilateral o de la administración de estrógenos.54-55 El papel del tratamiento hormonal adyuvante en pacientes con enfermedad localizada y con alto riesgo de recurrencia no ha sido establecido. El resultado final del protocolo 30846 de la EORTC, después de 13 años de seguimiento, demostró una supervivencia similar cuando se administró terapia hormonal inmediata vs. el momento de la progresión, en pacientes con ganglios positivos. De igual manera, la terapia hormonal antes de la cirugía, a pesar de influir en los límites quirúrgicos, no ofrece beneficio en supervivencia ni en intervalo libre de enfermedad. Cuando se ha administrado antes de la radioterapia, no se ha observado un beneficio estadísticamente significativo en la supervivencia general. Algunos estudios han sugerido beneficio en pacientes con tumores de alto grado con ganglios positivos y localmente avanzados, cuando se administra radioterapia externa y bloqueo androgénico concomitante, el cual se prolonga durante 4 a 6 meses. En estos casos se ha observado un beneficio en el tiempo a la progresión bioquímica (elevación del APE), en la mortalidad específica por cáncer de próstata y en la mortalidad por cualquier causa, en pacientes con una velocidad del APE pre-tratamiento mayor a 2 ng/mL/año.56-66 Para pacientes con enfermedad avanzada, la información disponible sugiere que la supresión androgénica temprana, reduce la progresión de la enfermedad y las complicaciones asociadas a ésta, además de proveer de un modesto, pero significativo beneficio en la supervivencia a 10 años.67
Los análogos de la hormona liberadora de la hormona luteinizante (leuprolide, goserelina) combinados con antiandrógenos (flutamida, bicalutamida, nilutamida), son el tratamiento de elección para pacientes que debutan con enfermedad metastásica; no obstante, recientemente se ha propuesto realizar el bloqueo androgénico total en forma secuencial, con base al comportamiento del APE, lo cual disminuye la toxicidad y los costos del tratamiento, sin afectar la supervivencia. Se sugiere iniciar con un agonista de la hormona liberadora de la hormona luteinizante (LH-RH). Cuando se administra el análogo solo, puede presentarse el fenómeno conocido como "flare" y que se atribuye a un incremento transitorio de los niveles séricos de testosterona debido a una estimulación inicial de LH-RH. Su traducción clínica es un incremento transitorio en la intensidad de los síntomas, aunque puede ser fatal en aquellos pacientes con gran volumen tumoral. Para prevenir el "flare", se debe administrar un antiandrógeno durante las primeras dos semanas del tratamiento, con lo que se inhibe la estimulación del incremento de la testosterona a nivel del receptor androgénico.68-77 Otra alternativa aún no aceptada fuera de estudios clínicos es la supresión androgénica intermitente. Este concepto fue introducido por Klotz y cols., en 1986 y seguido por estudios a nivel celular y en animales de experimentación. Al mantener clonas hormonosensibles con la terapia intermitente, podría prevenirse la ocupación del tumor por células resistentes, manteniendo así la hormonodependencia del tumor por periodos prolongados. La evidencia clínica actual en favor del bloqueo androgénico intermitente se debe a resultados de cuatro estudios clínicos en los que no se observaron iguales resultados en relación con el bloqueo continuo; pero con menor costo y morbilidad, y con mejor calidad de vida de los pacientes. Se requiere urgentemente de un estudio aleatorizado y multicéntrico que corrobore estos hallazgos.78-82 El promedio de tiempo a la progresión con bloqueo androgénico total en pacientes que debutan con enfermedad metastásica oscila entre 18 y 24 meses. En estos casos, al suspender el antiandrógeno puede observarse una disminución de más de 50% en el nivel sérico del APE, esta respuesta se obtiene en 20-30% de los pacientes y se conoce como "antiandrogen withdrawal". Cuando se combina el retiro del antiandrógeno con ketoconazol e hidrocortisona o prednisona a bajas dosis no hay mejoría en la supervivencia, pero sí un mejor control del dolor. El promedio de duración de la respuesta es de 5 meses.83-86 Cuando el marcador persiste elevado o vuelve a elevarse después del "withdrawal", se puede intentar una segunda línea de terapia hormonal con dosis altas de bicalutamida con un índice de respuestas entre 14 y 20% y con una duración de aproximadamente 4 meses. Otra opción es nilutamida a dosis de 150 a 300 mg/día, con respuestas entre 29 y 50% y con duración de la misma entre 7 y 11 meses. Al progresar a segunda línea de terapia hormonal, la enfermedad se considera andrógenoindependiente y el paciente es candidato a quimioterapia. En pacientes bajo terapia hormonal quienes tienen niveles séricos de testosterona correspondientes a castración y cursan con progresión de la enfermedad, ésta se considera castración-independiente. Aun en pacientes con niveles de castración, se ha encontrado un incremento en la conversión intracelular de andrógenos suprarrenales a testosterona y dihidrotestosterona a través de un mecanismo de adaptación de la célula prostática a la deprivación androgénica y puede ser un potencial blanco terapéutico. En este contexto, abiraterona, una droga que inhibe a la enzima CYP17 que juega un papel importante en la producción de hormonas como la testosterona, reduce hasta en 90% los niveles de APE en pacientes con enfermedad hormonorrefractaria.87-96 El bloqueo androgénico total causa una pérdida significativa de la masa ósea y muscular, con evolución hacia la osteoporosis y un incremento en la presentación de fracturas. La incidencia de las mismas es 7 a 45 veces más frecuente que en pacientes sin bloqueo hormonal. El ejercicio es probablemente la mejor protección contra estos efectos. No obstante, el uso de ácido zoledrónico incrementa la masa ósea en forma significativa y disminuye el riesgo de fracturas. Estudios iniciales demostraron estos efectos cuando se administraron 4 mg cada 3 meses, durante el primer año del tratamiento. Un estudio más reciente demostró que una sola dosis anual de ácido zoledrónico incrementa la densidad ósea lumbar en forma similar a la reportada con la administración trimestral. En presencia de metástasis óseas, la administración de 4 mg de ácido zoledrónico cada 3-4 semanas, disminuye significativamente el dolor, el consumo de opiáceos y la presentación de eventos óseos como fracturas. Su uso puede prolongarse con seguridad hasta por 24 meses. Las complicaciones más comunes asociadas con los bifosfonatos son falla renal, por lo que se recomienda monitorear la función renal y administrar la infusión en más de 15 minutos. Otra complicación poco frecuente es la necrosis mandibular, por lo que antes de iniciar el tratamiento el paciente debe someterse a profilaxis odontológica y evitar procedimientos dentales invasivos durante la terapia.97-104
¿ QUIMIOTERAPIA
En pacientes con enfermedad, resistente a tratamiento hormonal, la siguiente opción terapéutica es quimioterapia. Durante muchos años se intentó encontrar un esquema eficaz, sin lograrlo. En 1996 se publicó un estudio aleatorizado que demostró un beneficio en la paliación de síntomas utilizando mitoxantrona más prednisona vs. prednisona sola, sin mejoría de la supervivencia.105-107 En 2004 se publicaron dos estudios aleatorizados que demostraron un beneficio estadísticamente significativo en la supervivencia general. El primero de ellos llamado TAX 327, aleatorizó a 1006 pacientes con cáncer de próstata metastásico y hormonoindependientes en tres grupos: docetaxel 75 mg/m2SC IV c/21 días + prednisona 5 mg VO c/12 h continuamente, vs. docetaxel 30 mg/m2 c/semana x 5 a 6 semanas + prednisona 5 mg VO c/12 h continuamente vs. mitoxantrona 12 mg/m2 c/21 días + prednisona 5 mg VO c/12 h continuamente. La duración del tratamiento en los tres brazos fue de 30 semanas. La mediana de supervivencia fue de 18.9 meses para todo el grupo. El análisis por subgrupos mostró que la mediana de supervivencia en meses fue de 18.9, 17.3 y 16.4 para los pacientes tratados con docetaxel cada 3 semanas + prednisona, docetaxel semanal + prednisona y mitoxantrona + prednisona, respectivamente. La diferencia fue estadísticamente significativa entre los tres grupos a favor de docetaxel cada 3 semanas más prednisona. En este estudio, se observó mayor beneficio en pacientes de 69 años de edad o mayores y en asintomáticos vs. sintomáticos. También se observó que, el tiempo de doblaje del APE es un predictor de supervivencia: Con un tiempo de doblaje menor a un mes, la supervivencia media fue de 13.3 meses vs. 25 meses cuando el tiempo de doblaje fue mayor a 6 meses (p menor de 0.001).108-109 El segundo estudio es conocido como SWOG 99-16. En éste, se aleatorizaron 674 pacientes para recibir estramustina 280 mg VO 3 veces/día/ 5 días + docetaxel 60 mg/m2SC cada 21 días o mitoxantrona 12 mg/m2SC + prednisona 5mg VO c/12 h, continuamente. La mediana de supervivencia para el subgrupo tratado con docetaxel + estramustina fue de 17.5 vs. 15.6 meses para el subgrupo con mitoxantrona + prednisona, con una diferencia estadísticamente significativa (p = 0.02). La mediana de tiempo a la progresión también fue mejor para el subgrupo con docetaxel: 6.3 vs. 3.2 meses (p < 0.001).110 La duración exacta del tratamiento con quimioterapia aún no ha sido definida y no existe una segunda línea eficaz de tratamiento después de 10 a 12 ciclos de docetaxel. En el estudio ASCENT, los autores intentaron determinar la eficacia de docetaxel semanal a dosis de 36 mg/m2 con o sin calcitriol, administrado en 3 de cada 4 semanas, de manera intermitente.
El tratamiento era suspendido al observarse un descenso del APE en más de 50% o a una cifra de 4 ng/mL o menor (treatment holiday). Entonces, se monitorizaba el comportamiento sérico del APE cada 4 semanas y estudios de imagen cada 8 semanas en caso de tener enfermedad medible. Cuando se elevaba el APE nuevamente en 50% o más o era de 2 ng/mL o mayor, o había evidencia radiológica o clínica de progresión se reiniciaba el tratamiento. En los 45 pacientes estudiados, la mediana de tiempo después de la primera suspensión del tratamiento fue de 18 semanas. Al reiniciar el tratamiento 45.5% tuvieron respuesta manifestada por reducción del APE en 50% o más, 45.5% experimentaron estabilización de su enfermedad por al menos 12 semanas y 9% tuvieron progresión.111
¿ VALORACIÓN DE LA RESPUESTA
Para valorar la respuesta a la terapia sistémica en pacientes con enfermedad metastásica castración-independiente dentro de estudios clínicos, las recomendaciones del "Prostate Cancer Clinical Trials Working Group" son: realizar una determinación del APE, fosfatasa alcalina, deshidrogenasa láctica y evaluación de síntomas cada 3-4 semanas, estudios de imagen incluyendo gammagrama óseo, tomografía computarizada y/o resonancia magnética nuclear cada 12 semanas. En la práctica clínica, se recomienda continuar con el tratamiento sistémico por lo menos 12 semanas, antes de realizar una valoración integral de la respuesta clínica. Lo anterior bajo el concepto teórico de permitir una adecuada exposición al fármaco, ya que frecuentemente se observa una elevación transitoria del APE o un incremento de los síntomas, antes de percatarse una mejoría clínica o un descenso del marcador.112 Con base al estudio TAX 327 hoy día la primera línea de quimioterapia considerada como estándar en cáncer de próstata metastásico hormonorrefractario es docetaxel cada 3 semanas más prednisona. Los pacientes que más se han beneficiado son aquellos con APE menor de 115 ng/mL, sin dolor, con Karnofsky igual o mayor a 90% y sin involucro visceral.109
El tiempo de doblaje del APE es un factor importante que predice recurrencia en enfermedad localizada y supervivencia en enfermedad avanzada.113-117
¿ NOMOGRAMAS
Actualmente, el grupo de Urología del Memorial Sloan Kettering Cancer Center, ha desarrollado una serie de tablas logarítmicas que predicen con alta precisión la posibilidad de recaída, invasión extraprostática, ganglios positivos, malignidad en función del nivel del APE, etc. Estas tablas predictivas llamadas nomogramas cada vez ganan más aceptación en la comunidad médica urológica y oncológica. Desafortunadamente, muchos nomogramas se basan en resultados de estudios retrospectivos y hoy en día se están realizando estudios prospectivos para definir su valor real. Basados en los resultados del estudio TAX 327, Armstrong y cols., identificaron diez variables pronósticas independientes y han propuesto un nomograma que intenta predecir con certeza la supervivencia a 1, 2 y 5 años en pacientes con cáncer de próstata metastásico y hormonoindependiente tratados con docetaxel-prednisona.
El índice de concordancia en este estudio fue de 0.69 y dentro de los factores identificados se encuentra el tiempo de doblaje del APE, la intensidad del dolor, la forma de progresión y el número de sitios con metástasis.118-123
¿ CONCLUSIÓN
El tratamiento del cáncer de próstata es multidisciplinario y la terapia estándar hasta hoy incluye cirugía, radioterapia, terapia hormonal y quimioterapia. Aun está por dilucidarse el papel de nuevas combinaciones y drogas como satraplatino, terapias blanco como los inhibidores de la angiogénesis (bevacizumab, aflibercept), antagonistas del receptor de endotelina, anticuerpos contra RANKL como denosumab, abiraterona.124-130 Estas nuevas drogas podrán en un futuro formar parte de la terapia multimodal del cáncer de próstata, con lo que posiblemente se mejore la supervivencia y la calidad de vida de nuestros pacientes.
Correspondencia:
Dr. Mario A. Álvarez Blanco.
Tepic 139-608, Col. Roma Sur, Del. Cuauhtémoc, C.P. 06760. México D.F.
Celular: 55-54-53-11-73.
Correo electrónico: marioonco@hotmail.com