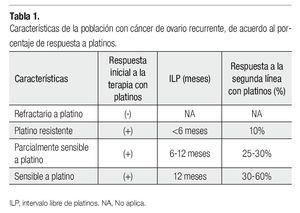
La efectividad del tratamiento con platinos en las mujeres con cáncer de ovario recurrente (ROC) depende del intervalo de tiempo entre la primera exposición al platino a la subsecuente administración en la primera recaída. (Intervalo Libre de Platinos ILP). Los agentes platinados pueden ser nuevamente utilizados en pacientes que recaen después de 12 meses de haber recibido una primera línea, aquellas pacientes que recaen antes de los 6 meses son refractarias al tratamiento con platinos.
La efectividad del tratamiento de segunda línea disminuye en las pacientes que recaen entre 6 y 12 meses ( Parcialmente Sensibles a Platino PPS), sin que exista un estándar de tratamiento.
Aquellas pacientes con resistencia al platino pueden responder posteriormente al mismo después de haber recibido un esquema de quimioterapia libre de platinos. La trabectedina es un derivado de un tunicado marino aprobado por la Unión Europea para el tratamiento del ROC, basado en el estudio fase III OVA 301. Evaluó la combinación de trabectedina más Doxorrubicina Liposomal (DLP), resultando en incremento en la SLP y en las tasas de respuesta. Un análisis de la población de pacientes PPS, demostró un incremento en la SG de 6 meses en este grupo pacientes. Además, en las pacientes que recibieron una tercera línea de tratamiento con un agente platinado se encontró que la supervivencia fue mejor en aquellas pacientes que recibieron DLP/ trabectedina. Estos resultados sugieren que prolongar el ILP con un agente no platinado mejora los resultados finales cuando se administra una tercera línea con platinos.
The efficacy of the treatment of platinum compounds in patients with recurrent ovarian cancer is directly related to the interval of time of first exposure to a platinum compound and the first relapse (Platinum Free Interval). Platinum compounds have been used in patients who have relapses for more than 12 months after first line treatment and that patients who relapse before 6 months, are refractory to these agents.
Response to treatment and efficacy in second line is not as important in patients who relapse between 6 and 12 months. There is no standard of treatment for this group of patients.
Patients with documented platinum resistance, can respond to chemotherapy with a non platinum regimen after having received platinum regimen. There is an unsatisfied need to identified new compounds in patiens with partially platinum sensitive disease. Trabectedine a compound, derived from a marine tunicate, approved by the European Medicines Agency for the treatment of ROC based in the OVA 301 phase III study. This trial studied the combination of trabectedin and Pegylated Liposomal Doxorubicin (PLD) that resulted in an increase of PFS and response rates. A sub population analysis in patients with partial platinum sensitive disease, showed an increase of 6 months in OS in this group of patients. Patients were able to receive a third line treatment with a platinum agent, with a better survival in the arm of PLD/trabectedin. Results suggest that prolonging the platinum free interval with a non-platinum agent improves results when a third line is given.
¿ INTRODUCCIÓN
El cáncer de ovario representa el 3% de los cánceres en Estados Unidos de América, ocupando el noveno lugar después del melanoma. Es la principal causa de mortalidad por cánceres ginecológicos y la quinta causa de muerte, por cáncer entre las mujeres.1 La Sociedad Americana de Cáncer estima que en el 2011 se diagnosticarán 21 990 nuevos casos de cáncer de ovario, y aproximadamente 15 460 mujeres morirán de esta enfermedad.2 En Estados Unidos se estima, que el riesgo durante la vida de una mujer de padecer cáncer de ovario es de 1.4% (uno en 71), y el riesgo de fallecer por cáncer metastásico es de uno en 95.3
En México, el Reporte Histopatológico de Neoplasias Malignas de 2003 señaló 2 907 nuevos casos, lo que representa 4.04% de todos los tumores malignos en la mujer. Se informó sobre 1 403 muertes, cifra que representó el 4.5% del total de las muertes por cáncer en mujeres. La supervivencia global (SG) a cinco años en el cáncer de ovario, depende principalmente del Estadio Clínico (EC), siendo del 50% al 90% para un EC I, del 30% al 80% para el EC II, del 20% al 30% para la EC III y menor al 10% para un EC IV.4
La incidencia del cáncer de ovario aumenta con la edad, siendo más prevalente en la octava década de la vida, con una tasa de 57/100 000 mujeres. La edad promedio al momento del diagnóstico es de 63 años, y el 70% de las pacientes se presenta con enfermedad avanzada.5
De las pacientes que se presentan con estadios avanzados, solamente un 10% a 15% lograrán remisión a largo plazo. Sin embargo, el resto tiende a experimentar progresión a pesar de los tratamientos de primera línea, basados en platinos y taxanos. En las últimas décadas, pocos cambios han ocurrido en el algoritmo de tratamiento del cáncer de ovario recurrente (ROC), el intervalo libre de platino (ILP) después de una primera línea de tratamiento ha permanecido relativamente constante. Debido a la mejoría en el tratamiento de la enfermedad recurrente, las pacientes pasan más tiempo en tratamiento después de la primera recurrencia, que desde el momento del diagnóstico a la primera recaída. La supervivencia global en las pacientes con ROC varía entre los 12 y 24 meses, lo que demuestra la naturaleza crónica de esta enfermedad.6
El objetivo de esta revisión es resaltar la importancia del ILP en las pacientes con ROC, y describir las nuevas combinaciones no basadas en platino, para alargar el ILP en las pacientes parcialmente sensibles a platinos (PPS).
La selección de un régimen de quimioterapia representa un desafío para el oncólogo, ya que las pacientes de manera general reciben varias líneas de tratamiento a intervalos cada vez más cortos.7 Actualmente, los regímenes basados en platinos constituyen el fundamento para el tratamiento del ROC, una de las decisiones más importantes es la de utilizar nuevamente regímenes que contengan platinos (cisplatino o carboplatino), ya que la probabilidad de respuesta y la efectividad del tratamiento, depende en gran medida del ILP posterior a una terapia previa con los mismos agentes.8
A finales de 1980, Blakledge y colaboradores,9 Gore y colaboradores10 y Markman y colaboradores11 reportaron un incremento en la tasas de respuesta en las mujeres con ROC, de acuerdo a la duración en ILP. Encontrando tasas de respuesta (RR) del 60%, cuando este intervalo se acercaba a los dos años.12 Estas observaciones fueron la base para el tratamiento actual del ROC.
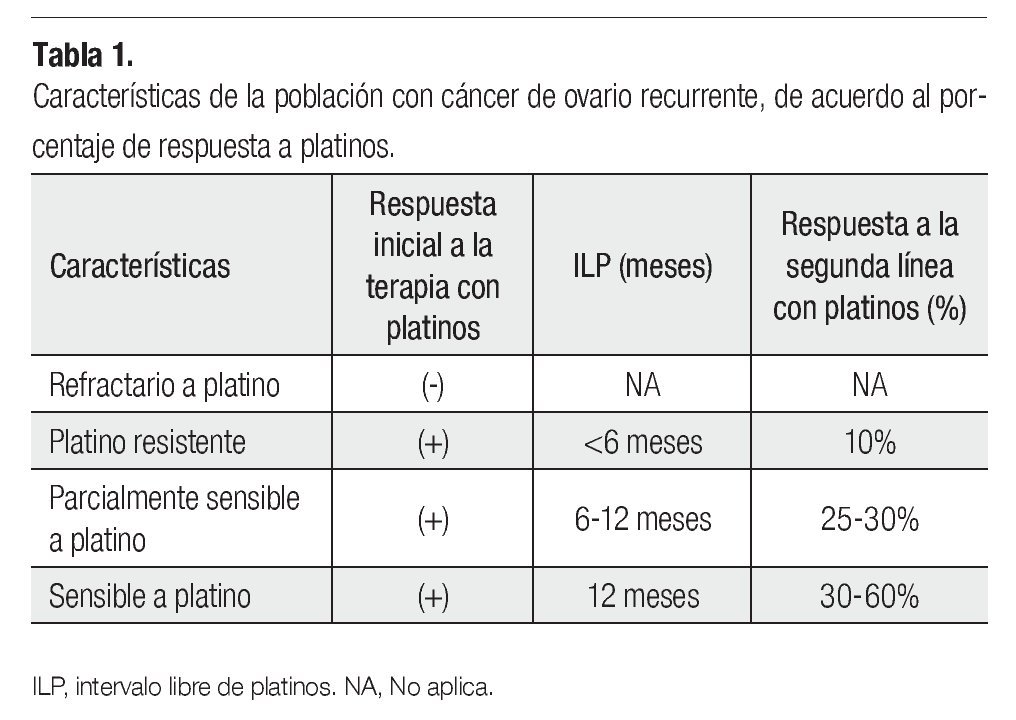
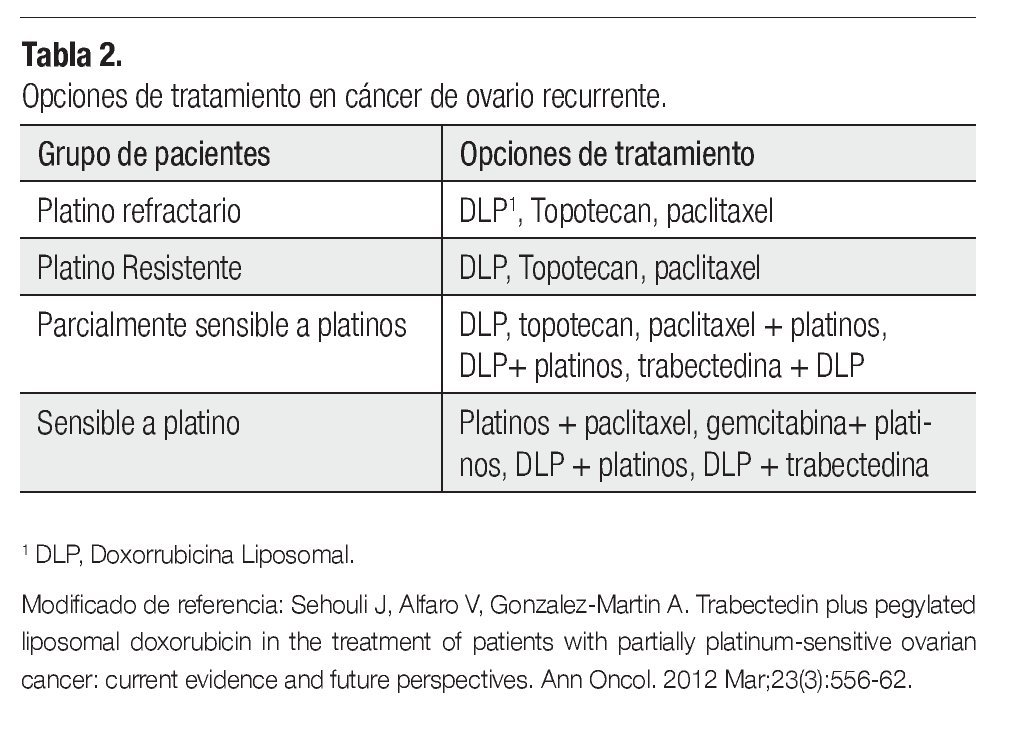
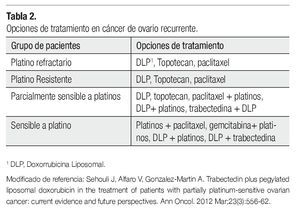
Se considera que aquellas mujeres que experimentan una recaída antes de seis meses, de haber recibido un tratamiento de primera línea son platino resistentes y no deben recibir esquemas platinados. Asimismo, se considera que los esquemas basados en agentes platinados pueden ser administrados nuevamente de manera segura, en aquellas pacientes con recurrencia de la enfermedad mayor a 12 meses, después de haber completado un régimen basado en platino (enfermedad platino sensible), con tasas de respuesta entre el 30% y 60%. No obstante, aquellas pacientes que presentan una recaída entre los seis y los 12 meses después del tratamiento de primera línea basado en platinos, las tasas de respuesta se disminuyen hasta un 25% a 30%8 (Tabla 1), por lo cual se les considera PPS. Como se mencionó previamente, estas categorías fueron hechas cuando la única opción de tratamiento en ROC era la reintroducción de la quimioterapia basada en platinos. En la actualidad, se han identificado nuevos agentes no platinos con actividad en este escenario clínico12 (Tabla 2), su uso para prolongar el ILP ha ganado interés recientemente, ya que la respuesta a la reinducción con platinos puede aumentar en la siguiente recaída.12
Aunque el tratamiento con platinos sea el estándar de tratamiento en mujeres con cáncer de ovario sensibles a platinos, existe menos certeza sobre el tratamiento adecuado en las mujeres con ROC parcialmente sensibles, ya que volver a someter a este grupo de pacientes a un tratamiento con platino está asociado a un incremento del riesgo de alergia grave,8 así como de desarrollar polineuropatía y alopecia.13
Estudios in vitro14 han demostrado que la resistencia a los platinos es un fenómeno inestable y potencialmente reversible, la demostración de esta hipótesis en la clínica es mucho más complicado, sin embargo existen estudios clínicos15 que sugieren, que la extensión del ILP en pacientes con ROC PPS, mediante la administración de una terapia no basada en platinos puede ser benéfico. Se cree que la sensibilidad a los platinos puede ser restaurada, si se prolonga el PFI.16
Un estudio de cohorte retrospectivo (estudio Sócrates), llevado a cabo por Pignata y colaboradores17 analizó el tratamiento de 428 pacientes con ROC platino sensibles, concluyendo que una mayor respuesta al tratamiento con platinos está directamente asociada, con el tiempo transcurrido desde la primera línea hasta la primera recaída (p=0.0132; OR=2.34)
Debido a la limitada actividad de los tratamientos actuales en las pacientes PPS, el identificar nuevos compuestos en pacientes previamente tratados con platinos y taxanos se ha convertido en una prioridad.18
La estrategia de extender el ILP es una conducta clínica que ha tomado fuerza en la práctica diaria en muchos países,19 ya que representa un plan secuencial, con un reconocimiento claro de la naturaleza crónica de esta enfermedad.20
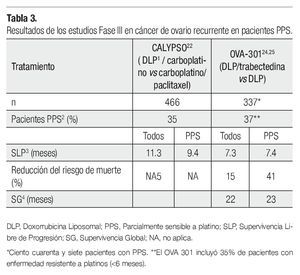
Existen tres estudios grandes, fase III (MITO-8, CALYPSO, OVA-301), que se han completado o que se están llevando a cabo para evaluar diferentes tratamiento en las pacientes PPS, con el objetivo de demostrar la hipótesis de que la prolongación artificial (con agentes no platinados) del ILP en pacientes con ROC, y progresión entre los seis y los 12 meses después de una primera línea con platinos, mejora las tasas de respuesta a terapias posteriores. Pignata y colaboradores están desarrollando un estudio multicéntrico, internacional MITO-8 (NCT00657878), que evaluará si la secuencia de doxorrubicina liposomal pegilada (DLP) seguida de carboplatino/paclitaxel en una recaída posterior es superior a una secuencia inversa de tratamiento (carboplatino/paclitaxel seguida de DLP en una progresión posterior). El estudio está proyectado para reclutar 253 pacientes, con un poder estadístico para detectar una mejoría en la media de supervivencia de 18 a 27 meses, en las pacientes que han recibido platino después de la administración de DLP.21
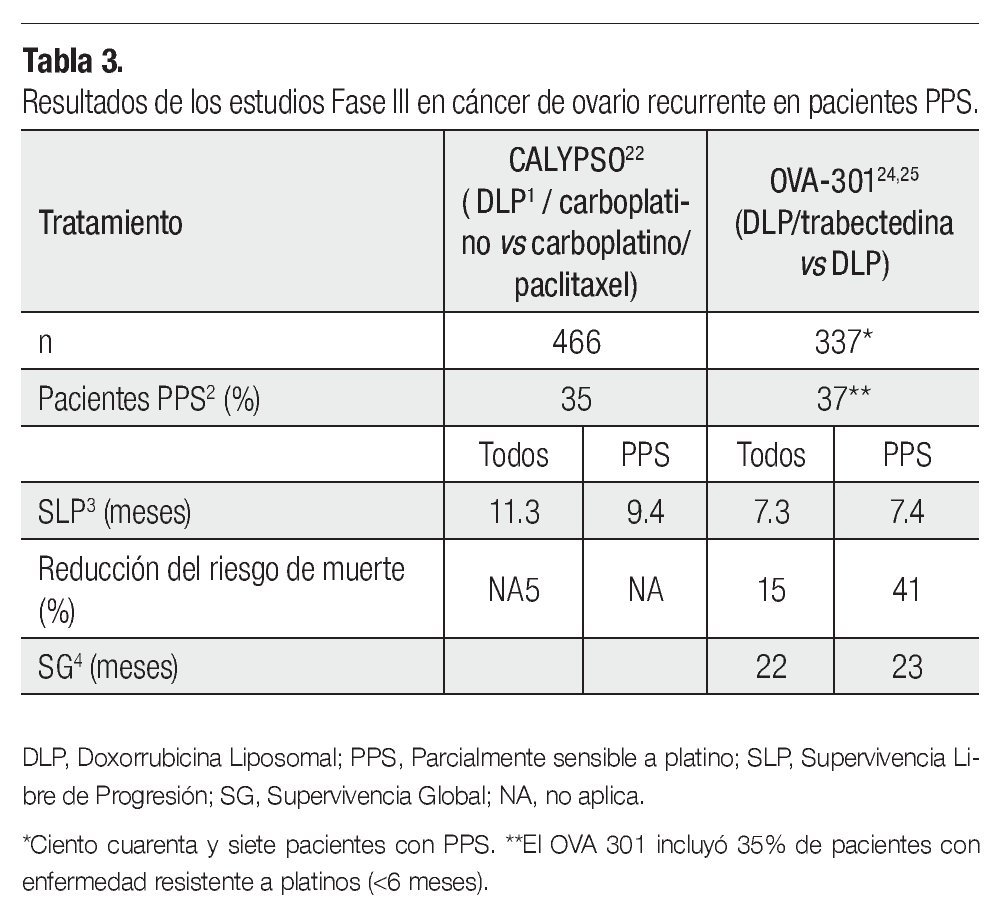
El estudio fase III CALYPSO,22 el más grande hasta el momento en ROC, reclutó 976 pacientes y comparó el estándar de tratamiento carboplatino vs DLP, demostrando superioridad de esta combinación de tratamiento con una mediana en la SPL de 11.3 vs 9.4 meses (HR 0.831; 95IC 0.72-0.94; p=0.005), al igual que en el análisis de la subpoblación PPS23 (35% de los pacientes) con una supervivencia libre de progresión (SLP) de 9.4 para DLP carboplatino y 8.8, para el estándar de tratamiento (p≤0.001) (Tabla 3).
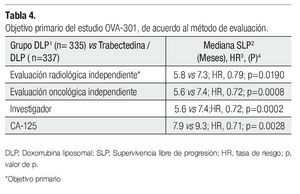
En el estudio OVA-30,124 estudio fase III, abierto, de asignación aleatoria, comparó la combinación de DLP más trabectedina vs DLP sola, en pacientes con ROC avanzado. El estudio fue diseñado para probar la hipótesis de que la combinación de DLP/ trabectedina es más efectiva, que la DLP sola. Un total de 672 pacientes fueron clasificadas de manera inicial, en base a su sensibilidad a los platinos y a su desempeño físico. El objetivo primario fue la SLP, los objetivos secundarios y terciarios fueron la supervivencia global, la RR, la seguridad y la farmacocinética. Un 65% de las pacientes incluidas en el estudio fueron platino sensibles, de estas el 37% se encontró dentro de la categoría de PPS (ILP entre seis y 12 meses).
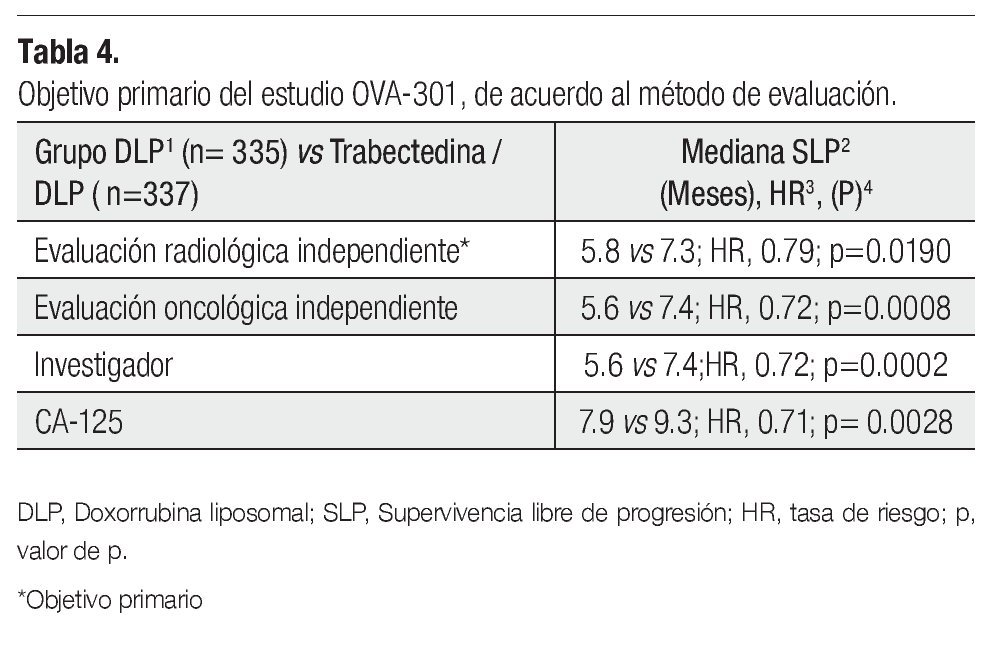
El estudio cumplió con el objetivo primario (Tabla 4), ya que por análisis radiológico independiente, la combinación de trabectedina y DLP tuvo una ventaja estadísticamente significativa en SLP comparada con la DLP sola (7.3 vs 5.8 meses, HR 0.79; IC95% 0.65-0.96). Los resultados fueron similares cuando el comité de evaluación oncológico realizó evaluaciones, tanto clínicas como radiológicas. Incluso en este análisis se demostró una ventaja aún mayor en SLP.
El estudio demostró que en aquellas pacientes con enfermedad platino resistente (ILP menor de seis meses), no existieron diferencias estadísticamente significativas en cuanto a SLP, entre los dos brazos de tratamiento (4 vs 3.7 meses; HR 0.95; 95%IC 0.70-1.30, p=0.7540). Por el contrario, se encontraron resultados muy positivos en la población PPS (ILP entre seis y 12 meses), con un beneficio en la SLP en el grupo que recibió la combinación (mediana de SLP 9.2 vs 7.5 meses; HR 0.73; 95%IC 0.56-0.95). Independientemente de los objetivos secundarios, la combinación demostró mejores tasas de respuesta global (remisión completa y parcial), comparada con la DLP sola. Los resultados en cuanto a la sobrevida global fueron mucho más alentadores en las pacientes PPS, el grupo que recibió la combinación de tratamiento con DLP/ trabectedina tuvo una mejoría de seis meses en la sobrevida (23 vs 17.1 meses; HR 0.59; 95%IC 0.42-0.82).
De acuerdo a la teoría de que al extender el ILP con esquemas sin platino, la respuesta a líneas posteriores con platinos se incrementara, en el estudio OVA-301 se analizó en ambos brazos de tratamiento, el tiempo desde la aleatorización de las pacientes hasta la administración subsecuente de un agente platinado. Los datos encontrados demuestran que la administración de trabectedina y DLP, retrasa la administración de una tercera línea con platinos (9.8 vs 7.9 meses; HR 0.64, 95%IC 0.44-0.93). De manera más importante se encontró que en cuanto a la sobrevida global, las pacientes asignadas a la combinación de tratamiento experimentaron una mayor supervivencia desde el inicio de la terapia subsecuente a platinos (13.3 vs 9.8 meses; HR 0.63; 95%IC 0.41-0.97; p=0.0357). Para confirmar estos resultados, se analizaron las terapias administradas a las pacientes después del término del estudio, así como sus potenciales ventajas en cuanto a la sobrevida. Demostrándose una mejoría significativa en la misma, en las pacientes PPS que recibieron platinos como primera opción de tratamiento después del OVA-301 (9.9 vs 18.6 meses), las pacientes en el grupo de la combinación recibieron quimioterapia de manera posterior (seis meses), comparado con el grupo de DPL sola.
El perfil de seguridad encontrado en las pacientes PPS que recibieron la combinación de trabectedina/ DLP, fue similar al encontrado en la población general.25 A diferencia de las combinaciones basadas en platinos y taxanos, la combinación de DLP/ trabectedina está asociada a una menor incidencia de neuropatía y alopecia, siendo una opción viable para aquellos pacientes que aún no se han recuperado de los efectos adversos de los platinos.
En conclusión, los resultados del estudio OVA-301 demuestran que la trabectedina en combinación con la DLP, mejora en pronóstico de las pacientes con ROC, demostrando un incremento tanto en SLP como en las RR y en la sobrevida global.
Se cree que el beneficio en la sobrevida, en el grupo de pacientes PPS observado en el estudio OVA-301, se debe a una regresión en el patrón de resistencia. Probar esta hipótesis es el objetivo primario del estudio INOVATYON (estudio internacional de pacientes con cáncer de ovario con Yondelis NCT01379989), promovido por el grupo Mario Negri de Ginecólogos Oncólogos (ManGO). Es un estudio fase III en pacientes con ROC, con progresión entre los seis y 12 meses de la última terapia con platinos. Los pacientes se aleatorizaran para recibir DLP/carboplatino vs trabectedina/DLP. El objetivo primario de este estudio será la sobrevida global, los secundarios incluyen SLP, seguridad y calidad de vida. El estudio actualmente se encuentra reclutando pacientes y se estima que se termine para el año 2017.26
¿ NUEVOS AGENTES NO PLATINADOS PARA INCREMENTAR EL ILP: TRABECTEDINA
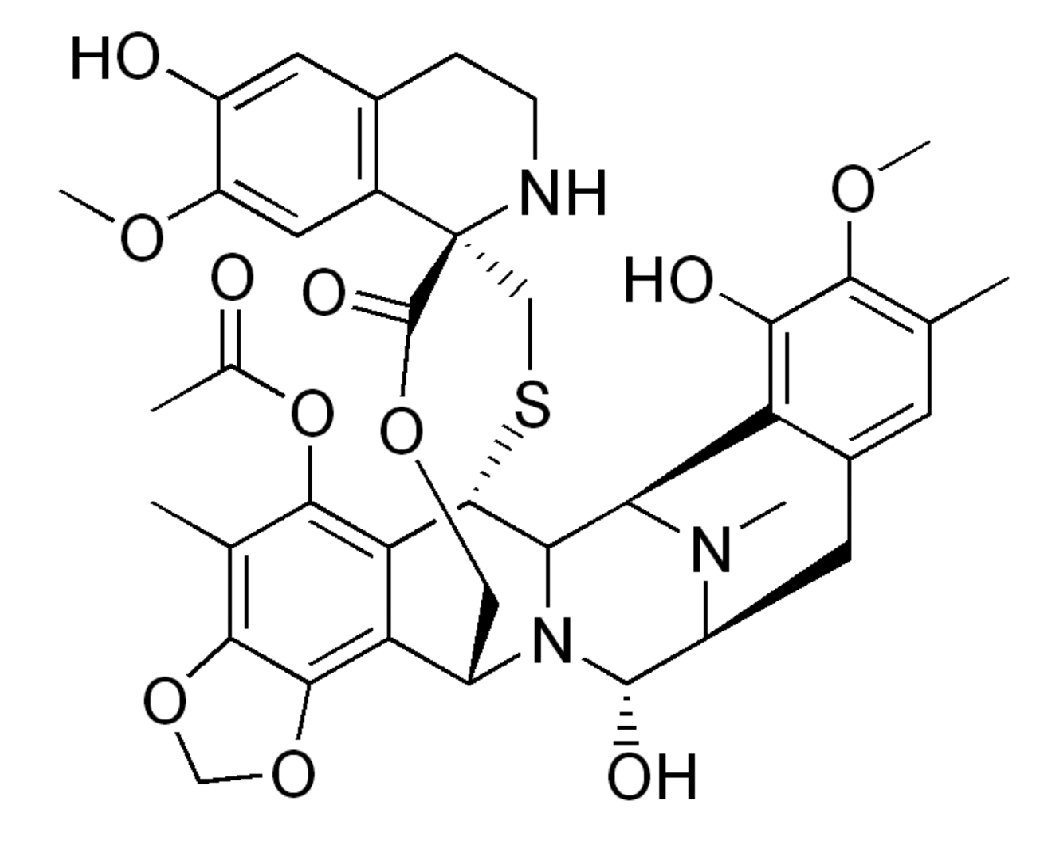
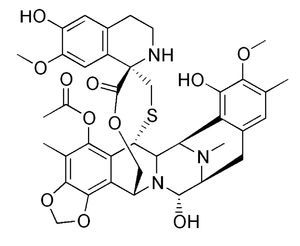
Existen diversos agentes para el tratamiento del ROC, dependiendo la sensibilidad a los platinos (Tabla 2). La trabectedina (Figura 1) es nuevo agente antineoplásico, derivado del tunicado marino del Caribe Ecteinascidia turbinata (Figura 2). En ensayos clínicos demostró ser eficaz para el tratamiento de sarcoma de tejidos blandos (STB) avanzado o metastásico, siendo aprobado en el 2007 como monoterapia después del fallo a la quimioterapia de primera línea con antraciclinas o ifosfamida por la Unión Europea. La combinación con DLP fue aprobada en el 2009, para el tratamiento del ROC platino sensible.
Figura 1. Estructura molecular de la Trabectedina.
Figura 2. Tunicado Marino. Ecteinascidia turbinata.
La trabectedina interactúa con la hélice menor del DNA, formando uniones covalentes en la posición N2 de la guanina, doblando la molécula del DNA hacia su hélice mayor.27 La citotoxicidad de la trabectedina está determinada principalmente, por la acción sinérgica de dos mecanismos de reparación del DNA: 1) la reparación eficiente de la escisión de nucleótidos (NER) y 2) una deficiencia homóloga en maquinaria de reparación de recombinación (HRR). De tal manera, que la trabectedina tiene una actividad disminuida (de dos a ocho veces) en las líneas celulares con deficiencia en NER, mientras que las células deficientes en HRR son extremadamente sensibles a esta droga, la cual ocasiona rupturas de doble cadena al DNA. Datos preliminares indican que la habilidad de la trabectedina, en la modulación de ciertos factores de la inflamación también tiene un rol terapéutico en el tratamiento del cáncer de ovario.28
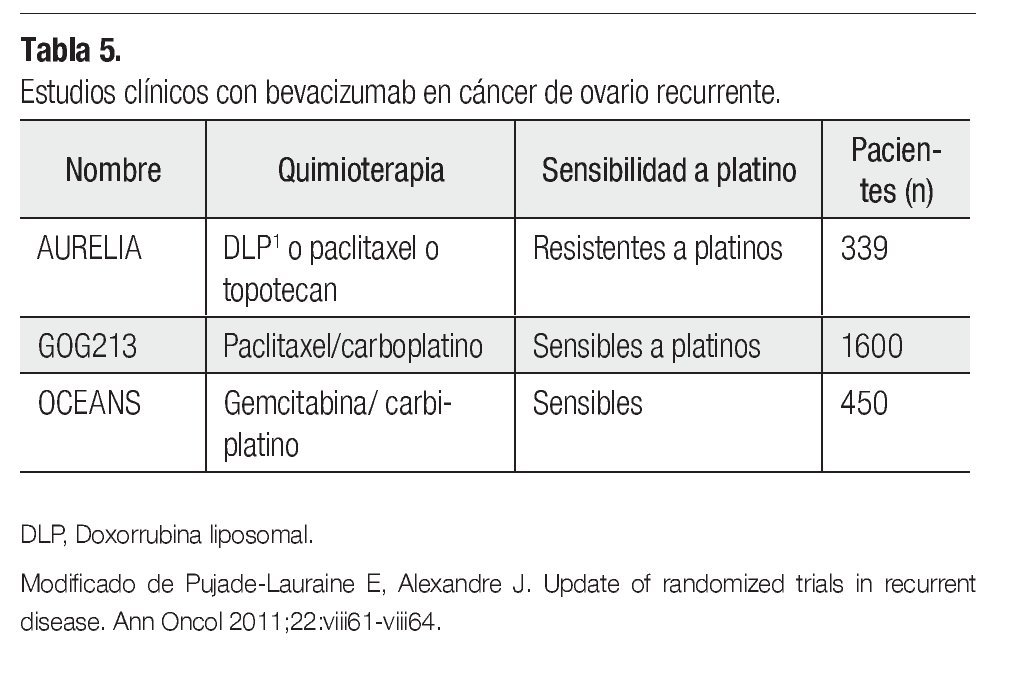
¿ AGENTES ANTIANGIOGÉNICOS EN ROC
Actualmente, en el tratamiento del cáncer de ovario además de nuevos agentes de quimioterapia tales como la trabectedina, existe una fuerte evidencia sobre el beneficio de integrar inhibidores de la angiogénesis de manera estándar, en el tratamiento de pacientes tanto de reciente diagnóstico como en ROC, ya que se ha comprobado que el factor de crecimiento del endotelio vascular (VEGF) es fundamental para la progresión de la enfermedad.29 El bevacizumab (anticuerpo monoclonal que neutraliza el VEGF) ha demostrado actividad en dos estudios clínicos en ROC, tanto en términos de respuesta objetiva (21% en una población mixta, 15% en pacientes resistentes a platinos) como en términos de SLP (40% de los pacientes en la población mixta no mostró progresión a las seis meses, 28% en la población con enfermedad resistente a platinos). Actualmente, este agente está catalogado como de primera línea para enfermedad recurrente por la National Comprehensive Cancer Network (NCCN, por sus siglas en ingles).30,31
En el 2010 se reportaron dos estudios internacionales fase III, sobre el uso de bevacizumab en el tratamiento de primera línea del cáncer de ovario. El estudio GOG0218 y el estudio ICON7,29,31 ambos demostraron que en comparación con aquellas mujeres tratadas únicamente con carboplatino y paclitaxel, las pacientes que recibieron quimioterapia en combinación con bevacizumab seguidas de bevacizumab, tuvieron un incremento estadísticamente significativo en el objetivo primario la SLP.32
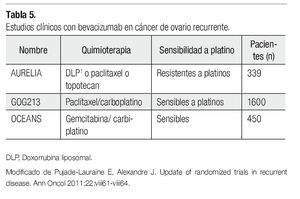
En ROC, se han llevado a cabo hasta el momento tres estudios clínicos con bevacizumab (15 mg/Kg cada tres semanas hasta la progresión), en los cuales se han incluido un total de 2 500 pacientes. Un estudio en pacientes con ROC a platino (AURELIA NCT00976911) y dos en pacientes sensibles (GOG213 NCT00565851 y OCEANS). El estudio OCEANS alcanzó su objetivo primario SLP en 2011. Bevacizumab más carboplatino/ gemcitabina seguido de bevacizumab hasta la progresión, incrementó de manera significativa la SLP comparada con el brazo control de quimioterapia sola (HR 0.484; p<0.0001), con una mediana en la SLP de 8.4 y 12.4 meses, respectivamente.33 Los resultados del estudio AURELIA estarán listos a finales del 2012 (Tabla 5).34
¿ CONCLUSIONES
Actualmente no existe un tratamiento establecido para las pacientes con ROC, lo cual la convierte en una enfermedad incurable y de alta mortalidad. Uno de los principales factores a tomar en consideración es la sensibilidad a los platinos. En las pacientes PPS la respuesta al retratamiento con estos agentes es menor, que en aquellas que cursan con una recaída después de 12 meses de haber recibido una primera línea de tratamiento. La evidencia demuestra que las combinaciones de quimioterapia son superiores a la monoterapia en las pacientes sensibles a platinos, y que además el agregar un inhibidor del VEGF incrementa aún más la SLP.
En el subgrupo de pacientes PPS, el estudio OVA-301 demostró que la combinación de trabectedina/DLP es superior a la DLP sola, en términos de sobrevida global. Se están llevando a cabo más estudios fase III, para demostrar que el prolongar el ILP de una manera artificial con combinaciones no basadas en platinos, revierte la resistencia a los mismos y mejoran las tasas de respuesta en las terapias subsecuentes (MITO-8, INOVATYON).
Correspondencia: Dra. Lucía Martínez-Hernández.
Janssen de México S.de R.L de C.V. Av. Miguel Ángel de Quevedo No. 247, Col. Romero de Terreros. Del. Coyoacán. C.P. 04310. México D.F., México.
Celular: 04455 1686 2019.
Correo electrónico: lmarti41@its.jnj.com