Objetivo: Evaluar las características por ultrasonido (US) de los ganglios axilares en pacientes con diagnóstico de cáncer de mama, y correlacionarlos con los resultados de la Biopsia Aspiración con Aguja Fina (BAAF), guiada por US.
Material y métodos: Se incluyeron pacientes femeninos con antecedente de cáncer de mama, y aquellos con lesiones de sospecha para carcinoma con ganglios axilares clínicamente sospechosos, a las que se les realizó BAAF guiada por US.
Resultados: Se realizaron 150 biopsias en mujeres con rango de edad de 25 a 87 años, media 54.21 años. El 93.67% de las pacientes tenían reporte histopatológico de carcinoma en diversas estirpes histológicas. La mama izquierda fue la más afectada en 56.67% de los casos. La sensibilidad para ganglios sospechosos de malignidad por US fue de 27.27% con una especificidad de 95.05%, VPN 80% y VPP 64.29%. En 14 (9.33%) pacientes el reporte citológico de la BAAF fue muestra inadecuada para diagnóstico.
Conclusión: La BAAF de ganglio axilar guiada por US se debe incluir en la evaluación preoperatoria de las pacientes con cáncer de mama. En nuestra serie, los valores que tuvieron significancia estadística fueron la edad de la paciente, el grosor de la cortical y el diámetro del eje corto del ganglio.
Objetive: To evaluate the characteristics of ultrasound of the axillary nodes in patients with breast cancer and correlate results with fine needle aspiration biopsy (FNAB), guide by ultrasound.
Materials and methods: Patients with a history of female breast cancer and those with lesions of suspicion for carcinoma with clinically suspicious axillary nodes that underwent ultrasound-guided FNA.
Results: A total of 150 biopsies in women with ages ranging from 25 to 87 years, mean 54.21 years, 93.67% of the patients had histopathologic carcinoma in various histologic subtypes. The left breast was the most affected in 56.67% of cases. The sensitivity for nodes suspicious of malignancy by ultrasound was 27.27% with a specificity of 95.05%, NPV 80% and PPV 64.29%. In 14 (9.33%) patients reporting of FNA cytology was inadequate sample for diagnosis.
Conclusion: FNAB of ultrasound-guided axillary node must be included in the preoperative evaluation of patients with breast cancer. In our series the values were statistically significant were the age of the patient, the cortical thickness and diameter of short axis of the ganglion.
¿ INTRODUCCIÓN
Los tres indicadores principales para el pronóstico del cáncer de mama son la presencia de metástasis en ganglios linfáticos, el diámetro máximo del tumor y el grado histopatológico. Las metástasis en ganglios linfáticos dependen del diámetro y la estirpe histológica, a mayor tamaño de tumor y más alto grado histológico, mayor es el riesgo de metástasis en ganglios linfáticos.
Actualmente, hasta el 70% de las pacientes diagnosticadas con cáncer de mama no presentan metástasis ganglionares, haciendo injustificada la disección axilar. Por esta razón, en años recientes la biopsia del ganglio centinela ha tenido una mayor aceptación, como un intento para minimizar el sobretratamiento de las axilas negativas. Por otro lado, el amplio uso de la biopsia de ganglio centinela ha incrementado el costo total del procedimiento debido al requerimiento de la linfocentellografía pre e intraoperatoria (sonda, tiempo quirúrgico prologando, espera para resultado del corte congelado). Como resultado se requiere de un estudio histopatológico amplio que consume mucho tiempo, con hasta 20% de falsos negativos en los cortes congelados, que revelen micrometástasis hasta la evaluación histopatológica final, por lo tanto, se necesita de un segundo procedimiento quirúrgico para realizar la disección ganglionar axilar.
La selección exacta de pacientes con alta probabilidad de tener involucro ganglionar, debe ser crucial en la optimización de la biopsia del ganglio centinela. El examen clínico de la axila es poco sensible para la correcta estadificación de los ganglios linfáticos, se ha reportado una sensibilidad de 33% a 68% con falsos positivos hasta 30% a 40%.1,2
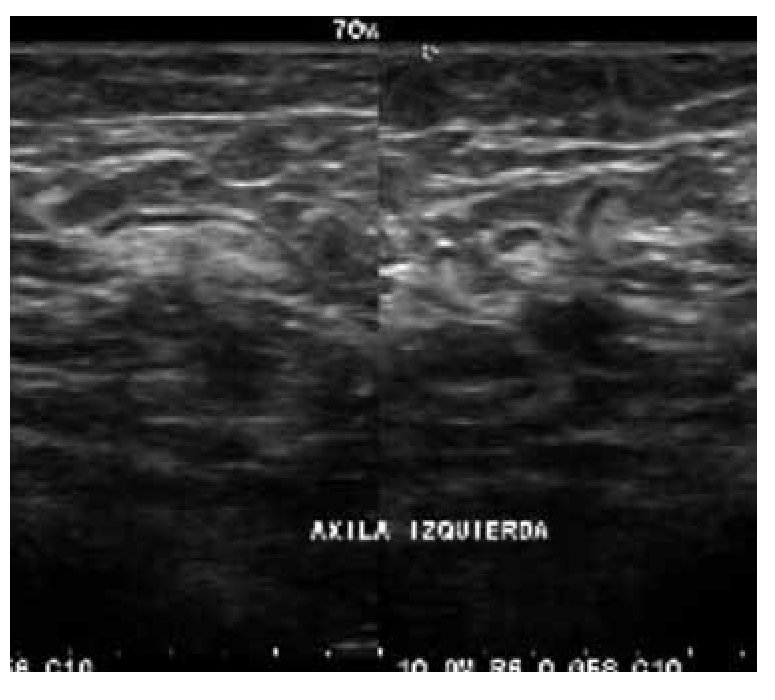
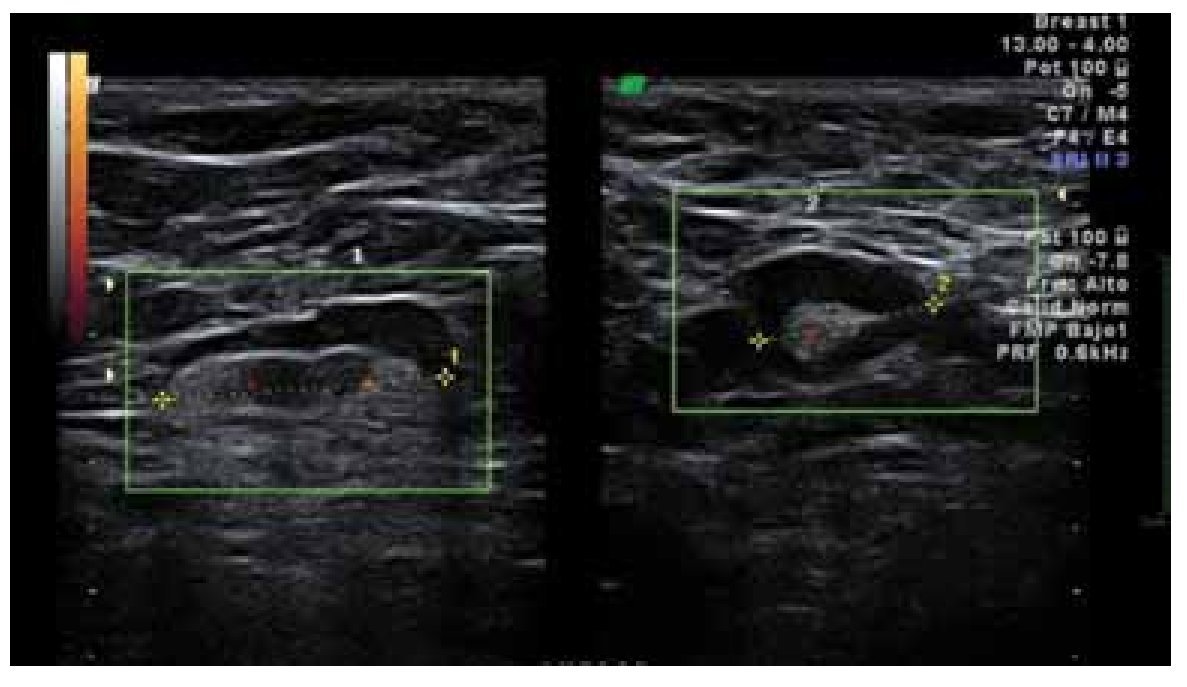
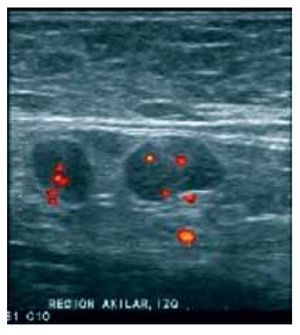
El ultrasonido (US) de la axila proporciona una mejor evaluación preoperatoria del estado ganglionar. En manos expertas, el US axilar casi siempre permite la identificación de ganglios linfáticos, la evaluación incluso de ganglios pequeños y una profunda evaluación de la morfología nodal (Figuras 1 y 2). Con los criterios ultra-sonográficos se puede reconocer un ganglio metastásico (Figura 3), el US axilar y su asociación con la biopsia axilar guiada por US, puede impactar significativamente en la elección del tratamiento quirúrgico.3
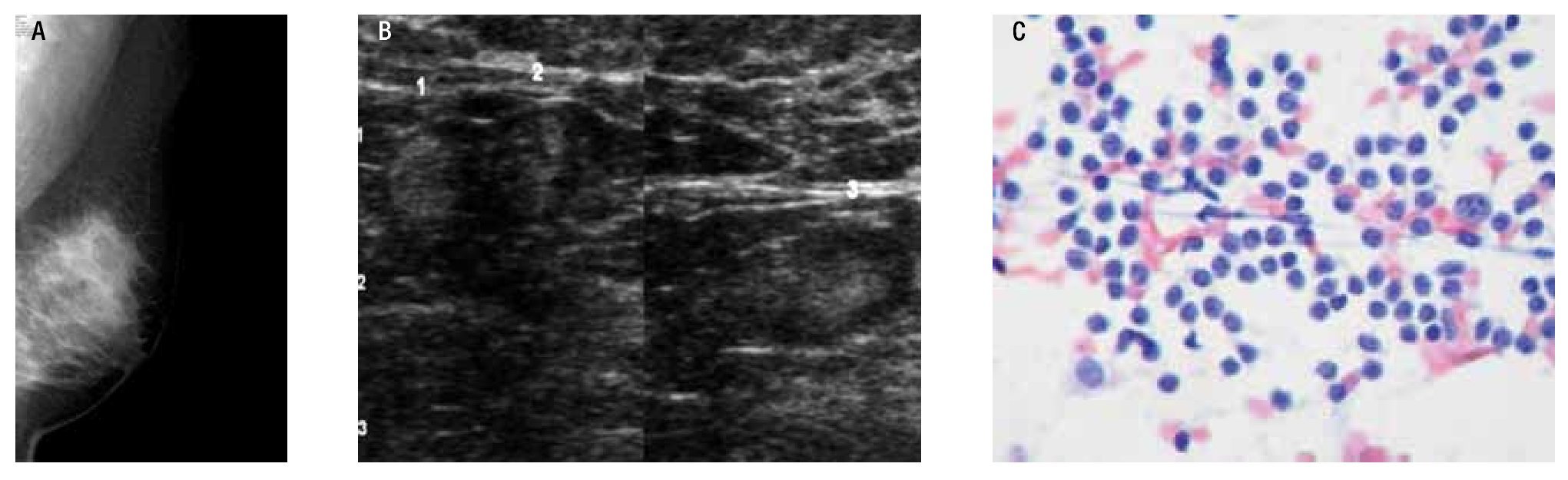
Figura 1. Ganglio axilar normal: Ganglio de morfología arriñonada o elíptica, hilio central y cortical delgada.
Figura 2. Ganglio axilar sospechoso: Morfología arriñonada, el hilio es central, la cortical esta engrosada de manera difusa, aunque pueden presentarse en casos de hiperplasia linfoide, no es posible descartar micrometástasis.
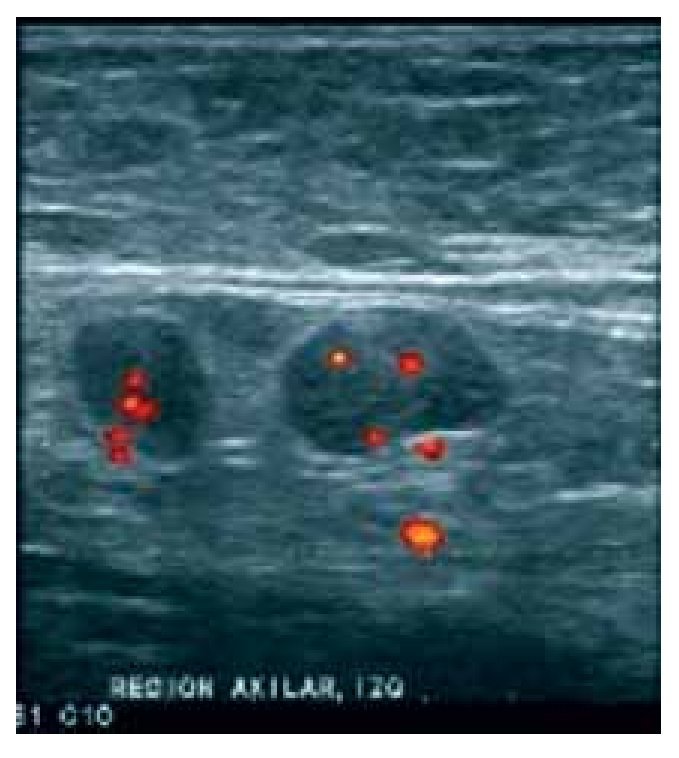
Figura 3. Ganglios sospechosos de malignidad: Ganglio redondo, con engrosamiento excéntrico de su cortical y desplazamiento periférico del hilio. Con el modo Doppler de potencia, se identifica vacularidad mixta.
Los pacientes con ganglios positivos diagnosticados por biopsia o altamente sospechosos por US, deben ir directo a la disección ganglionar axilar total, ahorrando dinero y tiempo.
Por lo anterior, se planteó el siguiente problema: ¿cuál es la utilidad de la evaluación por imagen de las características de los ganglios linfáticos axilares?, y ¿cuál es el valor de la biopsia aspiración con aguja fina (BAAF) guiada por US para la estatificación en pacientes con cáncer de mama, según la experiencia en el Servicio de Radiología e Imagen del Instituto Nacional de Cancerología?
El objetivo general de este estudio fue evaluar las características por US de los ganglios axilares, en pacientes con diagnóstico de cáncer de mama y correlacionarlos con los resultados de la BAAF guiada por US.
¿ ANTECEDENTES
El involucro axilar es un factor pronóstico esencial y determinante en el tratamiento de pacientes con cáncer. La disección axilar ganglionar ha sido el estándar de referencia para establecer el involucro ganglionar, sin embargo, del 40% a 70% de los paciente con cáncer de mama tienen ganglios axilares histopatológicamente negativos y se han reportados complicaciones hasta en el 80% de las pacientes sometidas a este procedimiento, éstas complicaciones incluyen desde seromas, entumecimiento, limitación de los movimientos del hombro hasta linfedema.4,5
Para reducir la alta morbilidad asociada con la disección ganglionar, se han empleado técnicas de biopsia menos invasivas como alternativa para la disección axilar ganglionar total. Una opción potencial para la linfadenectomía es la resección del ganglio centinela. El primer paso del drenaje linfático del tumor primario está limitado a un grupo de ganglios linfáticos regionales. Se han utilizado tinciones, agentes de contraste radiográfico y marcadores radioactivos para identificar tales ganglios. Hace más de 20 años, Cabañas propuso que el primer ganglio linfático que recibe el drenaje de un tumor se denominaría ganglio centinela, el cual puede ser resecado mediante cirugía no extensa y examinado para determinar si es necesario realizar una linfadenectomía extensa.4
En 1992, Morton y colaboradores utilizaron azul patente para identificar el ducto linfático que drenaba el ganglio centinela en pacientes con melanoma.5
Alex y Krag describieron la localización directa de los ganglios centinelas con trazadores radioactivos y gamma sonda, demostrando en un modelo animal que el trazador radioactivo y el azul patente eran igualmente efectivos en la localización de los ganglios.4,5
La biopsia del ganglio centinela es una técnica invasiva y está asociada con radiación ocasionada por el marcador radioactivo que facilita su identificación. La resonancia megnética (RM), tomografía computada (TC), US y mastografía permiten la visualización de los ganglios linfáticos, que pueden ser no palpables en la exploración física.6 Con estas técnicas de imagen, la evaluación preoperatoria de las metástasis a los ganglios linfáticos axilares está basada principalmente en la dimensiones del ganglio, tales como su diámetro transverso máximo o el índice del diámetro longitudinal máximo y diámetro transverso máximo, por lo que estas técnicas son limitadas. Además de los criterios morfológicos (forma, engrosamiento cortical, desplazamiento o ausencia del hilio graso), los patrones de reforzamiento y los ganglios axilares agrupados son parámetros importantes
Es poco frecuente la identificación de los ganglios axilares anormales, en mamografía sin anormalidades asociadas en la mama. En el léxico de BI-RADS (Breast Imaging Reporting and Data System), se hace referencia a los ganglios axilares como "hallazgos asociados".7 No existen lineamientos claros para el reporte y tratamiento de los ganglios axilares anormales identificados en mamografía, en ausencia de anormalidades en la mama. Los criterios para clasificar a un ganglio linfático como anormal por mamografía no son consistentes, algunos de estos criterios propuestos para ganglios linfáticos malignos incluyen: tamaño mayor de 2 cm, forma redonda e irregular, ausencia de hilio graso e incremento en su densidad.8 En mamografía, los ganglios axilares normales son menores de 2 cm y con hilio radiolúcido. No es posible diferenciar linfadenopatía metastásica o linfoma por mamografía. En las proyecciones estándar se observa sólo la parte inferior de la axila, durante el posicionamiento mamario los ganglios axilares pueden ser colocados fuera del campo de la imagen mamográfica, por lo que la mamografía no se considera un método exacto para la evaluación imagenológica del ganglio axilar.
En un estudio retrospectivo realizado en The Woman's Hospital of Texas se incluyó a pacientes subsecuentes con ganglios linfáticos sospechosos de anormalidad, identificados mediante screening o mamografía diagnóstica BI-RADS 1 y 2, y a quienes se les realizó US observando ganglios anormales. El autor principal revisó las características mamográficas de los ganglios linfáticos, que fueron examinados mediante US. Se incluyeron todos los ganglios de aspecto sospechoso.8.
Un incremento en la medición del eje largo mayor de 100% fue considerado un crecimiento sustancial en el intervalo del estudio. Los hallazgos sonográficos anormales de los ganglios linfáticos fueron los siguientes: tamaño mayor de 2 cm, ausencia de hilio graso, apariencia sonográfica anormal de la corteza, la cual incluyó engrosamiento focal o difuso o apariencia anormal de la ecotextura, forma redonda. La medición del eje largo fue usada para determinar el tamaño del ganglio linfático. Se revisó el expediente clínico de los pacientes para evaluar los hallazgos de la exploración física e identificar cualquier antecedente de anormalidad asociada, se incluyeron los pacientes que mostraban cualquiera de las anormalidades mencionadas.8
El US de la axila puede proporcionar una mejor evaluación preoperatoria del estado ganglionar. En manos expertas, el US axilar casi siempre permite la identificación de ganglios linfáticos, incluso de ganglios pequeños y una extensa evaluación de la morfología nodal. Con los criterios ultrasonográficos se puede reconocer un ganglio metastásico, y su asociación con la biopsia guiada por US, puede ser determinante en el tratamiento quirúrgico.3
Las biopsias por US a diferencia de las realizadas por estereotaxia, no utilizan radiación ionizante. Además, el US provee acceso a todas las áreas de la mama, independientemente del tamaño de la mama, así como también a los ganglios linfáticos regionales (axilares, infraclaviculares, supraclaviculares, y mamarios internos) y ganglios intramamarios. En general, una lesión que puede ser observada por US es accesible para una biopsia guiada por US.9
Una de las principales ventajas del US es que permite la monitorización en tiempo real de la lesión blanco y la aguja. La monitorización en tiempo real es particularmente importante en el muestreo de lesiones sólidas como fibroadenomas o lesiones móviles, con la manipulación de la aguja durante la biopsia.
La BAAF guiada por US ha sido utilizada en varios centros para biopsiar lesiones de mama sospechosas (especialmente, para documentar la evidencia de enfermedad multifocal y multicéntrica) y hace biopsia de los ganglios linfáticos regionales sospechosos (especialmente en la región axilar). La BAAF es altamente operador dependiente, el éxito de los programas de BAAF requiere de operadores hábiles que realicen las aspiraciones, preparación apropiada de las muestras y un equipo de expertos en citología. Si un experto citopatólogo está presente al momento de la BAAF puede determinar si la muestra es o no adecuada, y la interpretación preliminar puede ser emitida antes que el paciente abandone la sala del procedimiento.10.
A pesar de que la BAAF es más barata y consume menor tiempo que la biopsia guiada con aguja de corte, ha tenido poca aceptación en los Estados Unidos de Norte América, la BAAF puede resultar en muestra insuficiente y las técnicas con aguja de corte proveen mas material con mayor preservación de la arquitectura de la lesión blanco.
Boerner y colaboradores revisaron los hallazgos citológicos de 1885, BAAF guiadas por US de 1 639 pacientes. Los especímenes citológicos fueron correlacionados con especímenes patológicos en 851 casos y con un seguimiento clínico de dos años en 127 de 274 pacientes, los cuales tuvieron lesiones sólidas benignas. Basándose en el seguimiento histológico y clínico, la BAAF tuvo una sensibilidad del 97.1% y una especificidad del 99.1% (cuando se consideraron diagnósticos definitivamente benignos o malignos). El índice de falsos negativos de 3.7% se atribuyó al error de muestreo y las características de las lesiones. El índice de falsos positivos de 0.68% resultó de el error en la interpretación de las lesiones con epitelio proliferativo, tales como fibroadenomas, cicatrices radiales e hiperplasia epitelial. Los investigadores concluyeron que los diagnósticos de benignidad e inadecuada BAAF, debería ser correlacionados con los hallazgos clínicos y de imagen. En los casos en que no correlacionara deberían someterse a biopsia guiada con aguja de corte o escisión.11
Liao y colaboradores realizaron un estudio retrospectivo, evaluando 108 BAAF guiadas por US de lesiones sospechosas por US, no palpables con un sistema de reporte probabilístico. De 108 BAAF fueron diagnosticadas como positivas (n=32), sospechosas (n=8), atípicas (n=11), benignas (n=55) e insatisfactorias (n=2) cuando se compararon con 61 especímenes quirúrgicos. El seguimiento clínico y por imagen se realizó en los 47 casos restantes. Todas las BAAF positivas mostraron carcinoma en su histología. Los ocho casos sospechosos resultaron en cinco carcinomas, dos fibroadenomas y una lesión papilar. La biopsia después de las BAAF con resultado de atipia demostró cuatro carcinomas, tres fibroadenomas y dos lesiones papilares. Las 10 biopsias reportadas como benignas fueron cambios fibroquísticos. En dos casos con hallazgos sonográficos sospechosos y BAAF no satisfactoria, la histología demostró carcinoma lobulillar.12
El valor predictivo positivo (VPP) para la BAAF fue de 100%, cuando la lectura citológica inicial fue positiva. Para BAAF sospechosas, el VPP fue de 63%, para resultado de atipia de 36%, para las lesiones clasificadas como benignas fue de 0%.12
La BAAF de ganglio axilar guiada por US ha demostrado ser un método exacto con alta sensibilidad (89-98%), especificidad (95-100%) y exactitud (95-97%), ya que proporciona una información más certera que la obtenida por la biopsia a ciegas. Esto es porque permite identificar la punta de la aguja y la evaluación integral del ganglio linfático, y no existe riesgo de punción accidental de estructuras vitales. Con la BAAF guiada por US se pueden detectar metástasis en ganglios linfáticos, cuando la exploración física y el resto de las modalidades de imagen fueron negativas.13-18
¿ MATERIAL, PACIENTES Y MÉTODOS
Para este estudio se incluyeron pacientes subsecuentes de la consulta de Tumores Mamarios del Instituto Nacional de Cancerología (INCan), las cuales tenían antecedente de cáncer de mama o bien, lesiones de sospecha de cáncer mamario con ganglios axilares clínicamente o por imagen sonográfica de sospecha, a las cuales se les realizó BAAF guiada por US y contaban con estudios de mastografía y US previos.
ANÁLISIS DE LA IMAGEN
Los hallazgos radiológicos incluyeron las características por US de los ganglios axilares ipsilaterales a la lesión mamaria, y los contralaterales en los casos de pacientes ya tratadas, y que están en seguimiento en el Instituto.
Los estudios de US se realizaron por varios operadores: técnicas radiólogas especialistas en US mamario, médicos radiólogos adscritos y médicos residentes del posgrado en Radiología Oncológica, utilizando tres equipos dos LOGIC 5® y 7 EXPERT® (General Electric) y un VOLUSON 730 EXPERT® (General Electric), con transductores lineales de alta frecuencia (7.5 a 12 MHz).
En el análisis ultrasonográfico se determinó el tamaño, la longitud del eje largo y el eje corto, morfología (alargada, redonda, oval o irregular), la ecogenicidad (hipoecoico o anecoico), aspecto del hilio (central, excéntrico o sin hilio), grosor de la corteza (normal, engrosamiento focal/excéntrico o difuso/concéntrico), patrón de vascularidad (no evaluado, avascular, hiliar, periférico, central o mixto). Los criterios ultrasonográficos que utilizamos para reportar un ganglio como sospechoso incluyeron morfología redonda, pérdida del hilio o hilio estrecho, engrosamiento focal o difuso de la corteza e hipoecogenicidad de la misma. Se describió el patrón vascular en los casos en los que se utilizó doppler. Se consideraron como sospechosos aquellos ganglios que reunieran dos o más criterios, indeterminados sólo un criterio positivo y de aspecto benigno a los que no mostraron alteración alguna (Figuras 2 y 3).
PROTOCOLO DE TOMA DE BIOPSIA (BAAF)
Antes de iniciar la biopsia guiada por US, se explicó el procedimiento al paciente, se obtuvo el consentimiento informado, se discutieron los riesgos y se realizó un rastreo cuidadoso, además se correlacionaron los hallazgos de US y mastografías previas.
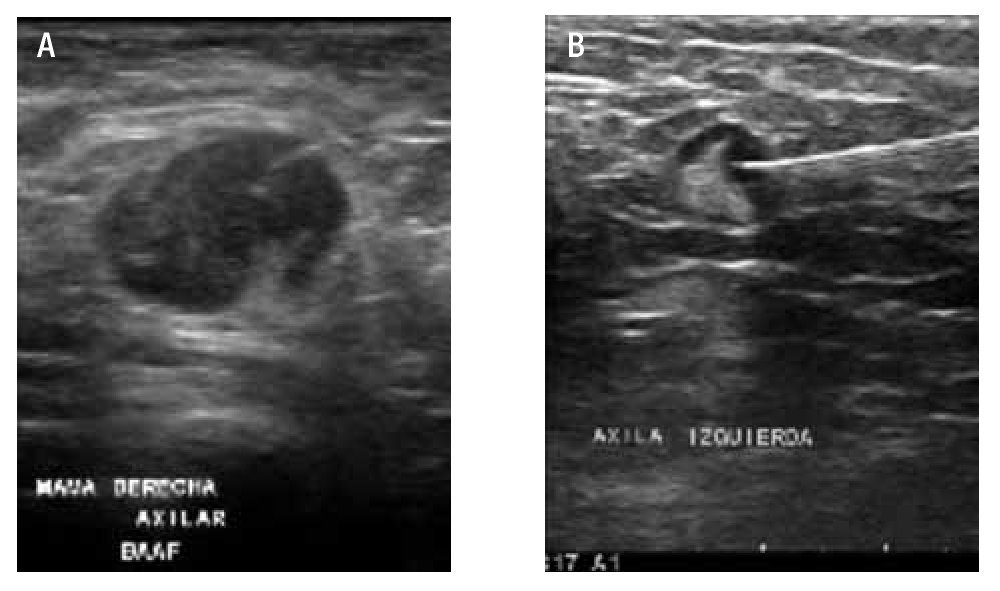
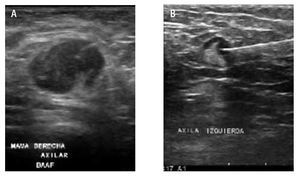
El paciente se posicionó de forma tal que el operador pudiera acceder a la lesión blanco. La piel de la región se limpió con solución de yodopovidona. Con guía ultrasonográfica se introduce y se aspira con la aguja (BD Yale 20G x 32 mm, ultrafina; BD Precision Glide 21G x 32 mm o TERUMO 23G x 25 mm) conectada a una jeringa de 20 cc, realizando en promedio dos punciones de 20 pases cada una a través del ganglio, poniendo énfasis a las zonas donde la corteza muestra mayor grosor y tratando de evitar áreas con mayor vascularidad, a fin de tener una muestra adecuada (Figura 4).
Figura 4. Toma de BAAF axilar. A) Ganglio redondo, con engrosamiento cortical, hilio excéntrico, márgenes mal definidos en probable relación con extensión extracapsular. Durante la toma de la BAAF del ganglio, es importante observar el trayecto y la punta de la aguja, de esta forma se asegura una toma de muestra adecuada. B) Ganglio axilar sospechoso de malignidad por engrosamiento focal de la cortical, la toma de BAAF debe ser dirigida hacia este sitio.
Todo el procedimiento se realizó en presencia de un citopatólogo (residente de posgrado en Citología Oncológica), quien realizó un frotis y fijó la muestra, posteriormente la procesó en el laboratorio de citología y una vez que se nos informó que la muestra fue adecuada para diagnóstico, se dio por concluido el procedimiento.
¿ ANÁLISIS ESTADÍSTICO
Los resultados fueron analizados utilizando métodos estadísticos descriptivos, prueba t de student para muestras independientes en las variables cuantitativas y ji cuadrada para k muestras en las categóricas. Se calculó la sensibilidad y especificidad de los hallazgos por imagen sonográfica, en correlación con los resultados definitivos de citología.
¿ RESULTADOS
Entre enero y julio del 2011, se realizaron 150 biopsias guiadas por US en pacientes subsecuentes de la consulta de Tumores Mamarios del INCan, las cuales tenían el antecedente de cáncer de mama tratado y están en control o bien, que presentaban lesiones de sospecha para cáncer con ganglios axilares clínicamente sospechosos, a las que se les realizó BAAF y biopsia con aguja de corte en los casos de lesión sospechosa en la mama, con un rango de edad de 25 a 87 años, con una media de 54.21 años.
Los diagnósticos de base fueron el 92.67% (139 casos) carcinoma en sus diferentes estirpes: lobulillar infiltrante, canalicular infiltrante, papilar, mucinoso, mixto (lobulillar y canalicular) y dos casos de enfermedad de Paget, tumor filodes en 1.33% (dos casos), mastitis granulomatosa en el 2% (tres casos), fibroadenoma hialinizado en el 2.67% (cuatro casos) y cambios fibroquísticos en el 1.33% (dos casos). La mama derecha estaba afectada en 43.33% de los casos (65/150), y la izquierda en 56.67% (85/150). El diagnóstico de envío fue clínico en 10% de los casos (15/150) y radiológico en el 90% (136/150). Es importante mencionar que el 78.67% de las biopsias efectuadas corresponden a pacientes con carcinoma ya tratado previamente, y que han estado en control en el Instituto, las cuales mostraron modificaciones en los ganglios axilares al momento de realizar el seguimiento y enviándose en el 100% de los casos a biopsia para descartar micrometástasis.
Las características sonográficas de los ganglios biopsiados fueron: medición del eje largo de 1.3 a 31 mm (media de 12.15) y en el eje corto de 2 a 19 mm (media de 6.71). En cuanto a la forma del ganglio, se encontró que en el 71.33% (107/150) fue ovalado, en el 12.67% (19/150) fue alargado y redondo en el 16% (24/150). En cuanto a la ecogenicidad el 98% (147/150) fue hipoecoica, y en el 2% (3/150) anecoica. Se analizó el engrosamiento de la cortical, mostrando un engrosamiento focal en el 23.33% (35/150) y difuso en el 76.67% (115/150). Asimismo, se analizó la localización del hilio, encontrando que fue central en el 63.33% (95/150), excéntrico en el 11.33% (17/150) y sin hilio en el 25.34% (38/150). En cuanto a la vascularidad de los ganglios, el 23.33% (35/150) fue hiliar, en el 2% (3/150) central, en el 14% (21/150) mixta, en el 7.33% (11/150) periférica y en el 53.34% (80/150) avascular.
Al correlacionar los hallazgos por US y los resultados definitivos de la citología, obtuvimos en 101 de los casos (67.33%) un diagnóstico de hiperplasia linfoidea, en 35 casos (23.33%) fueron positivos para metástasis y en 14 casos (9.33%) se reportaron como muestras inadecuadas para diagnóstico. En cuanto a las muestras inadecuadas para diagnóstico, se determinó que fueron condicionadas por el aspecto técnico dado que los ganglios biopsiados en estos casos eran muy pequeños, menores a 5 mm, o bien tenían una localización muy profunda de difícil acceso. En ocho casos de los 14 se realizó cirugía axilar, encontrando en cuatro casos carcinoma metastásico y en cuatro casos hiperplasia linfoidea. En los seis casos restantes, se volvió a revisar al paciente por US y en esta segunda evaluación, se decidió dejar en vigilancia dadas las modificaciones de la imagen de los mismos (Figuras 5 y 6).
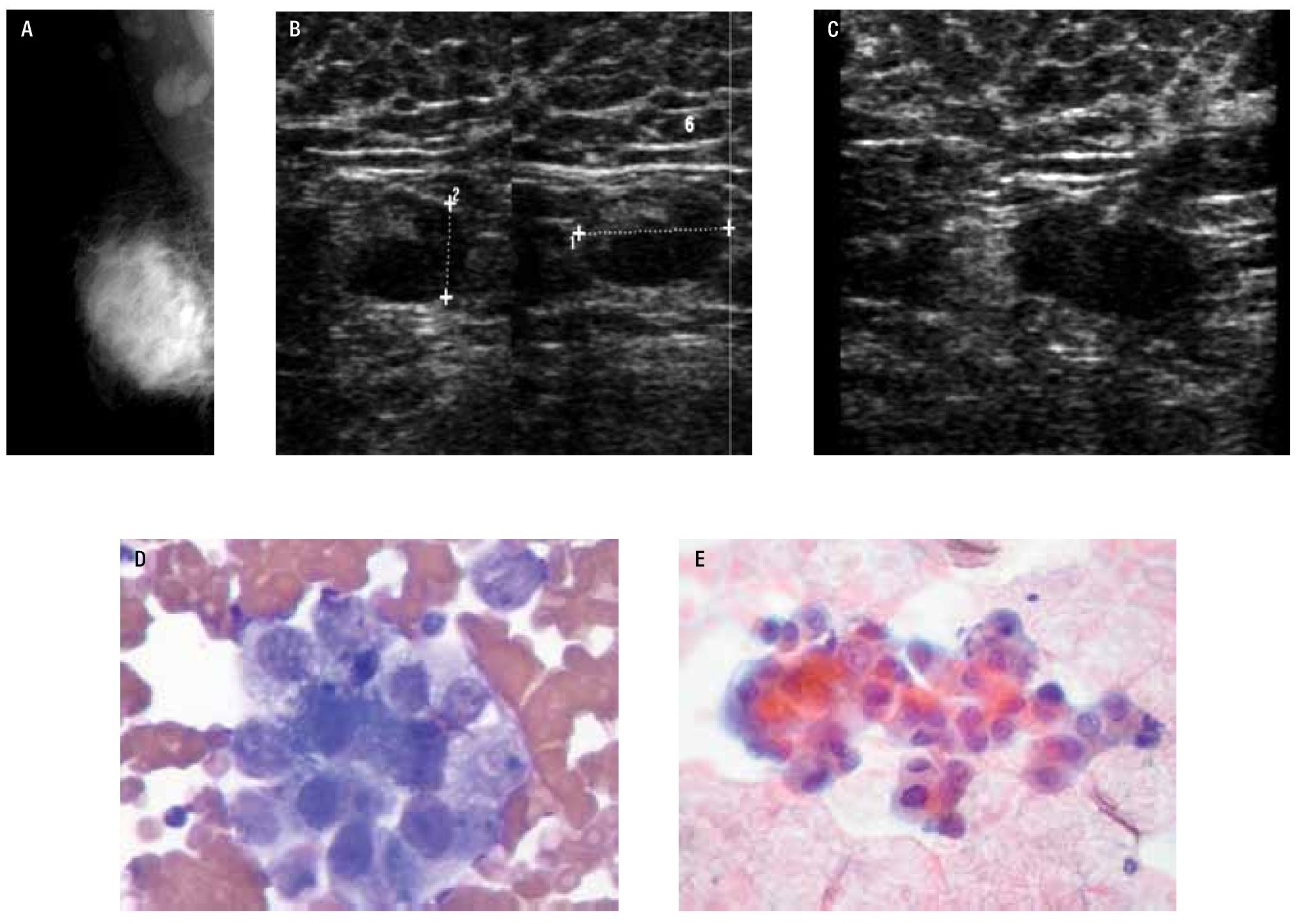
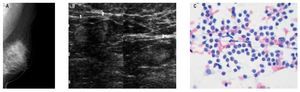
Figura 5. A) y B) Femenino de 56 años, cáncer de mama derecha (canalicular infiltrante, SBR9). Ganglios axilares izquierdos sospechosos por clínica. En la mamografía y US conservan su morfología, hilio y características normales de su corteza. C) Hiperplasia linfoide reactiva: constituida por linfocitos maduros, células plasmáticas y macrófagos.
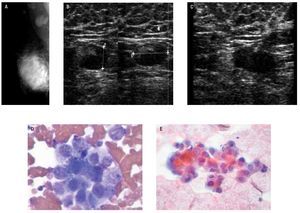
Figura 6. Paciente femenino de 37 años de edad con cáncer de mama derecha (CCI, SBR 9), ganglios axilares indurados al examen físico. A) y B) En la mastografía se identifican dos ganglios de 22 mm de diámetro, densos, hilio estrecho, sospechosos, se demuestra por US en engrosamiento excéntrico de la corteza. C) BAAF guiada por US de ganglio axilar derecho. D) y E) Carcinoma ductal metastásico: grupo de células en forma suelta, con pérdida de la relación núcleo citoplasma, cromatina granular y nucléolo prominente (Técnica diff-quik, papanicolaou, v10x y 40x).
¿ DISCUSIÓN
Los ganglios axilares actúan principalmente como un filtro entre la mama y el sistema venoso. Se evalúan buscando el borde anterior del pectoral mayor, mientras que el músculo pectoral menor es el marcador más importante para la evaluación de los niveles ganglionares de la axila. Los ganglios axilares inferiores (nivel 1) están situados en forma lateral a los ganglios axilares medios (nivel 2), que corren justo por detrás de éstos, y los ganglios axilares superiores (nivel 3, infraclaviculares) están ubicados en forma medial y superior al borde superomedial del pectoral menor. Es posible identificar ganglios normales en el nivel 1 en la mayoría de los pacientes, sin embargo, los localizados en los niveles 2 y 3, al igual que los ganglios de Rotter, son difíciles de demostrar a menos que se encuentren anormalmente aumentados de tamaño.
Los ganglios linfáticos están compuestos de una corteza externa hipoecoica y una médula, central hiperecoica. La apariencia hiperecoica de su médula se debe a la presencia de una densa red de sinusoides y conductos linfáticos. Las innumerables interfases entre estos sinusoides, muchas de las cuales son perpendiculares al haz del US, son la causa de su apariencia ecográfica. Por otro lado, la composición homogénea de los folículos linfoides incrementa la apariencia hipoecoica de la corteza. Con los eventos repetidos de inflamación, infección e incluso con la edad disminuye la respuesta del sistema inmune, por lo que los ganglios linfáticos tienden a atrofiarse, la corteza se adelgaza y su ecogenicidad se incrementa. Otro proceso que es más evidente con la edad es el reemplazamiento graso, que generalmente progresa más rápido que la atrofia, produciendo elongación del ganglio linfático. Los ganglios normales generalmente tienen morfología oval, su corteza muestra un grosor uniforme y es menor que la mitad del diámetro del hilio, su patrón de vascularidad es hiliar o aparentemente avascular. La modalidad Power Doppler o AngioDoppler tiene mayor sensibilidad para demostrarla, ya que el flujo es lento en estas estructuras.
El tamaño de los ganglios había sido utilizado como indicador de malignidad, sin embargo su valor es limitado. En la axila se utiliza el diámetro mayor o longitudinal (en lugar del diámetro transverso máximo para otras regiones del cuerpo), pero tampoco ha demostrado ser un indicador útil para metástasis.15,19 En nuestro estudio, el incremento en tamaño comparando los estudios previos se utilizó únicamente como predictor de respuesta el tratamiento, ya que si bien es cierto que los ganglios metastásicos tienden a aumentar en tamaño, los cambios en tamaño son utilizados para monitorizar el tratamiento.
Los ganglios metastásicos y linfomatosos generalmente toman un aspecto redondo, a diferencia de los ganglios reactivos que usualmente son ovales. En la mayoría de las enfermedades inflamatorias a excepción de las de tipo granulomatoso, el involucro de los ganglios es difuso u homogéneo preservando en la mayoría de los casos su morfología oval, a diferencia de los ganglios con involucro tumoral en los que la afección de la corteza es inicial, mostrando un aspecto redondo y asimétrico.
La detección sonográfica del hilio se ha relacionado con benignidad, la infiltración de la corteza en enfermedades inflamatorias activas y procesos tumorales produce estrechamiento y finalmente, desaparición del hilio. Vassallo y colaboradores20 reportaron que en el 84% a 94% de los ganglios benignos, el hilio era ecográficamente normal y en los ganglios malignos 76% a 96%, el hilio se reportó como ausente. En nuestro estudio, el 51.43% de los ganglios metastásicos presentaron anormalidades del hilio por US, de éstos en el 16.67% el hilio fue excéntrico y en el 83.33% hubo ausencia del hilio. Sin embargo, en los casos con reporte citológico de hiperplasia linfoidea, se observó alteraciones del hilio en un 30% de los casos, en donde el 40% mostró hilio excéntrico y en 60% hilio ausente. Feu16 confirmó que en casos tempranos puede conservarse el hilio, en nuestro estudio el 48.57% de los ganglios metastásicos conservaron su hilio y en los casos de hiperplasia linfoidea, se observó en el 70.29% de los casos.
La evaluación de la morfología nodal se enfoca principalmente en las características de la corteza, las metástasis afectan primero los sinusoides subcapsulares y corticales, afectando al ganglio desde el interior de la corteza. Los depósitos tumorales en los sinusoides subcapsulares tienden a producir lobulaciones en el borde externo del ganglio, los depósitos en los sinusoides profundos de la corteza tienen a crear indentaciones en el mediastino. Esto produce un engrosamiento excéntrico de la corteza en forma temprana y en los estados avanzados es evidente el engrosamiento difuso, cuando existe un engrosamiento severo el mediastino es desplazado fuera del ganglio.15-22
El engrosamiento concéntrico de la corteza ha sido descrito en el involucro tumoral del ganglio, sin embargo, también puede presentarse en los ganglios benignos con folículos linfáticos periféricos hipertrofiados.
Vassallo y colaboradores19 concluyeron que este hallazgo se presenta hasta en el 70% de los ganglios malignos y en 30% de los benignos, mientras que la serie de Esen y colaboradores,1 el 48% se presentó en ganglios benignos. En nuestro estudio, se obtuvo en los casos positivos para metástasis que en el 22.85% mostraron engrosamiento focal de la cortical y en el 77.15% un engrosamiento difuso. No obstante, en los casos reportados con hiperplasia, el engrosamiento focal se encontró en el 24.75% y engrosamiento difuso en el 75.25%, lo que demuestra que esta característica en nuestro estudio no es significativa, ya que se observa con similitud de porcentaje en ambos casos.
En ningún ganglio se demostraron microcalcificaciones, aunque éstas se ven con mayor frecuencia en metástasis por carcinoma medular o papilar de tiroides hasta en un 50% a 69%. En pacientes con cáncer de mama representan un indicador con alta especificidad para malignidad, los ganglios también pueden llegar a calcificarse después de la quimioterapia y radioterapia.
En cuanto a la vascularidad del ganglio, los ganglios metastásicos presentan frecuentemente un patrón de vascularidad periférico, central o mixto, especialmente los vasos transcapsulares son altamente específicos para metástasis. En nuestro estudio, en los casos positivos se encontró que el 20% mostró vascularidad hiliar, en el 14.29% fue mixta, en el 17.14% fue periférica y ausente en el 48.57%. Sin embargo, en los casos de hiperplasia se observó que se obtuvieron porcentajes similares: 25.74% hiliar, 2.97% central, 14.85% mixta, 4.95% periférica y 51.49% ausente.
No se presentaron complicaciones de ningún tipo en las BAAF guiadas por US, lo que va de acuerdo con la literatura médica, demostrando que éste es un método seguro para valorar las metástasis ganglionares del carcinoma mamario.
En 14 (9.33%) pacientes, el reporte citológico de la BAAF fue muestra inadecuada para diagnóstico, esta cifra concuerda con la reportada por Sapino y colaboradores,23 que en su serie obtuvieron muestras inadecuadas hasta en el 10%, aunque se ha reportado un rango de 4% a 15% en las diversas literaturas. En nuestra serie, en los casos que se reportó muestra insuficiente, los ganglios biopsiados fueron menores a 5 mm y aquellos que estaban entre 5 y 10 mm, mostraban localización profunda, lo que es una limitante parcial para la obtención de la muestra.
En múltiples series20-26 se ha demostrado que la sensibilidad, especificidad y exactitud del US para detectar malignidad en ganglios axilares es de 36% a 73%, 63% a 100% y 67% a 73%, respectivamente, VPP de 61% a 86% con valor predictivo negativo (VPN) de 63% a 72%. En nuestra serie obtuvimos una sensibilidad de 27.27%, con una especificidad de 95.05%, VPN 80% y VPP 64.29 %. Estas cifras confirman que los valores están determinados por la experiencia y habilidad del radiólogo para explorar la axila. En nuestra Institución los estudios fueron realizados por 12 operadores diferentes, consistentes en técnicas radiólogas, residentes de radiología oncológica y médicos adscritos, otra limitación de nuestro estudio fue que no se pudo correlacionar en todos los casos el resultado citológico con el resultado histopatológico de la cirugía, que hubiera sido útil para determinar la exactitud diagnóstica del procedimiento analizado (BAAF guiada por US), esto tendrá que ser evaluado en otra serie.
¿ CONCLUSIÓN
La evaluación mastográfica de los ganglios axilares no es posible en todos los casos, hasta en el 19% no se demuestran ganglios, por lo que US tiene mayor utilidad en la evaluación de los mismos y puede ser utilizado para guiar la BAAF de ganglios axilares sospechosos en pacientes con lesiones mamarias. También puede emplearse en pacientes con sospecha de cáncer recurrente, o en pacientes con linfoma o tumores que no sean primarios de mama, en los cuales se presente crecimiento de los ganglios axilares.
La experiencia y habilidad del radiólogo es fundamental para su correcta evaluación y selección del ganglio, sin embargo después del periodo de aprendizaje, se mejora la identificación y correcta aspiración de los ganglios, mejorando los resultados. Es importante resaltar que debe existir una adecuada comunicación entre el radiólogo, patólogo y cirujano, para mantener altos estándares en la calidad del procedimiento. Dada la diversidad de experiencia de los operadores en la evaluación sonográfica de la axila, así como la experiencia en la obtención de las muestras fue un factor determinante para que la sensibilidad de nuestro estudio fuera tan baja. Otro factor que contribuye a la baja sensibilidad fue que el 75% de las biopsias se realizaron a pacientes ya tratadas que estaban en control, y que mostraron modificaciones no tan sustanciales de los ganglios, no obstante, se enviaron a biopsia para descartar micrometástasis, debido a que en caso de ser positivas, se modificaría el tratamiento y esto condicionaría un peor pronóstico para la paciente.
En el análisis estadístico de la información obtenida en nuestra serie, se encontró que la edad de la paciente, el engrosamiento de la cortical y la medición del eje corto fueron más significativos para la sospecha de metástasis ganglionar, esto quiere decir que a menor edad de la paciente, a mayor espesor de la cortical y a mayor diámetro del eje corto del ganglio fue mayor la probabilidad de metástasis.
La BAAF de ganglio axilar guiada por US se debe incluir en la evaluación preoperatoria de las pacientes con cáncer de mama, dado su bajo costo y alta especificidad, permitiendo a las pacientes una mejor valoración de la región axilar, evitando cirugías innecesarias a este nivel, con las consecuentes complicaciones de la resección axilar.
Correspondencia:
Dra. Irlanda Pacheco Bravo.
Av. San Fernando N° 22, Colonia Sección XVI,
Delegación Tlalpan, C.P. 14080. México D.F., México.
Teléfonos: 5628 0457 (directo) o 5628 0400, extensión 306 o 190.
Correo electrónico: drairlancapacheco@hotmail.com