¿ METODOLOGÍA DE LOS LINEAMIENTOS ORIGINALES Y DE SU ACTUALIZACIÓN
Las guías originales, aquí actualizadas, fueron desarrolladas por un grupo de 23 médicos mexicanos especialistas en oncología, endocrinología, imagenología, cirugía oncológica, patología y medicina nuclear, representantes de las principales instancias hospitalarias del país donde se trata a pacientes con NET-GEP, con base en la metodología tipo "Panel DELPHI". En las recomendaciones los niveles de evidencia fueron estimados de acuerdo con el sistema GRADE. El sistema GRADE clasifica la evidencia y establece la fuerza de las recomendaciones o guías clínicas. El British Journal of Medicine estima cuatro aspectos: el riesgo, el diagnóstico, el pronóstico y el tratamiento.2
La calidad de la evidencia se define como alta cuando realizar más investigación es poco probable que cambie la estimación del efecto ya establecida; moderadamente alta cuando más investigación podría mejorar los medios para calcular el efecto; como baja cuando más investigación es probable que cambie la percepción del efecto y, por último, se califica como muy baja, cuando cualquier estimación del efecto es incierta. El sistema GRADE califica la calidad de la evidencia como A, B, C y D para calidades alta, moderada, baja y muy baja respectivamente, y la fuerza de las recomendaciones se califica como 1, 2, 3 y 4 para fuerte, débil para recomendar el uso, débil para desaconsejar el uso y fuerte para desaconsejar el uso, respectivamente.3
¿ ANTECEDENTES
Los NET y los NET-GEP son neoplasias raras de las que se tenía un conocimiento muy limitado hasta hace poco. Los NET-GEP requieren de un abordaje multidisciplinario (cirujanos, oncólogos, endocrinólogos, radiólogos, expertos en medicina nuclear, gastroenterólogos y patólogos). En esta actualización recordamos los aspectos fundamentales de dichos lineamientos1 y analizamos datos más recientes de la literatura.
El quirúrgico es el abordaje principal para pacientes con NET-GEP considerados con algún potencial para curación. La correcta selección de pacientes es trascendental para el resultado clínico. Los intentos previos de consensuar el abordaje quirúrgico muestran que éste se realiza dentro de diversas políticas de manejo entre los diversos centros, lo cual también refleja la falta de información categórica obtenida de estudios controlados con diseño aleatorio. Aunque no hay un fármaco suficientemente efectivo que pueda ejercer el papel principal en el tratamiento de NET-GEP, los análogos de somatostatina han asumido un relevante papel en el manejo de tumores indolentes. El interferón alfa (IFN-α) se sigue administrando, a pesar de no haber demostrado beneficios claros. Ciertos regímenes de quimioterapia son útiles en algunos tipos de NET-GEP. Es clara la necesidad de contar con mejores alternativas de manejo sistémico. Para lograrlo, debe realizarse más investigación en estudios de protocolos controlados.4,5
¿ ASPECTOS ETIOLÓGICOS
La fisiopatología de los NET-GEP es poco comprendida aún, y por ende no existe una definición categórica de su etiología. Estos tumores suelen ser esporádicos o bien formar parte de síndromes oncológicos endócrinos familiares: neoplasia endócrina múltiple tipo 1 (MEN1), la neoplasia endócrina múltiple tipo 2 (MEN2), la neurofibromatosis de tipo 1 (NF1), la enfermedad de Von Hippel Lindau (VHL) y el complejo o síndrome de Carney. La incidencia de MEN1 en NET-GEP va de 0% en carcinomas intestinales, a 5% en insulinomas, y 30% en gastrinomas. Debe estudiarse cuidadosamente la concomitancia de MEN1, MEN2 y NF1, así como la historia familiar. Los NET inician en las células neuroendócrinas, poseen capacidad secretora y pueden formar parte de síndromes de hipersecreción, mientras que NET-GEP se originan en los islotes pancreáticos o células neuroendocrinas del tracto gastrointestinal (células neuroendócrinas en intestino), las células neuroendócrinas se originan en el epitelio bronquial y las células parafoliculares en la tiroides (carcinomas medulares de la tiroides). Las neoplasias pituitarias, paratiroideas y adrenomedulares comparten características con NET-GEP.6-8
¿ EPIDEMIOLOGÍA
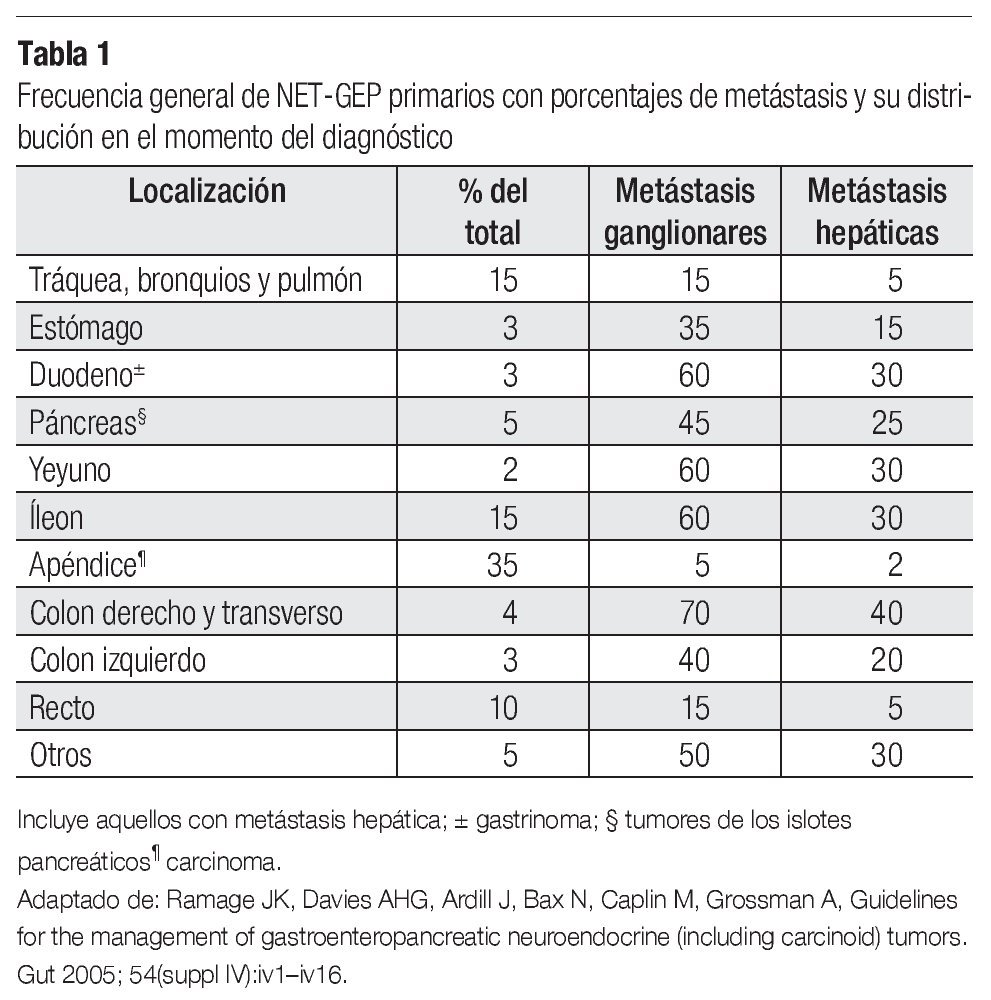
Se ha reportado un discreto aumento en la incidencia de NET-GEP, en especial de los carcinomas gastrointestinales. La incidencia se estimaba en menos de dos casos/100,000 personas/año, pero estudios recientes sugieren tres casos/100,000 habitantes/año, con predominio leve en mujeres (Tabla 1). Estudios post-mortem demuestran que los NET-GEP del tracto GI son mucho más comunes de lo que se pensaba. La historia familiar cuadruplica el riesgo en pacientes con familiares directos cursando con estas neoplasias.6
¿ DIAGNÓSTICO DE NET-GEP
Los NET-GEP gástricos, duodenales y colónicos se diagnostican mediante endoscopia. Los gástricos tipo 1 se localizan predominantemente en fondo y cuerpo del estómago y típicamente son múltiples, < 1 cm de diámetro, rodeados de un margen regular y con discreto aumento en la vascularidad con técnicas de cromoendoscopia digital (NBI y FICE). Los NET gástricos tipo 3 son solitarios, lesiones grandes con un margen irregular, difícil de definir y en ocasiones, ulcerado. Los duodenales generalmente son pequeños y podrían ser múltiples. Los de intestino medio se encuentran con mayor frecuencia en íleon más que en yeyuno y generalmente son pequeños. En consecuencia, estos tumores solamente se pueden observar mediante técnicas especiales de endoscopia tales como video-cápsula y enteroscopia,9,10 principalmente este último, el cual tiene acceso a lesiones de intestino medio y con toma de biopsia. Para NET de colon y recto, el papel de la endoscopia es la detección del tumor primario, generalmente de manera incidental y con toma de biopsia; a nivel rectal, el ultrasonido endoscópico nos permite apreciar el grado de invasión en la pared rectal.
Ultrasonido endoscópico (USE). El USE es un método de diagnóstico que depende en gran medida de la experiencia y acuciosidad de la persona que lo realiza y se define como una metodología "operador dependiente" tanto para sensibilidad como para especificidad. En manos experimentadas, USE es el método más sensible para diagnosticar NET-GEP pancreáticos con una media de 90% (rango de 77-100%).11
El USE puede utilizarse en un detallado de imágen anatómico para evaluar el páncreas y en el diagnóstico preoperatorio de insulinomas, los cuales requieren tratamiento quirúrgico en todos los casos. La sensibilidad en el diagnóstico de insulinomas es de 94%; la definición de la localización topográfica del tumor y su relación con estructuras vecinas (estereotopografia): relación con el conducto biliar, pancreático, papila mayor y pared duodenal es muy precisa12 USE muestra un mejor grado de acuciosidad de diagnóstico y detecta con mucha precisión NET pancreáticos por medio de los patrones de eco: insulinomas de páncreas con diferentes ecotexturas (27.4% heteroecoica, 21% isoecoica, 50% hipoecocica).13
El diagnóstico preoperatorio de NET-GEP en páncreas es importante. USE y biopsia por aspiración con aguja fina guiada por USE (EUS-FNA siglas en inglés) han demostrado ser útiles para la detección y diagnóstico citológico de lesiones pancreáticas; en un estudio multicéntrico14 la sensibilidad y especificidad con aguja fina de masas pancreáticas en pacientes con sospecha de NET fue de 100%. La sensibilidad y especificidad de EUSFNA en obtener un adecuado material para diagnóstico de patología de NET, fueron de 89% y 99.6%, respectivamente. En este estudio se concluye que la USE con aguja fina es un excelente método de diagnóstico en la evaluación de pacientes con NET del páncreas.14
En conclusión, USE-FNA es altamente seguro en el diagnóstico de lesiones NET-GEP en páncreas. Endoscopia es la modalidad más sensible en detectar y diagnosticar carcinoides menores de 1 cm. USE es una técnica relativamente buena para estadificar T de NET.15
IMAGENOLOGÍA
Las técnicas de imagen tienen un papel importante para la localización del tumor primario, identificar sitios de enfermedad metastàsica y en la evaluación de la respuesta al tratamiento. Alrededor de 75% de pacientes es diagnosticado con enfermedad localizada. La estadificación preoperatoria está orientada a identificar evidencia de extensión tumoral y a optimizar el abordaje terapéutico. Las pruebas de imagen que pueden ayudar a localizar tumores en estómago, páncreas, apéndice y cólon son la tomografía axial computada (TC) y la resonancia magnética nuclear (RM). El USE permite obtener imágenes de alta resolución en estómago, páncreas y duodeno, y es considerado uno de los métodos más seguros para el diagnóstico y estadiaje de enfermedad inflamatoria crónica y quística, así como de neoplasias del páncreas. Para lesiones de intestino medio se recurre a la enteroscopia mediante videocápsula o TC por enteroclisis.16,17 La endoscopia con videocápsula es un método altamente sensible para la evaluación del intestino delgado.9,10
Para la evaluación de la enfermedad metastásica en hígado se puede utilizar TC, RM o ultrasonido abdominal. La utilización de medios de contraste para ultrasonido eleva la detección de enfermedad neoplásica hepática, pero no ayuda en la diferenciación del tumor primario.16
En una proporción importante de casos, el tumor original es demasiado pequeño y poco sintomático para ser localizado por otros métodos de imagen anatómicos. Las modalidades de imagen funcional como la gammagrafía con receptores de somatostatina (SRS) se pueden utilizar para identificar tumores que expresan receptores de superficie tipo 2, 3 y 5. Esta técnica es útil para establecer una mejor etapificación de la enfermedad al identificar sitios tumorales no identificados por los métodos anatómicos.18 En el caso de tumores con captación positiva del radiofármaco se puede considerar el tratamiento con análogos de la somatostatina.19,20 La tomografía computada asociada a la tomografía por emisión de positrones, es útil en el seguimiento de tumores NET-GEP de alto grado de malignidad.21
En el caso de enfermedad fuera de tratamiento quirúrgico existen opciones de mínima invasión con propósitos paliativos (quimoembolización, embolización selectiva con 90Y-octreotato, ablación por radiofrecuencia).22
HISTOPATOLOGÍA
El estándar de oro para diagnóstico de NET-GEP es el estudio histopatológico realizado en tejido obtenido mediante biopsia endoscópica. En la gran mayoría de casos, el diagnóstico es sencillo con microscopio de luz. Se recomienda hacer un panel de inmunohistoquímica en las muestras de biopsia con duda diagnóstica de la naturaleza de la lesión (cromogranina A -CgA- y sinaptofisina) o cuando se necesite hacer el diagnóstico diferencial entre tumor neuroendócrino de bajo grado vs alto grado (Ki67). La calidad del reporte de patología depende de la calidad de tejido estudiado. El material de la biopsia debe ser suficiente y acompañarse de información clínica. Las biopsias con aguja gruesa se recomiendan sobre las de aguja fina.23, 24
¿ GUIAS DE DIAGNÓSTICO 2010
El estudio inicial depende de la sintomatología clínica del paciente. El seguimiento varía en función de si los pacientes deben ser sometidos a cirugía o a tratamiento sistémico.4,5
Grado 2B
Es necesario realizar una historia clínica familiar detallada de los pacientes con NET-GEP para detectar neoplasias endocrinas múltiples.4,5
Grado 2C.
El diagnóstico de NET-GEP está basado en la sintomatología clínica, la evaluación endoscópica, en la imagenología anatómica y nuclear, en la concentración de hormonas y en la histología.
Grado 1A
Siempre se requiere que el paciente firme un documento de consentimiento bajo información para realizar estudios invasivos diagnósticos y para cualquier tratamiento.
Grado 1A
Con base en las diferentes guías mundiales, debe considerarse la necesidad de evaluar a los pacientes ante la posibilidad de otros tumores endocrinos secundarios o neoplasias intestinales, dependiendo de la historia familiar, tipo de tumor, manifestaciones clínicas, estudios de laboratorio e imagen realizados previamente.6
Grado 2B
Publicaciones recientes han ratificado el poder de la clasificación de NET-GEP en las guías de la OMS, sustentándose el concepto de que los varios tipos de NET-GEP también varían en su comportamiento clínico, y debido a dicha diferencia biológica, el tratamiento deberá ser más específico para cada tipo.4
Grado 1A
En los pacientes con NET-GEP es necesario realizar las siguientes pruebas basales de cromogranina A (CgA) y ácido 5-hidroxi-indolacético séricos.
Grado 1B
La determinación de CgA sérica es el marcador más recomendable para la respuesta al tratamiento y el seguimiento tumoral.
Grado 1A
Una vez hecho el diagnóstico clínico/imagenológico/laboratorial incial los pacientes se evalúan dependiendo de si la enfermedad es locorregional o metastásica.25
Grado 1A
Otras pruebas para pacientes con NET-GEP que pueden considerarse son: las pruebas de función tiroidea, hormona paratiroidea, calcitonina, calcio, prolactina, alfa feto proteína, antígeno carcinoembriónico y gonadotropina coriónica humana beta, aunque guiadas por los datos clínicos y características del paciente.25
Grado 2C
Se recomienda realizar estudios de imagen cuando no haya mejoría, o cuando exista empeoramiento de la sintomatología que sugiera progresión tumoral o la presencia de complicaciones asociadas.15-17
Grado 2A
¿ ESTUDIO HISTOPATOLÓGICO
El estándar de oro para diagnóstico es la histopatología. Es importante realizar un panel inmunohistoquímico rutinario para los casos más difíciles.
Grado 1A
Dependiendo de la disponibilidad y experiencia del endoscopista, el radiólogo, y el patólogo, la mejor opción en diagnóstico es biopsia.
Grado 1A
Para realizar un diagnóstico histopatológico de NET-GEP es preciso que los patólogos cuenten con entrenamiento y experiencia en el área.
Grado 1A
El diagnóstico de NET requiere de microscopia de luz y cuando hay duda en el diagnóstico, será necesario utilizar marcadores de inmunohistoquímica como CgA y sinaptofisina.
Grado 1A
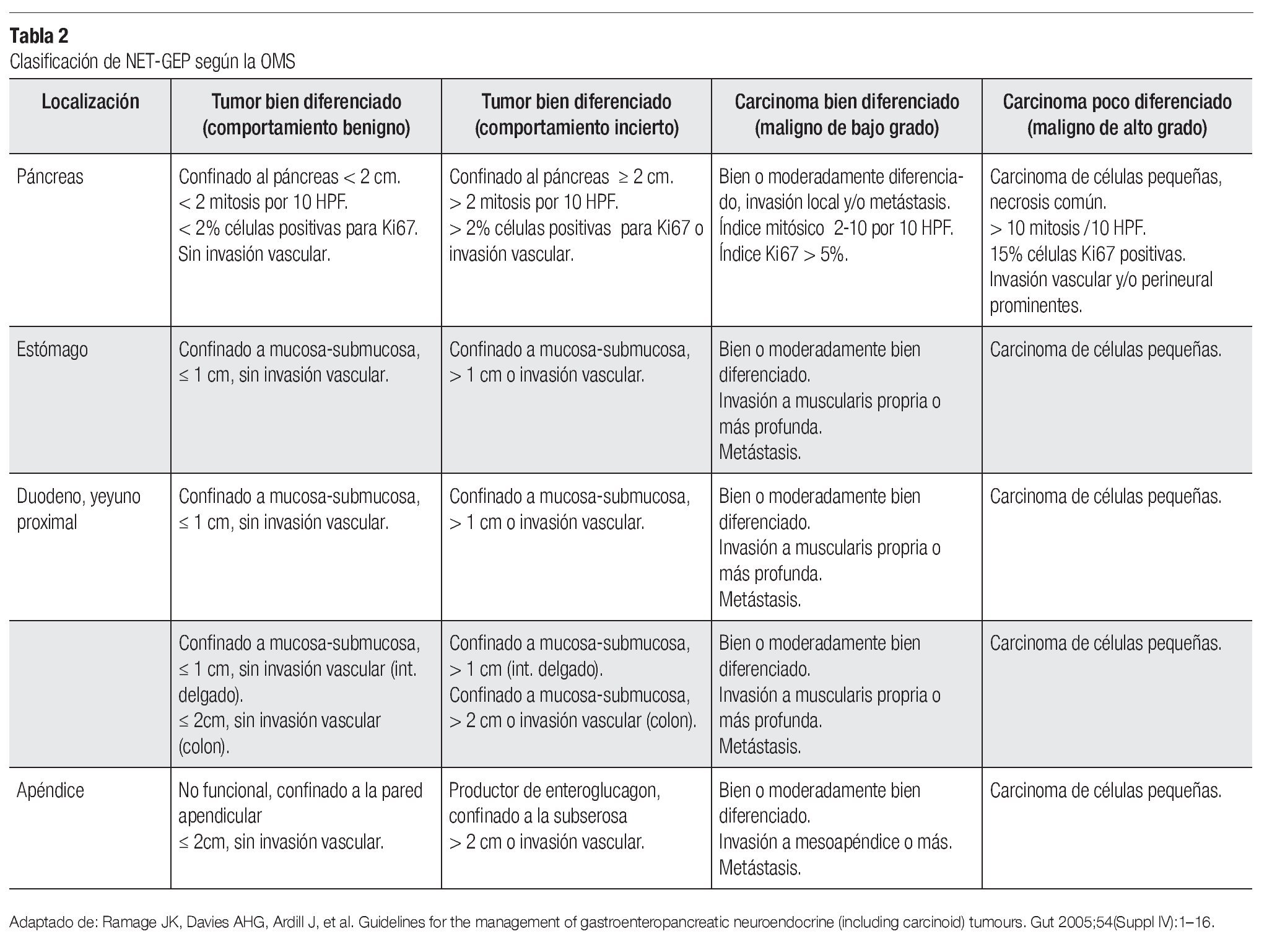
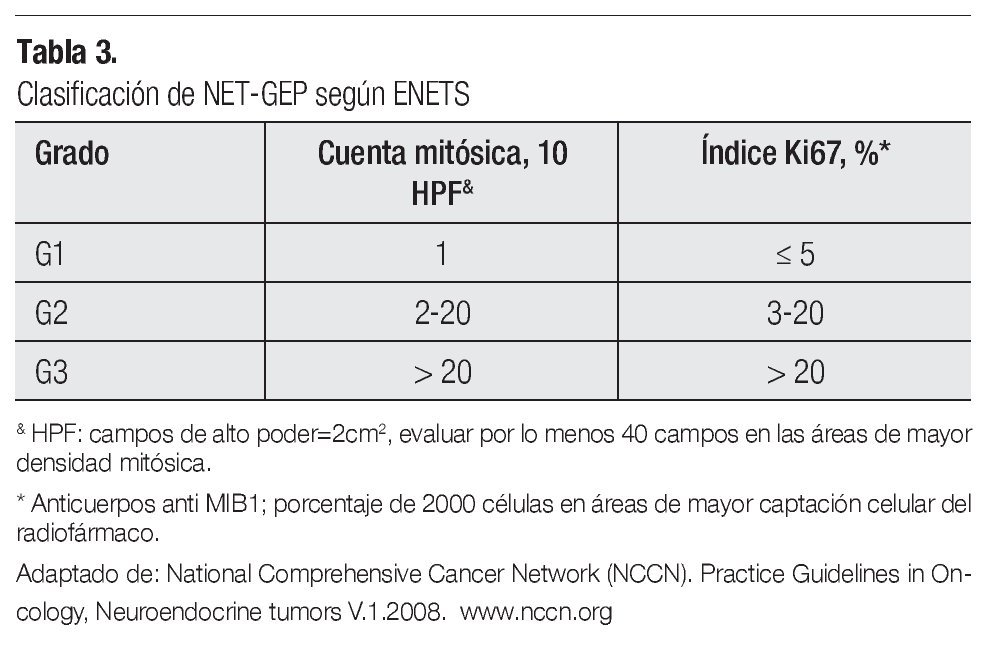
Hay dos tipos de clasificaciones mundialmente aceptadas y validadas, la emitida por la ENETS y la de la Organización Mundial de la Salud (OMS) (Tablas 2 y 3).
Grado 1A
Se aconseja el uso del Ki67 sólo en biopsias (escaso tejido) o en las metástasis, para evaluar el índice de proliferación del tumor (bajo vs alto grado). Ki 67 es un marcador de índice de proliferación que se usa con fines pronósticos.
Grado 1A
En la enfermedad metastásica de primario no conocido, se aconseja el uso de marcadores de inmunohistoquímica que sugieran el origen de la neoplasia, tales como CDX2 (Intestino y páncreas) y TTF1 (pulmón). 27, 28
Grado 1A
Algunos casos de NET, en especial los poco diferenciados, no expresan marcadores característicos de inmunohistoquímica, lo cual no las excluye del grupo. En estos casos, la microscopía electrónica puede ayudar al diagnóstico.
Grado 1A
Se enfatiza la necesidad de un procedimiento de estandarización morfológica que lleve a un más fácil diagnóstico, así como que indique el reconocimiento exacto y el tratamiento óptimo. En diciembre de 2007, la Sociedad Europea de Tumores Neuroendócrinos (ENETS) presentó un protocolo de diagnóstico morfológico de NET-GEP.7 En ese documento, la ENETS señala las sugerencias para valorar las biopsias, donde se estima como obligatorio realizar inmunotinción para marcadores neuroendócrinos como sinaptofisina, cromogranina A, Ki67 y MIB1, estimándose como opcional el realizar la inmunotinción para hormonas como insulina, gastrina, serotonina y otras, así como la inmunotinción para receptores de somatostatina (SSTR2, por ejemplo).
Grado 1B
Los tumores de bajo grado muestran un índice de proliferación entre 1-20% y los de alto grado entre 50-95%.
Grado 1A
Se desaconseja la aplicación de enolasa neuronal específica y de otros marcadores como CD56 y PGP9.5 para el reconocimiento de NET-GEP, por la falta de especificidad de los anticuerpos disponibles y de los mismos marcadores.4
Grado 1A
Una vez establecida la naturaleza neuroendócrina del tumor, debe determinarse su diferenciación y actividad proliferativa de acuerdo con clasificación de la OMS, lo cual se realiza por conteo de mitosis o inmunotinción del antígeno marcador dependiente del ciclo celular Ki67.7 El uso de Ki 67 no es necesario en tumores metastáticos.
Grado 1A
Los adenocarcinomas gastrointestinales y pancreáticos con diferenciación mixta son un reto para la clasificación, ya que en la mayoría de estas neoplasias la tinción de sinaptofisina y cromogranina representa una proporción menor de la población celular del tumor. Los carcinomas mixtos deben, pues, ser bien diferenciados de NET-GEP.7 El pronóstico lo dará el componente de adenocarcinoma.
Grado 1B
Se ha propuesto estratificar a NET-GEP en tres grupos de tratamiento, de acuerdo con 1) su crecimiento; 2) el estadio tumoral, metástasis en ganglios linfáticos y a distancia (TNM), y 3) el grado de diferenciación. Se debe incluir la extensión como localizado o extenso (desde muy bajo hasta alto riesgo) y la presencia de metástasis (desde lento hasta rápido crecimiento). Asimismo, se consigna el tipo histológico (pobre o bien diferenciado), el grado (G1 a G3), el estadio (T1, T2, T2-3 o T NIM1) y el tratamiento a emplear (cirugía, resección endoscópica, terapia adyuvante, quimioterapia).7
Para tumores benignos, en caso de diagnóstico histopatológico inicial de NET-GEP es suficiente el seguimiento con estudios bioquímicos y de imagen (5-HIAA/CgA y SRS).
Grado 2C
Se propone utilizar una forma de informe histopatológico estandarizado para biopsias y para productos de resección, en términos generales, debe incluir:
Tipo de material (biopsia o resección)
Sitio anatómico del tumor
Tamaño
Profundidad de invasión
Permeación vascular
Características morfológicas poco comunes (células claras, oncocíticas o con diferenciación glandular)
Grado histológico (reportar número de mitosis)
Presencia de necrosis
Presencia de otros componentes
Marcadores de inmunohistoquímica
Grado 1A
IMAGENOLOGÍA
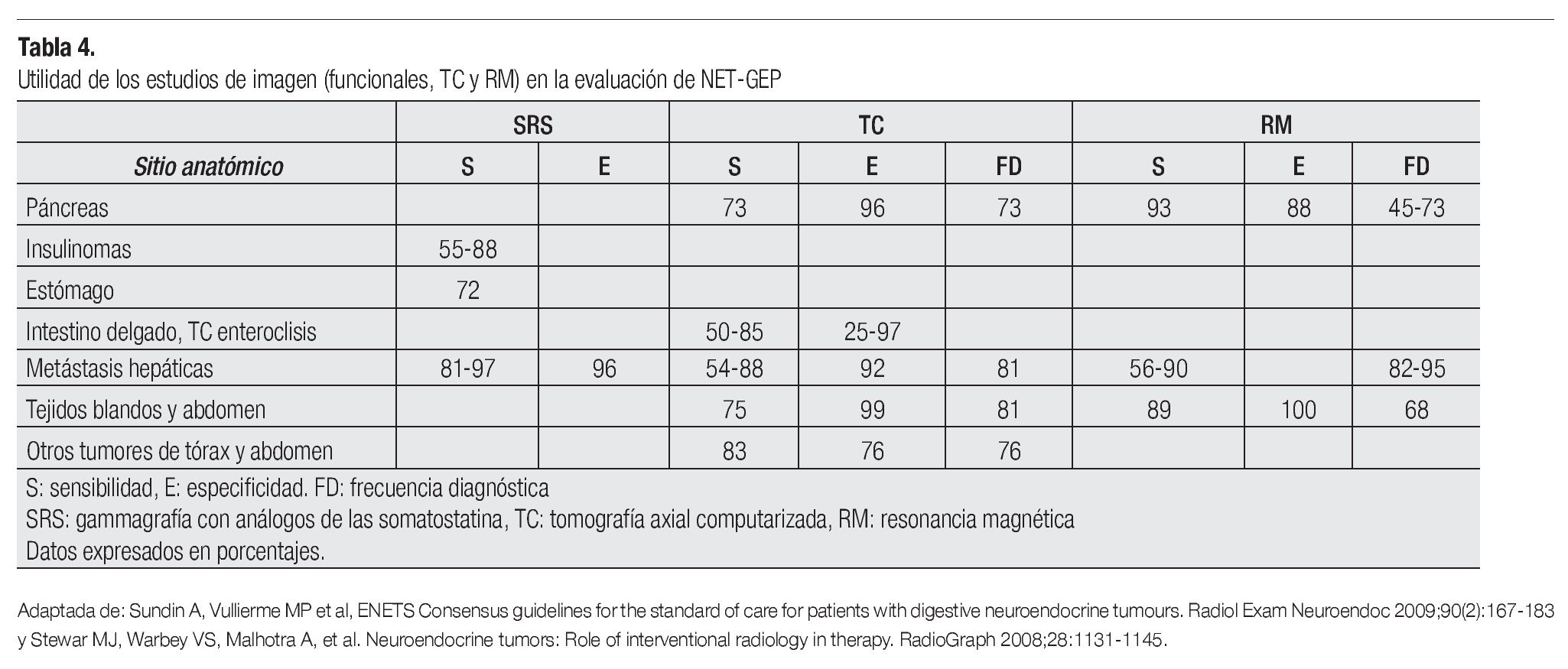
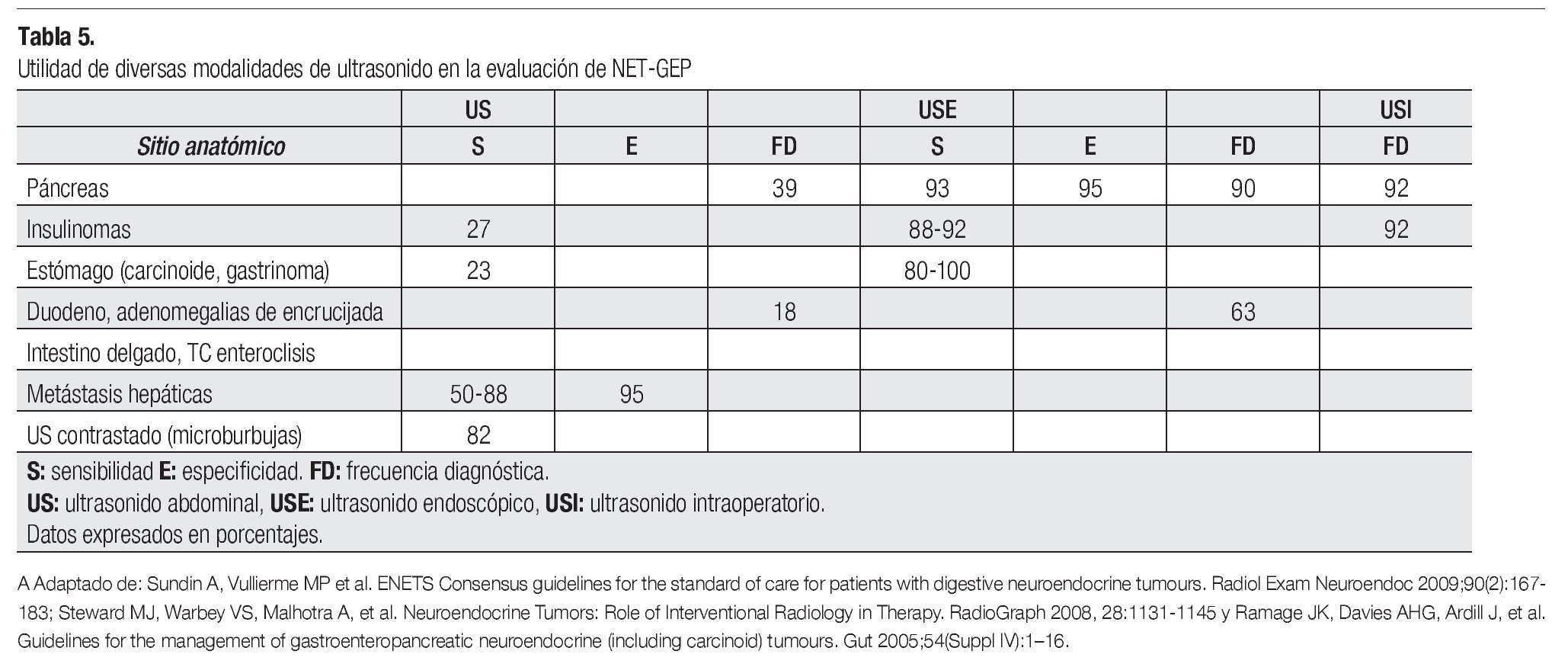
Los objetivos de los estudios de imagen anatómicos y funcionales son: detectar el tumor primario, definir la extensión local y su relación con las estructuras adyacentes, definir la presencia y densidad de receptores de somatostatina, monitorizar la respuesta a tratamiento y de persistencia/recurrencia de la enfermedad (Tablas 4 y 5).
Grado 1A
El panel general de estudios por imagen para la evaluación de estos tumores no es muy claro. Los estudios de imagen deberán adecuarse dependiendo de la presentación clínica de cada caso, de la situación anatómica de cada tumor y de la producción hormonal (tipo de tumor).
Grado 2A
La gammagrafía con análogos de somatostatina se considera y recomienda como el mejor estudio de imagen para la evaluación de NET-GEP (diagnóstico y seguimiento).17, 18
Grado 1C
Los NET gástricos, duodenales, rectales y colónicos se diagnostican por endoscopia. El papel de la TC en estos pacientes es detectar metástasis locales y distantes para la estadificación del tumor.16, 17
Grado 1A
La imagen de enfermedad metastásica de NET-GEP en la TC es similar a la de otros tumores malignos; sin embargo, es frecuente que exista un marcado aumento en la captación del contraste arterial temprano.16
Grado 1A
La literatura sobre el estudio con imágenes de RM en NET-GEP es aún menor que aquella sobre el uso de TC. De cualquier modo, la RM ha demostrado ser eficaz para ciertos diagnósticos (pequeños NET-GEP y pequeñas metástasis) no detectados por TC.16,17
Grado 1B
En lesiones menores de 2 cm, el USE aporta una mejor sensibilidad en la mayoría de lesiones en NET-GEP sobre todo pancreáticas y nos permite obtener material para estudio citopatológico.11
Grado 2A
La información aportada por el ultrasonido abdominal (US) en las metástasis hepáticas es similar a la aportada por TC y RM. En la monitorización de la enfermedad, la información sobre el tamaño tumoral es mejor estimada con TC y RM. De cualquier modo, el uso de US y TC juntos puede ser una buena opción para la vigilancia, principalmente en pacientes con buen pronóstico a largo plazo en que es particularmente importante reducir la exposición a radiación ionizante.16, 17, 22
Grado 2B
El diagnóstico multidisciplinario de NET-GEP puede incluir SRS, endoscopia, USE y determinación de péptidos y aminas específicas en sangre y orina, TC o RM.16
Grado 1A
La SRS es la mejor opción de vigilancia por imagen en tumores positivos para receptores, posterior a resección completa del primario o de metástasis.
Grado 1C
Es más fácil diagnosticar tumores neuroendócrinos primarios de estómago, duodeno, colon y recto mediante endoscopia. La TC y RM evalúan la extensión de la enfermedad y la resecabilidad.8, 15
Grado 1A
Un NET-GEP primario en el intestino medio no es fácil de identificar, por lo que un paciente con dolor abdominal y cambios en hábitos intestinales por muchos años, suele ser estimado como paciente con síndrome de intestino irritable. Las pruebas de bario y la TC pueden ser normales en masas pequeñas, pero mostrarán las lesiones de mayor tamaño y engrosamiento de la mucosa. Los estudios de enteroscopia, videocápsula, SRS y la angiografía mesentérica pueden ayudar en estos casos, aunque no son prácticas frecuentes. 9,10
Grado 1C
En pacientes con sospecha de NET-GEP con SRS y USE negativos, el estudio a realizar es la TC de tórax y abdomen contrastada en tres fases.17
Grado 1B
La SRS alcanza un potencial de 90% de detección en tumores intestinales y su sensibilidad puede incrementar con el uso de tomografía computada asociada a tomografía por emisión de positrones (PET-TC), siempre y cuando se utilice el Galio 68 como trazador.18, 21
Grado 1C
El PET-CT tiene valor en el diagnóstico y seguimiento de tumores de alto grado de malignidad.29
Grado 3B
Se recomienda realizar estudios de imagen cuando no haya mejoría, o cuando exista empeoramiento de la sintomatología que sugiera progresión tumoral o la presencia de complicaciones asociadas.
Grado 2A
GASTROENTEROLOGÍA
En pacientes con tumores neuroendócrinos gástricos el abordaje depende del tipo de tumor. Existen tres clases diferentes:
¤ Tipo 1. Asociado con hipergastrinemia y gastritis crónica atrófica.
¤ Tipo 2. Asociado con el síndrome de Zollinger-Ellison y NEM1. ¤ Tipo 3. Esporádico.
Grado 1A
Dependiendo de su localización, la gran mayoría de tumores de intestino delgado proximal incluyendo apéndice cecal se consideran benignos o de potencial maligno incierto; los distales se consideran de conducta biológica desfavorable, debido a la frecuencia con que metastatizan a ganglios linfáticos regionales e hígado.
Grado 1A
CARDIOLOGÍA
La enfermedad carcinoide se observa en 3-4% de todos los pacientes con un tumor neuroendócrino, y hasta en 40-50% de los pacientes con síndrome carcinoide. La ecocardiografía es el estándar dorado para la detección de afección cardiaca. 30
Grado 1A
El síndrome carcinoide suele desarrollarse hacia la etapa tardía de NET-GEP pero es importante documentarle oportunamente.30
Grado 2A
¿ GUÍAS DE TRATAMIENTO QUIRÚRGICO 2010
La principal forma de tratamiento de los NET-GEP es la cirugía.
La elección terapéutica depende de la sintomatología, el estadio de la enfermedad, el grado de captación de radionúclidos y las características histológicas.
Grado 1A
Una opción de tratamiento en NET-GEP gástricos es la mucosectomía endoscópica en lesiones menores de 1 cm (tipo I).
Grado 2B
En presencia de síndrome carcinoide, el paciente debe ser tratado con octreótida antes, durante y después de la intervención quirúrgica, para prevenir el desarrollo de una crisis carcinoide.
Grado 1A
En los tumores NET-GEP es indispensable conocer el tipo histológico, conducta biológica, localización y condiciones generales del paciente para determinar el tipo de cirugía.
Grado 1B
El tratamiento de los NET-gástricos es variado, incluye desde la observación, mucosectomía endoscópica, antrectomía, segmentectomía, gastrectomía total o bioterapia, en el tipo I. En el tipo II y III gastrectomía total con disección linfática de los primeros relevos ganglionares. Con respecto a la conducta biológica de los diferentes tipos histológicos, el tipo I se considera el más indolente por la baja frecuencia de penetración metástasis ganglionares y hepáticas, el tipo III y IV se consideran altamente linfofílicos y probabilidad de metástasis hepáticas hasta 70%, lo cual justifica un tratamiento más radical.
Grado 1B
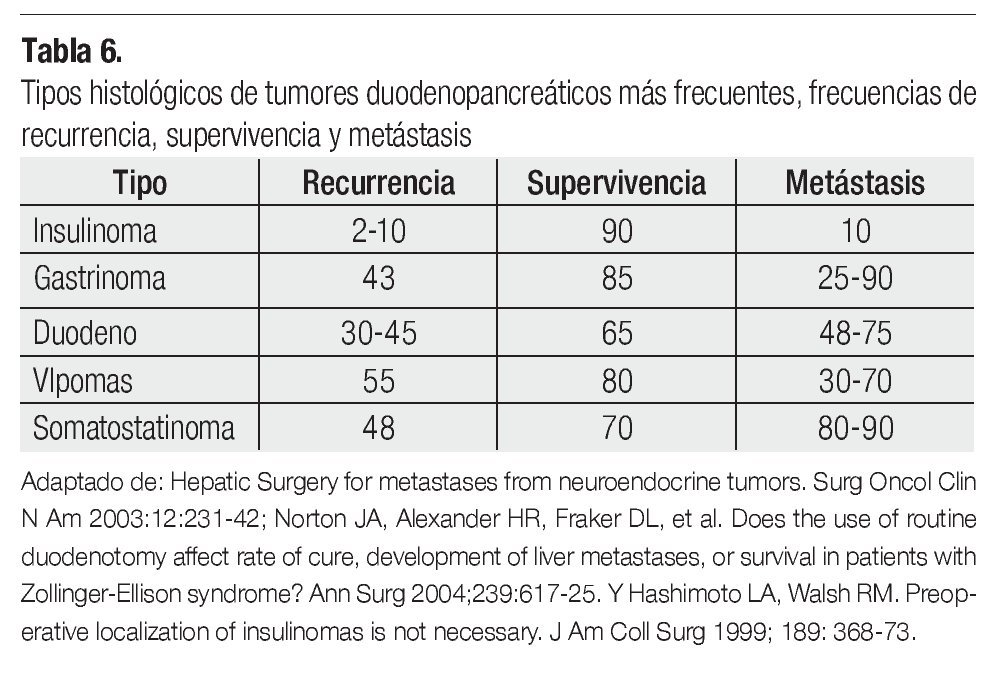
Los NET duodenopancréaticos son el grupo más variado de tipos histológicos. El tratamiento quirúrgico depende de la localización y la conducta biológica del tumor (Tabla 6).
El tratamiento quirúrgico incluye pancreatoduodenectomía, pancreatectomía distal, resección marginal, enucleación y en casos seleccionados, resección del ámpula.
La resección marginal es suficiente para los NETGEP de conducta benigna.
Grado 1B.
La linfadenectomía de primeros relevos está indicada en la resección primaria de los tumores NET-GEP malignos y de comportamiento incierto.
Grado 1B.
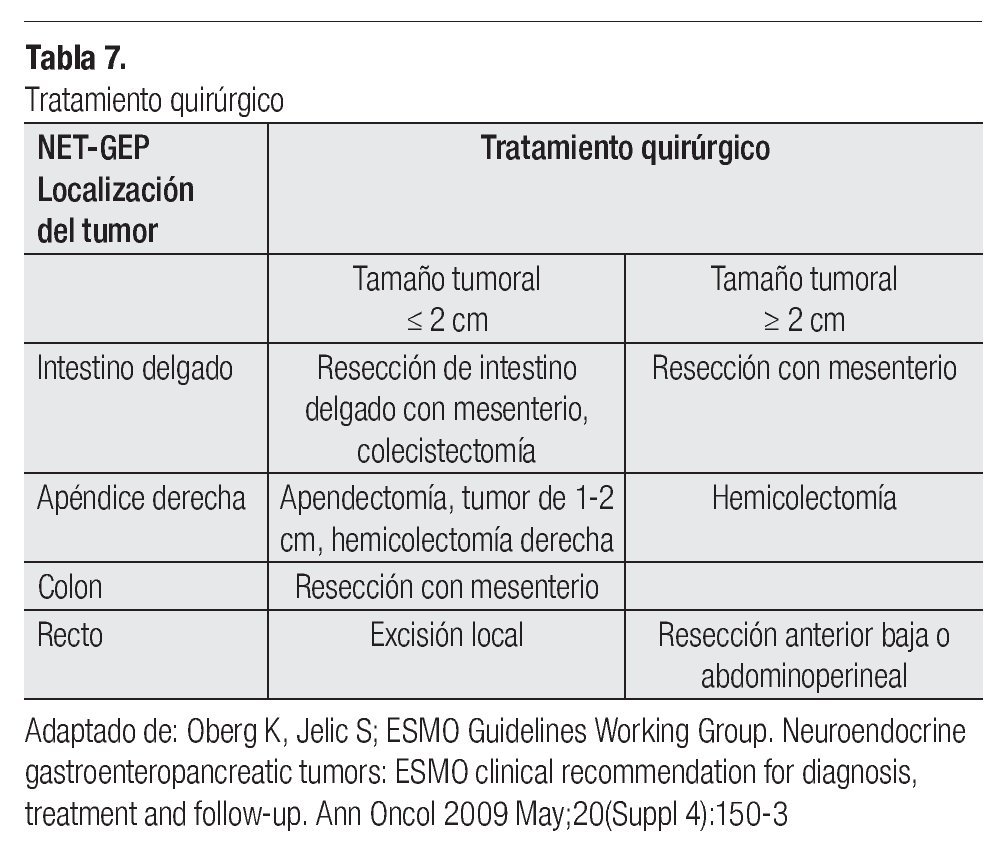
El tratamiento quirúrgico de los tumores neuroendócrinos de intestino delgado y colorrectales, depende de la localización, tamaño tumoral y conducta biológica. Las posibilidades quirúrgicas incluyen mucosectomías endoscópicas, resecciones transanales locales, resecciones parciales, hemicolectomía, resección anterior baja, abdominoperineal y exenteración pélvica (Tabla 7).
La mejor forma de controlar el síndrome carcinoide es la cirugía, cuando es posible.
Grado 1B
Actualmente se recomienda cirugía laparoscópica para tumores bien diferenciados, benignos, menores de 3 cm y de comportamiento incierto. La experiencia del equipo quirúrgico es fundamental para esta posibilidad de tratamiento.
Entre 20 y 40% de las metástasis hepáticas son funcionales.
Grado 1B
La cirugía debe considerarse ante presencia de metástasis hepáticas resecables.
Grado 1B
En la mayoría de los NET-GEP de yeyuno e íleon, con o sin presencia de metástasis, la resección del primario y la resección de nódulos linfáticos mesentéricos asociados, está indicada.
Grado 1B
En el momento actual no existe evidencia suficiente para recomendar el transplante hepático, en los pacientes con metástasis hepáticas no resecables.
Grado 2D
El papel de la cirugía paliativa en NET es realizar la resección quirúrgica de las metástasis nodulares que causan esclerosis con compromiso vascular para el intestino delgado, que promueven dolor, mala absorción y muerte. La resección de metástasis mesentéricas puede aliviar los síntomas dramáticamente y probablemente aumentar también la sobrevida.
Grado 1B
La embolización de la arteria hepática induce isquemia de las células tumorales para reducir la secreción hormonal e incrementar la respuesta a la terapia. Está indicada en pacientes con tumores no resecables y múltiples, secretores de hormonas.
Grado 2C
La determinación de CgA sérica es el marcador más recomendable para la respuesta al tratamiento quirúrgico y el seguimiento tumoral.
Grado 1A
¿ TRATAMIENTO FARMACOLÓGICO
El objetivo del tratamiento debe ser siempre paliativo.
Grado 2B
Para los pacientes que no son candidatos para el tratamiento quirúrgico por falta de condiciones generales, el objetivo de la terapia deberá ser mejorar los síntomas y mantener la calidad de vida.
Grado 2C
La elección del tratamiento depende de la sintomatología, en la etapificación de la enfermedad, el grado de captación de radionúclidos y las características histológicas del tumor.
Grado 2B
Las opciones de tratamiento para enfermedad con tumor no resecable incluyen los análogos de somatostatina y otras terapias biológicas, los radionúclidos, las terapias de ablación y la quimioterapia tanto sistémicas como transcatéter.
Grado 2B
La radioterapia con radiación externa y bisfosfonatos pueden aliviar el dolor óseo asociado con metástasis.
Grado 2C
La quimioterapia puede utilizarse para tumores NET-GEP metastásicos, recurrentes o irresecables e inoperables.
Grado 2B
La quimioterapia para NET incluye combinaciones de estreptozotocina (STZ) y doxorrubicina y/o 5-fluororacilo (5-FU), cisplatino, etopósido, oxaliplatino y capecitabina.35
Grado 1B
La decisión del uso de la quimioterapia, depende principalmente del grado histológico. Los tumores bien diferenciados NO son candidatos a recibirlo, los carcinomas poco diferenciados y los indiferenciados son los tipos histológicos que sí pudiesen ser considerados candidatos a recibirlo. Deben tener enfermedad irresecable y/o inoperable.36
Grado 1B
La bioterapia en el manejo de NET-GEP incluye esencialmente al tratamiento con análogos de somatostatina e interferón alfa.37 El uso los inhibidores de m-TOR y del receptor responsable de señalizar la angiogénesis han demostrado actividad antitumoral, sin embargo, sólo está indicado en pacientes con enfermedad avanzada y que han recaído después de la quimioterapia.38
Grado 2C
En tumores no susceptibles de tratamiento quirúrgico con captación positiva para análogos de somatostatina, es factible utilizar materiales radiactivos con fines terapéuticos, como el Itrio 90 y el Lutecio 177. El uso de radionúclidos como terapia ha reportado estabilización de la enfermedad en 50-70% de los casos y mejoría de la sintomatología en 70%. 5
Grado 2C
Las tasas de respuesta bioquímica (inhibición hormonal con análogos de somatostatina) se observan en 30%-70% de los pacientes y ejercen control sintomático en la mayoría de éstos; el tamaño del tumor puede estabilizarse hasta 50% y en raras ocasiones reducirse.
Grado 2B
En pacientes con síndrome carcinoide, los análogos de somatostatina pueden disminuir síntomas como diarrea y rubor. Entre 30 y 60% de estos pacientes presentan enfermedad carcinoide. En ellos, el uso de análogos de somatostatina reduce la sintomatología cardiaca e incluso prolonga la sobrevida.
Grado 2B
No se recomienda uso de octreótida de acción prolongada de manera rutinaria, sin embargo, está indicado en pacientes con NET-GEP independientemente de la sintomatología, ya que aumenta el tiempo a la progresión, en comparación con placebo en pacientes con tumores.20, 25, 39
Grado 1A
De acuerdo con el grupo de estudio PROMID, los análogos de la somatostatina tienen efectos adversos mínimos y actividad antiproliferativa in vitro en enfermedad metastásica e imposibilidad quirúrgica.
Los hallazgos de estudios no controlados en 90 pacientes mostraron que la ocreótida LAR tiene actividad antitumoral en pacientes con NET-GEP metastásico bien diferenciado en intestino medio, a pesar de no poderse confirmar regresión completa y de que los pacientes no habían sido sometidos a terapia previa. Para carcinoma poco diferenciado o indiferenciado, el beneficio es limitado.39 El paciente debe iniciar con octreótida subcutáneo 100 mcg c/8 horas por 1 a 2 semanas para evaluar tolerancia y continuar con octreótida de depósito 30mg cada 4 semanas.40
Grado 1A
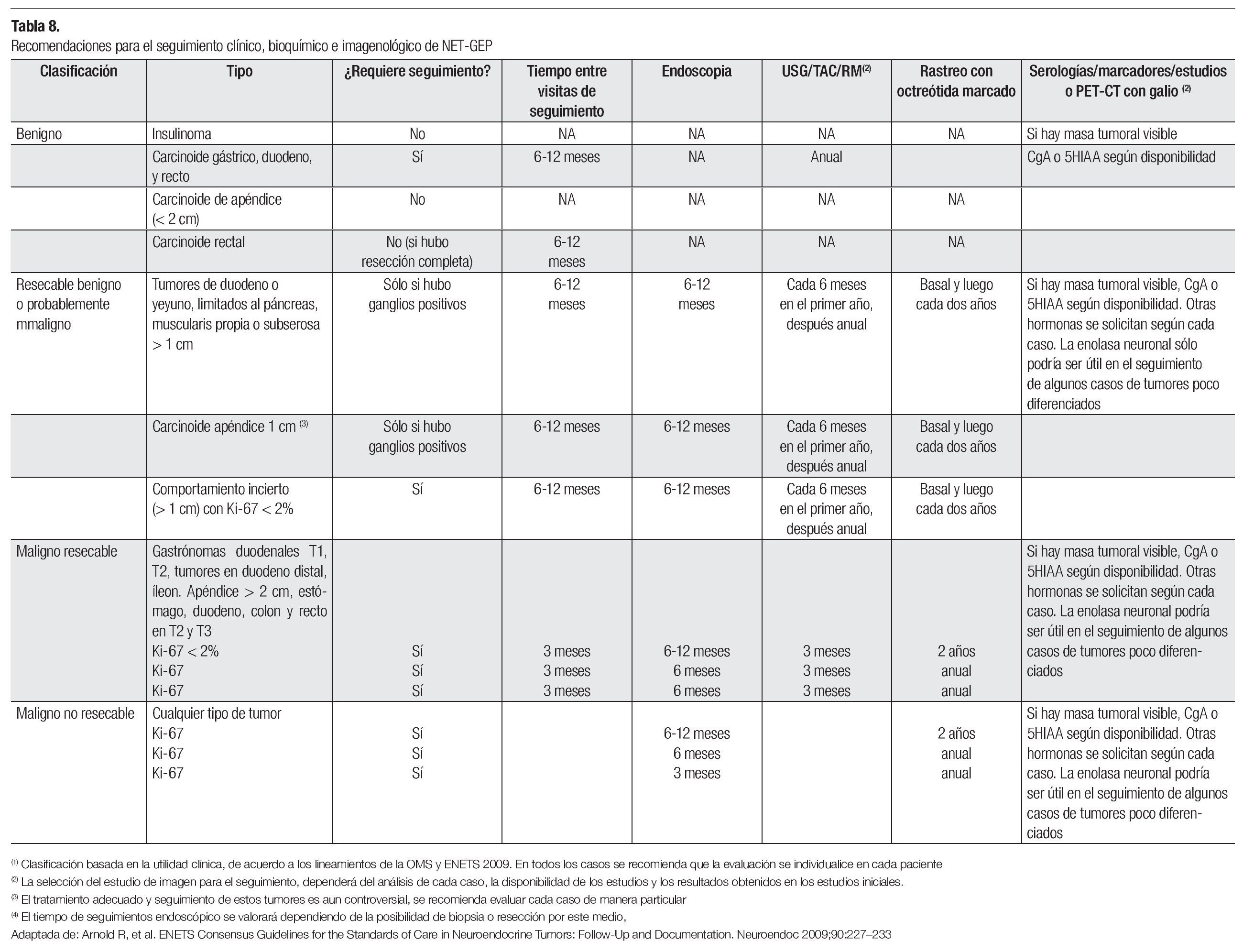
El seguimiento de los tumores neuroendócrinos, debe realizarse con marcadores bioquímicos e imagenología, dependiendo del tipo de tumor, clasificación inicial de riesgo, y características de la paciente. Se recomienda repetir los estudios basales por lo menos cada seis meses, el octreoscan por lo menos de manera anual y ajustar según la evolución del paciente y las recomendaciones de la Tabla 8.41
Grado 1B
Correspondencia: Dra. Aura Erazo Valle
Teléfono: 01.55.55.00.34.59
Correo electrónico:aerazo@issste.gob.mx, auraer@prodigy.net.mx