El propósito general de este estudio es aportar datos experimentales susceptibles de contribuir a la comprensión de la función cardiovascular de 2 hormonas como la grelina y la leptina, involucradas en la homeostasis energética. Datos recientes indican que la grelina sérica está asociada con índices cardiovasculares y que la leptina y su receptor soluble están asociados con el ritmo cardiaco. Estas asociaciones indican una clara interacción entre los sistemas endocrino y vascular en la obesidad. Por consiguiente, parece idóneo evaluar tales asociaciones y su utilidad clínica a través de las determinaciones analíticas de las concentraciones de grelina, leptina y su receptor soluble en pacientes con insuficiencia cardiaca tanto obesos como no obesos.
MétodosHemos medido los niveles de grelina, leptina y su receptor soluble en 87 pacientes diagnosticados de insuficiencia cardiaca (clasificados en 2 grupos: obesos y no obesos, acorde con criterios de índice de masa corporal) y 25 controles normoponderales, utilizando inmunoensayos comercializados. Asimismo, hemos investigado la asociación entre concentraciones séricas de grelina y leptina con el marcador cardiaco BNP (péptido natriurético cerebral) valiéndonos del análisis estadístico.
ResultadosMientras las concentraciones plasmáticas de grelina disminuyen en la insuficiencia cardiaca, tanto las de leptina como las de su receptor soluble aumentan. Adicionalmente, ambas resultan en asociación con los niveles de BNP. Hemos obtenido una diferencia significativa en los niveles de grelina entre pacientes con insuficiencia cardiaca y controles (p<0,05). También hemos obtenido diferencias estadísticamente significativas en las concentraciones de leptina entre pacientes obesos con insuficiencia cardiaca y controles (p<0,05). Sin embargo, no hemos hallado asociación significativa alguna en los niveles de grelina entre obesos y no obesos con insuficiencia cardiaca.
ConclusionesEs posible que algunas de las diferencias metabólicas y hormonales entre pacientes obesos con insuficiencia cardiaca y normoponderales, tales como los niveles elevados de leptina obtenidos en aquellos, sean cardioprotectoras.
This study aimed to provide experimental data that could enhance understanding of the cardiovascular function of 2 hormones, ghrelin and leptin, which are involved in energy homeostasis. Recent data indicate that serum ghrelin is associated with right ventricular cardiovascular indexes and serum leptin and its soluble receptor are associated with resting heart rate. These associations indicate a close interaction between the endocrine and cardiovascular systems in obesity. Therefore, we sought to evaluate these associations and their clinical significance by measuring ghrelin, leptin and leptin soluble receptor levels in both obese and non-obese patients with cardiac insufficiency.
MethodsWe measured serum ghrelin, leptin and soluble leptin receptor levels in 87 patients diagnosed with cardiac insufficiency (classified into 2 groups: obese and non-obese, according to body mass index) and 25 lean controls, using commercially available immunoassays. We also investigated the association of serum ghrelin and leptin levels with brain natriuretic peptide (BNP) as a diagnostic cardiac marker, using a statistical analysis.
ResultsGhrelin levels were decreased in cardiac insufficiency. Both leptin and its soluble receptor plasma levels were increased and both correlated with BNP. Serum ghrelin levels differed significantly between patients with cardiac insufficiency and controls (P <.05). Statistically significant differences were also found in serum leptin levels between obese patients with cardiac insufficiency and healthy controls (P<.05). However, no relationship was found between ghrelin levels in obese and non-obese patients with cardiac insufficiency.
ConclusionsSome of the metabolic and/or hormone differences between obese patients with heart failure and non-obese individuals, such as elevated leptin levels, may be cardioprotective.
Azterketa honen helburu orokorra da homeostasi energetikoan parte hartzen duten bi hormonaren (grelina eta leptina) funtzio kardiobaskularra ulertzen lagun dezaketen datu esperimentalak ematea. Datu berri samarren arabera, grelina serikoa indize kardiobaskularrekin erlazionatuta dago, eta leptina eta bere hartzaile disolbagarria, berriz, bihotzaren erritmoarekin erlazionatuta daude. Erlazio horiek agerian uzten dute pertsona gizenengan sistema endokrinoak eta baskularrak elkarri eragiten diotela. Ondorioz, egokia dirudi erlazio horiek eta beren erabilera klinikoa ebaluatzea, bihotz gutxiegitasuna duten eta gizenegi dauden edo ez dauden gaixoengan grelinaren, leptinaren eta leptinaren hartzaile disolbagarriaren kontzentrazioak analizatuta.
MetodoaBihotz gutxiegitasuna duten 87 gaixorengan neurtu ditugu grelinaren, leptinaren eta leptinaren hartzaile disolbagarriaren mailak. Gaixoak bi taldetan banatu ditugu (gizenegi daudenak eta ez daudenak), gorputz masaren indizearen (GMI) arabera. Gainera, 25 kontrol normoponderal egin ditugu, merkaturatutako immunosaiakuntzak erabilita. Bestalde, grelinaren eta leptinaren kontzentrazio serikoen arteko erlazioa ikertu dugu BNP (garuneko peptido natriuretikoa) markagailu kardiakoarekin, analisi estatistikoa baliatuta.
EmaitzakBihotz gutxiegitasuna duten pertsonengan grelinaren kontzentrazio plasmatikoa murriztu egiten den bitartean, leptinaren eta bere hartzaile disolbagarriaren kontzentrazioak areagotu egiten dira, eta gainera, biak erlazionatuta dauden BNP mailekin. Desberdintasun nabarmenak detektatu ditugu bihotz gutxiegitasuna duten gaixoen eta kontroletako grelina mailen artean (p<0,05). Era berean, estatistikoki nabarmenak diren desberdintasunak detektatu ditugu bihotz gutxiegitasuna duten gaixo gizenen eta kontroletako leptina kontzentrazioen artean (p<0,05). Aldiz, ez dugu erlazio nabarmenik detektatu bihotz gutxiegitasuna duten gaixo gizenen eta ez-gizenen grelina mailen artean.
OndorioakBaliteke bihotz gutxiegitasuna duten gaixo gizenen eta ez-gizenen arteko desberdintasun metaboliko eta hormonal batzuk, hala nola leptina maila altuak, kardiobabesleak izatea.
La insuficiencia cardiaca (IC) es un síndrome clínico complejo que presenta una elevada prevalencia1–3. Además, dado que la edad es el principal factor de riesgo para desarrollar IC4,5, su incidencia continúa aumentando por el envejecimiento de la población. A pesar de los avances terapéuticos que han conseguido mejorar la calidad de vida y aumentar la supervivencia de estos pacientes6–14, el pronóstico de este síndrome sigue siendo malo y se asocia a una alta morbimortalidad1,15. Debido a esto, se ha considerado que la IC es una de las enfermedades en las que es más rentable el tratamiento16.
Desde un punto de vista operativo, podemos considerar la IC como el síndrome caracterizado por la presencia de síntomas y signos de hipertensión venosa pulmonar (disnea) y/o sistémica (edemas) o de bajo gasto cardiaco (fatiga), atribuibles a una disfunción mecánica del corazón17–19. La disfunción mecánica puede ser debida a disfunción sistólica (por la pérdida de fuerza contráctil del miocardio y/o hipertrofia compensadora insuficiente, «afterload mismatch»), disfunción diastólica (dificultad de llenado por una disminución de la distensibilidad o de la relajación ventricular) o por obstrucción mecánica (estenosis tricúspide, estenosis mitral, mixoma)17,18.
A pesar de la alta prevalencia de este síndrome, su diagnóstico clínico continúa siendo un desafío, sobre todo en los pacientes crónicos y en aquellos con enfermedades asociadas tales como obesidad o enfermedad pulmonar. No existe un estándar absoluto y los signos y los síntomas de la IC no son ni específicos ni sensibles para un diagnóstico preciso20–22; además, el ecocardiograma no siempre es accesible y es una exploración cara2.
La leptina es un regulador de la homeostasis energética, producido a nivel de los adipocitos. Tiene acciones cardiovasculares que le atribuyen un posible papel en el desarrollo de este tipo de enfermedades. Sin embargo, los estudios clínicos demostraron resultados contradictorios23.
Las mutaciones en el gen OB humano son poco frecuentes y la mayoría de las personas obesas expresan leptina, presentando niveles superiores en sangre que los no obesos, lo cual sugiere fenómenos de resistencia a su acción fisiológica24.
En 1995 Tartaglia et al.25 identificaron el receptor de la leptina (OB-R). Los receptores más largos (OB-Rb) predominan en el hipotálamo y sus funciones consisten en mediar las acciones de la leptina a nivel del SNC. Presentan dominios extracelular, transmembranal e intracelular, lo que indica una posible función de transducción de la señal al interior de la célula. Las formas cortas (OB-Ra, OB-Rc, OB-Rd y OB-Rf) se localizan, además de en el hipotálamo, en tejidos como el cerebro, los riñones y los pulmones, entre otros. Carecen de dominio intracelular y sus funciones se han relacionado con el transporte y la aclaración de la leptina y con la regulación del sistema inmune, entre otras. El receptor más pequeño, la isoforma OB-Re, carece de dominio intracelular. Parece probable que este receptor, al ser una forma soluble, esté relacionado con el transporte de leptina en plasma y a través de la barrera hematoencefálica.
Existe una gran similitud en la estructura de los receptores humanos y de rata, presentando una homología del 71% para el dominio intracelular y un 78% para el extracelular26.
En receptores de ratones se han encontrado numerosas mutaciones afectando a casi todas las isoformas y provocando por tanto una fijación deficiente de leptina. En humanos, por el contrario, se han referido solo mutaciones aisladas27.
La unión de la leptina al receptor es un proceso en el que están implicadas las proteínas JAK (janus activated kinasas) y STAT3 (signal transducer and activators of transcription), que estimulan la transcripción de los genes blanco sensibles.
La grelina es una hormona sintetizada básicamente por el estómago y, en cantidades menores, por el intestino y, también, por la hipófisis, el riñón, la placenta y el hipotálamo. La grelina estimula la liberación de somatotropina (hormona del crecimiento) y a través de esta tiene un papel clave en la homeostasis energética. En líneas generales, el estómago produce grelina y esta posee una función orexígena, es decir, de estímulo del apetito. Después de la ingesta, los niveles de grelina bajan (por acción de otras hormonas como la insulina o la leptina). La grelina, además de estimular el apetito, limita el metabolismo lipídico y, de este modo, favorece el aumento de las reservas grasas en el organismo28. Presenta un ritmo circadiano, muestra grandes fluctuaciones a lo largo de las 24 horas, pero estas son similares tanto en los individuos delgados como en los obesos. Sin embargo, se observa que la grelina presenta un aumento por la noche, durante las horas de sueño, que en los sujetos obesos es más poco marcada que en los delgados28.
La obesidad es una de las «epidemias» de nuestro siglo junto al exceso de peso. El sobrepeso se define como la presencia de un índice de masa corporal (IMC) entre 25 y 29,9kg/m2 y la obesidad por un IMC>30kg/m229. Se han propuesto diferentes clasificaciones. Es más útil utilizar el IMC (peso en kilogramos dividido por el cuadrado de la talla en metros) que el perímetro de la cintura para identificar a las personas con obesidad, ya que la altura y el peso son medidas simples y rutinarias que se calculan fácilmente en contraste con la estimación del perímetro de la cintura, que ni se realiza rutinariamente ni su medida está bien estandarizada30.
Además, el IMC se ha usado con mucha frecuencia para definir la obesidad en los Estados Unidos y en Europa y la clasificación de peso normal, sobrepeso y obesidad se basa en el uso del IMC, lo mismo que las directrices actuales sobre el uso adecuado del tratamiento farmacológico de la obesidad30.
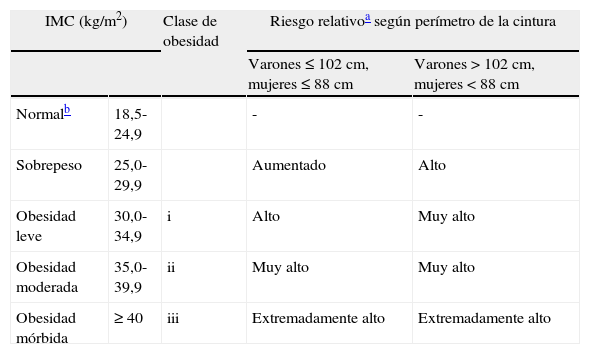
Aunque la obesidad central se ha propuesto como un factor de riesgo cardiovascular, el IMC también es un buen predictor de los efectos negativos de la obesidad sobre la glucosa, los lípidos plasmáticos y la presión arterial31 (tabla 1). Por otra parte, el IMC y el perímetro de la cintura están estrechamente relacionados con un coeficiente de correlación de aproximadamente r=0,932. Además, en los pacientes con un IMC≥35kg/m2 los puntos de corte mencionados en la tabla 1 para el perímetro de la cintura pierden su valor para predecir el incremento del riesgo.
Clasificación del sobrepeso y de la obesidad según el índice de masa corporal, el perímetro de la cintura y el riesgo asociado
| IMC (kg/m2) | Clase de obesidad | Riesgo relativoa según perímetro de la cintura | ||
| Varones≤102cm, mujeres≤88cm | Varones>102cm, mujeres<88cm | |||
| Normalb | 18,5-24,9 | - | - | |
| Sobrepeso | 25,0-29,9 | Aumentado | Alto | |
| Obesidad leve | 30,0-34,9 | i | Alto | Muy alto |
| Obesidad moderada | 35,0-39,9 | ii | Muy alto | Muy alto |
| Obesidad mórbida | ≥ 40 | iii | Extremadamente alto | Extremadamente alto |
Actualmente se acepta que la obesidad, además de ser un factor de riesgo para desarrollar IC, es una entidad que por sí misma puede originar una cardiomiopatía, la cardiomiopatía por obesidad33, entidad que es diferente a otras cardiomiopatías producidas por procesos que se asocian frecuentemente con la obesidad tales como la hipertensión arterial, la arteriosclerosis coronaria, la apnea del sueño y la diabetes. Se cree que la gravedad de esta cardiomiopatía se relaciona con la duración y la severidad de la obesidad34 e inicialmente se caracteriza por un fracaso cardiaco debido a aumento del gasto cardiaco. La cardiomiopatía por obesidad produce disfunción sistólica35 y diastólica, hipertrofia ventricular izquierda36 y aumenta las presiones de llenado del ventrículo izquierdo. En los pacientes con obesidad clase 4, la enfermedad cardiovascular es la principal causa de muerte37. El aumento del IMC se ha asociado con un aumento del riesgo de sufrir ICC38.
En los pacientes con sobrepeso y en los obesos resulta especialmente dificultoso el diagnóstico de IC. Es frecuente que presenten comorbilidad asociada, por ejemplo, a insuficiencia ventilatoria restrictiva, cuyos síntomas pueden semejar a los de la IC. También es frecuente en estos pacientes que los resultados de las exploraciones complementarias que ayudan a diagnosticar la IC no sean de buena calidad. Por ejemplo: una mala ventana acústica dificulta o impide la correcta interpretación de un ecocardiograma, una de las técnicas fundamentales en el diagnóstico de la IC.
Material y métodosHemos estudiado a un grupo de 87 pacientes del Servicio de Cardiología con el diagnóstico inicial desde urgencias de IC. Para la comparación de los resultados se ha utilizado un grupo de 53 pacientes sin IC y edades aproximadas a las del grupo anterior.El péptido natriurético cerebral (BNP) es un parámetro bioquímico útil en el diagnóstico y pronóstico de los pacientes con IC, por lo que fue el marcador clínico analítico utilizado para confirmar dicho diagnóstico.
Se excluyeron los pacientes que no quisieron participar en el estudio, y aquellos en los que no se confirmó el diagnóstico de IC; también aquellos en los que no se pudo obtener el consentimiento informado y los menores de 18 años. El resto de los pacientes fueron incluidos en el estudio.
Variables y clasificación de los pacientesCon el fin de realizar el diagnóstico diferencial de otras enfermedades que pueden cursar con síntomas parecidos a la IC, como enfermedades pulmonares, anemia, tirotoxicosis, enfermedades hepáticas, renales, metabólicas o endocrinas, a todos los pacientes incluidos en el estudio se les realizó:
- -
Historia clínica adecuada registrando la presencia o ausencia de los síntomas incluidos en los criterios de Framingham.
- -
Exploración física (presión arterial, frecuencia cardiaca, temperatura, valoración de pulsos, presión venosa, auscultación cardiovascular, valoración abdominal y de extremidades inferiores). Se anotará la presencia o ausencia de los signos incluidos en los criterios de Framingham.
- -
Ecocardiograma transtorácico en las primeras 72 horas desde el ingreso: medidas en modo M de cavidades cardiacas (aurículas, ventrículos y raíz aórtica); valoración de la función sistólica del ventrículo izquierdo (cálculo de la fracción de eyección, modo M y modo 2D y movilidad segmentaria); estudio doppler valvular (doppler color, doppler continuo y doppler pulsado, cuantificación de insuficiencia y/o estenosis si las hubiese); estudio de la función diastólica (ondas E, A, cociente E/A, tiempo de deceleración mitral, período isovolumétrico, relación S/D, Vp).
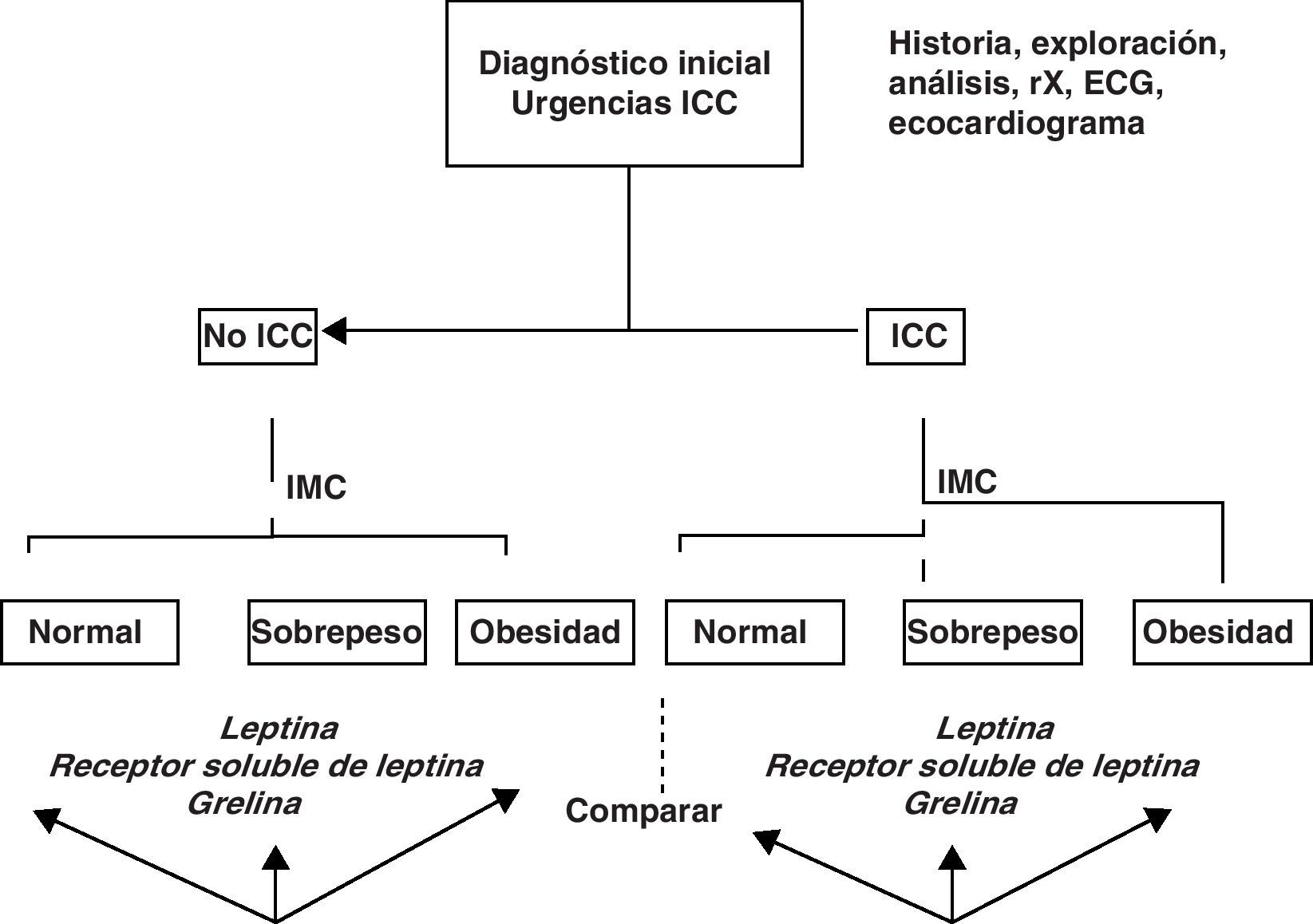
Todos los pacientes en los que se confirmó un diagnóstico alternativo al de IC que justificó el ingreso o que no cumplían los criterios exigidos para el diagnóstico de IC (tabla 2) se incluyeron en el grupo de pacientes sin IC.
El grupo de pacientes con IC incluirá a aquellos que presenten 2 criterios mayores de Framingham o uno mayor y 2 menores (tabla 3) acompañados de disfunción mecánica cardiaca evidenciada mediante un ecocardiograma (tabla 4).
Criterios de Framingham
| Criterios mayores |
| Disnea/disnea paroxística nocturna |
| Ingurgitación yugular |
| Reflujo hepatoyugular |
| Crepitantes |
| Edema agudo de pulmón |
| Galope |
| Criterios menores |
| Edemas maleolares |
| Tos nocturna |
| Disnea de esfuerzo |
| Hepatomegalia |
| Derrame pleural |
| Taquicardia |
| Otros |
| Nicturia (frecuente y precoz) |
| Taquipnea (> 30) |
| Bradicardia intensa |
Se establece el diagnóstico con 2 criterios mayores o uno mayor y 2 menores.
Por lo que se refiere a la disfunción mecánica cardiaca, podemos distinguir 3 tipos (tabla 4): disfunción ventricular sistólica, disfunción ventricular diastólica y la obstrucción mecánica. La disfunción ventricular sistólica se define por la depresión de la fracción de eyección del ventrículo izquierdo<50%. La disfunción ventricular diastólica se define por la anormalidad inequívoca de los índices de relajación o distensibilidad como las ondas E, A, cociente E/A disminuido, tiempo de deceleración mitral aumentado o período isovolumétrico aumentado, o alteración S/AVp con una fracción de eyección normal en ausencia de cardiomegalia (volumen telediastólico>110ml/m2, diámetro telediastólico>6cm) y en presencia de una cardiopatía con hipertrofia, insuficiencia valvular aguda o miocardiopatía. Por último, la obstrucción mecánica provoca IC derecha o izquierda sin afectar directamente a la función ventricular (estenosis mitral o tricuspídea, mixoma).
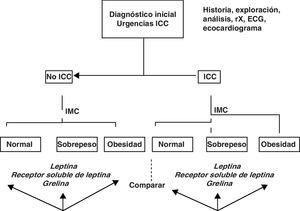
En aquellos pacientes en los que el registro ecocardiográfico sea deficiente, el diagnóstico de IC se basará en los criterios clínicos una vez excluidas otras causas con la ayuda de las demás exploraciones complementarias. Dentro del grupo de pacientes con IC se distinguirán 3 subgrupos según el IMC: normal (IMC<25kg/m2), sobrepeso (IMC>25kg/m2 y<30kg/m2) y obesidad (IMC>30kg/m2). La figura 1 muestra el algoritmo de esta clasificación de forma resumida.
Se realizó un seguimiento de los pacientes al mes, a los 6 meses y al año para valorar la presencia de muerte, muerte cardiovascular, IAM, ángor o ICC.
El seguimiento se realizará telefónicamente o mediante la historia clínica del paciente o de los informes médicos por personal médico (adjuntos o residentes); en los casos en los que sea posible, mediante valoración personal del paciente.
- -
Radiografía de tórax, proyecciones posteroanterior y lateral. Se registrará la presencia o ausencia de derrame pleural, criterio menor de Framingham.
- -
Determinaciones analíticas: leptina, su receptor soluble, grelina, glucosa, urea, creatinina, GOT, GPT, GGT, FA, LDH, iones, colesterol total, colesterol HDL, colesterol LDL, triglicéridos, hemograma, coagulación y hormonas tiroideas; análisis de orina: sistemático y sedimento.
- -
Determinación de leptina, su receptor soluble y grelina: se realizó mediante los correspondientes métodos de enzimoinmunoensayo (DSL, Beckman Coulter).
- -
Determinación de la fracción N-terminal del propéptido natriurético cerebral: se ha realizado por un método ECLIA (inmunoensayo de electroquimioluminiscencia) tipo sándwich, automatizado en un analizador Elecsys (Roche Diagnostics).
La elección de este método ha estado condicionada por los siguientes factores: alta sensibilidad analítica (5pg/mL); gran intervalo de medida: hasta 35.000pg/mL; buena precisión intra e interensayo; bajo tiempo de respuesta analítica: 18min; posibilidad de análisis urgente; mayor estabilidad de las muestras y mayor vida media en sangre respecto a ANP y BNP; pocas exigencias en cuanto a condiciones de extracción de la muestra, pudiendo ser en suero o plasma; no tiene ritmo circadiano; y un valor predictivo similar a BNP para diagnóstico de IC.
La asociación de los criterios clínicos con los ecocardiográficos nos permitirá tener una relativa seguridad de que en los pacientes incluidos en el grupo de IC el diagnóstico será fiable. Por el contrario, es posible que al aumentar la exigencia en el diagnóstico, algunos de los pacientes clasificados como sin IC puedan tener este síndrome en fases más iniciales. Por otro lado, en aquellos en los que el ecocardiograma no sea valorable, el diagnóstico dependerá de la valoración clínica. No obstante, las pautas seguidas para diagnosticar a los pacientes son las recomendadas actualmente por las principales sociedades científicas cardiológicas y esta dificultad para el diagnóstico es lo habitual en la práctica diaria.
Se podría argumentar que al ser una serie consecutiva de pacientes diagnosticados de IC en el Servicio de Urgencias es posible que sean pocos los pacientes que finalmente se incluyan en el grupo sin IC. No obstante, estudios previos demuestran que no es así, por ejemplo, un 43% de los diagnósticos clínicos de IC realizados en pacientes que acuden por disnea a un servicio hospitalario de urgencias era inseguro o dudoso39 y en el estudio de Remes et al.40 aproximadamente la mitad de los diagnósticos de IC en atención primaria era erróneo.
Por lo tanto, si estimamos en un 40-45% el error en la clasificación inicial, sería de esperar que de los 87 pacientes que se incluyeron en el estudio, alrededor de 30 no presentaran IC.El BNP es un parámetro bioquímico útil en el diagnóstico y pronóstico de los pacientes con IC, por lo que fue el marcador clínico analítico utilizado para confirmar dicho diagnóstico.
ResultadosHemos obtenido los siguientes resultados en el estudio al poner a punto las técnicas:
La curva de calibración de la técnica de inmunoensayo ELISA (DSL, Beckman Coulter) de la leptina se realizó procesando los calibradores por duplicado con los siguientes valores: 0, 0,5, 2,5, 10, 25 y 50ng/ml. Se obtuvo una curva de calibración y=64,94x+0,13 para el cálculo de las muestras y de los controles.
Se obtuvo un valor medio de leptina del control bajo, utilizado en la técnica de 2,34±1,2ng/mL y del control alto de 9,8±3,2ng/mL.
La curva de calibración de la técnica de inmunoensayo ELISA (DSL, Beckman Coulter) del receptor soluble de leptina se realizó procesando los calibradores por duplicado con los siguientes valores: 0, 2,5, 5, 25, 100 y 200ng/mL. Se obtuvo una curva de calibración y=123,95x-5,92, para el cálculo de las muestras y de los controles.
Se obtuvo un valor medio de receptor soluble de leptina del control bajo de 7,5±3,9ng/ml y del control alto de 108,61±17,4ng/mL.
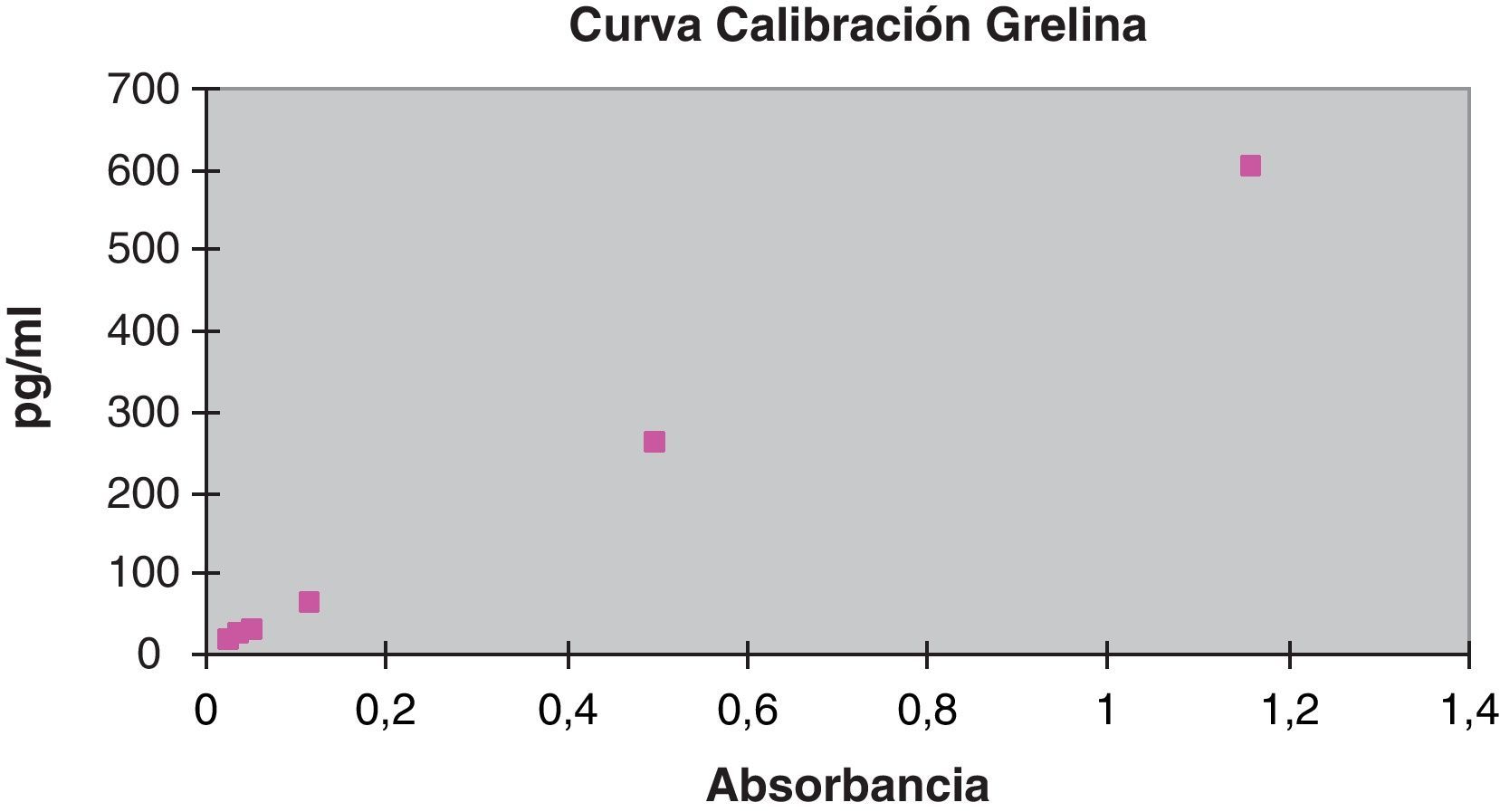
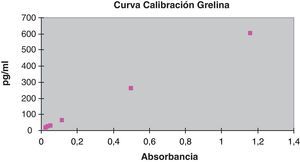
La curva de calibración de la técnica de inmunoensayo ELISA (DSL, Beckman Coulter) de la grelina se realizó procesando los calibradores por duplicado con los siguientes valores: 0, 8, 30, 100, 260 y 600pg/ml. Se obtuvo una curva de calibración y=515,55x+3,56, para el cálculo de las muestras y de los controles.
La recta de calibración de la hormona grelina aparece recogida en la figura 2.
Se obtuvo un valor medio de grelina del control bajo de 59,87±21,34pg/mL y del control alto de 108,45±31,49pg/mL.
Cuando procedimos a estudiar los valores medios de los marcadores leptina, receptor soluble de leptina y grelina en los grupos sin IC y en el grupo de estudio con IC, se obtuvieron los siguientes resultados:
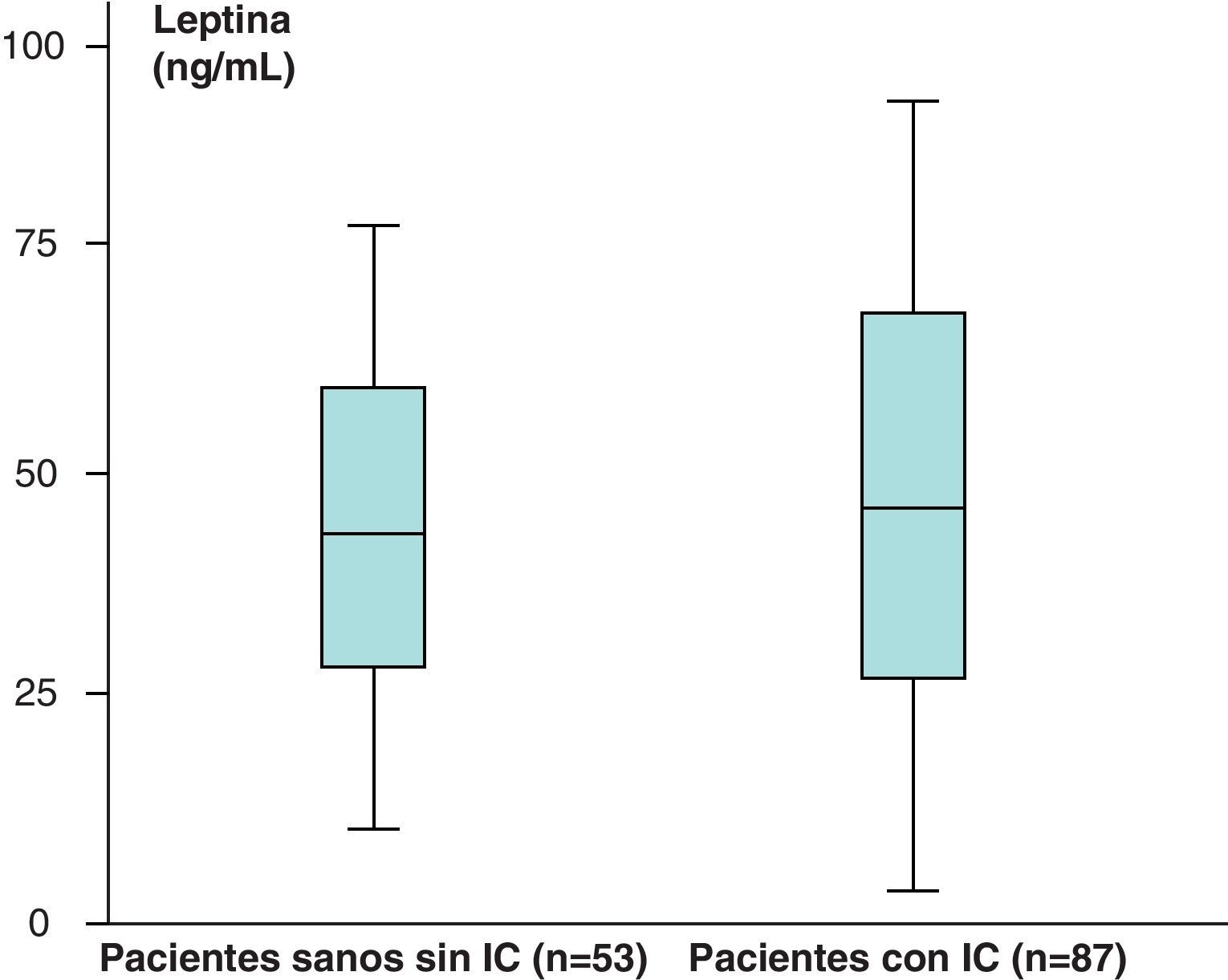
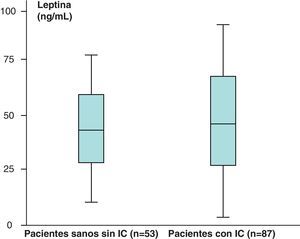
Los valores medios de leptina de los pacientes sanos sin IC (n=53) obtenidos fueron de 38,23±39,81ng/ml y en los pacientes con IC (n=87) de 46,58±35,78ng/mL, que aparecen recogidos en la figura 3.
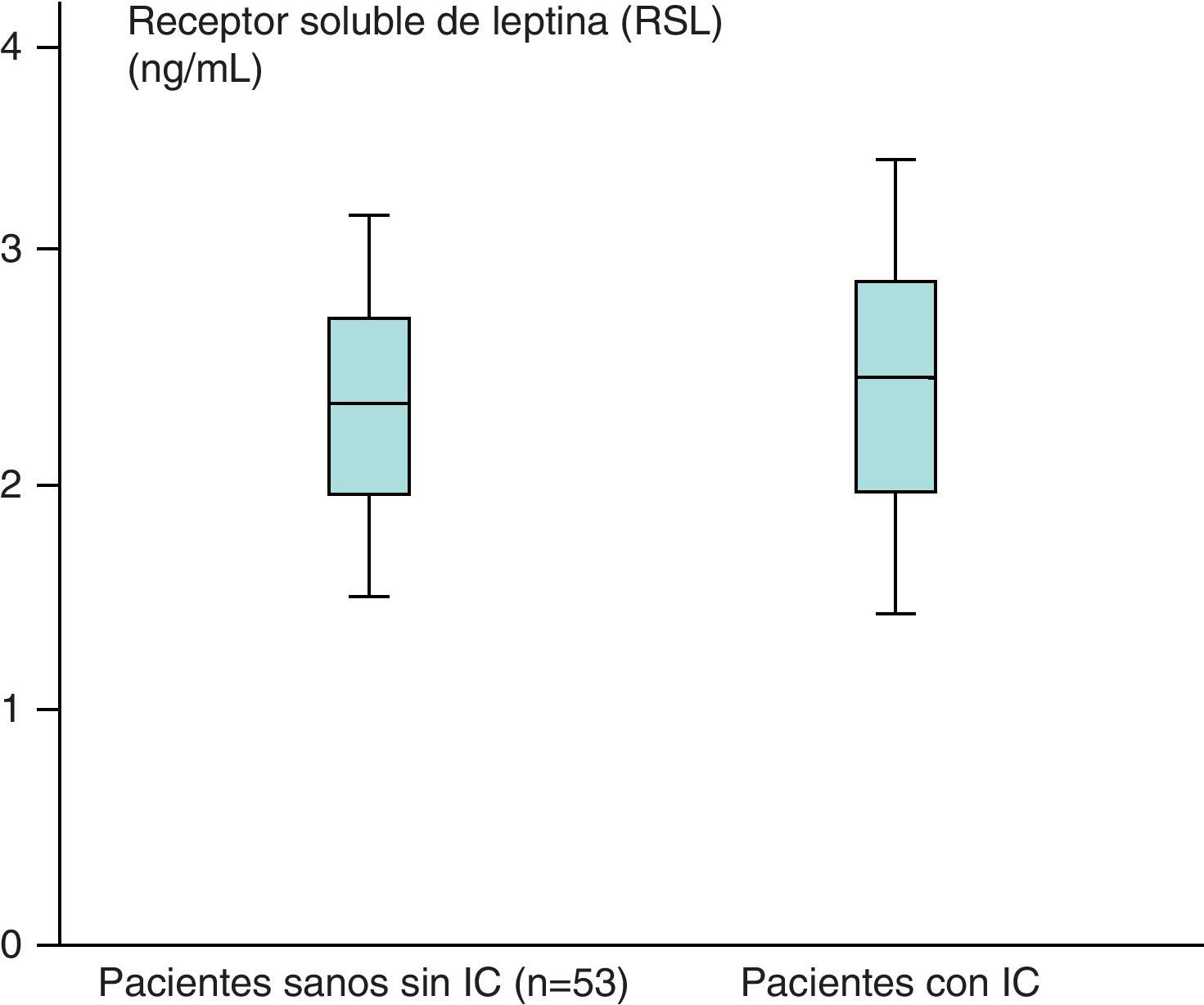
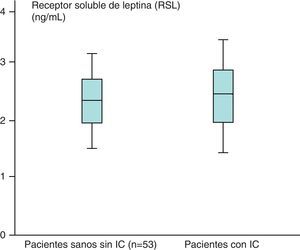
Los valores medios de los pacientes sanos para el receptor soluble de leptina (n=53) obtenidos fueron de 2,31±1,48ng/mL y en los pacientes con IC (n=87) de 2,39±1,73ng/ml, que aparecen recogidos en la figura 4.
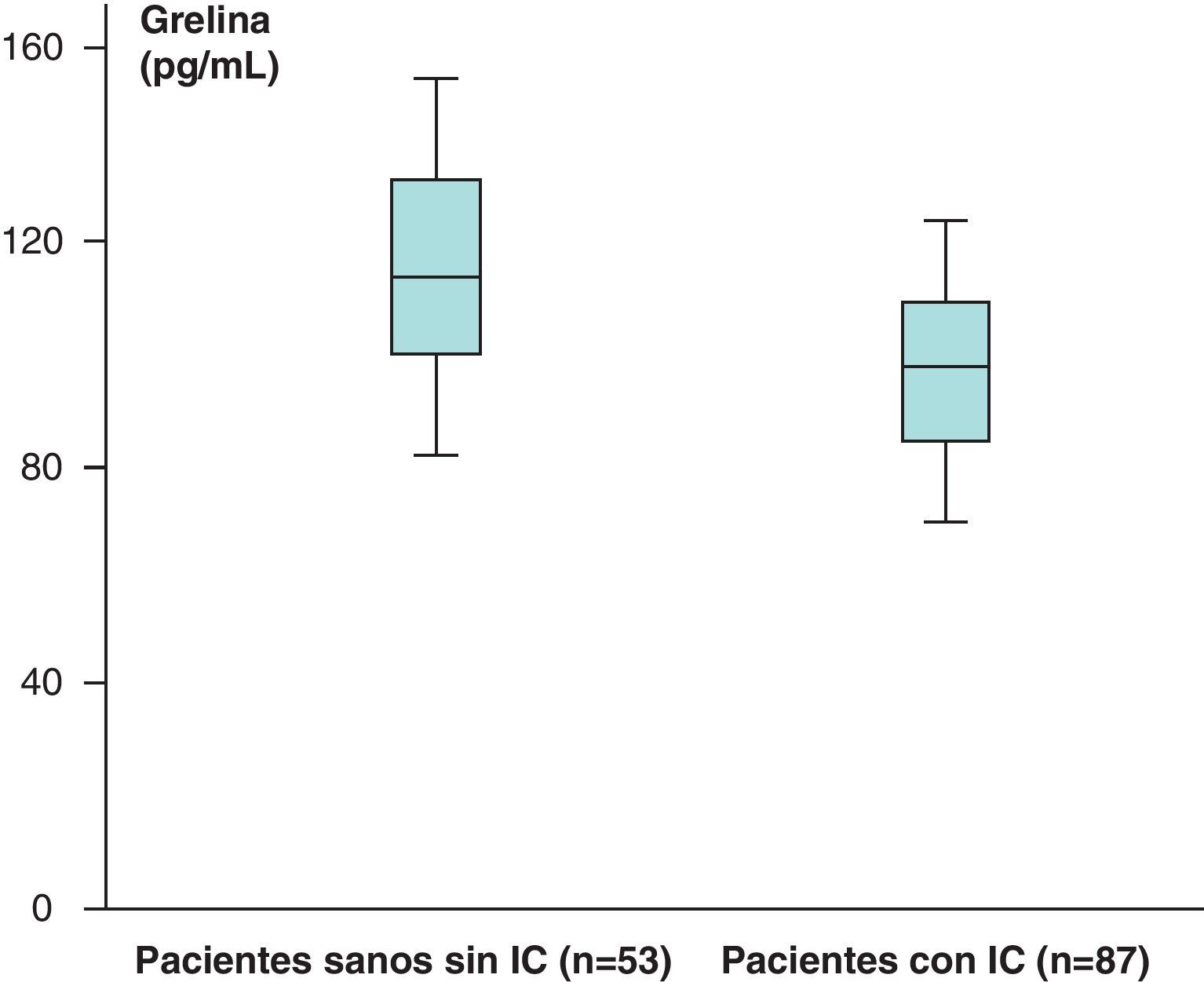
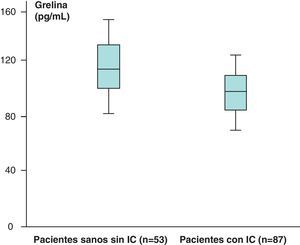
Los valores medios de grelina de los pacientes sanos sin IC (n=53) obtenidos fueron de 121,76±31,51pg/mL y en los pacientes con IC (n=87) de 112,84±19,9pg/mL, que aparecen recogidos en la figura 5.
El IMC obtenido en el grupo de pacientes sanos sin IC fue de 27,38±4,6 y en el grupo de 87 pacientes con IC fue de 29,0±4,71.
En nuestra serie, cuando estudiamos en un grupo de 30 pacientes con IC los niveles de BNP y los correlacionamos con los valores de leptina y receptor soluble de leptina, encontramos una asociación estadísticamente significativa (p<0,05) en ambos casos.
DiscusiónLa homeostasis energética es el conjunto de mecanismos que permiten un buen ajuste de las reservas lipídicas, que han de ser lo suficientemente importantes como para asegurar el mantenimiento de las funciones durante los períodos de inanición, pero que no pueden sobrepasar un límite que afecte a las funciones vitales41–43.
Hemos encontrado un aumento en los valores medios de leptina y diferencias estadísticamente significativas (p<0,05) al comparar los valores de leptina de los pacientes sanos sin IC (n=53), 38,23±39,81ng/mL, con respecto a los de los pacientes con IC (n=87), de 46,58±35,78ng/mL. Sin embargo, no hemos encontrado diferencias estadísticamente significativas (p>0,05), aunque sí valores más aumentados, al comparar los valores medios del receptor soluble de leptina de los pacientes sanos sin IC (n=53) con respecto a los obtenidos en el grupo de pacientes con IC (n=87) (2,31±1,48 vs 2,39±1,73ng/mL) (p>0,05). En el caso de la hormona grelina, sin embargo, se han encontrado valores disminuidos y estadísticamente significativos al comparar los valores medios del grupo de pacientes sanos sin IC con respecto al grupo de pacientes con IC (p<0,05) (121,76±31,51 vs 112,84±19,9pg/mL).
Los resultados obtenidos al estudiar el IMC en el grupo de pacientes sanos sin IC fue de 27,38±4,6 y en el grupo de 87 pacientes con IC fue de 29,0±4,71.
Mientras las concentraciones plasmáticas de grelina disminuyen en la IC, tanto las de leptina como las de su receptor soluble aumentan. Adicionalmente, ambas resultan en asociación con los niveles de BNP.
Hemos obtenido una diferencia significativa en los niveles de grelina entre pacientes con IC y controles (p<0,05).
También hemos obtenido diferencias estadísticamente significativas en las concentraciones de leptina entre pacientes obesos con IC y controles (p<0,05).
Sin embargo, no hemos hallado asociación significativa alguna en los niveles de grelina entre obesos y no obesos con IC.
Por tanto, la leptina, que es un regulador de la homeostasis energética producido a nivel de los adipocitos, tiene acciones cardiovasculares que le atribuyen un posible papel en el desarrollo de este tipo de enfermedades43,44. La leptina es una hormona producida básicamente por el tejido adiposo. La principal acción es la limitación de la acumulación de grasas. Constituye el principal regulador a largo término del peso corporal (y, básicamente, del peso graso) y de la homeostasis energética32,45.
La grelina es una hormona sintetizada básicamente por el estómago y, en cantidades menores, por el intestino y, también, por la hipófisis, el riñón, la placenta y el hipotálamo.
La adiponectina es una hormona que, en la medida en que se sabe, tan solo es segregada por el tejido adiposo (tejido graso)28. Desempeña una importante función metabólica (refuerza la acción de la insulina) y, de hecho, unos niveles bajos de adiponectina indican un riesgo de desarrollar diabetes tipo 231.
ConclusionesPodemos concluir que en la actualidad nos enfrentamos a 2 grandes epidemias, la de la IC y la del exceso de peso (obesidad). Ambas entidades se caracterizan por una elevada morbimortalidad, por lo que es necesario un diagnóstico precoz para mejorar la calidad de vida y la supervivencia de estos pacientes. Sin embargo, no existe un método estándar para diagnosticar la IC y en los pacientes obesos o con sobrepeso el diagnóstico se dificulta aún más por la comorbilidad asociada. Recientemente se ha visto que las concentraciones de leptina aumentan de forma directamente proporcional al IMC y se ha demostrado que además tiene acciones cardiovasculares que podrían favorecer el desarrollo de la cardiomiopatía por obesidad, pero se desconoce su utilidad diagnóstica en los pacientes obesos con IC23.
Con respecto al IMC estudiado en el grupo de pacientes sanos sin IC, este fue de 27,38±4,6, y en el grupo de 87 pacientes con IC el IMC obtenido fue de 29,0±4,71.
Hemos encontrado un aumento en los valores medios de leptina, así como diferencias estadísticamente significativas (p<0,05) al comparar los valores de leptina de los pacientes sanos sin IC (n=53), 38,23±39,81ng/ml, con respecto a los pacientes con IC (n=87), de 46,58±35,78ng/mL.
No hemos encontrado diferencias estadísticamente significativas (p>0,05), aunque sí valores más aumentados al comparar los valores medios del receptor soluble de leptina de los pacientes sanos sin IC (n=53) con respecto a los obtenidos en el grupo de pacientes con IC (n=87) (2,31±1,48 vs 2,39±1,73ng/mL) (p>0,05).
En el caso de la hormona grelina, sin embargo, se han encontrado valores disminuidos y estadísticamente significativos al comparar los valores medios del grupo de pacientes sanos sin IC con respecto a los del grupo de pacientes con IC (p<0,05). Esto puede ser debido a que la grelina, que es una hormona que estimula la liberación de somatotropina (hormona del crecimiento), a través de esta tiene un papel clave en la homeostasis energética, ya que el estómago produce grelina y esta posee una función orexígena, es decir, de estímulo del apetito. Después de la ingesta, los niveles de grelina bajan (por acción de otras hormonas como la insulina o la leptina). La grelina, además de estimular el apetito, limita el metabolismo lipídico y, de este modo, favorece el aumento de las reservas grasas en el organismo.
Además, también se han elaborado otras hipótesis en base a:
- -
Que la obesidad es el resultado de una desregulación de unos circuitos centrales de señales neuropeptídicas y monoaminérgicas.
- -
Que la grelina es un péptido orexígeno (estimula el apetito) pero también modulador de otros sistemas hormonales (somatotropina, etc.).
- -
Y que la falta de aumento nocturno de grelina alteraría todos los demás sistemas hormonales.
Los autores declaran no tener ningún conflicto de intereses.