El tumor desmoplásico de células pequeñas y redondas es un tumor poco frecuente y agresivo que afecta a varones jóvenes. Presentamos el caso de un varón de 31 años con tumor desmoplásico de células pequeñas y redondas estadio iv diagnosticado en el contexto de dolor abdominal y hemoperitoneo. Se decide intervención, realizándose hemostasia y biopsia de nódulos. Tras la cirugía se inicia tratamiento con quimioterapia. El paciente continúa vivo a los 7 meses de la intervención. El tumor desmoplásico de células pequeñas y redondas normalmente surge en el peritoneo abdominal o pélvico. Está asociado a signos y síntomas inespecíficos, pero con un perfil citogenético único [t(11;22)(p13;q12) EWS-WT1]. El tratamiento combinado de quimioterapia, radioterapia y cirugía ha demostrado los mejores resultados. El pronóstico es pobre, con una supervivencia total del 15% a los 5 años.
Desmoplastic small-round-cell tumor is an uncommon highly aggressive type of cancer that affects young men. We present the case of a 31-year-old man with stage iv desmoplastic small-round-cell tumor, diagnosed in the context of abdominal pain and hemoperitoneum. Surgery confirmed extensive hemoperitoneum and revealed multiple peritoneal nodules. Hemostasis was performed, a biopsy was taken, and chemotherapy was initiated. Seven months after surgery, the patient is still alive. Desmoplastic small-round-cell tumor usually occurs in the abdominal or pelvic peritoneum and is associated with nonspecific signs and symptoms but with a unique cytogenetic profile [a translocation t(11;22)(p13;q12) affecting the EWS and WT1 genes]. The best outcomes are produced by a combination of chemotherapy, radiotherapy and surgery. Nevertheless, the prognosis of desmoplastic small-round-cell tumor is poor, with an overall 5-year survival rate of 15%.
Zelula txikiko eta biribileko tumore desmoplasikoa ezohikoa eta oldarkorra da, eta gizonezko gazteei eragiten die. Kasu honetan, 31 urteko gizonezko bat dugu, zelula txikiko eta biribileko tumore desmoplasikoa duena. iv estadioan diagnostikatu zaio, bularreko eta hemoperitoneoko minaren testuinguruan. Ebakuntza egitea erabaki, eta hemostasia eta noduluen biopsia egiten zaio. Kirurgiaren ondoren, kimioterapiako tratamendua hasi da. Pazientea bizirik dago, ebakuntza egin eta zazpi hilabetera. Zelula txikiko eta biribileko tumore desmoplasikoa abdomeneko edo pelbiseko peritoneoan sortu ohi da. Sintoma eta zeinu zehaztugabeei lotuta ageri da, baina profil zitogenetiko bakarra du [t(11;22)(p13;q12) EWS-WT1]. Kimioterapia, erradioterapia eta kirurgia konbinatzen dituen tratamenduak eman ditu emaitza onenak. Pronostikoa pobrea da, 5 urtera kasu guztien % 15k irauten baitu bizirik.
El tumor desmoplásico de células pequeñas y redondas (TDCPR) es una neoplasia poco frecuente y altamente agresiva. Se han descrito en la literatura mundial menos de 200 casos1–7.
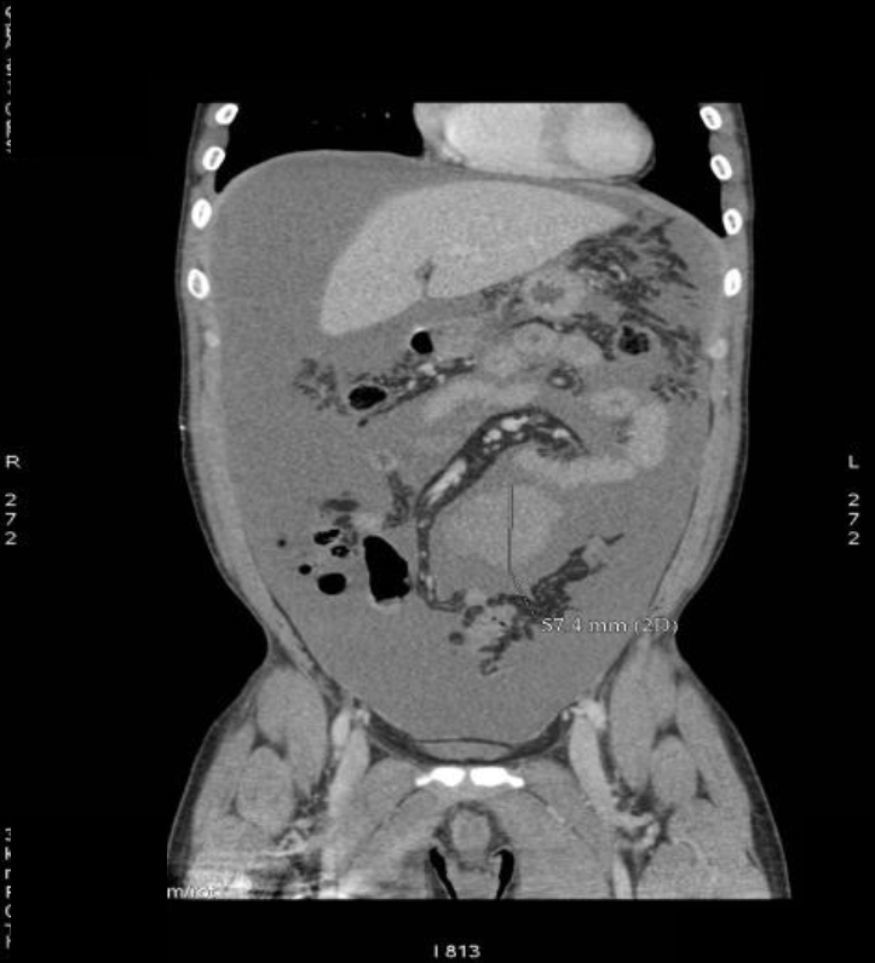
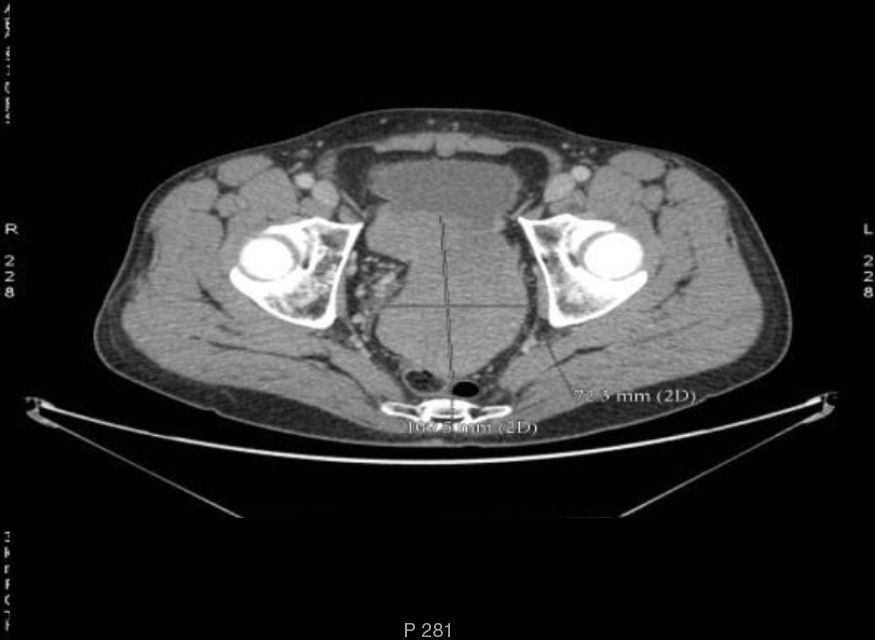
Caso clínicoPresentamos el caso de un varón de 31 años, con antecedente de osteosarcoma osteoblástico de fémur derecho diagnosticado hace 6 años y tratado con quimioterapia neoadyuvante, cirugía y quimioterapia posterior. Se le hicieron controles anuales sin evidencia de enfermedad. Consulta por dolor y distensión abdominal de 5 días de evolución. Exploración: abdomen distendido, doloroso sin peritonismo. Analítica: hemoglobina 7,9g/dl; normocítica y normocrómica. Ecografía-tomografía axial computarizada (TAC) toracoabdominopélvica: masas sólidas peritoneales múltiples, la mayor en pelvis (11×8cm), líquido libre de alta densidad e infiltración nodular del omento mayor compatible con carcinomatosis peritoneal. Implantes nodulares pleurales bilaterales (figs. 1 y 2). Punción peritoneal: positiva para células malignas sobre fondo hemático.
Ante la duda diagnóstica, se decide laparoscopia. Hallazgos quirúrgicos: hemoperitoneo masivo (8 l), múltiples implantes peritoneales diseminados compatibles con carcinomatosis peritoneal. Hemorragia activa del peritoneo pélvico con hemostasia técnicamente difícil, por lo que se reconvierte a laparotomía. Se realiza biopsia de nódulos peritoneales, extracción de masa pélvica compatible con hematoma y hemostasia. Informe anatomopatológico: TDCPR de alto grado proliferativo. Inmunohistoquímica para detección de WT1 carboxiloterminal positiva. Reordenamiento de EWSR1 detectado mediante técnica de hibridación fluorescente in situ (FISH). Positividad para vimentina, CD99, queratina, CD57, EMA y desmina.
Con diagnóstico de TDCPR estadio iv, se decide quimioterapia paliativa (vincristina 2mg+adriamicina 75mg/m2 en 48h+ciclofosfamida 1.200mg/m2). Por apreciarse progresión de la enfermedad en TAC de control al mes, se cambia el esquema de quimioterapia a ifosfamida 1,8g/m2/día en infusión continua (con soporte de Mesna)+VP-16 100mg/m2/día por 5 días.
En la actualidad, el paciente continúa vivo a los 7 meses de la intervención, apreciándose en la última TAC de control mejoría de la enfermedad. Continúa en tratamiento con quimioterapia paliativa, habiendo recibido hasta el momento 5 ciclos.
DiscusiónEl TDCPR, descrito por primera vez por Gerald y Rosai en 1989, es una entidad rara que afecta sobre todo a varones jóvenes (entre 15 y 35 años) y que sigue una evolución clínica agresiva1–7.
El TDCPR típicamente surge en el peritoneo abdominal o pélvico1–3,5–7. Aunque su origen no ha sido identificado, se cree que surge del mesotelio2,4,6. Tiene tendencia a diseminación omental y peritoneal, afectación de los ganglios linfáticos y metástasis hematógenas, especialmente al hígado1,5.
La clínica es inespecífica1,3,5–7. No existen anormalidades específicas en los datos analíticos. Se ha descrito un aumento del CA 125 en más del 86% de casos de TDCPR intraabdominal1,3.
Las pruebas de imagen revelan múltiples nódulos tumorales heterogéneos por la cavidad peritoneal5,6. La mayoría de los pacientes presentan una masa dominante mayor de 10cm6, como en nuestro caso. Radiológicamente, el TDCPR es similar a otros tumores intraabdominales primarios, lo que, junto con la clínica inespecífica, exige una biopsia de tejido para el diagnóstico1,5.
El diagnóstico diferencial debe realizarse con otros tumores de células pequeñas y redondas como, por ejemplo, el sarcoma de Ewing/PNET1–3,6,7. Se revisó la anatomía patológica del osteosarcoma del paciente, confirmándose el diagnóstico y descartando un sarcoma de Ewing.
Se han descrito perfiles característicos del TDCPR1:
Examen microscópico: el tumor normalmente forma nidos o hebras de células pequeñas redondas integrados en el estroma desmoplásico. Las células tumorales son de tamaño pequeño a medio con escaso citoplasma, núcleo redondo u ovalado y figuras mitóticas visibles1,3,5–7.
Inmunohistoquímica: las células del TDCPR muestran una diferenciación multifenotípica con expresión de marcadores epiteliales, mesenquimales, miogénicos y neurales1,3,7, como expresa nuestro paciente.
Citogenética: se ha descubierto recientemente una anomalía citogenética específica del TDCPR, la translocación (11;22)(p13;q12) de los genes EWS-WT1. Esta translocación se demuestra mediante FISH o técnica de reacción en cadena de la polimerasa en transcripción reversa. Se considera el marcador diagnóstico definitivo1–7.
En cuanto al tratamiento, las principales modalidades son:
- -
Resección quirúrgica: una resección completa raramente es posible1,3–6. La cirugía citorreductora paliativa tiene un papel en la mejoría de síntomas1.
- -
Quimioterapia combinada: han sido ensayados muchos regímenes de quimioterapia, no logrando todavía resultados curativos ni un impacto significativo en la supervivencia a largo plazo1.
- -
Radioterapia local: la mayoría de los estudios hablan del empleo de la radioterapia para la paliación de síntomas1,4.
La combinación de quimioterapia, radioterapia y cirugía ha demostrado los mejores resultados en varios estudios1,4.
Han sido empleadas otras terapias, pero los resultados están aún por ser evaluados (células madre autólogas, anticuerpos monoclonales, bloqueantes androgénicos, perfusión continua de quimioterapia hipertérmica intraperitoneal, etc.)1,2,4,5.
El pronóstico del TDCPR es pobre, con una supervivencia total de 15% a los 5 años. Los pacientes normalmente mueren por diseminación de la enfermedad dentro de los 3 años siguientes al diagnóstico1–7.
En conclusión, el TDCPR es una neoplasia rara y agresiva que muestra un perfil citogenético único. Su tratamiento requiere ser individualizado en cada paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.