Se realizó ablación por radiofrecuencia guiada por tomografía computarizada (TC) bajo anestesia general y cirugía mayor ambulatoria sin ingreso. La sintomatología cedió entre 0 y 5 días. En todos los casos el dolor se resolvió sin complicaciones. Ninguno ha recidivado (seguimiento entre 9 meses y 3 años). No ha habido afectación fisaria, incluso cuando la lesión era cercana a la fisis.
Computed tomography-guided radiofrequency ablation was performed under general anesthesia and in outpatient surgery. Symptoms resolved within 0–5 days. Pain resolved in all patients without complications. There were no recurrences during a follow-up of between 9 months and 3 years. No physeal involvement was observed, even when the lesion was close to the physis.
TACez gidatutako erradiofrekuentzia bidezko ablazioa egin zen, anestesia orokorrarekin eta Kirurgia Handi Anbulatorioan, ospitaleratu gabe. Sintomatologia 0–5 egunetan eten zen. Kasu guztietan mina arazorik gabe joan zen. Inor ez da berriro gaixotu (jarraipena 9 hilabete eta 3 urte bitartean egin zitzaien). Ez da nahasmenik gertatu, ezta lesioa fisisatik gertu zegoen kasuetan ere.
La ablación térmica por radiofrecuencia (RF) es una forma de electrocirugía en la que una corriente alterna de ondas de alta frecuencia (< 10 KHz; ondas electromagnéticas) pasa a través de la punta de un electrodo en el tejido corporal de forma que esa energía se disipa como calor (en un circuito cerrado). Un generador de RF produce una corriente alterna (460 kHz de frecuencia) que se transmite a la punta del electrodo, colocado en el tumor, y la corriente aplicada sale a través de electrodos de toma de tierra en parches colocados en la piel. La resistencia de las estructuras biológicas origina vibración de los iones (agitación iónica), lo que produce fricción alrededor de la punta del electrodo, a medida que los iones tratan de seguir los cambios de dirección de la corriente alterna, creando calor: ablación térmica. La RF se diferencia del electrocauterio en que en aquélla el tejido circundante al electrodo es la fuente primaria de calor más que el electrodo mismo.
La RF ha sido ampliamente utilizada en el tratamiento de tumores de partes blandas en la mama, el hígado, etc. La ablación por RF se ha utilizado en tumores óseos como el osteoma osteoide (OO) y en metástasis óseas1.
El OO es un tumor benigno cuya primera descripción la realizó Jaffe en 19352. Representa alrededor del 12 % de los tumores benignos óseos. Aparece con mayor frecuencia entre los 5 y los 40 años, pero fundamentalmente en la segunda década de la vida. Se manifiesta por un dolor continuo, pero de predominio vespertino o nocturno, independiente del ejercicio y que suele empeorar con el reposo. Cede con salicilatos y antiinflamatorios no esteroideos (AINE) (menos con alcohol).
Su evolución es hacia un dolor más evidente y nocturno. En casos excepcionales se ha descrito su desaparición espontánea. Provoca una reacción inflamatoria crónica e intensa en los tejidos circundantes, con reacción perióstica, esclerosis ósea y sinovitis, por la producción de prostaglandinas. En raros casos (niños) el dolor puede ser leve o nulo3,4. Su manifestación radiológica en huesos largos es una gran reacción perióstica: zona osteoblástica fusiforme. En la tomografía computarizada (TC) y la resonancia magnética (RM) aparece el nidus de un tamaño de entre 1,5 y 2 cm. En la localización periarticular se observa una gran inflamación local. Es raro en articulaciones (10-13 %).
En la última década es cada vez más frecuente encontrar referencias bibliográficas sobre los beneficios y la efectividad de la RF en el tratamiento del OO, sobre todo en localizaciones extraespinales y no inmediatamente adyacentes a estructuras neurovasculares5–11. En huesos de carga, la ablación por RF puede ser complementada por inyección de cemento12.
Existe suficiente evidencia acerca de la efectividad de la RF guiada por TC como tratamiento del OO del adulto, pero son escasas sus referencias en niños y adolescentes, tanto de resultados como de riesgos por las características típicas de la edad (posible lesión fisaria, etc.). El principal motivo del presente trabajo es mostrar nuestra experiencia en pacientes inmaduros (niños y adolescentes).
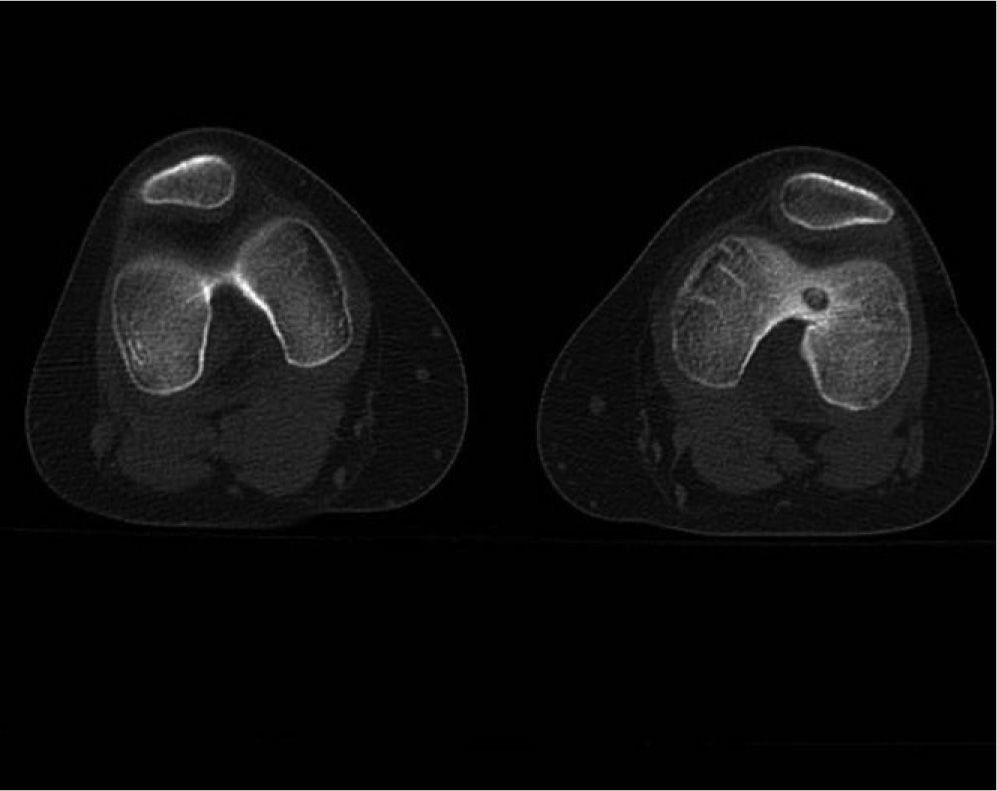
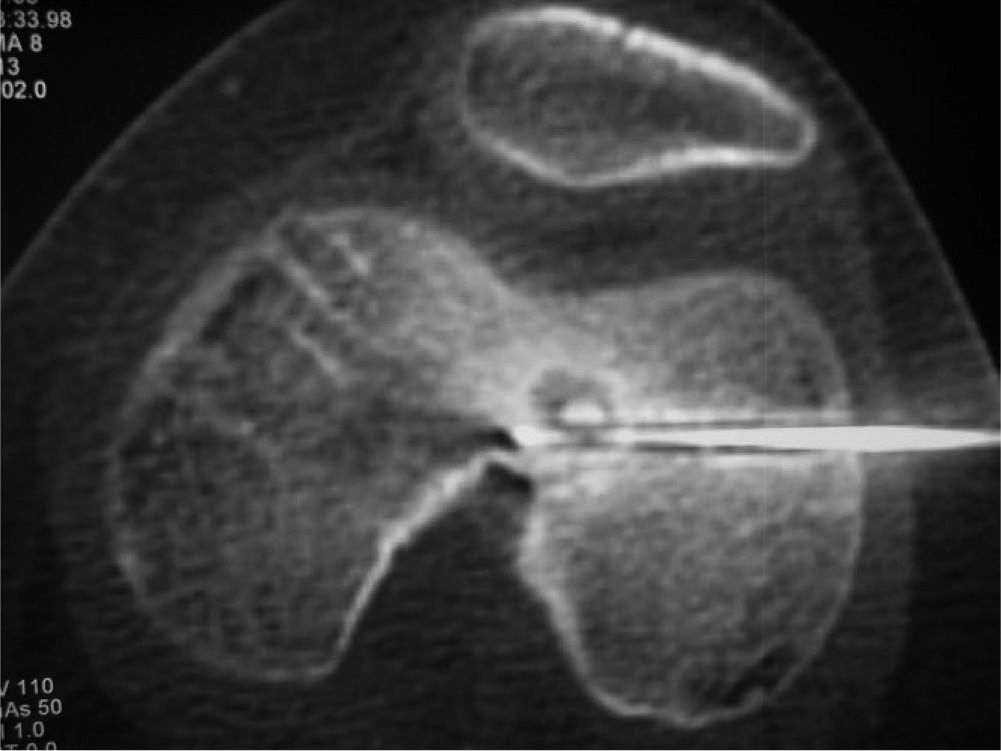
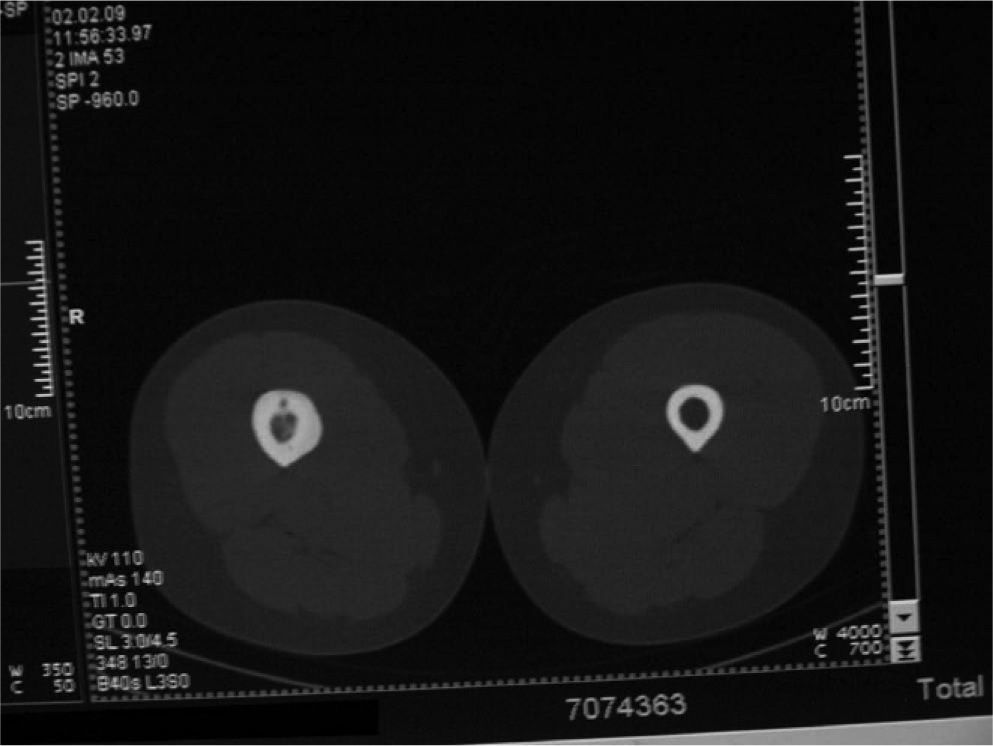
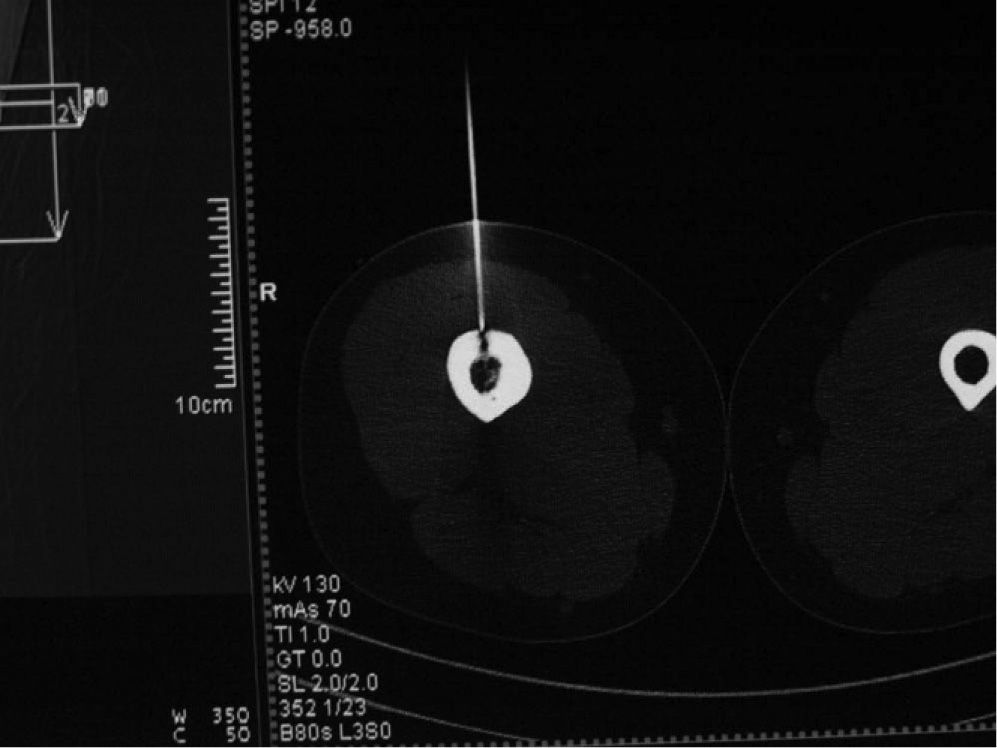
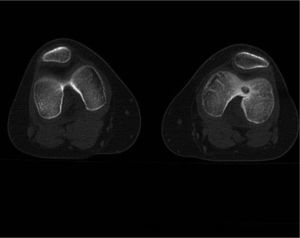
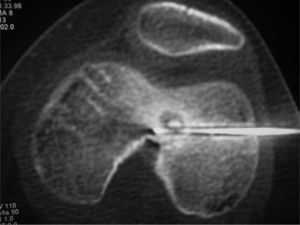
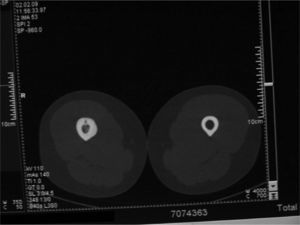
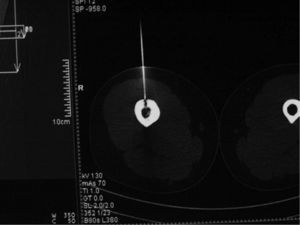
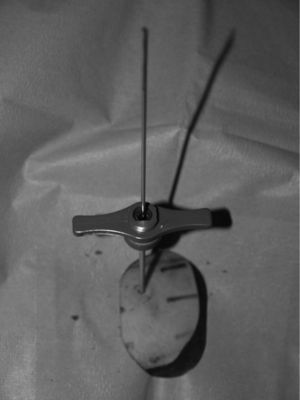
Material y métodoCaso clínico 1: osteoma osteoide intraarticularChica de 8 años y 6 meses con gonalgia izquierda de 10 meses de evolución. La radiografía era anodina en principio pero con discreta lesión osteolítica. En el estudio por TC se podía observar nidus en la zona posterior del intercóndilo (figs. 1 y 2). Tras la realización de la ablación (fig. 3) el dolor desapareció inmediatamente, al despertarse. No presentó complicaciones. Con un seguimiento de 3 años y medio, no presenta recidiva.
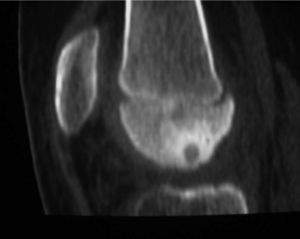
Chica de 14 años con dolor en el muslo izquierdo de 9 meses de evolución. Sin dolor mecánico, sino constante, con períodos más acusados vespertinos y nocturnos. Cedía con aspirina y AINE. En la radiografía se podía apreciar reacción perióstica, con zona osteoblástica fusiforme (fig. 4), típica del OO diafisario en pacientes inmaduros.
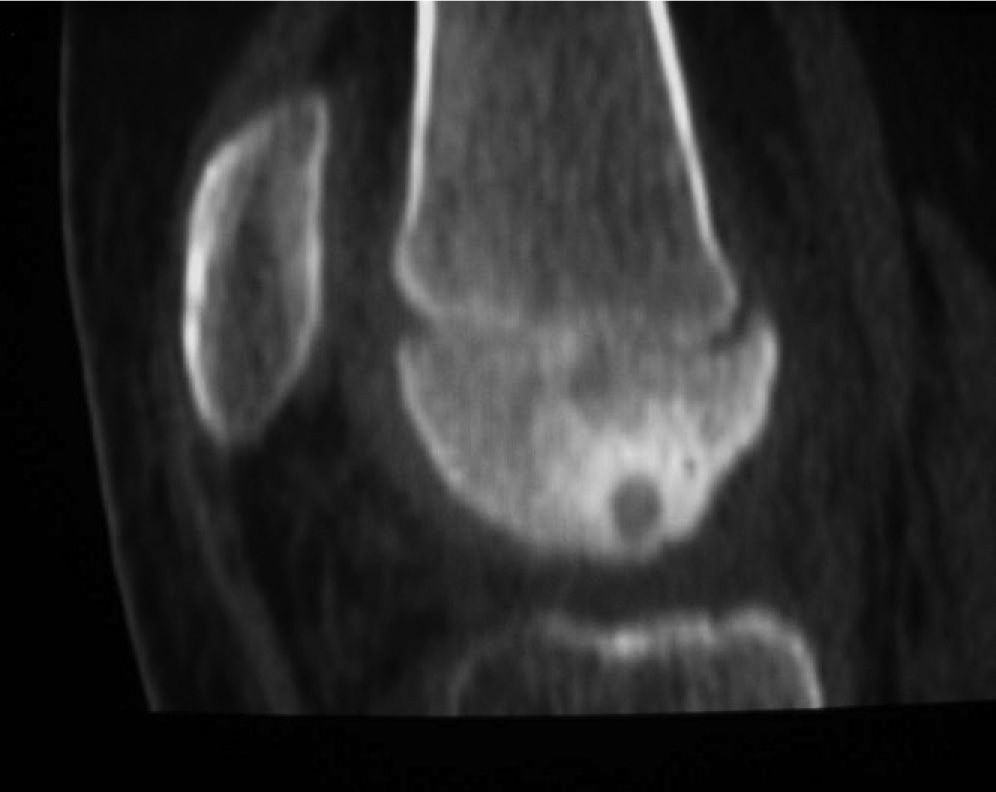
En la TC se podía observar engrosamiento cortical y nidus cortical en el tercio medio de la diáfisis femoral (fig. 5). Después de la ablación el dolor desapareció, y refirió otro tipo de dolor que desapareció en 5-6 días. Tras un seguimiento de 1,5 años, no ha presentado recidiva.
Casos 3 y 4: osteoma osteoide metafisarioCaso clínico 3Paciente varón de 15 años de edad remitido por dolor en la rodilla izquierda de 1 año de evolución y predominio vespertino. En la radiografía se podía observar discreta lesión lítica y esclerosis en la metáfisis proximal de la tibia izquierda a 1,5 cm de la superficie articular. En la TC se observaba lesión compatible con OO.
Tras realizarse la ablación percutánea por RF guiada por TC, el dolor desapareció en 24 h. Dos años más tarde permanece asintomático.
Caso clínico 4Paciente varón de 16 años de edad que acude a consulta por dolor en el hombro derecho de un año de evolución. La evolución ha sido progresiva en lo referente a la intensidad y la frecuencia del dolor. Refería dormir mal por dolor. Cedía con aspirina y AINE.
En la radiografía se podía observar esclerosis periférica metafisaria del húmero derecho. En la TC se apreciaba lesión compatible con OO. Tras realizar ablación con RF guiada por TC el dolor disminuyó progresivamente durante 2 días y acabó por desaparecer. Diez meses más tarde permanece asintomático.
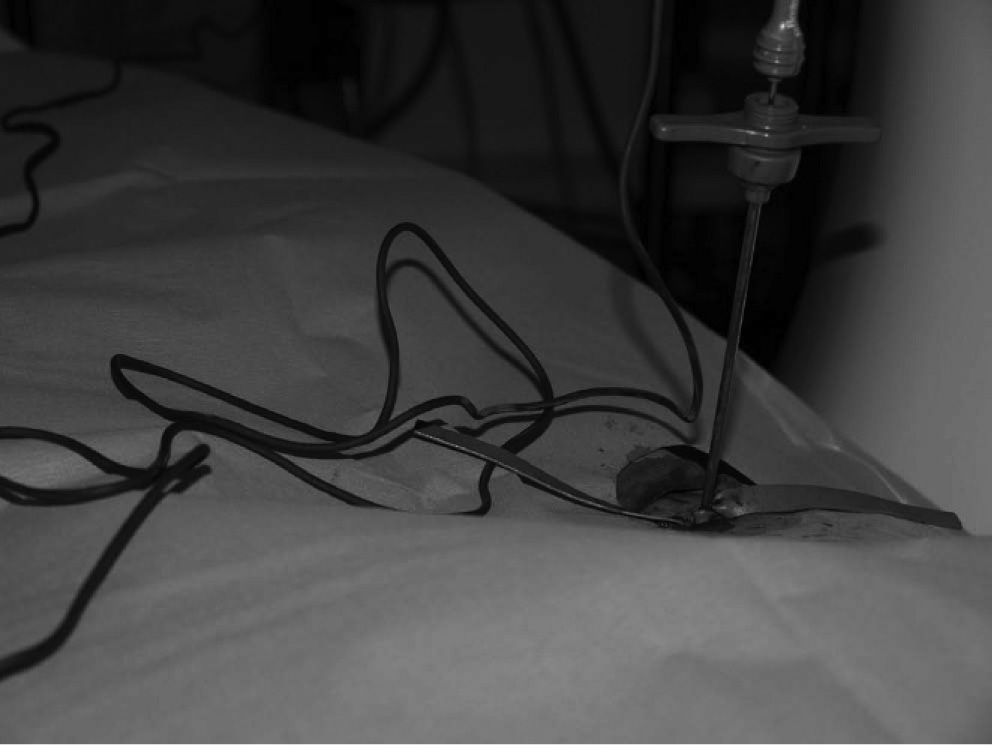
Ejecución del procesoTras la información adecuada y la formalización del consentimiento informado, todo el proceso se realizó mediante cirugía mayor ambulatoria. La ablación por RF con técnica de control de la liberación de energía por impedancia es un procedimiento mínimamente invasivo guiado por TC, que precisa un equipo multidisciplinar: radiólogo, cirujanos ortopédicos, anestesista, enfermería de anestesia e instrumentista. En niños, adolescentes y adultos que no lo toleren por claustrofobia, se realiza en la sala de TC con anestesia general.
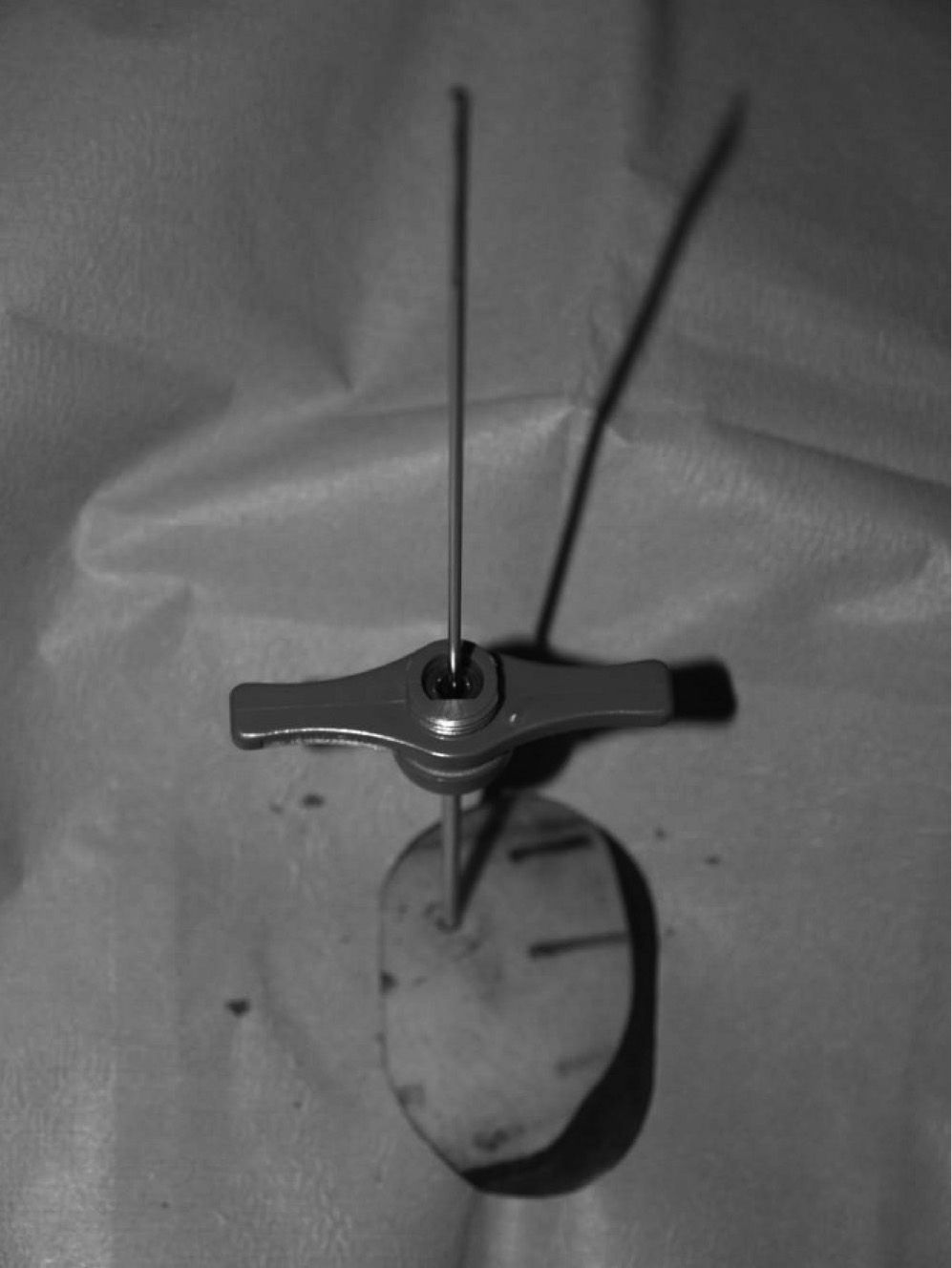
La localización tumoral se realiza por medio de la TC. Con una aguja espinal se señala la dirección y el lugar de la piel para su abordaje. Posteriormente se realiza una perforación de la primera cortical con aguja de Kirschner y/o broca (figs. 3 y 6). La posición del orificio se mantiene con una trefina de biopsia (fig. 7), a través de la cual se introduce la sonda de RF (normal o con enfriamiento distal tipo cool tip system) (fig. 8). Una vez comprobada por la TC su correcta localización, se procede a la realización de la ablación: temperatura objetivo entre 60 y 100 °C, durante un tiempo de 4-8 min, y a 90 °C durante 6 min.
En nuestros pacientes hemos utilizado el protocolo de electrodo Soloist®, con el introductor CoAccess® (Boston Scientific), con parches de retorno del generador de RF de Boston Scientific. El generador utilizado es el RF3000, de 460 kHz/200 W.
ResultadosEn todos los casos el procedimiento pudo realizarse de forma ambulatoria, por cirugía mayor ambulatoria. El único gasto de material fue la sonda de RF.
Preoperatoriamente, la movilidad activa articular estaba levemente limitada en los cuatro casos por dolor, pero no la pasiva. Una vez realizada la RF, todos los casos mostraban completa normalidad en movilidad activa y pasiva. Los casos 1 y 3 eran de afectación adyacente al cartílago articular, y en ninguno se produjo sintomatología articular alguna, ni derrame, inflamación o dolor que pudiera sugerir daño del cartílago articular.
El tiempo de desaparición del dolor osciló entre inmediatamente tras las RF (caso 1) hasta 5 días (caso 2). En los otros casos el dolor cedió en las primeras 24 h (caso 3) y en 48 h (caso 4). Creemos que esa diferencia en el tiempo se debe al diferente grado de quemadura que provoca la RF, en dependencia de la localización del tumor así como del tipo y de la cantidad de tejidos blandos circundantes.
No hemos tenido que lamentar ningún tipo de complicación. No ha ocurrido ninguna recidiva, con un seguimiento de entre 9 meses y 3 años.
En el seguimiento final hemos podido comprobar ausencia de lesión fisaria adyacente en los cuatro casos.
En ninguno de los cuatro casos hemos realizado TC y/o RM postoperatorias de control por considerarlas tan sólo indicadas en caso de recidiva o de alivio incompleto de la sintomatología.
DiscusiónEl OO es una pequeña lesión tumoral menor de 2 cm de diámetro, compuesto de osteoide y con tejido conectivo altamente vascularizado, rodeado por un anillo de hueso esclerótico; requiere tratamiento debido al intenso dolor que produce. Con frecuencia se da en huesos largos de las extremidades inferiores, y con menor frecuencia en el húmero, las falanges o el esqueleto axial. Aparece de forma excepcional en las articulaciones Es un tumor benigno y no infiltrativo, que no metastatiza. Son típicos los ataques de dolor nocturno, que se alivian con AINE. En la radiografía el hallazgo clásico es una lesión radiolucente pequeña rodeada de hueso esclerótico en la cortical. Sin embargo, en pacientes inmaduros, sobre todo en huesos largos, es típica la imagen de engrosamiento cortical fusiforme2,13. Las opciones de tratamiento son:
- •
Tratamiento conservador, mediante AINE durante largo plazo (naproxeno, 2 años)14. Es una opción terapéutica sobre todo en caso de afectación de zonas de difícil acceso. Winkelmann et al15, con estudios seriados de RM, muestran la regresión significativa de la reacción inflamatoria en un caso y la desaparición del tumor en otro. Por tanto, el tratamiento médico del OO es considerado como una buena opción si el diagnóstico es dudoso, si existen elevados riesgos anestésicos o si el abordaje es quirúrgico16.
- •
Tratamiento quirúrgico invasivo:
- –
Exéresis en bloque: su riesgo radica en que precisa una mayor resección ósea, lo cual debilita el hueso e incrementa el riesgo de fractura patológica.
- –
Curetaje: precisa una localización precisa de la tumoración, cosa que no siempre es posible.
- –
Resección intralesional con visión directa. Con abordaje quirúrgico abierto, se retira el hueso en virutas hasta alcanzar el OO en la zona del ápex del bultoma óseo, en su profundidad7. Con esta técnica se obtiene un 100 % de éxitos por un 83 % con RF.
- –
- •
Tratamiento percutáneo (mínimamente invasivo):
- –
Perforación mecánica, con una broca7,17. Puede realizarse el procedimiento con/sin alcohol (etanol)18,19.
- –
Crioablación.
- –
Termoablación: por medio de láser, por generador de microondas o bien por generador de RF8–11,20, que es el proceso que nosotros realizamos. Existe algún caso excepcional de uso de la RF y alcohol21.
- –
Aunque se ha descrito la regresión espontánea del OO15,22, ello sólo se da en una baja proporción de los casos. Por tanto, el tratamiento quirúrgico es todavía hoy, en general, el más utilizado.
Es escasa la bibliografía que se dedica en exclusiva a valorar la ablación por RF guiada por TC en niños y adolescentes, ya que mayoritariamente se procede a ella en adultos jóvenes. Recientemente Donkol et al23 publicaron una revisión de 23 niños-adolescentes, concluyendo que también en ellos es un procedimiento seguro y efectivo aunque con éxito clínico discretamente inferior en resultados (78,2 %) respecto a las series de adultos. Matera et al24 refieren incluso un OO con doble nidus en un niño de 10 años tratado con éxito mediante ablación por RF. A la luz de nuestros resultados podemos confirmar la seguridad y la efectividad de este método en pacientes inmaduros. Los cuatro casos que presentamos representan una nueva aportación entre las escasas que se refieren a la ablación por RF de OO en niños-adolescentes, lo que confirma su eficacia, su comodidad, su seguridad y su bajo costo. Aunque no se realiza evaluación de la lesión excepto que exista recidiva, un autor25 ha estudiado mediante RM la lesión tras realizar la RF, y ha encontrndo una zona central de ablación (Z1) rodeada por una banda (Z2) y un área periférica (Z3). Z1 es una zona sin potenciación, con un centro hipointenso en T1, T2WI. Z2 es una zona bien potenciada con anillo hiperintenso en T2WI. Z3 es una zona menos hiperintensa y menos potenciada que Z2. Todos los nidi estaban en la zona Z1. Este aspecto es evidente desde la primera semana hasta 1-2 meses después.
El diagnóstico diferencial principal del OO es con la osteomielitis (sobre todo el absceso de Brodie); ambos suelen presentar un borde esclerótico26, pero la sintomatología es diferente, con otro patrón del dolor. La existencia del nidus es patognomónica del OO. Es excepcional la existencia de un doble nidus que dificulte el diagnóstico24. Las fracturas por estrés, sobre todo en el hueso del pie, pueden presentar un dolor inespecífico que pueden inducir a plantearse su diagnóstico diferencial con el OO27. El osteoblastoma es un tumor benigno de la misma estirpe que el OO pero de mayor tamaño (> 2 cm) y en general con localización diferente (arco posterior de las vértebras, etc.).
Las ventajas de la ablación por radiofrecuencia guiada por TC radican en que es un método no invasivo; precisa de menor tiempo quirúrgico; es más barato, con una mejor relación coste-efectividad28 (en nuestro caso el único gasto fue el de la aguja-electrodo); proporciona excelentes resultados (igual o mejor que el resto de los métodos); precisa un menor uso de los recursos sanitarios (menos consultas, etc.), y permite realizar una vida normal en 24 h (máximo 3-4 días)28. Se ha descrito también como segura y eficaz en raquis, como refieren diversos autores29–33.
Aunque en niños es recomendable su realización bajo anestesia general (como se realizó en nuestros casos), en adultos puede llevarse a cabo bajo anestesia local, lo cual en determinadas localizaciones de riesgo permite valorar signos y síntomas de inicio de posibles complicaciones.
Los resultados de la ablación por radiofrecuencia del OO son excelentes (alrededor del 90 % de los casos), según se constata en la bibliografía: éxito en las series de Sung et al34 (90 %), Donkol et al23 (91,3 %), Woertler et al35 (94 %), etc. En el caso de precisar una segunda RF, el éxito es del 100 %35.
Las indicaciones de la radiofrecuencia guiada por TC en el tratamiento del OO son cualquier localización no superficial, y está especialmente indicada en localizaciones articulares, cuello femoral, acetábulo, pelvis, etc., donde el abordaje quirúrgico es complejo, agresivo y/o arriesgado36. La aparición de OO en la rodilla como nuestro caso 1 es excepcional 32,37, por lo cual es de gran ayuda comprobar la efectividad del procedimiento en tal localización (en la proximidad del cartílago articular y de la fisis).
Últimamente hay autores que refieren casos esporádicos en raquis con excelentes resultados31–33. Laus et al31 publicaron su experiencia con seis casos localizados en la columna cervical tratados con éxito por medio de la RF, destacando que es un tratamiento que puede realizarse de forma segura, con anestesia local y con el paciente despierto, lo cual permite comprobar en todo momento la posible aparición de signos o síntomas de inicio de una posible lesión neurológica. Otro método protector de estructuras nobles es proceder al enfriamiento de la piel en localizaciones superficiales y poca cobertura de partes blandas (tibia, radio), y lo mismo en zonas con estructuras vasculonerviosas adyacentes, por medio de la emisión de suero frío por una aguja adicional adyacente38. Por seguridad se considera adecuado respetar 1,5 cm de distancia respecto a los nervios mayores10,26.
Es tal la sencillez y la efectividad de la ablación por RF que ya es considerada como la primera elección terapéutica en el tratamiento del OO, siendo catalogadas como terapias de segunda línea la crioterapia, la inyección de etanol y la escisión guiada39. Algunos autores5 expresan su creencia de que la ablación por RF ha reemplazado a la cirugía por el tratamiento curativo de tumores benignos como el OO, confirmándose que se trata de una técnica útil como tratamiento paliativo en tumores óseos metastáticos y de tumores de partes blandas que provocan dolor.
El primer caso que presentamos es de afectación yuxtaarticular, que es una localización muy infrecuente (alrededor del 10 % de todos los OO)37. Algunos autores han mostrado su recelo ante la RF por la posibilidad teórica de dañar el cartílago articular. Martel et al 26 han demostrado experimentalmente, en perros, que la ablación por RF puede realizarse de forma segura cercana a la articulación sin producir daño en el cartílago. Papagelopoulos et al40 refieren el resultado de una serie de 16 pacientes con OO intraarticular, en la cadera. El dolor cedió en todos los pacientes en menos de dos semanas (cinco en tres días, nueve en la primera semana y dos en las dos primeras semanas). Al año de seguimiento, la TC y la RM mostraban osificación completa y regeneración ósea en el lugar de la lesión en tres pacientes, osificación parcial en seis y sin cambios en siete. Rosenthal et al10 avisan acerca del posible riesgo de lesión térmica del cartílago articular, pero afirman no tener constatación de ello. Afirman que, si ocurre, es bien tolerado.
Existen incluso trabajos en los que la ablación por RF se ha realizado con éxito en el tratamiento de condroblastomas41, cordomas sacros42, etc.
Como contraindicaciones de la ablación por radiofrecuencia, para algunos autores han sido una contraindicación las lesiones espinales y adyacentes a estructuras vasculonerviosas6, pero como hemos referido previamente, cada vez se van limitando dichas contraindicaciones 32,33. Hoy ya no se consideran necesariamente una contraindicación.
Una piel de pobre calidad, diabetes, infección local, regional y/o sepsis son contraindicaciones aceptadas. Además, debe actuarse con mayor precaución en los pacientes portadores de marcapasos.
Los fracasos de la radiofrecuencia son más frecuentes en lesiones > 10 mm por una posición inadecuada de la aguja (lo que ocurre con mayor frecuencia si se hace con control fluoroscópico, y sólo excepcionalmente si se realiza el proceso guiado por TC). No existe relación con la localización anatómica, la presencia de calcificación, el sexo, el tiempo de coagulación, la curva de aprendizaje del cirujano o del radiólogo, ni con la realización de tratamientos previos43. Se reduce el riesgo de fallo con varias posiciones de la aguja. Este autor también encuentra mayor riesgo de fracaso en los menores de 20 años de edad, y en los casos en que la aguja fue colocada de forma poco precisa (lo que ocurrió en 9 de los 23 casos que fracasaron).
Nosotros no hemos tenido que lamentarlo en ninguno de nuestros casos, pero es una corta casuística, debido a que se centra en niños y en adolescentes. El mayor porcentaje de fracasos de la ablación por RF es del 23 % (sin complicaciones), por un 30 % de la cirugía (sin incluir en la serie de Rosenthal et al9 a dos pacientes que tuvieron que recibir un nuevo tratamiento quirúrgico por complicaciones). Las recidivas oscilan entre el 5 y el 25 %, y están relacionadas con la precisión en la colocación de la sonda. Es mucho más precisa la correcta colocación de la sonda si se realiza mediante visualización por TC en vez de la fluoroscopia (en la cual ocurren la mayor parte de los fracasos).
Donkol et al23 refieren dos fracasos en niños, en una serie de 23 pacientes, uno por localización imprecisa de la aguja y el otro por poco tiempo de realización de la ablación por RF.
La causa de fallo es la colocación imprecisa de la aguja, bien por acceso difícil o bien por pobre visualización del nidus debido a alteraciones óseas locales (secundarias a otros procedimientos previos).
A la luz de la mayor parte de las revisiones bibliográficas se considera aceptada la curación (no recidiva) a partir del segundo año10. Sin embargo, lo habitual es que cuando se produce recidiva lo haga en los seis primeros meses tras la ablación.
Inconvenientes. En la RF, la punción ósea incrementa los latidos cardíacos (una media de 26 latidos/min) y la frecuencia respiratoria (una media de 12/min)10. Para valorar la exactitud de la punción, el anestesista puede indicarlo44. Esto reafirma a los defensores del origen neurógeno del dolor asociado al OO4.
Un inconveniente de la ablación por RF es la ausencia de confirmación por anatomía patológica45. La RF puede realizarse con biopsia previa10 o sin ella. Los hallazgos clínicos (sobre todo el tipo y las características del dolor) y las pruebas complementarias son habitualmente diagnósticas (la radiografía y/o TC-RM muestran las características típicas), por lo que no se hace necesaria la biopsia10,15,46,47. Además, las biopsias son positivas entre el 36 y el 73 %, por lo que los datos aportados por la biopsia no son seguros10,48. En nuestro caso la clínica y las pruebas de imagen son valoradas al menos por dos radiólogos y dos cirujanos ortopédicos. De esa manera no se ha presentado ningún fallo diagnóstico. Indicamos la biopsia en caso de clínica y radiografía-TC-RM dudosas, disparidad de opinión entre cirujanos ortopédicos/ radiólogos, o bien ausencia de disponibilidad de TC y/o RM (hoy en día altamente improbable).
Donkol et al23, en su serie con pacientes inmaduros, refieren que en dos pacientes se presentó hipertermia durante el proceso, que cedió espontáneamente.
Es frecuente la existencia de dolor diferido unos días tras la realización de la ablación por RF (siempre < 2 semanas), por lo que el éxito inicial de la ablación por RF se valora por la desaparición del dolor en menos de 2 semanas. La diferencia en el tiempo de desaparición postoperatoria del dolor creemos que se debe al diferente grado de quemadura que la RF provoca, en dependencia de la localización del tumor, así como del tipo y de la cantidad de tejidos blandos circundantes. Cantwell et al39 y Barei et al6 refieren en sus series que el dolor desaparecía entre 3 y 7 días. Lo atribuyen a que ese dolor postoperatorio depende de la extensión de la zona de ablación, incluyendo la cortical, el periostio y la zona medular. En las primeras 24 h el dolor es de una intensidad parecida al dolor nocturno preoperatorio, y en las siguientes 24 h es de intensidad parecida al dolor diurno39. Es importante avisar a los pacientes y a su familia (si se trata de menores) de esas características para evitar que se alarmen por no percibir la desaparición del dolor.
Complicaciones de la ablación por radiofrecuenciaDentro de la escasas complicaciones, la necrosis cutánea es la más frecuente, aunque en la bibliografía se relaciona como raros casos clínicos8,49,50. Aparece en huesos superficiales como la tibia, el radio, los metacarpianos, los metatarsianos o las falanges.
Para evitar quemaduras cutáneas, hay que evitar la RF en lesiones a menos de 1,5 cm de la piel, y/o utilizar la irrigación periférica (enfriamiento de la piel por el uso de una aguja adicional), o el sistema de enfriamiento de la punta del electrodo o cool tip system39.
De la misma forma se evita el riesgo de lesionar nervios adyacentes, así como en el raquis. La zona de coagulación habitual de la RF es alrededor de 1 cm de diámetro. Para obtener una mayor zona de coagulación existen varias posibilidades:
- •
Colocación de múltiples agujas adyacentes.
- •
Utilización de cánulas con punta fría (cooled tip), aunque la zona de tratamiento no es completamente predecible10,44. Es válido en lesiones con gran tamaño (> 1 cm)44.
- •
Electrodo perfundido (aumenta la conductividad). Hoffman et al38 realizan el enfriamiento de la piel en localizaciones superficiales y poca cobertura de partes blandas (tibia, radio) por medio de emisión de suero frío por una aguja adicional adyacente, lo mismo en zonas con estructuras vasculonerviosas adyacentes.
- •
Aumento del tamaño de la punta del electrodo (denominado tipo paraguas)43,47.
Pinto et al44 afirman que para realizar la ablación por RF debe comprenderse el concepto de “zona de tratamiento”, que se define como la cantidad de tejido de ablación. El tamaño máximo de la zona de tratamiento se puede predecir con las ecuaciones:
- •
Longitud del eje de la zona de tratamiento = 2 x longitud de la punta de la sonda sin vaina (aislamiento).
- •
Eje transverso = 2/3 eje mayor. Así, para un electrodo de 5 mm de punta no aislada corresponderían unos 10 mm de zona de tratamiento esférica de osteonecrosis focal. El hueso cortical realiza una cierta protección en la transmisión del calor10.
Otras complicaciones más raras todavía son: celulitis45, rotura de la broca en la realización del procedimiento, infección local, hematoma local y dolor prolongado (hasta 2 semanas)10,38; en la serie de 11 años en la que se realizaron 271 ablaciones por RF, se contabilizaron tan sólo dos complicaciones menores: una celulitis y una distrofia simpático-refleja. Donkol et al 23, en niños, refiere tres casos de complicaciones mayores: dos quemaduras y una infección superficial.
ConclusionesPuede establecerse que la ablación del OO por RF en niños y adolescentes es un procedimiento seguro, mínimamente invasivo, que está particularmente indicado en localizaciones de difícil o complejo abordaje, así como en articulaciones, en la pelvis, etc.
Tras su realización hemos obtenido excelentes resultados, sin complicaciones ni alteraciones fisarias en pacientes inmaduros.
Es una técnica económica, con una buena relación coste-efectividad, que se realiza con cirugía mayor ambulatoria y permite una reincorporación escolar inmediata.
Los únicos datos negativos son la ausencia de confirmación histológica y la mayor cantidad de radiación recibida.
Conflicto de interesesNingún autor (ni familiares inmediatos) ha recibido compensación alguna por ninguna entidad comercial, directa o indirectamente, ni existe acuerdo de recibirlo en un futuro, para subvencionar la práctica clínica, u organizaciones sin ánimo de lucro a las cuales pertenezcan o estén afiliados tanto los autores como sus familiares inmediatos.
No existen fondos ni becas que financien parcial o totalmente la realización del trabajo ni de la técnica. No existe asociación comercial de los autores.s