Los autores revisan la clasificación del melanoma, su epidemiología, clínica, factores de riesgo, diagnóstico, tratamiento y seguimiento. Aunque esta patología cutánea sea tratada exclusivamente en la consulta del médico especialista, el farmacéutico puede utilizar estos conocimientos para reforzar su competencia como informador en materia de salud y, más en concreto, como asesor en fotoprotección.
El melanoma es el cáncer de piel que ha suscitado más investigación en la últimas décadas por muchos motivos, pero a pesar de los esfuerzos realizados en el estudio de esta enfermedad, la mortalidad por melanoma sigue en aumento desde 1950. Su tasa de incidencia ha aumentado significativamente en las dos últimas décadas, sobre todo en individuos de raza blanca de países industrializados, y existen evidencias que sugieren que su incidencia seguirá en aumento en las próximas décadas1.
DEFINICIÓN
El melanoma cutáneo resulta de la transformación maligna de los melanocitos localizados en la piel. Los melanocitos derivan de la cresta neural y producen melanina. Durante el desarrollo embrionario, las células precursoras conocidas como melanoblastos migran hacia la capa de células basales de la epidermis, o menos frecuentemente a la dermis y a las glándulas sebáceas. El melanoma puede desarrollarse a partir de los melanocitos situados en estas localizaciones y de los melanocitos alterados (llamados células névicas) de ciertas lesiones precursoras2.
EPIDEMIOLOGÍA
El aumento de la incidencia del melanoma en las últimas décadas en todo el mundo resulta espectacular. Dicha incidencia se ha visto triplicada en los últimos 40 años3,4 y tiende a duplicarse cada 10-15 años, sin que ello se deba a una mejoría de la vigilancia sanitaria o de los registros de tumores5, ni tampoco a cambios en los criterios diagnósticos histopatológicos de la neoplasia6.
El melanoma supone el 3% de todas las neoplasias malignas de la piel, pero causa el 65% de las muertes debidas a cáncer cutáneo y el 1% de todas las muertes por cáncer7.
En Estados Unidos, la incidencia casi se ha triplicado en las últimas 4 décadas, más rápidamente que la de cualquier otro cáncer8,9; con un riesgo actual de 1 por 87 frente al 1 por 1.500 registrado en 1930.
En Australia el melanoma es uno de los cánceres más frecuentes. En Queensland, región del planeta con mayor incidencia de melanoma, en 1993 se registraba una tasa anual en varones de 41,4 casos por 100.000 habitantes, y en mujeres de 33,6 nuevos casos al año por 100.000 habitantes.
En Europa la incidencia ha seguido aumentando en la mayoría de países hasta muy recientemente y todavía sigue incrementándose en los países mediterráneos. Sin embargo, en algunas costas del norte de Europa y en Canadá parece detectarse un aplanamiento en la curva de incidencia que resulta más marcada en la población más joven.
En España, los datos estadísticos sobre este tumor son escasos, pero destacan los registros de tumores en determinadas áreas. Por ejemplo, en Andalucía se registró una incidencia en el año 1990 de 7,38 por 100.000 personas en Granada y de 8,34 en Sevilla.
En Asia no se ha detectado el espectacular aumento en la incidencia observado en las poblaciones de raza caucásica. En Japón la incidencia anual de melanoma ha permanecido constante entre 1981 y 1991. En este país existe una incidencia de 1,0 a 1,5 nuevos casos por 100.000 habitantes, claramente inferior a la de los países antes mencionados10.
La incidencia del melanoma en el globo generalmente se correlaciona de forma inversamente proporcional con la latitud, con las tasas más altas de incidencia en las localizaciones más cercanas al ecuador y con una disminución progresiva en las áreas cercanas a los polos11.
FACTORES DE RIESGO
La etiología del melanoma es desconocida, si bien las investigaciones recientes se han centrado en los factores de riesgo: factores genéticos, exposición a la luz ultravioleta y exposición ambiental.
Factor genético
Dentro de los factores de riesgo para el melanoma, la importancia de los factores genéticos se refleja en un 6% de los pacientes, en los que hay antecedentes familiares de este cáncer. Además, aquellos con antecedentes de melanoma en sus padres o descendientes tienen un riesgo estimado 8 veces mayor de desarrollar la enfermedad12,13.
Papel del sol
La epidemiología y los estudios de caso control destacan el papel del sol en la patogenia del melanoma. A pesar de que la radiación ultravioleta B (UVB) con un rango de 290-320 nm parece ser un factor causal, la acción precisa del espectro en el melanoma humano permanece desconocida, y la radiación ultravioleta A (UVA) también se ha demostrado capaz de inducir melanoma en ciertos modelos experimentales14,15,16. Muchos estudios han evaluado los hábitos de exposición solar de los pacientes con melanoma y han encontrado un aumento de la sensibilidad al sol en los pacientes de piel clara, pelo rubio o rojo, la presencia de numerosas arrugas y la tendencia a quemarse en vez de broncearse. En algunos casos, se encuentra historia de quemaduras dolorosas o ampollosas en la infancia y adolescencia. Dos o más episodios como éstos antes de los 20 años parecen ser un factor de riesgo importante17.
El papel de la exposición solar crónica es mucho más controvertido. Mientras que algunos estudios sugieren que la exposición solar total acumulada es un importante factor de riesgo, otros han encontrado que la exposición solar ocupacional a largo plazo podría ser un factor protector. A pesar de que el papel de la exposición crónica aún no se ha esclarecido por completo, se acepta generalmente que las exposiciones solares intensas de forma intermitente en individuos sin bronceado (o escasamente bronceados) constituyen uno de los factores de riesgo más importantes18,19.
Presencia de nevus
La presencia de ciertos tipos de nevus es también un factor de riesgo. Los nevus congénitos gigantes (fotografía de apertura) y los nevus displásicos han sido reconocidos como lesiones precursoras en algunos casos. Los nevus congénitos gigantes presentan un elevado riesgo de malignización que oscila según los estudios publicados entre el 3,8% y el 18%20. El fenotipo del síndrome de nevus displásico está presente en el 15% o más de los pacientes con melanoma. El riesgo parece ser más significativo cuando el número de nevus excede los 50, y se sabe que este número aumenta en la infancia y primera adolescencia en relación con la exposición al sol19.
Otros factores
Se han descrito muchas otras asociaciones. Algunas de ellas representan sólo la ocurrencia casual de dos condiciones, pero otras parecen definir en algunos casos factores de riesgo parciales. Algunos melanomas se han descrito asociados a xeroderma pigmentoso, enfermedad de Cowden, neurofibromatosis, retinoblastoma, mastocitosis, síndrome de Lynch e infecciones como el virus de inmunodeficiencia humana. La inmunosupresión por enfermedades genéticas, adquiridas o bien secundaria a tratamientos, suponen un aumento del riesgo de melanoma en una magnitud comprendida entre 3 y 6 veces1,21.
Otros factores de riesgo menos comunes estarían en relación con el uso frecuente de salones de bronceado, exposición a solventes y cloruro de polivinilo, ingestión de aguas contaminadas con arsénico y cicatrices de quemaduras1.
La introducción de filtros solares, que ha supuesto un gran avance en la prevención de otros tipos de cáncer cutáneo, en el caso del melanoma resulta controvertida. Existen diversos estudios que demuestran un aumento del riesgo del melanoma en los grupos que usan filtros solares de forma habitual, pero ello es debido a una conducta imprudente: como los productos solares les protegen de las quemaduras, estos usuarios permanecen al sol durante un tiempo claramente excesivo22. Por lo tanto, los filtros solares, aún siendo imprescindibles y fundamentales, deberían acompañarse de otras medidas de fotoprotección, además de evitar las exposiciones de riesgo prolongadas.
Las mujeres tienen una incidencia discretamente superior pero sus lesiones son de mejor pronóstico que en los varones. La relación entre la toma de anticonceptivos y embarazo con la enfermedad en la actualidad se considera de escasa trascendencia23.
CLASIFICACIÓN
El melanoma fue clasificado inicialmente por Clark y colegas en tres subtipos clinicopatológicos: melanoma de extensión superficial, melanoma sobre lentigo maligno, y melanoma nodular. Posteriormente se añadió la descripción del melanoma lentiginoso acral. Finalmente se han descrito otras variantes menos frecuentes tomando como base aspectos de localización, clínicos e histológicos: melanoma verrucoso, melanoma polipoide, melanoma nevoide, nevus azul celular maligno, nevus de Spitz maligno, melanoma amelanótico, melanoma desmoplásico y neurotropo y melanoma de mucosas. Existen autores que insisten en la necesidad de abandonar esta diferenciación entre subtipos y mantener tan solo el diagnóstico de melanoma, porque consideran que la clasificación responde únicamente a su diferente localización24. Sin embargo, existen diferencias entre dichos subtipos en cuanto a su comportamiento biológico y epidemiología que hacen preferible mantener esta clasificación.
Excepto en el caso de la forma nodular, todos los melanomas presentan una fase inicial de crecimiento superficial que puede persistir durante semanas, meses o años hasta progresar a una forma de crecimiento vertical en profundidad que conduce a la diseminación de la enfermedad.
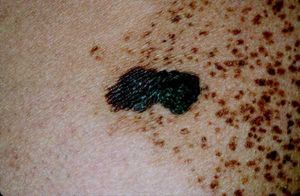
Melanoma de extensión superficial
Es el más frecuente de los subtipos (fig. 1), con una incidencia de alrededor del 70%. Se puede desarrollar en cualquier parte del cuerpo, a cualquier edad. Es particularmente común en el tronco de hombres y en las extremidades inferiores de mujeres. Es la forma que se asocia con mayor frecuencia a la presencia de lesiones precursoras névicas y a exposiciones solares de carácter intermitente1,25.
Melanoma sobre lentigo maligno
Representa cerca del 5% de todos los melanomas, y ocurre más comúnmente en las zonas de exposición solar continua y máxima como son la cara y el cuello, con un claro predominio en personas de edad avanzada26,27,28. Este subtipo se asocia con poca frecuencia a nevus melanocíticos25. Aunque se había pensado que era la forma de mejor pronóstico, a igualdad de grosor y nivel de invasión no hay diferencias con el resto de las formas de melanoma6. En este caso existe siempre una lesión premaligna (el lentigo premaligno) que consiste en una mácula pigmentaria con un crecimiento lentamente progresivo en superficie (fig. 2).
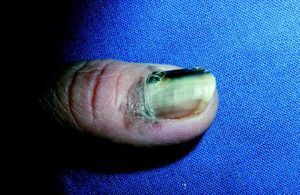
Melanoma lentiginoso acral
Representa entre el 2 al 10% de los melanomas, afectando predominantemente palmas, plantas, lecho ungueal y membranas mucosas (fig. 3). Esta forma es más frecuente en asiáticos y en la raza negra que en los blancos24,29. En Japón supone el 44,8% de todos los casos. La localización plantar supone el 28,4% del total de tumores incluyéndose los demás subtipos de este país6.
Melanoma nodular
Es la segunda forma más frecuente. Representa entre el 15 y el 30% de todos los casos, siendo el de peor pronóstico por su rápido crecimiento ver tical. Esta lesión debe sospecharse ante una tumoración que se desarrolla en pocos meses, con un crecimiento vertical uniforme y con una coloración negra o negra-azulada; aunque puede presentarse también como un nódulo amelanótico24.
MANIFESTACIONES CLÍNICAS
El primer indicio visual de cualquiera de los cuatro tipos histogenéticos del melanoma suele ser un cambio de color, ya sea en forma de una hiperpigmentación que aparece en un área de piel que antes estaba normalmente pigmentada, o bien como una variación del pigmento en un nevus pigmentado preexistente. El cambio en la pigmentación puede adoptar la forma de un aumento o disminución de la pigmentación melánica, o ser atribuible a un aumento del aporte sanguíneo en el área. Antes de que sea visible cualquier alteración, el paciente puede ser consciente de una sensación, descrita por algunos como un leve picor u hormigueo. El sangrado de una lesión pigmentada debería ciertamente levantar sospechas, pero suele ser una alteración clínica más tardía que la variación del pigmento o el trastorno sensitivo. A menudo están presentes simultáneamente todos los factores, y por esto es difícil ser dogmático acerca de las alteraciones específicas que deberían levantar sospechas. Sin embargo, en general, cualquier lesión que previamente tenga un color marrón uniforme y en la que aparezcan áreas irregulares de color marrón más oscuro, centrales o periféricas, o nódulos elevados o un borde inflamatorio debería considerarse muy sospechosa.
Además de estas características generales que deberían hacer sospechar un melanoma desarrollándose bien de novo o asociado a un nevus preexistente, hay características clínicas específicas indicadoras de cada uno de los subtipos histogenéticos del melanoma descritos previamente30.
DIAGNÓSTICO
Debido a que el factor que incide de forma más notable en el pronóstico del melanoma es el diagnóstico precoz, la identificación de lesiones delgadas en fase no invasiva resulta fundamental.
La precisión diagnóstica del melanoma, aun en el caso del dermatólogo más experimentado resulta baja, sin superar el 60%, con una sensibilidad en el diagnóstico del melanoma invasor que no sobrepasa el 80%31,32.
En el examen clínico, un nevus pigmentado no complicado es imposible que se confunda con un melanoma. Sin embargo, las sospechas son fundadas si se inflama o se desarrolla un granuloma en su interior. El agrandamiento resultante no se asocia con un cambio de color, y el examen mostrará una tumoración dolorosa por debajo del nevus. Los nevus melanocíticos que surgen en la adolescencia o en la vida adulta son bastante más difíciles de diferenciar. Tienen una forma más regular que el melanoma, y después de una breve fase de crecimiento inicial rápido suelen volverse estáticos. Desde un punto de vista clínico, no es habitual que una lesión simétrica, monocroma, de borde regular y menor de 6 mm sea un melanoma. La regla del ABCD (Asimetría, Borde irregular, Color y Diámetro > 6 mm) define a grandes rasgos las características clínicas del melanoma, aunque de forma poco específica debido a que muchas lesiones benignas pueden cumplir estos criterios, ya que el melanoma, especialmente en estadios iniciales, puede no presentar estos signos.
Criterios de sospecha de melanoma como el cambio de su tamaño, forma, color o superficie o la aparición de una lesión nueva de rápido crecimiento deben ser interpretados con cautela por el especialista. La mayoría de nevus melanocíticos benignos cambian de aspecto en función de la edad y otros factores como la exposición solar, sin que esto suponga ningún signo de malignidad. Por otro lado, cambios bruscos de tamaño o de color o la aparición de otros signos como el dolor o el prurito en la mayoría de las ocasiones se deben a inflamación, traumatismos o infección de una lesión benigna. Sin embargo, el cambio brusco de una lesión con o sin atipia clínica es un signo muy importante de sospecha de malignización que obliga a plantear la exéresis de la lesión.
FACTORES PRONÓSTICOS
Múltiples estudios clínicos y patológicos han definido los factores pronósticos del melanoma.
Según la clasificación de la American Joint Cancer Committee (AJCC) de 1992, seguida en la mayoría de los ensayos terapéuticos, se define como estadios I y II a la enfermedad clínicamente localizada sin afectación nodal. La afectación ganglionar regional y la existencia de metástasis en tránsito se definen como estadio III, mientras que la enfermedad metastásica corresponde al estadio IV.
Sin embargo, además del estadiaje, existen otras variables de carácter clínico, histopatológico y biológico que han demostrado una gran importancia para determinar el pronóstico de la enfermedad.
Para el melanoma confinado a la piel, Clark y colaboradores fueron los primeros en proponer un peor pronóstico relacionado con un incremento en los niveles de microinvasión en la dermis o el tejido subcutáneo; de esta forma describieron los 5 niveles de invasión de Clark. Poco después, Breslow34,35,36 encontró que la medida de crecimiento o grosor vertical del tumor era un mejor predictor. Desde entonces, muchos estudios han confirmado la importancia del grosor del tumor vertical (en milímetros) como el mejor indicador del pronóstico del melanoma confinado a la piel37-40. Por ejemplo, la mayoría de pacientes con lesiones en estadio I (lesiones < 0,75 mm de grosor) pueden tener períodos prolongados de sobrevida libres de enfermedad e inclusive curarse después del tratamiento, mientras que aquellos con lesiones de mayor grosor (> 4,0 mm) tienen mucha más probabilidad de morir de enfermedad metastásica. Los datos limitados sugieren que el melanoma in situ se asocia con un índice de sobrevida a los 5 años que alcanza el 100%41,42.
Además del grosor del tumor, otros factores clínicos e histológicos afectan el pronóstico del melanoma localizado. El sitio anatómico es un factor importante37,40: las lesiones ubicadas en el cuero cabelludo, manos y pies parecen tener un peor pronóstico. Los pacientes de mayor edad y de sexo masculino tienen un peor pronóstico que los pacientes más jóvenes y de sexo femenino.
Los hallazgos histológicos relacionados con un pronóstico desfavorable incluyen un alto índice de actividad mitótica, la presencia de lesiones microscópicas satélites del tumor, crecimiento vertical, ulceración y el volumen del tumor43,44.
TRATAMIENTO
La cirugía es la terapéutica que ha demostrado, por sí sola, mejores resultados en el tratamiento del melanoma cutáneo. Los demás tratamientos, por ahora, son adyuvantes. Su eficacia es paralela al diagnóstico precoz. Cuanto menor sea la progresión del tumor en el momento de la intervención mejores son los resultados obtenidos.
Cirugía
El tratamiento quirúrgico del melanoma primario consiste en la exéresis completa de toda la lesión tumoral hasta la fascia muscular, con un margen de piel clínicamente sana que depende del grosor de la tumoración45.
Las siguientes recomendaciones propuestas por Kroon y colegas46, del Instituto del Cáncer de Países Bajos, son parámetros razonables que el médico debe seguir para el adecuado manejo del problema. La biopsia excisional es el procedimiento diagnóstico más apropiado para una lesión de piel sospechosa de ser melanoma. Los márgenes recomendados para la excisión diagnóstica son de 2 mm de piel normal alrededor de la lesión; en el caso de la excisión terapéutica el margen debe ser de 1 cm en lesiones con un nivel de Breslow < 2 mm y 2 cm cuando el grosor de Breslow sea > 2 mm y < 4 mm.
Disección de los ganglios linfáticos
La disección electiva de los ganglios linfáticos no está recomendada. La técnica de mapaje (trazado de un mapa descriptivo) del ganglio centinela es el método recomendado para detectar las metástasis ocultas en los ganglios linfáticos regionales en pacientes en estadios I y II. La linfadenectomía regional se reserva para los pacientes en estadio III, en los que el vaciado ganglionar terapéutico puede suponer la curación del paciente. Las cifras de supervivencia en este grupo de enfermos se sitúan en la actualidad entre un 13 y un 45% a los 5 años47.
Perfusión aislada regional
La perfusión aislada regional está indicada para tumores inoperables en las extremidades. La radioterapia puede ser utilizada de forma paliativa o postoperatoria cuando se sospecha que no ha habido una resección ganglionar radical.
Terapias sistémicas
Algunas terapias sistémicas adyuvantes están todavía en fase experimental. No existe un tratamiento estándar para pacientes con metástasis hematológica y cuando sea posible deben ser incluidos en protocolos de ensayo. Los tratamientos complementarios a la cirugía no han demostrado un beneficio definitivo y los regímenes de asociaciones con varios fármacos en la enfermedad diseminada, hasta la reciente incorporación del cisplatino, no ofrecían resultados superiores a los del DTIC (dimetil-triaceno-imidazol-carboxamida), fármaco estándar en régimen de monoterapia con tasa de respuesta más alta (alrededor del 20%). La obtención de una remisión completa no es frecuente, sin embargo la duración de la respuesta alcanza medianas de un año. Las respuestas suelen observarse en metástasis subcutáneas, ganglionares y pulmonares. Prácticamente no se consiguen en metástasis cerebrales. Si bien algunos pacientes pueden beneficiarse de la quimioterapia estándar o en diversas combinaciones experimentales, en la mayoría de los casos no se produce un incremento de la supervivencia, incluso en presencia de respuesta objetiva, puesto que eventualmente tiende a ocurrir la recidiva y progresión de las metástasis.
Interferón alfa
En la actualidad el único tratamiento adyuvante que ha demostrado su eficacia en el melanoma de alto riesgo (Breslow > 4 mm o con ganglios positivos) es el interferón alfa. Con este tratamiento, administrando una dosis de inducción de 20 millones de unidades (MUI) por metro cuadrado de superficie corporal, 5 días a la semana el primer mes y 10 millones de unidades por metro cuadrado tres días a la semana los 11 meses siguientes como mantenimiento, se consiguió en un ensayo clínico un incremento de la supervivencia global a los 5 años del 9% y un aumento significativo del tiempo libre de enfermedad a los 5 años48. Sin embargo, en estudios más amplios publicados posteriormente no se ha confirmado esta mejor respuesta en comparación con el grupo control, aunque este tipo de tratamiento adyuvante, pese a su elevada toxicidad, sí parece ser más eficaz que la administración experimental de vacunas. La administración de interferón alfa 3 MUI s.c. 3 días por semana durante 18 meses produce un aumento del intervalo libre de recidiva (pero no de la supervivencia global) y puede utilizarse como tratamiento adyuvante en pacientes con melanomas en estadio II.
El único tratamiento adyuvante que ha demostrado su eficacia en el melanoma de alto riesgo es el interferón alfa
Seguimiento
Por lo que respecta al seguimiento de los pacientes con melanoma, se considera que un período de seguimiento de 5 años es suficiente para pacientes con melanoma <1,5 mm de Breslow y de 10 años para pacientes con un grosor superior al citado, aunque la posibilidad de recidivas tardías (y de aparición de un segundo melanoma) justifica la recomendación de que el paciente consulte ante cualquier signo sospechoso. Por otra parte, los familiares de primer grado presentan un riesgo aumentado que justifica una evaluación y seguimiento iconográfico periódicos para detectar cualquier posible melanoma en una fase incipiente de su desarrollo.
En la lucha contra el melanoma, la prevención primaria constituye el arma más eficaz. Se deben evitar las circunstancias peligrosas (exposición solar) anteriormente mencionadas, especialmente en los jóvenes y las personas sometidas a un mayor riesgo por su fenotipo. También es importante el conocimiento, por parte de la población, de los signos de alarma que permitirán un diagnóstico precoz y un tratamiento quirúrgico curativo. *
BIBLIOGRAFÍA GENERAL
Ackerman AB, Cavegn BM, Abad-Casintahan, Robinson RJ. Resolving Quandaries in Dermatology. Pathology and Dermatopathology 1995; 169.
Autier P, Doré JF, Schifflers E. Melanoma and use of sunscreens: an EORTC case-control study in Germany, Belgium and France. Int J Cancer 1995; 61: 749-755.
Balch CM, Soong SJ, Milton GW, et al. A comparison of prognostic factors and surgical results in 1786 patients with localized (stage I) melanoma treated in Alabama, USA, and New South Wales, Australia. Ann Surg 1982; 196: 677-683.
Barnhill RL. Melanocytic nevi and tumor progression: Perspectives concerning histomorphology, melanoma risk and molecular genetics. Dermatology 1993; 187: 86-90.
Bevilacqua RG, Coit DG, Rogatko A, et al. Axilary disection in melanoma: Prognostic variables in node-positive patients. Ann Surg 1990; 212: 125-131.
Breslow A. Tumor hickness, level of invasion and node dissection in stage I cutaneous melanoma. Ann Surg 1975; 182: 572-575.
Calabro A, Singletary SE, Balch CM. Patterns of relapse in 1001 consecutive patients with melanoma nodal metastases. Arch Surg 1989; 124: 1051-1055.
Cascinelli N, Morabito A, Bufalino R et al. Prognosis of stage I melanoma of the skin: WHO collaborating centres for evaluation of methods of diagnosis and treatment of melanoma. Int J Cancer 1980; 26: 733-739.
Clark WH, Elder DE, Guerry D et al. A study of tumor progression: the precursor lesion of superficial spreading and nodular melanoma. Hum Pathol 1984; 15: 1147-1165.
Clark WH, Elder DE, Van Horn M. The biologic forms of malignant melanoma. Hum Pathol 1987; 17: 433-450.
Clark WH, From L, Bernardino EA et al. The histogenesis and biologic behavior of primary human malignant melanoma of the skin. Cancer Res 1969; 29: 705-727.
Elder DE. Skin cancer: melanoma and other non melanoma skin cancers. Cancer 1995; 75: 245-256.
Elwood JM, Gallagher RP, Hill GB et al. Pigmentation and skin reaction to sun and risk factors for cutaneous melanoma: Western Canada melanoma study. Br Med J 1984; 288: 99-102.
Garbe C, Buttner P, Weiss J et al. Associated factors in the prevalence of more than 50 comelanoma on melanocytic nevi, atypical melanocytic nevi, and actinic lentigines: multicenter case-control study of the central malignant melanoma registry of the German Dermatological Society. J Invest Dermatol 1994; 102: 700-705.
Glass AG, Hoover RN. The emerging epidemic of melanoma and squamous cell skin cancer. JAMA 1989; 262: 2097-2100.
Grin CM, Kopf AW, Welkovitch B et al. Accuracy in the clinical diagnosis of malignant melanoma. Arch Dermatol 1990; 126: 763-766.
Husain Z, Pathak MA, Flotte T et al. Role of ultraviolet radiation in the induction of melanocytic tumors in hairless mice following 7,12 dimethylbenz (A) anthracene application and ultraviolet radiation. Cancer Res 1991; 51: 4964 - 4970.
Koh HK, Kligler BE, Lew RA. Sunlight and cutaneous malignant melanoma: evidence for and against causation. Photochem Photobiol 1990; 51: 765-779.
Kopf AW, Gross DF, Rogers GS et al. Prognostic index for malignant melanoma. Cancer 1984; 53: 1236-1241.
Kopf AW, Rigel DS, Friedman RJ. The rising incidence and mortality rates of malignant melanoma. J Dermatol Surg Oncol 1982; 8: 760-761.
Kraemer KH, Lee MM, Scotto J. Xeroderma pigmentosum: Cutnaeous, ocular and neurologic abnormalities in 830 published cases. Arch Dermatol 1987; 123: 241-250.
Kroon BB, Nieweg OE. Management of malignant melanoma. Ann Chir Gynaecol 2000; 89 (3): 242-250.
Lemish WM, Heenan PJ, Holman CDJ et al. Survival from preinvasive and invasive malignant melanoma in Western Australia. Cancer 1983; 52: 580-585.
Lew RA, Sober AJ, Cook N et al. Sun exposure habits in patients with cutaneous melanoma: A case control-study. J Dermatol Surg Oncol 1983; 9: 981-986.
Mackie RM, Freudenberger T, Aitchison TC. Personal risk factor chart for cutaneous melanoma. Lancet 1989; 2: 487- 490.
Marghoob AA, Schcenbac SP, Kopf AW et al. Large congenital melanocytic nevi and the risk for development of malignant melanoma. Arch Dermatol 1996; 132: 170-175.
Osterlind A, Hou-Jensen K, Jensen OM. Incidence of cutaneous malignant melanoma in Denmark 1978-1982: Anatomic site distribution, hystologic types and comparison with non melanoma skin cancer. Br J Cancer 1988; 58: 385-391.
Rhodes AR, Weinstock MA, Fitzpatrick TB et al. Risk factors for cutaneous melanoma. JAMA 1987; 258: 3146-3154.
Rigel DS, Kopf AW, Firedman RJ. The rate of malignant melanoma in the United States: Are we making an impact? J Am Acad Dermatol 1987; 17: 1050-1053.
Rigel DS, Friedman RJ, Kopf AW. The incidence of malignant melanoma in the United States: Issues as we approach the 21st century. J Am Acad Dermatol 1996; 34: 839-847.
Rogers GS. Surgical management of stage I malignant melanoma. Dermatol Clin 1989; 9: 649-655.
Roor A, Wilkinson DS, Ebling FJG, Champion RH, Burton JL. Tratado de Dermatología (3.ª ed.). Barcelona: Ediciones Doyma, 1989.
Roses DF, Ackerman AB, Harris MN. Assessments of biopsy techniques and histopathology interpretations of primary cutaneous melanomas. Ann Surg 1979; 189: 294.
Ruiz Maldonado RMD, Orozco-Covarrubias L. Malignant melanoma in children. Arch Dermatol 1997; (133): 363-373.
Sagebiel RW. The dysplastic melanocytic nevus. J Am Acad Dermatol 1989; 20: 496-501.
Schreiber MM, Bozzo PD, Moon TE. Malignant melanoma in Southern Arizona: Increasing incidence and sunlight as etiologic factor. Arch Dermatol 1981; 117: 6-11.
Setlow RB, Woodhead AD. Temporal changes in the incidence of malignant melanoma: Explanation from action espectra. Mut Res 1994; 307: 365-374.
Sober A, Rhodes A, Mihm M, Fitzpatrick T. Dermatology in general medicine (3.ª ed.). Nueva York: McGraw-Hill, 1987.
Sorenson FB. Objective histopathologic grading of cutaneous malignant melanomas by stereologic estimation of nuclear volume. Cancer 1989; 63: 1784-1798.
Spratt JS. Epidemiology of screening of cancer. Cancer 1982; 6: 1-58.
Thorn M, Adami HO, Ringborg U et al. The association between anatomic site and survival in malignant melanoma. An analysis of 12.353 cases from the Swedish Cancer Registry. Eur J Cancer Clin Oncol 1989; 25: 483-491.
Van Der Esch EP, Muir CS, Nectoux J. Temporal change in diagnostic criteria as a cause of the increase of malignant melanoma over time is unlikely. Int J Cancer 1991; 47: 483-90.
Vollmer RT. Malignant melanoma: A multivariate analysis of prognostic factors. Path Ann 1989; 24: 383-407.
Weedon D, Struton G. Skin Pathology. Hong Kong: Churchill Livinston 1997; 690-711.
Weinstock MA, Colditz GA, Willet WC et al. Melanoma and the sun: The effect of swimsuits and a «healthy» tan on the risk of nonfamilial malignant melanoma in women. Am J Epidemiol 1991; 134: 462-470.
Wolf IH, Smolle J, Soyer P et al. Sensitivity in the clinical diagnosis of malignant melanoma. Melanoma Res 1998; 8: 425-429.
Yamamoto A. The epidemiology of melanoma in the East. Melanoma Res 1997; 7(1): S1.