No cabe duda de que la prestación farmacéutica, en su vertiente económica, se encuentra inmersa en una cierta crisis, no ajena al sistema sanitario en su conjunto. Esta situación justifica la implantación de medidas tendentes a racionalizar el gasto público en medicamentos, como fueron las especialidades farmacéuticas genéricas (EFG) y, posteriormente, los precios de referencia, que contribuyen a mantener el estado del bienestar implantado en la década de los sesenta y a principios de los setenta.
Las EFG y los precios de referencia constituyen las dos medidas estructurales más relevantes, históricamente, puestas en marcha por la administración sanitaria en España, en la que se ven implicados todos los agentes de la cadena del medicamento: industria far macéutica, médicos, farmacéuticos de atención primaria, farmacéuticos comunitarios y pacientes.
ANTECEDENTES DE LAS SIGLAS EFG
Una Orden ministerial de 1 de diciembre de 1983 (BOE del 9) clasificaba las solicitudes de registro de especialidades farmacéuticas de uso humano en absoluta novedad, novedad relativa y resto. Otra Orden del mismo día y boletín establecía, por primera vez, una diferenciación en el grupo tercero entre especialidades farmacéuticas con un sólo fármaco (monofármacos), que utilizarían la Denominación Común Internacional (DCI) del principio activo seguido del nombre del laboratorio y para las que fijaba en 270 el número de autorizaciones, y las que no cumplían con las condiciones anteriores, para las que cifraba el número en sólo 60. El texto legal generó una viva polémica de la que se hicieron eco los medios de comunicación, hasta el punto de que el Subdirector General, Fernando Montoro, concedió una entrevista a un periódico en 1984 para explicar la situación.
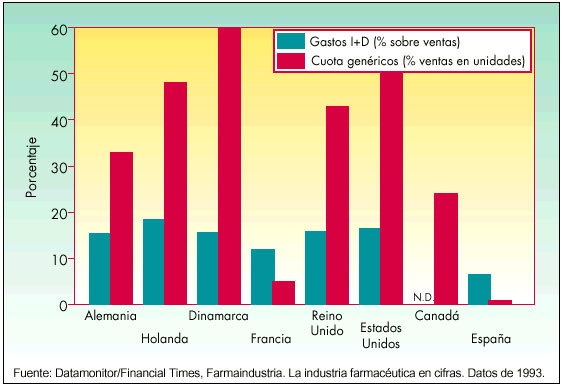
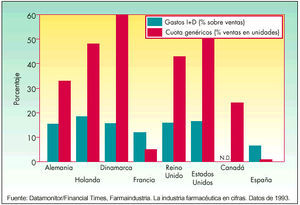
En 1983, el Centro de Estudios para Fomento de la Investigación (CEFI) publicó un folleto con el título «¿Ahora genéricos?», en el que se cuestionaba si el consumidor obtendría algún beneficio con la introducción de «medicamentos genéricos» y si con tal medida se podía perjudicar, «aún más si es posible», el panorama de la investigación en España. Estas cuestiones planteadas hace casi 20 años hoy están prácticamente solventadas, ya que son los países que tienen mayores índices de investigación farmacéutica (Estados Unidos, Alemania, Países Bajos, Reino Unido) los que tienen una cuota mayor de genéricos. Estos países tienen un mayor porcentaje de gastos en I+D sobre la cifra de ventas global del sector farmacéutico. Tales países son además los que presentan índices más altos de medicamentos genéricos, expresados en unidades (porcentaje del mercado farmacéutico), como se observa en la figura 1.
Fig. 1. La investigación y los genéricos
Esta primera referencia al término genérico nada tiene que ver con el de especialidad farmacéutica genérica (EFG) que actualmente se conoce, pues sólo conserva la denominación con DCI seguida del nombre del laboratorio titular.
Antes de que en el último día de 1996 naciera una definición legal de EFG, ya se habían iniciado los contactos con Farmaindustria, consciente ésta de que era preciso clarificar la autorización e identificación de los medicamentos genéricos en España. Para ello presentó en abril de 1995 a la administración farmacéutica el documento que fue remitido por la circular OIF/16/95, en el que definía la especialidad farmacéutica genérica equivalente validada (GEV):
La GEV debía reproducir un modelo de la especialidad farmacéutica original a la que se refería específicamente.
La eficacia y seguridad terapéuticas que el medicamento modelo demostró en el proceso de investigación preclínica y clínica le eran atribuidas a la GEV, en función de las identidades en composición cualitativa y cuantitativa de principios activos y especificaciones comprobadas experimentalmente y de las pruebas positivas de biodisponibilidad, estableciendo la equivalencia terapéutica.
Aparte de los requerimientos naturales y experimentales descritos, serían elegibles como integrantes de los medicamentos genéricos aquellos principios activos que habían recibido la confirmación de su valor terapéutico por el uso clínico durante los períodos establecidos por la Directiva 87/21/CEE y legislación específica, en ausencia de presentación de un perfil de peligrosidad, de exigencias críticas de biodisponibilidad o de cualquier otra limitación. Esto se entendía por haber transcurrido 10 años desde que fue autorizado en España el medicamento original al que el solicitante pretendiera referir el suyo como «esencialmente similar». Los principios activos protegidos por una patente en la Unión Europea no podrían presentarse como GEV.
Debía tener un precio menor al medicamento original de referencia.
La Especialidad Farmacéutica Genérica asociaría indisolublemente a su nombre las siglas oficiales GEV que acreditaban su naturaleza de medicamento genérico. Estas siglas constaban en todo el material impreso de embalaje en forma tipificada, siguiendo el modelo de las especialidades farmacéuticas publicitarias.
Así, el nombre de la especialidad farmacéutica genérica equivalente Validada se formaba por: la DCI del principio activo, el nombre del fabricante, el nombre de la forma farmacéutica y las siglas GEV.
La intención de hacer figurar las siglas GEV no existía en ningún país de la Unión Europea, donde actualmente los medicamentos genéricos participan con un alto porcentaje y contribuyen en gran medida al ahorro y al uso racional del medicamento. Posteriormente se han utilizado distintivos para los genéricos en países como Francia (GE) o Italia (AIC/G), cuya cuota de genéricos es baja.
LEGISLACIÓN VIGENTE
En 1990 aparecía la Ley del Medicamento. En su artículo 15 encargaba al Ministerio de Sanidad la atribución a cada sustancia medicinal de una Denominación Oficial Española (DOE) de uso obligatorio y dominio público, sin perjuicio de que pudiera expresarse, además, en las correspondientes lenguas oficiales de las comunidades autónomas. Esta ley dispone que «podrá designarse a una especialidad farmacéutica con un nombre de fantasía o marca comercial o bien con una denominación común o científica unidas ya a una marca, ya al nombre del titular de la autorización o fabricante».
La Organización Mundial de la Salud (OMS) recomienda las denominaciones comunes internacionales (DCI). Así, las administraciones sanitarias de los distintos países se encargan de la traducción a su propia lengua y las oficializan. De esta forma, en algunos países se han creado denominaciones como Denominación Común Italiana (DCIT), la inglesa (British Adopted Name o BAN), la americana (United States Adopted Name o USAN), etc. La OMS recomienda su uso por ser un valioso instrumento de información sobre las propiedades de los medicamentos. Conociendo unas 200 raíces se pueden clasificar según su acción terapéutica prácticamente todos los medicamentos. De ahí la facilidad que los genéricos proporcionan en su manejo y evitan duplicidades de tratamientos farmacológicos.
El medicamento genérico esencialmente surge para ahorrar en lo posible en la factura pública de medicamentos, tal es así que fue definido en la Ley de Acompañamiento a los Presupuestos Generales del Estado para 1997, exactamente en la Ley 13/1996, de 30 de diciembre (BOE del 31) de Medidas Fiscales, Administrativas y del Orden social, que modifica la Ley del Medicamento incorporando al artículo 8 la siguiente definición: «6 bis. Especialidad Farmacéutica Genérica: La especialidad con la misma forma farmacéutica e igual composición cualitativa y cuantitativa en sustancias medicinales que otra especialidad de referencia, cuyo perfil de eficacia y seguridad esté suficientemente establecido por su continuado uso clínico. La especialidad farmacéutica genérica debe demostrar la bioequivalencia terapéutica con la especialidad de referencia mediante los correspondientes estudios de bioequivalencia. Las diferentes formas farmacéuticas orales de liberación inmediata podrán considerarse la misma forma farmacéutica siempre que hayan demostrado su bioequivalencia».
También se añade un párrafo en el apartado 1 del artículo 16 para indicar como deben denominarse los medicamentos genéricos: «Cuando se trate de especialidad farmacéutica genérica, la denominación estará constituida por la denominación oficial española o, en su defecto, por la denominación común o científica acompañada del nombre o marca del titular o fabricante. Las especialidades farmacéuticas genéricas se identificarán por llevar las siglas EFG en el envase y etiquetado general».
Se observa que la definición legal establecida es muy similar a las primeras consideraciones sobre lo que debía ser un medicamento genérico, lo único que ha variado son las siglas EFG en lugar de GEV como en un primer momento se valoró.
Posteriormente, se han establecido distintas normas que hacen referencia al registro de EFG, a los precios de referencia y a la orden ministerial que los desarrolla. En la tabla I se indica toda la normativa vigente de las EFG y los precios de referencia.
EVOLUCIÓN DESDE 1997 A 2001
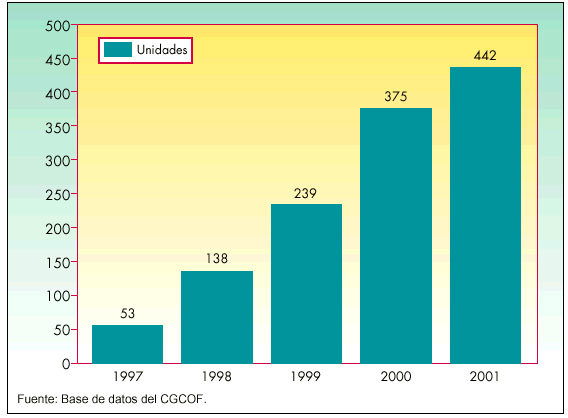
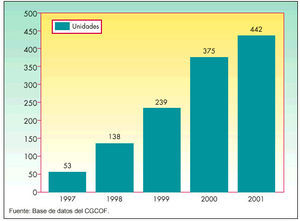
En abril de 1997 fueron autorizadas las primeras 8 EFG, concedidas a dos laboratorios y que contenían estos 4 principios activos: alopurinol, atenolol, captopril y naproxeno. Desde aquel año la oferta del número de EFG ha crecido considerablemente hasta superar el millar de EFG comercializadas por más de 70 laboratorios. En la figura 2 se aprecia la trayectoria en la autorización de EFG durante estos 5 años.
Durante los 4 primeros años las presentaciones de EFG que contenían el mismo principio activo se autorizaban al mismo precio o muy similar, situación que ha cambiado en el primer año de aplicación de los precios de referencia. Desde entonces las EFG se han ido registrando a precios mucho más bajos que las mismas presentaciones de EFG que ya existían en el mercado, tal es el caso del omeprazol, ciprofloxacino, enalapril, ranitidina, etc.
Esta competencia en precios que da lugar a precios más bajos traerá como consecuencia una reducción del precio de referencia que se fija cada año. Las revisiones se realizan en base a la media ponderada por las ventas (PVP IVA), en los 12 meses anteriores a la revisión, del número mínimo de las presentaciones de las especialidades de menor precio, necesario para alcanzar una cuota de mercado en unidades del 20%. Cada nueva presentación de EFG que se registra puede dar lugar a un conjunto homogéneo no definido anteriormente según se establece en el Real Decreto 1035/1999, por el que se regula el sistema de precios de referencia. Así en la Orden Ministerial de 27 de diciembre de 2001 (BOE 29-12-2001) se han incluido 28 conjuntos homogéneos nuevos y se han revisado los precios de referencia de los 114 grupos homogéneos de la Orden de 13 de julio de 2000, en la que los precios de algunas presentaciones no han variado y otras han sufrido un pequeño descenso en torno al 10% de media y que, seguramente, será menor al que experimente la siguiente revisión de la Orden del año 2003, en la que se tendrán en cuenta las ventas anuales de las EFG de bajo precio posteriormente comercializadas.
Esta disminución paulatina de los precios significa un progresivo alejamiento de los precios de la Unión Europea. No hay que olvidar que España no sólo tiene los precios intervenidos previamente sino que además el precio medio de los medicamentos está un 28% por debajo de la media europea (sólo Francia y Grecia tienen los precios más bajos) y supone un inconveniente al mercado único europeo, sin olvidar que con ello se fomenta las exportaciones paralelas.
La aprobación de la Orden de 27-12-2001 supondrá un ahorro adicional en gasto de medicamentos de unos 144 millones de euros según el Ministerio de Sanidad y será efectiva para las presentaciones afectadas en el plazo de tres meses desde la fecha de entrada en vigor de la orden. Las facturaciones cerradas a partir del día 1 de mayo de 2002 se liquidarán con los nuevos precios.
El año 2001 ha terminado con un incremento del gasto del 7,93% frente al 7,52% de 2000, dato que puede calificarse de positivo. Este es el primer año en que la aplicación de precios de referencia junto con el consumo de EFG ha jugado su papel junto a otras medidas de contención llevadas a cabo por la Administración.
CONSUMO DE EFG
En el apartado anterior se ha señalado un incremento espectacular en la autorización de EFG y también en el número de laboratorios que han centrado su actividad en estas especialidades farmacéuticas. Sin embargo, el consumo de EFG ha experimentado un pequeño crecimiento sostenido no acorde con la oferta del mercado de genéricos español. El consumo de medicamentos genéricos varía de unas comunidades autonómas a otras, desde el 2,5% registrado en la Comunidad Valenciana a lo largo del año pasado hasta cuotas de mercado de estos medicamentos superiores al 6% en Cataluña y con valores por encima del 7% en aquellos territorios entonces gestionados por el Insalud. En todo el estado, se sitúa en torno al 5% del total de especialidades dispensadas en el Sistema Nacional de Salud (SNS), una cifra de consumo aún lejana al 15% de media de los países de la Unión Europea
Un ejemplo: Andalucía
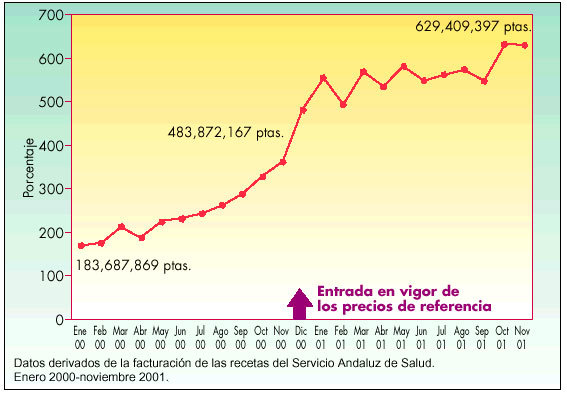
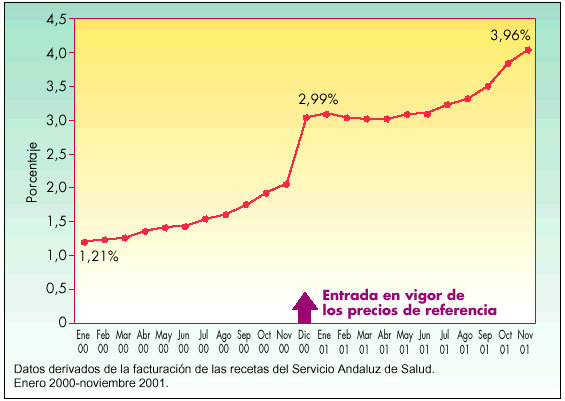
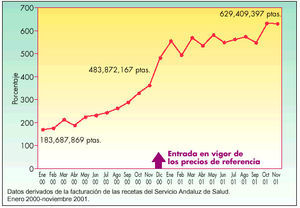
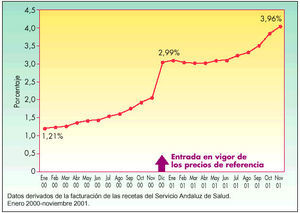
En Andalucía se observa un crecimiento de la cuota de mercado de EFG en el período estudiado, de enero de 2000 a noviembre de 2001, según se indica en las figuras 3 y 4, expresado en millones de pesetas y en porcentaje, respectivamente, del total de las recetas dispensadas en el Servicio Andaluz de Salud (SAS). Es significativo el incremento que se produjo desde noviembre de 2000 a diciembre de 2000, mes en que entró en vigor el sistema de precios de referencia. Se pasó de un consumo en el número de envases de genéricos de 200.839 (370.007.095 en millones de pesetas) en noviembre a 258.806 envases (483.872.167 en millones de pesetas) en diciembre de 2000, lo que supuso un incremento de un punto en el porcentaje de envases de genéricos. La evolución de la cuota de mercado de estos medicamentos una vez puesto en marcha los precios de referencia fue lenta, con un crecimiento sostenido que incluso desaceleró de mayo de 2001 a junio de 2001, para después experimentar una evolución más favorable en los últimos tres meses estudiados.
Fig. 3. Evolución del mercado de EFG en Andalucía por unidades (millones de pesetas)
Desde 1997 la ofertadel número de EFG ha crecido considerablemente hasta superar el millar
Fig. 4. Evolución del mercado de EFG en Andalucía por unidades (porcentaje)
El consumo de EFG ha experimentadoun pequeño crecimientosostenido no acordecon la oferta del mercadode genéricos español
El SAS, más que llevar a cabo una política de genéricos, ha basado su sistema de control del gasto en la prescripción de las especialidades farmacéuticas más económicas, aspecto que culminó con la firma de un acuerdo entre el SAS y el Consejo Andaluz de COF firmado el pasado 6 de junio y que entró en vigor en septiembre de 2001. En el pacto se establecen precios máximos que paga la Administración cuando el médico prescribe medicamentos sin indicar una especialidad farmacéutica o marca comercial concreta. El precio máximo que paga el SAS se fija eligiendo, de las distintas especialidades de un principio activo, los dos medicamentos más baratos. El más caro es el que marca el precio a abonar.
EL FARMACÉUTICO DE ATENCIÓN PRIMARIA
Antes de entrar a evaluar si el médico está realizando un uso racional del medicamento se deben poner a su disposición protocolos que le sirvan de referencia en sus prescripciones. Ésta es considerada una de las funciones clásicas de los farmacéuticos de atención primaria.
La OMS hace la siguiente definición de prescripción racional: «La prescripción racional se consigue cuando un profesional bien informado, haciendo uso de su mejor criterio, y con apoyo específico, prescribe al paciente un medicamento bien seleccionado en la dosis y período de tiempo apropiados, al menor coste posible».
Si se atiende a esta definición, el médico debe ser asesorado en su prescripción para llevar a cabo un uso racional de los medicamentos y son las EFG las especialidades farmacéuticas que mejor se adaptan a este concepto, pues aportan las garantías de calidad, seguridad y eficacia mediante el cumplimiento de las normas de correcta fabricación y control de calidad y los correspondientes estudios de bioequivalencia, así como un precio menor, que es la razón de ser de estos medicamentos.
La gestión eficaz del proceso de prescripción puede ahorrar tiempo, facilitar una mayor eficacia en la utilización de los recursos y un servicio más eficiente para los pacientes. Cada vez hay un mayor control del consumo de medicamentos, en parte, para mejorar la calidad de la prescripción y, en parte, para garantizar que el gasto en la asistencia sanitaria sea eficaz. La inversión en el apoyo profesional a la prescripción médica que realizan los farmacéuticos de atención primaria se verá compensada rápidamente con creces, tanto desde el punto de vista económico como por la optimización del tiempo y de otros recursos.
Funciones
Los farmacéuticos de primaria son técnicos de salud en los distritos sanitarios de atención primaria. Su misión fundamental es el uso racional del medicamento en su distrito. Para ello, en Andalucía, por ejemplo, cuentan con la comisión de farmacia de distrito y con las sesiones de famacia de las zonas básicas de salud, según contempla la Circular 13/90 del Servicio Andaluz de Salud.
En cada centro de salud de la comunidad autónoma andaluza a la sesión de farmacia y terapéutica asisten, con carácter obligatorio, todos los facultativos médicos del equipo de atención primaria, el farmacéutico del distrito responsable del área de medicamentos, que actúa como secretario, y el director del centro, que la preside y la modera.
En cada distrito de atención primaria se constituye una comisión de farmacia y terapéutica integrada por un médico general y un pediatra de cada centro de salud, el coordinador de epidemiología, si existiera, el farmacéutico responsable del área de medicamentos, que actúa como secretario, y el director o técnico en quien delegue, que lo preside.
La actividad básica, tanto de las sesiones como de las comisiones de farmacia y terapéutica, es la elaboración, promoción y actualización permanente de unas guías farmacológicas de distrito, concebidas como expresión del mayor consenso posible entre los conocimientos cientificotécnicos actuales sobre medicamentos y la práctica médica real en cada medio. Entre sus objetivos destaca introducir una dinámica de selección racional de medicamentos para conseguir que sea la guía de consulta habitual de todos los médicos prescriptores. De esta forma constituye el estándar de referencia en el control de la calidad de la prescripción.
Otra de las funciones de las sesiones y las comisiones de farmacia y terapéutica es el estudio y evaluación de los resultados de los programas de análisis del consumo de medicamentos (perfiles farmacoterapéuticos, estudios de utilización, etc). Uno de los objetivos del análisis de la prestación farmacéutica es detectar desviaciones de consumo que orienten los programas de control de calidad de la prescripción y las necesidades de información.
Sería muy útil que los farmacéuticos de atención primaria informasen a los farmacéuticos comunitarios del momento en que se planifican cambios en la prescripción. Ellos pueden verse afectados de muchas formas y facilitaría atender la prescripción del médico de forma inmediata. Además, los farmacéuticos comunitarios pueden ayudar a apoyar a los pacientes en los cambios de la prescripción, reforzándoles mensajes clave y proporcionando apoyo y confianza.
Vademécum de EFG
En el VI Congreso Nacional de la Sociedad Española de Farmacéuticos de Atención Primaria (SEFAP) celebrado en Madrid se presentó el primer vademécum de EFG en Internet, una iniciativa llevada a cabo con la colaboración de la Asociación Española de Fabricantes de Sustancias y Especialidades Farmacéuticas Genéricas (AESEG). El vademécum pretende paliar la falta de información existente hoy día en este campo y concienciar al médico en la prescripción y al farmacéutico en la dispensación.
Este vademécum permite a todos los profesionales de la salud disponer de información permanentemente actualizada sobre las EFG, identificar el medicamento que el paciente está tomando y disminuir errores terapéuticos, establecer su disponibilidad comercial, establecer las características básicas del material de acondicionamiento, establecer excipientes de declaración obligatoria (EDO) y coste. Posibilita la búsqueda de las EFG por principio activo, nombre de la especialidad, grupo homogéneo, laboratorio, etc. También se puede identificar una EFG a partir de la morfología de la presentación. Este catálogo visual de EFG dispone de 800 fotografías que irán actualizándose en colaboración con la AESEG.
Este vademécum puede estimular la prescripción de medicamentos genéricos tanto desde el punto de vista educativo como desde la relación coste-eficacia. De esta forma se facilita información adicional sobre el potencial de ahorro mediante una mayor prescripción de EFG.
COLABORACIÓN INTERPROFESIONAL
La creación de la última sociedad farmacéutica el año pasado, la SEFAC (Sociedad Española de Farmacéuticos Comunitarios), junto con la SEFAP (Sociedad Española de Farmacéuticos de Atención Primaria) y la SEFH (Sociedad Española de Farmacéuticos de Hospital) dan lugar a los tres vértices que componen la profesión farmacéutica en su conjunto, que completan la implicación farmacéutica en la cadena asistencial del paciente.
Los farmacéuticos de atención primaria han dado lugar en los últimos años a una de las ramas de la profesión farmacéutica de mayor crecimiento. Sus funciones van ampliándose como así consta en las ordenaciones farmacéuticas de las comunidades autónomas.
El farmacéutico de atención primaria como miembro del equipo de primaria puede facilitar la comunicación entre el farmacéutico comunitario y el médico. El trabajo del farmacéutico de oficina cambiará con las nuevas tecnologías, con Internet y con la receta electrónica. La historia farmacológica informatizada conllevará que el farmacéutico comunitario se implique más en los proyectos de salud pública así como en la vigilancia epidemiológica de medicamentos, en las intervenciones sanitarias, en la resolución de PRM, etc. Todas estas acciones podrían estar coordinadas conjuntamente con el farmacéutico de atención primaria en colaboración con el médico. El farmacéutico de atención primaria cumpliría sus funciones de nexo de unión entre ambos colectivos con el fin de conseguir un uso adecuado del medicamento en el paciente, derivado de un seguimiento del tratamiento farmacológico.
Podrían establecerse grupos de investigación con participación de farmacéuticos de primaria y de oficina sobre nuevos fármacos para tratar enfermedades de primaria, como la diabetes o la hipertensión llevando a cabo estudios epidemiológicos.
Es imprescindible para llevar a cabo este acercamiento o desarrollo de programas conjuntos que realice un cambio en la actitud de los profesionales y una redefinición de sus funciones para que se entienda que son complementarias. También es necesario establecer un proceso de capacitación, así como definir y dotar de los recursos necesarios ese nuevo escenario de colaboración interprofesional.
BIBLIOGRAFÍA GENERAL
¿Ahora genéricos? Centro de Estudios para Fomento de la Investigación: Barcelona, 1983.
Mateos L. EFG y factura farmacéutica. Herramienta de control. Farmacia Profesional 2001;15(9):15-26.
Mateos L. La Hora del Medicamento Genérico (tomos I y II). Barcelona: Genéricos Esteve, 1999.
Mateos L, Herrera J. La investigación y los genéricos. Un tándem especial. Farmacia Profesional 2000;14(5):97-106.
Montoro F. ABC, 14 de enero de 1984. Reproducido con el título de «¿Medicamentos genéricos?», Acofar 1984; 23:8.
Orden Ministerial de 27 de diciembre de 2001, por la que se determinan nuevos conjuntos homogéneos de presentaciones de especialidades farmacéuticas, se aprueban los correspondientes precios de referencia y se revisan los precios de referencia aprobados por Orden de 13 de julio de 2000.
El gasto farmacéutico creció un 7,93% el año pasado. Correo Farmacéutico 2002; 21-27 de enero.
Sanidad pretende duplicar el consumo de genéricos, que alcanza sólo el 2,5% de la venta de medicamentos [consultado el 9 de febrero de 2002]. Disponible en: www.rathiopharm.es/noticias/duplicar.htm
Sanidad rebaja los precios de referencia de los medicamentos y ahorra 144 millones de euros. Farma 2002 PM [consultado el 14 de enero de 2002]. Disponible en: www.pmfarma.com/noticias/noticias/noti.asp?ref=800