La esterilidad e infertilidad suponen una situación carencial que no compromete la integridad física del individuo ni supone un riesgo vital, sin embargo, dado que la mayoría de los adultos contemplan como objetivo vital esencial el tener hijos, esta carencia puede incidir negativamente en el desarrollo de la persona, produciendo frustración y desmoralización. Por ello suponen un problema de salud pública de trascendencia. Las técnicas de reproducción humana han alcanzado un auge importante en las dos últimas décadas. El desarrollo de nuevas estrategias diagnósticas y novedosos procedimientos terapéuticos han sido ampliamente divulgados en los medios de comunicación, lo que ha facilitado el acceso de la mayoría de la población a los centros de reproducción asistida para abordar el problema.
ESTERILIDAD E INFERTILIDAD
Se entiende por esterilidad la incapacidad, tanto por parte del varón como de la mujer, para concebir1. La esterilidad se clasifica en: primaria (cuando la pareja, tras un año de relaciones sin tomar medidas de protección, no ha conseguido un embarazo) y secundaria (la de la pareja que, tras la consecución del primer hijo, no logra una nueva gestación tras 2 o más años de intentarlo). El tiempo mínimo a partir del cual se habla de esterilidad se fija en un año de relaciones sexuales con deseo de descendencia.
El concepto de infertilidad es distinto: es la incapacidad para producir un hijo vivo. Así, se denomina infertilidad primaria la que padece una pareja que consigue una gestación que no llega a término con un recién nacido normal, e infertilidad secundaria cuando, tras un embarazo y parto normales, no se consigue una nueva gestación a término con recién nacido normal.
FERTILIDAD HUMANA
En comparación con otras especies animales, el proceso reproductivo en humanos resulta altamente ineficaz. Existe un momento de máxima fecundidad en los primeros meses (alrededor de 20-30% de embarazos por ciclo) de forma que al cabo de tres ciclos, dos terceras partes de las mujeres han logrado el embarazo. Dicha fecundidad se reduce paulatinamente en ciclos sucesivos. Globalmente, la tasa acumulada de embarazo entre parejas de fecundidad probada es del 90% aproximadamente a los 12 meses y de alrededor del 95% a los 24 meses2.
INCIDENCIA Y FACTORES IMPLICADOS
Por lo tanto, aproximadamente nueve de cada diez parejas en edad fértil que mantienen relaciones sexuales regulares consiguen un embarazo durante el primer año. Las cifras de prevalencia de esterilidad que manejan los especialistas sitúan entre un 12 y un 20% la imposibilidad de tener un hijo2. Alrededor de 800.000 parejas españolas sufren problemas de fertilidad.
La realidad es que ha habido un incremento en la demanda de atención especializada en las consultas de esterilidad, lo que crea la impresión de que se ha visto incrementada la prevalencia en las últimas décadas de esterilidad e infertilidad. A ello contribuyen sin duda, cambios socioculturales que se han producido en nuestra sociedad en los últimos años, tales como la incorporación de la mujer al mundo laboral y la formación universitaria, el desempleo, el retraso en la independencia económica de ambos cónyuges, uniones matrimoniales más tardías y búsqueda de descendencia a edades mayores. Es evidente, asimismo, el deterioro durante las últimas décadas de la calidad del semen humano. Las causas de este deterioro progresivo no han sido claramente establecidas, aunque sí se han postulado algunos factores ambientales como implicados: temperatura, radiaciones, toma de fármacos, exposición ocupacional, estimulantes (drogas, alcohol, tabaco), deficiencias nutricionales (selenio, cinc, vitaminas)3.
La edad de la mujer es importante: se estima que las posibilidades de que una mujer de 20-24 años no se quede embarazada están entre el 4-5%. Estas posibilidades aumentan lentamente con la edad, de tal forma que a los 35 años estarían alrededor del 14%. Este suave aumento de la esterilidad en la mujer sufre un brusco cambio a partir de los 35 años, de tal forma que a los 40 años la esterilidad en la mujer rondaría cifras del 65-70%. Este incremento se ve agravado por el hecho de que también aumentan las tasas de aborto, que a partir de esta edad son aproximadamente del 71%.
ETIOLOGÍA
Un 40% de los casos de esterilidad son de causa masculina: por alteraciones en el ámbito testicular, obstrucción de conductos, patologías en la próstata, alteraciones en la eyaculación o erección y alteraciones en el semen. Otro 40% se debe a causas femeninas, como la menopausia precoz, la endometriosis, las obstrucciones o lesiones de las trompas de Falopio, anomalías uterinas y cervicales o los problemas ovulatorios. El 20% restante corresponde a causas mixtas o combinadas, en las cuales ambos cónyuges son responsables.
ABORTO DE REPETICIÓN
Posiblemente pocos problemas ginecológicos resulten tan frustrantes, tanto para la pareja como para el médico, como el aborto de repetición, equivalente al término castellano «infertilidad». Para la pareja, por lo traumático que resulta la pérdida repetida de gestaciones que, en general, se suelen conseguir con facilidad, se malogran sin justificación clara y carecen de expectativas satisfactorias de tratamiento en algunas ocasiones.
El término «aborto de repetición» se aplica en la actualidad a aquellas situaciones en las que se han producido al menos dos abortos consecutivos o más de dos alternos.
DIAGNÓSTICO DE LA PAREJA ESTÉRIL
Se han descrito multitud de pruebas diagnósticas encaminadas al despistaje de cada uno de los factores implicados en la reproducción. Sin embargo, no todas las exploraciones son necesarias o imprescindibles para el diagnóstico y/o para la orientación terapéutica del caso. Por ello, y en un intento de simplificar el camino a estas parejas que tanta carga psíquica, física y económica han de soportar, se ha simplificado al máximo el estudio. Pruebas diagnósticas esenciales son:
Evidencia de que la mujer ovula, para lo cual es suficiente comprobar que menstrúa cada 28 ± 7 días.
Anamnesis e historia clínica para detección de enfermedades concomitantes (diabetes, hipertensión, alteraciones tiroideas, etc.) e historial médico familiar sobre patologías y enfermedades hereditarias.
Evidencia de una reserva ovárica suficiente: se determina sistemáticamente, de forma basal (tercer día del ciclo), la FSH (hormona folículoestimulante) y el estradiol sérico.
Evidencia de que el semen es normal, para lo cual se realiza un seminograma.
Evidencia de que el canal genital es normal, para lo cual basta inicialmente con una histerosalpingografía (HSG) y una ecografía transvaginal que explore también los ovarios, en busca de quistes endometriósicos o endometriomas y miomas uterinos fundamentalmente. La HSG es una prueba molesta, por lo que siempre se realiza tras evidenciar un espermiograma normal o suficiente para la realización de coitos programados o inseminaciones artificiales.
A partir de ese momento, se decide ya un tratamiento para la pareja. Si todas las exploraciones resultan normales se indica la realización de coitos programados con estimulación de la ovulación (si el problema es una disfunción ovulatoria, como ocurre en los ovarios poliquísticos) o de inseminaciones artificiales (cuando supuestamente los ciclos de la mujer han sido regulares). La experiencia demuestra que la inseminación conyugal proporciona tasas acumuladas de embarazo > 60%, por lo se aconseja instaurar este tipo de terapia durante 4 ciclos. Si la mujer no gesta, el camino a seguir dependerá mucho de su edad, pero en casi todos los casos se decide practicar fecundación in vitro (FIV) para estudiar ambos gametos en el laboratorio y la interacción de ambos (fecundación y desarrollo embrionario). En el 20% de los casos en los que las inseminaciones fallan y se realiza fecundación in vitro, se ha observado que no se produce la penetración del espermatozoide en el interior del ovocito u óvulo y por lo tanto se produce un fallo de fecundación, responsable de la esterilidad en estas parejas. Por ello, en un primer ciclo tras fallo de inseminaciones, se realiza con la mitad de los óvulos FIV y con la otra mitad ICSI o microinyección intracito plasmática de espermatozoides (1/2 FIV- 1/2 ICSI), lo que permite decidir sobre la técnica más adecuada en el futuro y al menos asegurar fecundación en la mitad de los ovocitos, para poder realizar transferencia embrionaria y rentabilizar el ciclo con posibilidad de gestación.
Durante el screening inicial se evidencia la existencia de las siguientes patologías:
Alteraciones en la ovulación: síndrome de ovarios poliquísticos, amenorreas de causa central o periférica, fallos ováricos precoces o menopausia precoz, fallos ováricos ocultos, etc. Según la patología encontrada se completan las pruebas pertinentes: cariotipo, resistencia a la insulina, anticoagulantes circulantes, autoanticuerpos, etc.
Presencia de quistes endometriósicos, miomas uterinos, pólipos endometriales, alteraciones mullerianas en la anatomía genital (útero doble, tabiques, ausencia de vagina, etc.), alteraciones en las trompas de Falopio (obstrucciones, inflamación y presencia de hidrosálpinx). En estos casos se considera la necesidad de realizar una valoración endoscópica por vía laparoscópica o histeroscópica para definir mejor el diagnóstico o para realizar las correcciones quirúrgicas pertinentes.
Alteraciones en el espermiograma: se valora la concentración, la motilidad y la morfología de los espermatozoides. En ocasiones se objetiva una ausencia de espermatozoides en el eyaculado (azoospermia), por lo que se deberá recurrir a la biopsia testicular para completar el estudio y obtener espermatozoides testiculares o de epidídimo con los que poder trabajar a posteriori.
TRATAMIENTO
Las opciones de tratamiento para los problemas expuestos son diversas:
Estimulación e inducción
de la ovulación
En la mayoría de las ocasiones se intenta aumentar las posibilidades de gestación incrementando la calidad y número de ovocitos maduros disponibles. En el caso de coitos programados, se sincroniza el momento de la ovulación con las relaciones sexuales.
Inseminaciones artificiales
Se pueden realizar cuando el aparato genital de la mujer sea normal, tenga permeabilidad tubárica y se obtenga tras capacitación espermática una concentración superior a 3 millones de espermatozoides móviles con progresión.
En la inseminación con semen del cónyuge, la tasa de gestación por ciclo es del 13-15% y alcanza el 65% acumulando 4 ciclos. En el caso de inseminaciones con semen de donante la tasa de gestación por ciclo es del 20% y del 80% acumulando 6 ciclos.
Con la inseminación conyugal (IAC o IAH), en una mujer bien reglada, se trata la fase folicular con hormona foliculoestimulante, induciendo la ovulación con gonadotrofina coriónica humana (HCG) y añadiendo progesterona para suplir la fase lútea, con lo que cualquier tipo de disfunción ovulatoria estará cubierto. Además, se seleccionan los espermatozoides móviles y se elimina la barrera cervical al ser intrauterina, por lo que se ayuda a los casos de subfertilidad masculina leve, esterilidad cervical e incluso a los hipotéticos casos de dificultad de transporte espermático. Es lógico pensar, pues, que en caso de fallar la inseminación artificial, pueda existir una mala función tubárica o un problema en los gametos o en la interacción de los mismos.
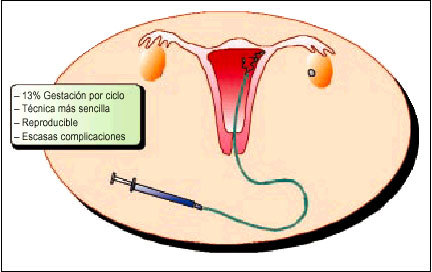
Cuando se opte por la inseminación artificial con semen de donante (IAD) el procedimiento será el mismo (fig. 1).
Fig. 1. Inseminación intrauterina
La duda surge cuando fracasa la inseminación artificial: ¿es más conveniente la laparoscopia o por el contrario se debe realizar un 1/2 FIV-1/2 ICSI? En la mayoría de los casos se suele hacer un 1/2 FIV-1/2 ICSI. Una laparoscopia podría revelar una endometriosis leve o unas adherencias leves. La primera no justifica la esterilidad y ambas se han tratado con inseminación. Si se realiza un ciclo 1/2 FIV-1/2 ICSI, sin embargo, se consigue el diagnóstico definitivo de un problema de interacción de gametos y simultáneamente se aplica un tratamiento, cuyas tasas de embarazo doblan a las de la inseminación.
Aunque ésta es la pauta de conducta generalmente aceptada y adaptada a casi todas las parejas en el IVI, la edad de la mujer va a ser un factor determinante de primera magnitud.
FECUNDACIÓN IN VITRO
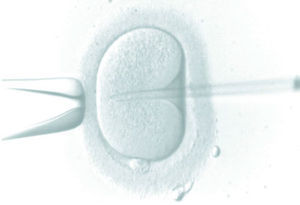
La fecundación in vitro consiste en reproducir el proceso de fecundación que se produce de manera natural, pero esta vez en el laboratorio de reproducción asistida, para lo cual es preciso tener en el laboratorio los ovocitos y los espermatozoides y un ambiente reproducible al natural para conseguir su fecundación mediante diferentes técnicas. Es preciso realizar un ciclo de estimulación ovárica con el objeto de conseguir numerosos ovocitos y garantizar una buena transferencia embrionaria e incluso poder congelar embriones sobrantes, para transferir en otros ciclos posteriores si no quedara embarazada en el primero, o si la paciente quisiera quedar de nuevo gestante.
Tras una estimulación ovárica se aspiran los folículos de la paciente en el quirófano, con punción ecoguiada y bajo sedación anestésica. Los ovocitos conseguidos en la punción folicular son tratados de diferente manera, según la indicación que requiera el caso, y son inseminados con los espermatozoides previamente recuperados y preparados; todo ello siempre en el laboratorio.
Fecundación in vitro convencional
Consiste en depositar los ovocitos obtenidos en la punción en gotas de medio de cultivo, en las cuales se ha preparado una dilución de espermatozoides que, por sus propios medios, han de reconocer al ovocito, penetrar en su citoplasma y conseguir así la fecundación de éste. Para poder ser realizada se precisa: función ovárica activa, madurez ovocitaria, existencia de una cantidad mínima de espermatozoides que permita confiar en que uno de ellos fecunde al ovocito (es precisa una concentración de espermatozoides con buena movilidad mínima de 100.000 por mililitro). Por lo tanto estará indicada en el factor masculino moderado, aglutinación espermática grave y sobre todo en el factor tubárico (obstrucciones, ligadura tubárica).
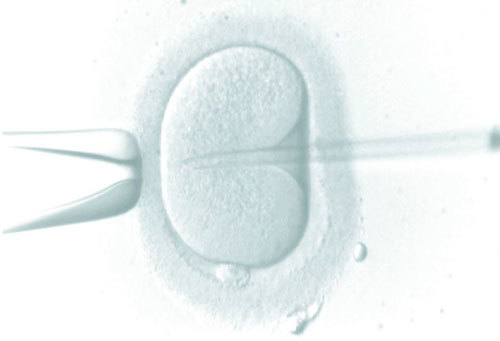
Microinyección intracitoplasmática de espermatozoides
Es la inyección de un solo espermatozoide en cada uno de los ovocitos maduros obtenidos en la punción folicular, mediante un proceso de micromanipulación. La ventaja de este procedimiento es que sólo se necesitan tantos espermatozoides móviles como ovocitos se hayan obtenido. Es la técnica que se utiliza con espermatozoides testiculares y epididimarios (fig. 2).
Fig. 2. Microinyección intracitoplasmática de espermatozoides
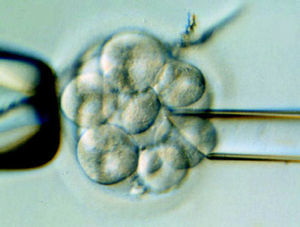
A las 24 horas de la fecundación se desarrolla la primera división embrionaria en 2 y después en 4 células. A partir de este momento, podemos realizar la transferencia embrionaria, pero el día en que ésta se debe realizar está en función de las características especiales de cada paciente, por lo tanto, se informa puntualmente a cada pareja del procedimiento más conveniente para el éxito del ciclo. La transferencia embrionaria se puede realizar mediante técnicas de abordaje diferentes, pero generalmente se realiza a través del cuello uterino, sin sedación y en condiciones de asepsia. Una vez realizada la transferencia embrionaria habrá que esperar unos días hasta realizar el test de embarazo. Esta espera será más o menos larga en función del estadio de los embriones transferidos. Transfiriendo tres embriones se consiguen tasas de gestación del 50% en un ciclo. Acumulando 4 ciclos se supera el 85%.
CONGELACIÓN EMBRIONARIA
Una vez finalizado un procedimiento de fecundación in vitro, y transferidos los embriones seleccionados, es cada vez más frecuente la posibilidad de que existan embriones sobrantes de buena calidad. Estos embriones son criopreservados para su utilización en caso de que falle la gestación con la transferencia en fresco o bien se busque una segunda gestación. La tasa de gestación por ciclo alcanza el 35%.
DONACIÓN DE OVOCITOS
El programa de donación de ovocitos se desarrolla para pacientes que por diferentes causas no presentan función ovárica capaz de producir ovocitos con calidad susceptibles de originar una gestación. De esta manera se dispone de ovocitos donados por mujeres jóvenes y sanas que de manera altruista donan sus gametos para aquellas mujeres que los necesitan. Para ello se prepara el endometrio de la paciente receptora, de tal forma que cuando se disponga de ovocitos de donante compatible en grupo sanguíneo, factor Rh y aspecto físico, se inseminen estos ovocitos donados con el semen de la pareja de la receptora, o de donante si fuera necesario, y los embriones producto de esa fecundación sean transferidos a la receptora para procurar una gestación. Este programa funciona en gran manera como un programa de donación de órganos.
Está indicada en el fallo ovárico precoz (FOP), menopausia fisiológica, menopausia quirúrgica, enfermedades hereditarias de la paciente que impidan la utilización de sus ovocitos, mala calidad ovocitaria o embrionaria dependiente del gameto femenino.
La tasa de gestación por ciclo es del 50%, y acumulada en 4 ciclos supera el 90%.
COCULTIVO EMBRIONARIO
Se desarrolla para pacientes con fallos repetidos de gestación con procedimientos de reproducción asistida en los que se transfirieron buenos embriones, en número y calidad, sin conseguir gestación. Los embriones se mantienen en el laboratorio hasta el estadio de blastocisto, sobre una monocapa de células del epitelio endometrial humano. Al transferir los embriones en estadio de blastocisto es posible evaluar los primeros días de división embrionaria en los que se supone que hubo deficiencias que hicieron fracasar la implantación en los ciclos anteriores. Se requiere un número de embriones de buena calidad igual o superior a 5, para asegurar la transferencia de, al menos, 1 blastocisto.
DIAGNÓSTICO PREIMPLANTATORIO
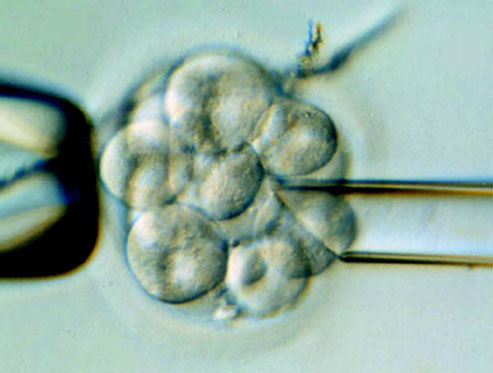
El diagnóstico genético preimplantatorio (DPI) se presenta como un nuevo campo que, unido a las técnicas de reproducción asistida, ofrece la posibilidad de analizar la presencia de alteraciones cromosómicas y genéticas en embriones antes de ser transferidos al útero y, por tanto, antes de que se haya producido la implantación. La pareja debe someterse a un tratamiento de fecundación in vitro. En estas condiciones, después de la fecundación, el cigoto humano se divide aproximadamente cada 24 horas de manera que, 3 días después de la obtención de los óvulos, los embriones tienen una media aproximada de 8 células o blastómeros. En este momento, se realiza la biopsia embrionaria, técnica mediante la cual podemos extraer 1 o 2 blastómeros para su análisis posterior, mientras que el embrión se mantiene en cultivo hasta que se obtienen los resultados y se realiza la transferencia (fig. 3). Estas técnicas de análisis cromosómico o genético permiten un diagnóstico muy rápido, que oscila entre las 3 horas y las 48 horas, según los casos, compatible con el tiempo máximo de desarrollo embrionario in vitro. De esta manera, es posible mantener los embriones en cultivo hasta que se obtienen los resultados y así seleccionar embriones normales para la transferencia al útero materno.
Fig. 3. Diagnóstico preimplantatorio: biopsia de blastómeros
Así pues, se realiza una selección muy precoz, previa a la implantación, lo cual representa una gran ventaja frente a las técnicas de diagnóstico prenatal (amniocentesis, biopsia corial) en las que en caso de diagnosticar un feto como afectado, se plantea la opción de un aborto terapéutico.
Está indicado en casos de abortos de repetición en los que la causa es cromosómica (60% de los casos). En estas parejas el 70% de los embriones que producen tienen alteraciones. Con el DPI se seleccionan los embriones normales para su transferencia4.
FÁRMACOS EMPLEADOS
La terapia farmacológica contempla las siguientes opciones:
Citrato de clomifeno
Se emplea por vía oral. Su acción se basa en la unión del fármaco con los receptores estrogénicos de la hipófisis, que provoca el bloqueo de la retroalimentación negativa del estradiol. Ello induce un incremento de la secreción de gonadotropinas por la hipófisis. Es un fármaco de fácil uso y barato, pero el efecto antiestrogénico a nivel endometrial y del cuerpo lúteo puede ser responsable de las bajas tasas de implantación que permite obtener5.
En comparación conotras especies animales, el proceso reproductivo en humanos resulta altamente ineficaz
Gonadotropinas humanas
Las primeras estimulaciones de la ovulación se realizaron con gonadotropina hipofisaria humana, pero tuvo que ser abandonada por la aparición de la enfermedad de Creutzfeldt-Jakob. Años más tarde se aislaron gonadotropinas en las orinas de las mujeres menopáusicas (gonadotropina coriónica humana o HMG) con escasa pureza y conteniendo FSH y hormona luteinizante (LH). Desde entonces ha habido una intensa investigación farmacéutica para aislar FSH de alta pureza sin carga de LH y con posibilidad de administración subcutánea, y desde 1998 existe la FSH recombinante obtenida por ingeniería genética. En breve saldrá al mercado LH recombinante.
Análogos de la GnRH
Uno de los avances más importantes en el campo de la reproducción asistida ha sido el descubrimiento de los análogos de la GnRH. Administrados en distintas fases del ciclo menstrual y combinados con la estimulación de la ovulación con gonadotropinas, proporcionan una mayor sincronía en el crecimiento de los folículos, impiden el pico espontáneo de LH que provocaría una luteinización prematura de los mismos (impiden la ovulación espontánea) y disminuyen el número de cancelaciones de procedimientos. Con su uso se han mejorado las tasas de fecundación, de número de ovocitos obtenidos y ovocitos maduros obtenidos, así como de las tasas de gestación.
Su mecanismo de acción es en dos tiempos: en un primer momento por su unión al receptor estimulan la producción (efecto flare up), para que horas después desensibilicen los receptores por saturación (hipofisectomía médica reversible).
Inductores de la ovulación HCG
La HCG u hormona del embarazo farmacológica induce la ovulación 37 horas tras su administración. Obtenida de la orina de mujeres embarazadas, su acción es equivalente a la de la LH hipofisaria. La LhRH recombinante está en fase de ensayo clínico.
Antagonistas de la GnRH
Bloquean los receptores de la GnRH, suprimiendo la secreción de gonadotropinas por la hipófisis de forma inmediata y evitando el efecto flare up provocado por el uso de análogos de la GnRH. En breve aparecerán en el mercado farmacéutico español preparados de administración subcutánea. *