La dermatitis atópica, una de las enfermedades más frecuentes en la infancia, se inicia en el primer año de vida en el 60% de los casos y antes de los 5 años en por lo menos el 85%1. Tiende a mejorar con la edad, desapareciendo en la pubertad en el 50% de los casos, por lo que su prevalencia durante la infancia es del 10-20% en los países industrializados, en los que su incidencia ha aumentado en un 200-300% en los últimos 30 años2. Aunque se desconoce su etiología, la dermatitis atópica grave en la infancia se asocia a un riesgo elevado de padecer eventualmente asma o rinitis alérgica.
Etiología de la dermatitis atópica
La dermatitis atópica parece deberse a una compleja interacción de factores genéticos y ambientales que determinan una alteración en la regulación del sistema inmune, caracterizada en las lesiones agudas que se observan en la infancia por una respuesta predominantemente Th2 (T helper tipo 2; producción de interleucinas IL-4 e IL-13) con una escasa respuesta Th1 (producción de interferón gamma [IFN-gamma])3. Este patrón se parece al fisiológico en los primeros meses de vida, pero se invierte y se aproxima al del adulto hacia los 3 años de edad4.
Tratamiento con corticosteroides tópicos
Desde la introducción de los corticosteroides tópicos en los años 50, estos fármacos se han venido considerando la base del tratamiento para los brotes de dermatitis atópica5, y recientemente se han publicado ensayos clínicos en apoyo del empleo intermitente (dos veces por semana) de algunos corticoides con fines preventivos (en zonas lesionales en ausencia de afectación clínica), sin producir atrofia clínicamente evidente durante períodos relativamente prolongados6.
Efectos adversos de los corticosteroides tópicos
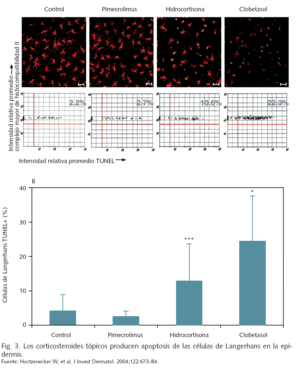
Los efectos adversos locales de los corticosteroides tópicos, tales como atrofia cutánea, estrías, telangiectasias, hipopigmentación o dermatitis perioral son bien conocidos, y pueden producirse de forma relativamente rápida (en unas dos semanas), al igual que el riesgo de desarrollo de glaucoma y cataratas tras la aplicación prolongada en la región periocular7. Un efecto celular de los corticosteroides tópicos, incluso de baja potencia, es la eliminación por apoptosis de las células de Langerhans de la epidermis, que tardan semanas en recuperarse8.
Los efectos adversos de los corticosteroides tópicos debidos a su absorción sistémica han sido menos estudiados. En pacientes pediátricos, especialmente por debajo de dos años, es bien conocido9,10 el riesgo de supresión del eje hipotálamo-hipófiso-suprarrenal, con aparición ocasional de cuadros de síndrome de Cushing yatrógeno y retraso del crecimiento. La supresión del eje no es exclusiva de los corticosteroides tópicos más potentes, que la producen en la mayoría de los casos, sino que se ha descrito en el 38% de los niños tratados con crema de acetato de hidrocortisona al 1% sin oclusión en un estudio11.
Tratamiento con inhibidores de la calcineurina
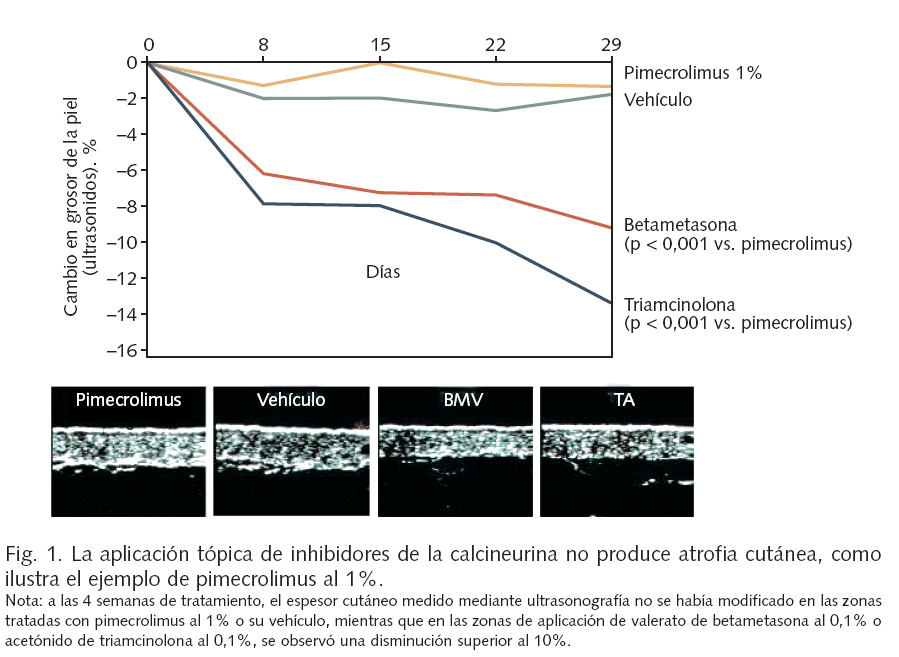
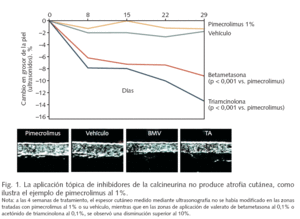
Los inhibidores de la calcineurina aplicados por vía tópica constituyen un tratamiento eficaz de la dermatitis atópica, con un mecanismo de acción selectivo que asegura una ausencia de atrofia local (fig. 1) y otros efectos adversos de los corticosteroides, con una absorción sistémica despreciable y un excelente perfil de seguridad.
Tacrolimus
El ungüento de tacrolimus, una formulación tópica de un inmunosupresor extensamente utilizado en la medicina del trasplante, se ha demostrado eficaz y seguro como tratamiento de la dermatitis atópica moderada a severa en niños (más de 2 años de edad, a la concentración aprobada del 0,03%) y adultos (más de 16 años, a la concentración del 0,1%), en numerosos estudios efectuados tanto a corto como a largo plazo12. El perfil de efectos adversos a largo plazo (más de 4 años, con una duración promedio del tratamiento de 30 meses) en adultos no difiere del observado en los estudios de 12 semanas de duración13. La eficacia de tacrolimus al 0,1% se ha comparado con la de diversos corticosteroides tópicos en varios estudios12, habiéndose demostrado la superior eficacia de tacrolimus (también a la concentración del 0,03%) con respecto a acetato de hidrocortisona al 1% en estudios a corto plazo14,15. En dos estudios japoneses extensos se ha comprobado, asimismo, la superior eficacia de tacrolimus al 0,1% con respecto al dipropionato de alclometasona 0,1% y con respecto al valerato de betametasona 0,1%12; en otro estudio efectuado en 570 adultos se observó la similar eficacia de tacrolimus al 0,1% y butirato de hidrocortisona al 0,1%, aunque la formulación de tacrolimus al 0,03% fue menos efectiva que el corticoesteroide elegido16.
Pimecrolimus
La crema de pimecrolimus al 1% fue el primer inhibidor de la calcineurina desarrollado específicamente para el tratamiento de la dermatitis atópica, y se aprobó en Estados Unidos y la Unión Europea para el tratamiento de la dermatitis atópica leve a moderada.
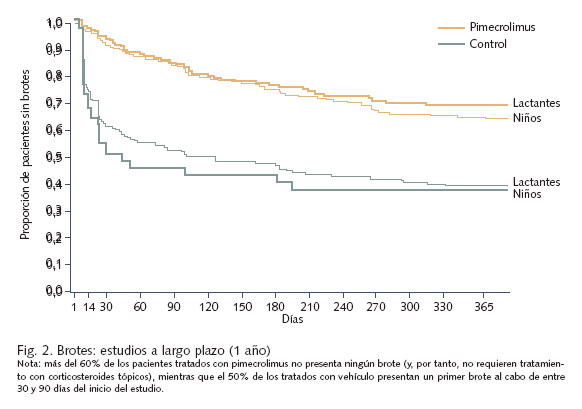
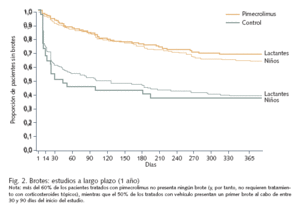
Eficacia y seguridad. La eficacia y seguridad, tanto a corto como a largo plazo, de pimecrolimus al 1% en crema en el tratamiento de la dermatitis atópica se han confirmado plenamente en diversos estudios, en los que se han incluido hasta la fecha 19.000 pacientes. Los estudios más prolongados se han efectuado en lactantes y niños con enfermedad moderada a grave tratados de forma intermitente durante hasta 2 años17-19 (fig. 2). En un estudio de 130 adultos con dermatitis atópica moderada que fueron asignados aleatoriamente a tratamiento con pimecrolimus 1% en crema o vehículo ante los primeros signos o síntomas de dermatitis atópica durante un período de 6 meses, el 60% de los pacientes tratados con el fármaco no presentaron ninguna exacerbación durante el período de estudio, en comparación con el 22% de los tratados con vehículo20. El grupo tratado con pimecrolimus requirió asimismo un número significativamente menor de días de tratamiento con el corticoide de rescate (prednicarbato 0,25%, aplicado en caso de exacerbación) que el tratado con vehículo. En otro ensayo clínico de diseño similar en el que participaron 192 adultos con dermatitis atópica moderada a severa, no presentó ninguna exacerbación el 45% de los pacientes tratados con pimecrolimus (en comparación con el 19% de los pacientes en el grupo control)21. El empleo de corticosteroides durante el período del estudio (24 semanas) fue, asimismo, significativamente inferior en el grupo de tratamiento con pimecrolimus (un promedio de 14% de los días del estudio frente a 37% en el grupo control); de hecho, el 49% de los pacientes tratados con pimecrolimus al 1% no necesitaron emplear corticoides en absoluto21.
Potencia. La potencia relativa de pimecrolimus 1% comparada con corticosteroides tópicos ha sido evaluada en 2 estudios. En el primero, un ensayo de fase 2 en 260 pacientes con dermatitis atópica moderada a severa, se demostró la superioridad de las diferentes concentraciones de pimecrolimus frente al vehículo, pero la formulación del 0,1% (la más potente) no fue tan eficaz como la crema de valerato de betametasona al 0,1% en el tratamiento de la dermatitis atópica extrafacial en el breve período de tiempo de tratamiento evaluado en este estudio (3 semanas)22. En otro estudio en el que se comparó pimecrolimus 1% con un tratamiento corticosteroide combinado (acetónido de triamcinolona al 0,1% para el tronco y las extremidades y acetato de hidrocortisona al 1% para la cara), el segundo fue más eficaz al cabo de 1 semana, 3 semanas y 6 meses, aunque no hubo diferencias significativas al final del período de estudio (12 meses)23.
Estudios comparativos
Se han efectuado diversos estudios comparativos de los dos inhibidores de la calcineurina tópicos. En un estudio aleatorizado de 6 semanas de duración efectuado en 141 niños con dermatitis atópica moderada, no se observaron diferencias al final del estudio en cuanto al porcentaje de pacientes blanqueados o prácticamente blanqueados entre el grupo tratado con pimecrolimus 1% y el grupo tratado con tacrolimus 0,03%24, siendo más frecuentes y prolongadas las reacciones de eritema/irritación después de la aplicación del fármaco en los pacientes tratados con tacrolimus25.
Recientemente se han publicado los resultados de 3 estudios multicéntricos de asignación aleatoria y 6 semanas de duración, efectuados en un total de 1.065 pacientes, incluyendo niños (tratados con tacrolimus al 0,03% frente a pimecrolimus 1%) y adultos (tratados con tacrolimus al 0,1% frente a tacrolimus al 1%), en los que se observó una mayor eficacia de tacrolimus tópico al final del estudio en los adultos, en los niños con enfermedad moderada/severa y al cabo de la primera semana de tratamiento, pero no más tarde, en niños con enfermedad leve26.
Mecanismo de acción
El mecanismo de acción de los inhibidores de la calcineurina consiste en la inhibición de la entrada en el núcleo del factor nuclear de las células T activadas, lo que inhibe la producción y liberación de citocinas proinflamatorias y la proliferación de los linfocitos T, lo que se ha confirmado en clonas aisladas a partir de la piel de pacientes con dermatitis atópica27.
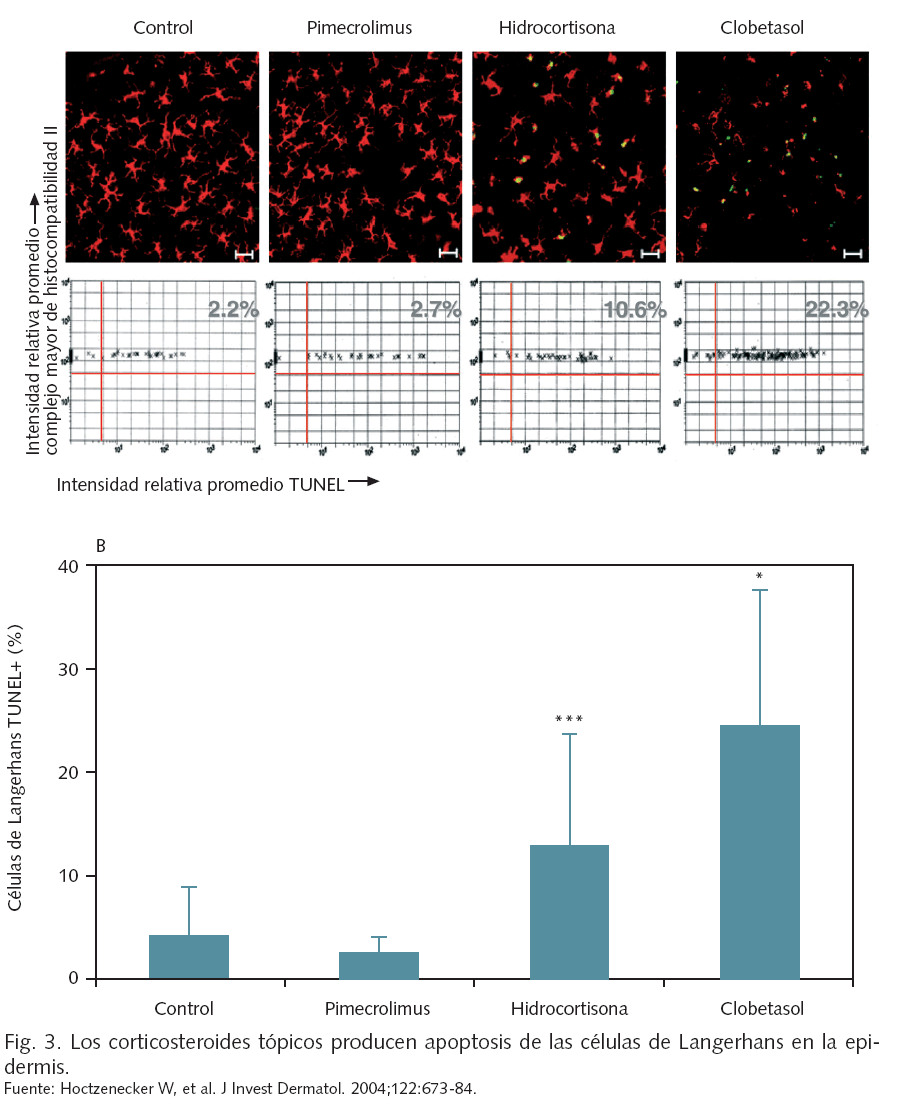
A nivel celular, si bien tanto pimecrolimus como los corticosteroides inhiben la activación de los linfocitos T, la acción de pimecrolimus es selectiva en cuanto a que no suprime la función o viabilidad de las células de Langerhans28 (fig. 3). Los corticosteroides tópicos tienen, asimismo, un efecto inhibitorio de la expresión de IL-12 (promotora de la expresión de citocinas Th1) por parte de las células de Langerhans y las células dendríticas, que podría retrasar la maduración del sistema inmune del recién nacido29. El efecto de los corticosteroides sobre las células dendríticas podría ser más intenso en los lactantes que en los adultos, como sugiere un estudio efectuado en células obtenidas de sangre de cordón30.
Seguridad de los inhibidores de la calcineurina tópicos
Pese a los extensos datos de seguridad que demuestran una exposición sistémica mínima y transitoria y una ausencia de inmunosupresión sistémica en pacientes tratados con ambos productos, existen datos clínicos (en pacientes sometidos a trasplante) en el caso de tacrolimus y basados en experimentación animal en ambos que indican que la exposición sistémica durante períodos prolongados es capaz de producir inmunosupresión y un aumento en el riesgo de cáncer. Este riesgo teórico ha dado lugar a la realización de estudios de farmacovigilancia poscomercialización basados en cohortes extensas de pacientes, que están actualmente en curso.
Trastornos linfoproliferativos. En el transcurso de los estudios toxicológicos efectuados para desarrollar la formulación oral de pimecrolimus para el tratamiento de la psoriasis, se administró por vía oral a monos Cynomolgus. A la dosis de 15 mg/kg/día, la exposición sistémica promedio de los animales fue de 1.200 ng×h/ml, y al cabo de 39 semanas 1 de los 8 monos desarrolló un proceso linfoproliferativo, lo que indica que esta dosis sería el umbral de inmunosupresión sistémica que permite el desarrollo de procesos linfoproliferativos32; en un estudio similar, la dosis correspondiente en el caso de tacrolimus sería 10 mg/kg/día a los 90 días33.
Con el fin de comparar los perfiles de toxicidad experimental de estos fármacos, se puede establecer como referencia la máxima dosis humana recomendada, calculada como promedio de las áreas bajo la curva AUC(0-24 h) que se han podido determinar en los estudios farmacocinéticos efectuados en el transcurso de ensayos clínicos (incluyendo lactantes de 3 meses con una afectación superior al 90% de la superficie corporal), aunque en la mayoría de los casos la exposición por vía transcutánea no dio lugar a niveles detectables en sangre32. Los valores correspondientes son 23 ng×h/ml en el caso de pimecrolimus y 20,4 ng×h/ml en el caso de tacrolimus (en adultos)32.
Los trastornos linfoproliferativos relacionados con la inmunosupresión que se pueden observar en pacientes tratados con inhibidores de la calcineurina por vía oral (no tópica) son un espectro de proliferaciones de linfocitos B, que abarcan desde hiperplasias policlonales hasta linfomas malignos, y que aparecen en pacientes sometidos a trasplante de órganos o médula ósea y sometidos a regímenes inmunosupresores intensivos, que incluyen dosis altas de ciclosporina o tacrolimus asociados a corticosteroides, azatioprina, anticuerpos antilinfocíticos y otros inmunosupresores durante períodos prolongados34. Los linfomas asociados a inmunosupresión generalmente son proliferaciones de linfocitos B transformados por el virus de Epstein-Barr, e involucionan cuando se reduce o suspende el tratamiento inmunosupresor, a diferencia de los que ocurren en pacientes no inmunosuprimidos34. Hasta la fecha no se ha descrito este tipo de linfomas en los estudios de seguimiento y comunicación espontánea de reacciones adversas en pacientes tratados con pimecrolimus o tacrolimus; la incidencia de los casos reportados es muy inferior a la esperable por la epidemiología, y la relación causal con el empleo de inhibidores de la calcineurina se considera altamente improbable sobre la base del tipo histológico y la intensidad, duración y relación temporal de la exposición a los mismos35.
Por otra parte, en el caso de los linfomas cutáneos de tipo T, las primeras manifestaciones clínicas pueden haber sido diagnosticadas erróneamente como eccema, justificando el tratamiento tópico con inhibidores de la calcineurina.
Ausencia de potencial inmunosupresor. Por otra parte, no existe ninguna evidencia basada en los extensos ensayos clínicos efectuados de que los inhibidores de la calcineurina tópicos interfieran en modo alguno con la función inmune cutánea o sistémica32,36-39, siendo destacable que en un estudio a largo plazo comparando pimecrolimus 1% con corticosteroides tópicos en adultos con dermatitis atópica moderada a severa, los pacientes tratados con corticosteroides presentaron una mayor incidencia de infecciones bacterianas, en especial foliculitis, y por virus del herpes simplex23.
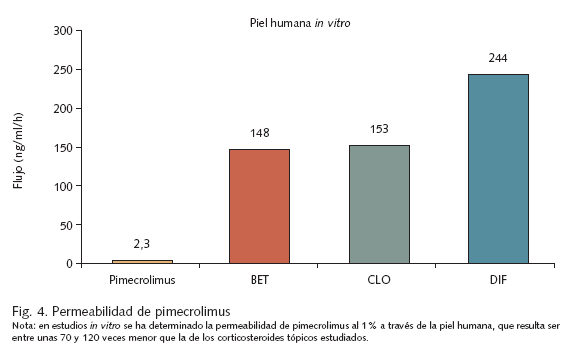
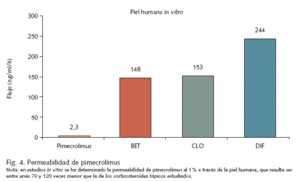
Esta ausencia de potencial inmunosupresor por parte de los inhibidores de la calcineurina no es sorprendente, pues debido a su elevado peso molecular tienen una mínima capacidad de penetración a través de la piel y absorción sistémica, a diferencia de los corticosteroides tópicos (fig. 4). Los estudios farmacocinéticos han demostrado que la absorción a través de la piel de tacrolimus 0,1% en adultos36 o pimecrolimus 1% en niños39 es despreciable, detectándose sólo puntualmente, en el caso de pimecrolimus, concentraciones superiores a 2 ng/ml en individuos aislados (posiblemente por contaminación del lugar de la punción venosa39), con independencia de la duración del tratamiento o la superficie afectada, y sin que se haya observado ningún tipo de efecto acumulativo.