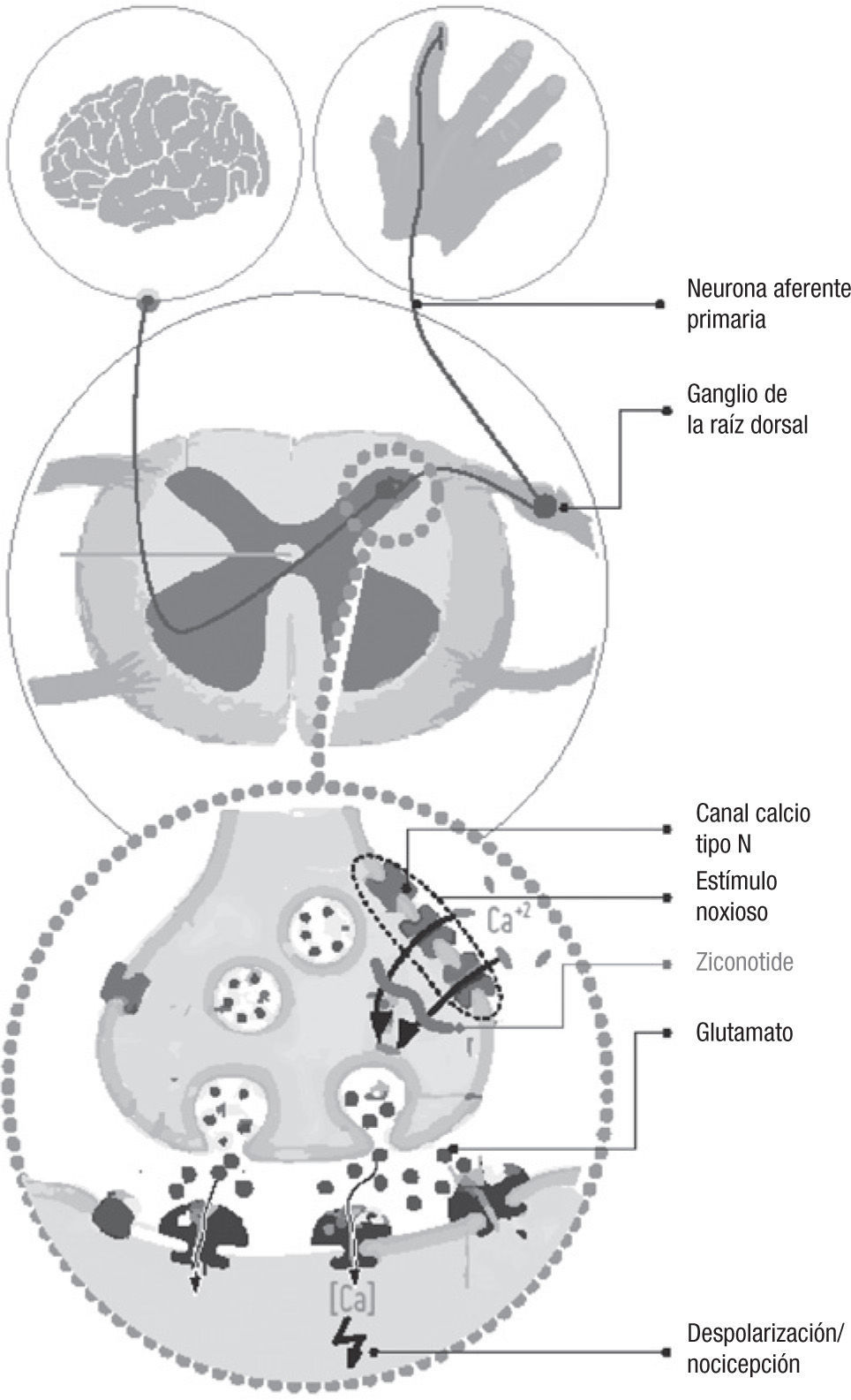
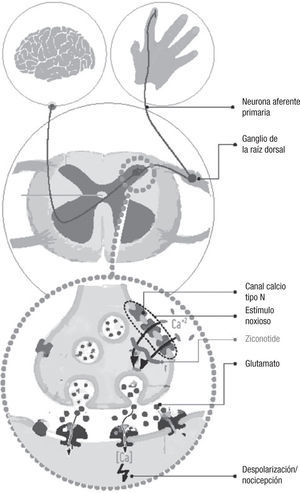
El ziconotide, péptido sintético análogo de la Ω-conotoxina de un caracol marino, ha sido introducido recientemente como un fármaco para el tratamiento del dolor rebelde a opioides. Consigue su efecto terapéutico a través de un bloqueo selectivo de los canales de calcio (Ca) tipo N dependientes de voltaje, por medio del cual reduce la liberación de neurotransmisores pronociceptivos en el asta posterior de la médula espinal, inhibiendo, de esta manera, la transmisión del impulso doloroso.
Una de sus ventajas es la de no provocar tolerancia, e incluso en caso necesario, podría ser administrado conjuntamente con morfina, potenciándose la acción de ambos fármacos.
The ziconotide is structurally the synthetic peptide analogue of the Ω-conotoxin Conus magus, a marine snail. It has recently been introduced as a drug for the treatment of pain unresponsive to opioids. Achieves its therapeutic effect via a potent selective blockade of voltage sensitive calcium channels, which in turn reduces the release of neurotransmitters pronociceptivos in the dorsal horn of the spinal cord by this action inhibits the transmission of painful stimulus.
Among its advantages is to not cause tolerance. In addition, if necessary, could be co-administered with morphine, producing a synergistic effect on its action on pain.
El dolor, uno de los principales motivos de consulta en atención primaria (AP), es un padecimiento universal, por lo que no resulta vano afirmar que uno de los deberes de los profesionales de este nivel (médicos, DUE, farmacéuticos) debe ser el adquirir una formación adecuada en su diagnóstico y tratamiento. Por fortuna, los profesionales de la sanidad son cada vez más conscientes de ello y en unas pocas décadas hemos asistido a un cambio en nuestro pensamiento: desde aceptar y resignarnos ante el dolor, a considerar que ninguna persona, dentro de nuestras capacidades, debería de padecer dolor, sobre todo actualmente que poseemos un arsenal terapéutico que podría impedir este sufrimiento.
Hoy en día existe un importante incremento de líneas de investigación sobre el dolor, tanto en fisiología como en farmacología. Respecto a este último campo, vemos cómo están apareciendo nuevos grupos de fármacos con mecanismos de acción hasta ahora no experimentados.
El presente artículo es una propuesta orientada a ampliar y poner al día nuestros conocimientos. Hablamos de un nuevo medicamento, el ziconotide, que es el primer bloqueador neural específico, abre nuevos caminos en el tratamiento del dolor cuando ya se agotaron otras alternativas; además está sirviendo como modelo para el desarrollo de drogas analgésicas innovadoras.
La vía intratecalAtendiendo a que la administración del ziconotide se realiza por vía intratecal (empleada por primera vez en el s. xix) sólo se utiliza cuando otras vías han fracasado o están contraindicadas.
Los medicamentos administrados por esta vía actúan gracias a que intervienen en la neuromodulación de la nocicepción aferente; cuentan con la ventaja de que al ser administrados en el sistema nervioso central, entran directamente en los receptores medulares, lo que permite con dosis muchísimo menores conseguir una analgesia más eficaz que la obtenida por otras vías1.
Las sustancias inyectadas en este espacio ejercen su acción sobre el tejido nervioso, médula y raíces nerviosas, dependiendo de la dosis, liposolubilidad, accesibilidad de la estructura nerviosa, de su contenido en lípidos y vascularización.
La bomba de infusión intratecal es un dispositivo seguro y eficaz, logrando un adecuado alivio en los pacientes con dolor crónico intratable, mejorando su funcionalidad y por tanto su calidad de vida2.
Los efectos adversos y posibles complicaciones de la perfusión intratecal son obstrucción, desconexión y migración del catéter, mal funcionamiento de la bomba, granuloma aséptico o masa inflamatoria en la punta del catéter y meningitis derivada de la contaminación inadvertida del sistema de infusión3.
ZiconotideEl ziconotide es el equivalente sintético del conopéptido hidrofílico Ω-MVIIA, uno de los péptidos venenosos que produce el Conus Magus, caracol marino que vive en el Pacífico y que consigue la paralización de sus víctimas al inyectarles el veneno a través de un conducto a modo de arpón.
Las características químicas del Ω-MVIIA lo dotan de una alta afinidad por los canales del calcio tipo N voltaje-específico, a los que se une de una forma reversible. Otros tipos de canales del Ca, como por ejemplo los L, sobre los que actúan verapamil, nifedipino, etc., no son afectados por las conotoxinas.
Los canales tipo N se localizan fundamentalmente en las terminales neuronales presinápticas4, donde desempeñan un papel decisivo en la liberación de neurotransmisores (fig. 1). La despolarización provocada por un potencial de acción hace que estos canales se abran y permitan la entrada de calcio a través de ellos, iniciando la fusión de vesículas y la liberación de los neurotransmisores almacenados, tales como el glutamato, a la hendidura sináptica, quienes son los encargados de transmitir el impulso nervioso a la neurona postsináptica.
Se ha observado que en las terminales presinápticas de las neuronas aferentes primarias que finalizan en el asta dorsal de la médula espinal existe una gran densidad de canales tipo N5. Al unirse a ellos el ziconotide, se bloquea el paso del calcio al interior de la terminal nerviosa; como consecuencia los neurotransmisores no son liberados desde la neurona a la hendidura sináptica, interrumpiendo la progresión del impulso nervioso en su camino hacia el cerebro6.
Aunque los canales de Ca tipo N pueden tener un papel importante en la transmisión del dolor agudo, la potencia y eficacia del ziconotide sugiere que éstos desempeñan un papel más significante en el desarrollo y mantenimiento de múltiples estados dolorosos por hipersensibilidad. La evidencia experimental sugiere que estos canales, expresados en los múltiples lugares a lo largo de las vías del dolor, son importantes en la transmisión de señales nerviosas. Uno de estos lugares sería la zona periférica del nervio lesionado, donde estarían involucrados en la generación de actividad neuronal espontánea persistente y secundaria al daño nervioso. Además los canales de Ca tipo N son importantes para la transmisión de las señales nociceptivas entrantes a las neuronas sensoriales secundarias de la médula espinal donde, en la zona rostral ventromedial de la médula, pueden estar involucradas en la activación del sistema facilitador descendente del dolor, el cual se ha demostrado que contribuye al mantenimiento de estados neuropáticos.
Aunque en la realidad se administran por vía intratecal diferentes medicamentos (baclofeno, clonidina), sólo están admitidos la morfina y el ziconotide como fármacos para ser utilizados por medio de esta vía.
La eficacia analgésica del ziconotide administrado por vía intratecal en animales es conocida desde la década de los 907. La ficha técnica del ziconotide (Prialt®) recoge como indicación de este medicamento el dolor grave crónico en adultos que necesitan la vía intratecal8. La dosis inicial recomendable es de 2,4μg/día y el ascenso no debe de ser superior a 1,2μg/día no más de una vez a la semana. La dosis máxima en Europa es de 21,6μg/día.
Para establecer la seguridad y eficacia analgésica de este medicamento en los humanos se llevaron a cabo entre los años 2004 y 2008 diferentes estudios randomizados, de tipo caso-control y doble ciego. Se incluyeron más de 1.200 pacientes que sufrían dolor crónico, oncológico o no, severo y resistente a los tratamientos convencionales, incluidos opioides9–14. En varios de ellos la titulación de la dosis se realizó de forma rápida y en otro estudio de forma lenta (la mayoría de los pacientes de este grupo padecían dolor neuropático). Los primeros obtuvieron como resultado un efecto analgésico mucho mayor que el logrado con la titulación lenta, pero a costa de provocar importantes efectos secundarios, lo que imposibilitaba su empleo.
Como consecuencia, las agencias para el medicamento americana y europea (FDA y EMEA respectivamente) aprobaron sólo para el tratamiento humano el ziconotide por vía intratecal en titulación lenta, donde los efectos secundarios eran moderados o leves.
Se comprobó, así mismo, que debido a sus características el paso del ziconotide desde el líquido cefalorraquídeo (LCR) hasta el asta dorsal de la médula era lento, por lo que existe un tiempo de retraso desde el momento en que es administrado y el inicio de su acción, ocurriendo lo mismo desde el instante en que se suspende su administración y deja de ejercer su efecto. La vida media en el LCR del ziconotide después de su administración intratecal se sitúa alrededor de 4,6h (rango: 2,9–6,5h); la tasa de aclaramiento en el LCR se acerca a la tasa de aclaramiento del LCR humano (0,3–0,4ml/minuto)15.
El ziconotide presenta una serie de ventajas frente a los opioides: no produce dependencia ni depresión respiratoria. Se ha demostrado que la infusión continua mantiene su eficacia analgésica durante meses sin que hayan producido secuelas y que se puede retirar bruscamente sin que aparezca un síndrome de deprivación. Además, no produce desarrollo de tolerancia, probablemente porque puentea los mecanismos secundarios G-proteina dependientes16. Puede reducir el dolor y mejorar la calidad de vida en los pacientes con dolor crónico severo. Aunque tiene mejor efecto terapéutico sobre el dolor neuropático, también actúa sobre el dolor de tipo mixto, e investigaciones recientes aportan evidencias de su efecto positivo en el síndrome de dolor regional complejo y sobre el dolor visceral intratable17,18. En otro estudio se refleja también que es efectivo en la prevención del dolor que surge tras intervenciones de cirugía mayor19.
Hay que recordar que al no ser un opioide puede ser usado en los pacientes que son o han sido drogadictos, en enfermos con síndrome de apnea obstructiva del sueño y en aquellos con enfermedades pulmonares severas18. Tampoco existe evidencia de supresión hormonal20.
Si fuera necesaria una analgesia aún mayor a la ofrecida por el ziconotide o por la morfina intratecal cuando se utilizan individualmente, ambos fármacos pueden ser administrados conjuntamente consiguiendo un efecto analgésico aditivo13,21.
Los efectos secundarios (con titulación lenta y a dosis bajas), se presentaron casi siempre después de varios días tras el inicio del tratamiento. Por orden de frecuencia fueron: mareos, náuseas, confusión, ataxia, vómitos, pérdida de memoria, aumento de CK-MM (creatinquinasa musculoesquelética), nistagmus, alucinaciones, vértigo; sólo en un pequeño porcentaje de pacientes (2%) se precisó la retirada del ziconotide. Para tratar los efectos secundarios ligeros es suficiente con reducir la dosis; en el caso de que fueran severos (psicosis manifiesta, intento de suicidio, sedación profunda,…) la medicación debería de ser suspendida inmediatamente. El tiempo de resolución de dichos efectos tras la retirada de la medicación, dada la lenta eliminación desde la médula, fue mayor, unas dos semanas.
Los efectos secundarios psiquiátricos pueden llegar a ser importantes22, y a pesar de que no ha sido aceptada una relación directa entre el ziconotide y el aumento de intento de suicidio, los pacientes deberían de ser controlados23, estando contraindicado en aquellos que tienen cuadros de depresión grave, psicosis, esquizofrenia y trastorno bipolar24.
Se aconseja la vigilancia de los niveles de creatina-kinasa, que pueden aumentar hasta 3 veces, incluso más, por encima de los valores normales y evitar el uso de fármacos que incrementan las concentraciones de ésta, como por ejemplo, las estatinas, a fin de evitar un mayor riesgo de aparición de miopatía y rabdomiolisis.
Si se administran diuréticos, el riesgo de aparición de efectos secundarios por ziconotide es mayor, porque provocan una disminución de su aclaramiento. Así mismo, aquellos medicamentos que afectan al movimiento transcelular del calcio o a los canales tipo N, son susceptibles de aumentar el riesgo de sufrir efectos adversos. Y, por el mismo motivo, medicamentos tales como antiepilépticos, sedantes y neurolépticos, son capaces de aumentar el riesgo de aparición de efectos adversos en el sistema nervioso central.
No existen todavía antagonistas para los efectos tóxicos15.
Como hemos dicho anteriormente, el ziconotide debe ser administrado por vía intratecal en perfusión continua por medio de una bomba; su distribución es exclusivamente por el LCR, donde no sufre transformaciones metabólicas, lo que supone que el 100% se encuentra disponible para realizar su acción. El principal mecanismo de aclaramiento es por transporte a la circulación sistémica, donde es degradado rápidamente por diversas enzimas.
En presencia de insuficiencia renal o hepática no es precisa la reducción de la dosis, except o que la insuficiencia provoque una disminución del aclaramiento del ziconotide del LCR.
En la actualidad se está trabajando en fármacos que puedan administrarse por vía oral, para ello se pretende que bloqueen a los canales de Ca tipo N a nivel de neuronas periféricas de forma selectiva. Con este objetivo se han abierto varias vías de investigación, una de ellas busca actuar sobre conexiones específicas localizadas en el ganglio de la raíz dorsal25 y otra intenta crear moléculas que se unan preferentemente a los estados activos o inactivos de los canales de Ca tipo N26, lo que sería de máxima importancia. La esperanza de encontrar moléculas que muestren un mecanismo de acción uso-dependiente consiste en que estos nuevos fármacos ofrecerían una más alta eficacia analgésica y un índice terapéutico mejorado respecto al ziconotide.
La facilidad de la administración de los medicamentos es una propiedad deseable para conseguir una buena cumplimentación terapéutica por parte de los pacientes, y la vía oral es la más aceptada. Los medicamentos que se están ensayando actualmente para ser administrados por esta vía han demostrado en las pruebas preclínicas con modelos animales de dolor neuropático e inflamatorio que poseen una alta eficacia analgésica y un buen perfil de seguridad27. Un beneficio adicional de la administración por vía oral sería el reducir el riesgo de infección y otras complicaciones que lleva asociado un dispositivo quirúrgicamente implantado.
ConclusionesEl ziconotide es el primer agente bloqueante selectivo de los canales del Ca tipo N testado en ensayos clínicos.
Es eficaz tanto en el tratamiento del dolor no oncológico como en el oncológico3.
Normalmente se emplea cuando han fracasado otros medicamentos frente al dolor, pero ya empieza a ser considerado como un medicamento de primera línea, al mismo nivel que la morfina24,[28–30].
Se trata de una sustancia extraída del Conus Magus que bloquea selectivamente los canales del Ca tipo N dependientes del voltaje en la médula. Es la forma sintética del omega-conopeptido. Su acción consiste en impedir la liberación de neurotransmisores, lo que produce una inhibición (modulación) de la transmisión del impulso nociceptivo en el asta posterior medular, lo que lo convierte en un potente y efectivo medicamento contra el dolor (mil veces más potente que la morfina); además posee la ventaja de que no provoca tolerancia ni conductas adictivas.
Se puede afirmar que el disponer de bloqueadores de los canales de Ca tipo N, que se puedan dispensar por vía oral, aún a pesar de que con toda probabilidad provocaría efectos secundarios similares al ziconotide intratecal, beneficiaría a un gran número de personas.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.