En artrosis, glucosamina y condroitín, solos o asociados, tienen el mismo efecto que placebo
Wandel S, Juni P, Tendal B, Nüesch E, Villiger PM, Welton NJ, et al. Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. BMJ. 2010;341:c4675.
Pregunta de investigación. En artrosis de rodilla o cadera, ¿qué efecto tienen glucosamina, condroitín o su asociación en el dolor articular y la progresión radiológica de la enfermedad?
Método
Diseño. Metaanálisis en red. Las comparaciones directas dentro de los ensayos se combinaron con una evidencia indirecta de otros ensayos, a partir de un modelo bayesiano que permite la síntesis de múltiples puntos temporales.
Fuente de datos. Bases de datos electrónicas y publicaciones de congresos hasta 2009, contacto con expertos y sitios web relevantes.
Selección y valoración de artículos. Ensayos clínicos aleatorizados (ECA) a gran escala con más de 200 pacientes con artrosis de rodilla o cadera que comparan glucosamina, condroitín o su combinación entre sí o con placebo.
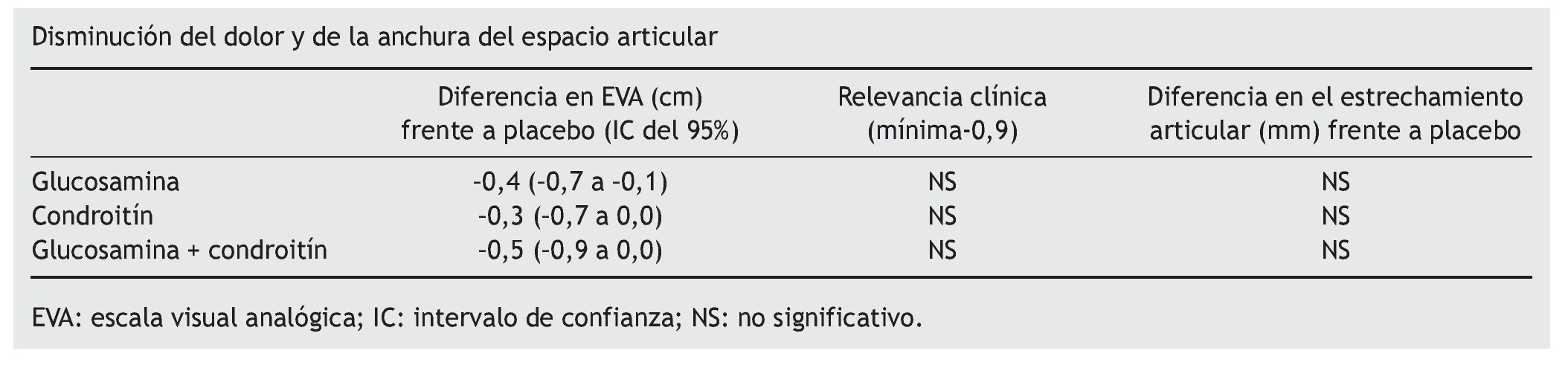
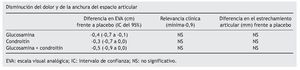
Variable resultado principal. Diferencia absoluta en intensidad del dolor, considerando clínicamente significativa una diferencia de -0,9 cm en una escala visual analógica (EVA) de 10 cm.
Variable secundaria. Modificación en la anchura mínima del espacio articular.
Resultados
Se incluyeron 10 ECA con un total de 3.803 pacientes. En los ECA independientes de la industria el efecto encontrado (intensidad del dolor) fue menor (p = 0,02). En la variable secundaria (cambios en el espacio articular) tampoco se encontraron diferencias.
Conclusión de los autores. Comparado con placebo, ni glucosamina, ni condroitín, ni su asociación reducen el dolor, ni tienen efecto en la reducción del espacio articular. Las autoridades sanitarias no deberían financiarlos, y los profesionales no deberían iniciar tratamientos con ellos.
Fuente de financiación.Swiss National Science Foundation.
Comentario
La eficacia de los fármacos sintomáticos de acción lenta para artrosis (SYSADOA, del inglés symptomatic slow-acting drugs for osteoarthritis) en artrosis es controvertida. Su eficacia sintomática se ha puesto en duda, por basarse en estudios con deficiencias metodológicas y haber sesgo de publicación1.
La evidencia es inconsistente, en algunos ensayos no se encuentra ningún beneficio y en otros la eficacia demostrada es sólo frente a placebo. En un metaanálisis de 2007 se encontró que los estudios con glucosamina patrocinados por la industria obtienen mejores resultados2.
En cuanto a su posible actividad condroprotectora, algunos estudios han mostrado la capacidad de glucosamina y condroitín de reducir el estrechamiento del espacio articular, aunque no está establecida la relación entre este parámetro radiológico y el dolor, la funcionalidad o la progresión de la enfermedad. Además, se discute la relevancia clínica de los resultados1. Por estos motivos, en las principales guías de práctica clínica no recomiendan el uso de estos me di camentos3,4, que en muchos países están considerados como suplementos dietéticos.
Este nuevo metaanálisis, independiente de la industria, no encontró ningún efecto de estos medicamentos ni en alivio de dolor, ni en estrechamiento del espacio articular. Se ha cuestionado la exclusión de pequeños estudios en el metaanálisis, aunque en un estudio metaepidemiológico5 para esta enfermedad, y valorándose también el dolor percibido, se observa que los estudios pequeños a menudo suelen estar distorsionados hacia resultados favorables que estudios mayores no consiguen corroborar.
En conclusión, estos fármacos no parecen aportar ninguna ventaja en eficacia, en comparación con el tratamiento actual de elección en artrosis (paracetamol y/o antiinflamatorios no esteroideos [AINE]). Además, son mucho más caros que las alternativas existentes. Asimismo, es importante fomentar las medidas higiénico-posturales, la pérdida de peso, una buena alimentación, así como ayudar a los pacientes a tratar el dolor cuando aparezca4.
Mensaje para la práctica clínica. El paracetamol sigue siendo el analgésico de elección en artrosis; si no es efectivo, puede valorarse el empleo de AINE, teniendo presentes los riesgos que puede ocasionar su empleo crónico.
Conflictos de intereses. Los autores declaran no tener ningún conflicto de intereses.
Cumple 23 de los 27 criterios PRISMA.
Términos Mesh:meta-analysis, osteoarthritis, glucosa-mine, chondroitin, pain.
Autores:
M.C. Vela Márquez, I. Ferrer López y J.C. Domínguez Camacho
Servicio Andaluz de Salud.
Bibliografía
1. ¿Existen realmente fármacos condroprotectores? INFAC. 2004; 12:1-4.
2. Vlad SC, LaValley MP, McAlindon TE, Felson DT. Glucosamine for pain in osteoarthritis: why do trial results differ? Arthritis Rheum. 2007;56:2267-77.
3. The care and management of osteoarthritis in adults. National Institute for Health and Clinical Excellence - Clinical Guidelines (UK), 2008.
4. Collaborating Centre for Chronic Conditions. Osteoarthritis: national clinical guideline for care and management in adults. London: Royal College of Physicians; 2008.
5. Nuesch E, Trelle S, Reichenbach S, Rutjes AW, Tschannen B, Altman DG, et al. Small study effects in meta-analyses of osteoarthritis trials: meta-epidemiological study. BMJ. 2010;341: c3515.
El tratamiento intensivo con estatinas no reduce significativamente los episodios vasculares mayores y aumenta la incidencia de miopatía
Grupo de investigación del estudio SEARCH. Intensive lowering of LDL cholesterol with 80 mg versus 20 mg sim vastatin daily in 12.064 survivors of myocardial infarction: a double-blind randomised trial. Lancet. 2010;376:1658-69.
Pregunta de investigación. El tratamiento intensivo con estatinas, ¿es más eficaz y seguro en la reducción de episodios cardiovasculares en pacientes con alto riesgo cardiovascular?
Método
Diseño. Ensayo clínico multicéntrico, doble ciego, aleatorizado y controlado.
Aleatorización. Entre septiembre de 1998 y octubre de 2001; centralizada utilizando un algoritmo de minimización 2 × 2; ratio 1:1.
Enmascaramiento. Doble ciego.
Seguimiento. A los 2, 4, 8 y 12 meses de la aleatorización y después cada 6 meses hasta fin de seguimiento (media de seguimiento de 6,7 años).
Ámbito. Ochenta y ocho hospitales del Reino Unido.
Pacientes. 12.064 varones y mujeres entre 18 y 80 años (media de 64,2 años) con historia de infarto de miocardio.
Criterios de inclusión. Pacientes en tratamiento con estatinas y colesterol total ≥ 3,5 mmol/l (135 mg/dl) o pacientes con clara indicación de tratamiento con estatinas y colesterol total ≥ 4,5 mmol/l (174 mg/dl).
Criterios de exclusión. Pacientes con otros problemas clínicos que pudieran impedir el seguimiento del tratamiento a largo plazo.
Intervención. Simvastatina 80 mg/día.
Control. Simvastatina 20 mg/día.
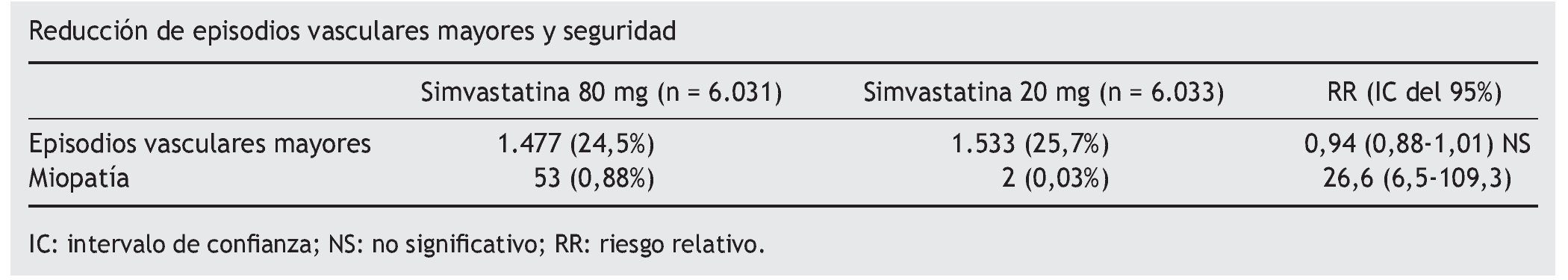
Variable resultado principal. Combinada de episodios vasculares mayores (muerte coronaria, infarto de miocardio, ictus o revascularización).
Diseño del análisis. Análisis por intención de tratar.
Resultados
La adherencia al tratamiento de estudio a los 84 meses de seguimiento fue del 77% en el grupo de simvastatina 80 y del 69% en el grupo de simvastatina 20. A los 84 meses, el colesterol unido a lipoproteínas de baja densidad (cLDL) fue reducido 0,35 mmol/l (14 mg/dl) más en el grupo de simvastatina 80. No hay diferencias significativas entre ambos grupos en el número de episodios coronarios, ictus, mortalidad de causa vascular o no vascular, ni incidencia de cáncer.
Conclusión de los autores. El 6% de reducción relativa del riesgo de episodios vasculares mayores con una reducción de cLDL de 0,35 mmol/l es consistente con los resultados de otros estudios. La miopatía se incrementa con simvastatina 80 mg, pero esta reducción intensiva de cLDL puede conseguirse con seguridad con otros regímenes.
Fuente de financiación. Merck, Consejo de Investigación Médica de Reino Unido y Fundación Británica del Corazón.
Comentario
Grandes ensayos con estatinas han mostrado que la reducción de cLDL reduce el riesgo de episodios cardiovasculares, relacionando la reducción de riesgo relativo con la magnitud de la reducción de cLDL1. Sin embargo, no está clara la posibilidad de ocasionar efectos adversos significativos, como miopatía, con un tratamiento intensivo.
Aunque sin significación estadística, en este ensayo se obtienen resultados de reducción del riesgo relativo de episodios del 6%, con una bajada media de cLDL de 0,35 mmol/l (14 mg/dl), lo cual es consistente con los datos de un meta-análisis reciente en el que se observó una reducción del riesgo relativo de episodios vasculares del 20% por cada 1 mmol/l (38 mg/dl) de cLDL reducido2.
En cuanto a la seguridad del tratamiento intensivo, la incidencia de miopatía se incrementa significativamente en el grupo de simvastatina 80 mg (4 casos por cada 1.000 pacientes durante el primer año de tratamiento, descendiendo después a 1 por 1.000) y aproximadamente un 20% desarrolla rabdomiólisis. Estos hallazgos indican que cuando se prescribe simvastatina 80 mg debe considerarse un seguimiento sistemático para detectar signos tempranos de miopatía.
Hay que tener en cuenta que desde el año 2008 hay evidencias que recomiendan el uso de tratamiento intensivo de reducción de cLDL en pacientes que han experimentado un síndrome coronario agudo3; como consecuencia, muchos pacientes del ensayo suspendieron su tratamiento con simvastatina para ser prescrita otra estatina por su propio médico (de ahí la baja adherencia al tratamiento en el grupo de sim vastatina 20 mg).
A la luz de este estudio, no debería indicarse tratamiento intensivo con simvastatina 80 mg en pacientes con historia de infarto, por presentar un equilibrio beneficio-riesgo desfavorable. Actualmente, no hay evidencia que sustente la indicación de los autores, que la adición de otro agente reductor de cLDL (como ezetimiba) a simvastatina 40 mg ofrezca mejor tolerabilidad que simvastatina 80 mg; la eficacia de ezetimiba está basada en variables subrogadas como la reducción de colesterol y no ha demostrado beneficios orientados al paciente.
Mensaje para la práctica clínica. En prevención secundaria de episodios cardiovasculares, no se recomienda tratamiento intensivo con simvastatina 80 mg/día.
Cumple 22 de los 25 criterios CONSORT 2010.
Términos Mesh:myocardial infarction, simvastatin, intensive cholesterol therapy.
Autores:
B. García Robredoa, V. Olmo Quintanab y E. Candela Marroquíncc
aServicio Andaluz de Salud. bServicio Canario de Salud. Servicio Extremeño de Saludc.
Bibliografía
1. Cholesterol Treatment Trialists' Collaboration. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90.056 participants in 14 randomised trials of statins. Lancet. 2005;366:1267-78.
2. Cholesterol Treatment Trialists' Collaboration. Efficacy and safety of intensive LDL-cholesterol-lowering therapy: a meta-analysis of individual data from 170.000 participants in 26 randomised trials. Lancet. 2010;376:1670-81.
3. Josan K, Majumdar SR, McAlister FA. The efficacy and safety of intensive statin therapy: a meta-analysis of randomized trials. CMAJ. 2008;178:576-84.
Tiotropio asociado a cortoicoides inhalados mejora la función pulmonar en asma sin aportar suficiente evidencia en variables clínicas
Peters SP, Kunselman SJ, Icitovic N, Moore WC, Pascual R, Ameredes BT, et al. Tiotropium bromide step-up therapy for adults with uncontrolled asthma. N Engl J Med. 2010;363:1715-26.
Pregunta de investigación. ¿Se produce una mejora mayor del flujo espiratorio máximo (PEF) por la mañana añadiendo tiotropio que duplicando la dosis de corticoides inhalados (CI) en pacientes con asma leve moderado no controlados con dosis bajas de CI?
Método
Diseño. Ensayo clínico aleatorizado de 3 brazos, controlado con placebo y cruzado.
Aleatorización. No se especifica.
Enmascaramiento. Triple ciego.
Seguimiento. Evaluación clínica de los resultados en las semanas 0, 4, 9 y 14. La duración total del estudio fue de 52 semanas.
Ámbito. No se especifica.
Pacientes. Doscientos diez varones y mujeres mayores de 18 años, volumen espiratorio forzado en el primer segundo (FEV1) > 40% del valor predicho, necesidad de tratamiento diario el año previo al estudio y síntomas > 2 veces/semana, no fumador (< 10 paquetes/año), adherencia mínima del 75%, sin exacerbaciones de asma durante el período de selección. Se excluyó comorbilidad respiratoria, disfunción de cuerdas vocales, historia de infección respiratoria o exacerbación asmática las 4 semanas previas al estudio, comorbilidad grave asociada, episodio de asma con intubación, embarazo, descoordinación en el manejo de los dispositivos.
Intervención. Diseño cruzado de 14 semanas cada rama de tratamiento. Se administró a cada paciente las tres pautas: beclometasona Qvar (80 μg/12 h) y tiotropio (18 μg/24 h); doble dosis de beclometasona Qvar (160 μg/12 h) y beclometasona Qvar (80 μg/12 h) más salmeterol (50 μg/12 h).
Control. Cada paciente fue comparado consigo mismo.
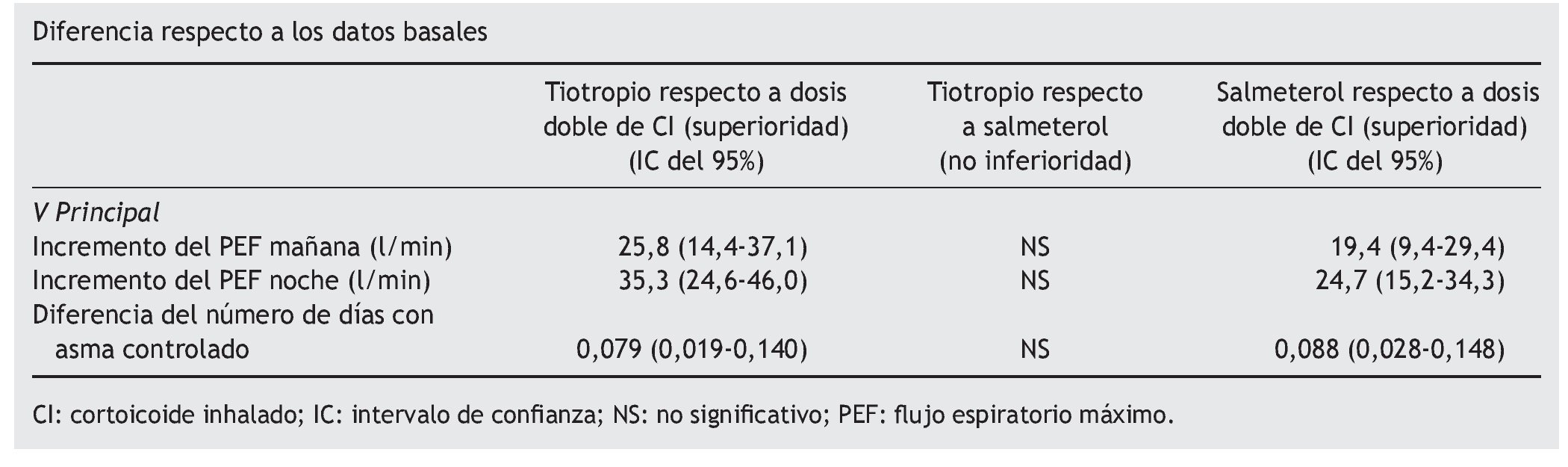
Variables resultado principal. Flujo espiratorio máximo (PEF) por la mañana con tiotropio respecto a la doble dosis de beclometasona.
Diseño del análisis. Análisis por intención de tratar, con un 17% de pérdidas.
Resultados
Conclusión de los autores. La utilización de tiotropio mejoró la función pulmonar y los síntomas del asma en pacientes asmáticos no controlados. Este efecto parece ser equivalente al salmeterol.
Fuente de financiación.National Heart, Lung and Blood Institute.
Comentario
Cuando el asma no se controla con un cortoicoide inhalado (CI) a dosis bajas, las principales guías, tras comprobar la adherencia y la correcta técnica inhalatoria, se inclinan por añadir a este tratamiento un beta-agonista de larga duración (BALD) y dejar como alternativa aumentar la dosis de CI en monoterapia1-3.
Por otra parte, la seguridad de los BALD ha sido un tema controvertido desde que se publicaron los resultados del estudio SMART, donde se observó un incremento en las muertes relacionadas con asma en pacientes tratados con salmeterol que no recibían CI4.
El bromuro de tiotropio es un fármaco que actualmente sólo tiene aprobada indicación para la enfermedad pulmonar obstructiva crónica, por lo que su utilización en asma no está avalada por la ficha técnica. Su seguridad también ha sido muy cuestionada, aunque un metaanálisis concluyó que no aumentaba de forma significativa el riesgo de episodios cardiovasculares adversos5.
En este ensayo clínico se observa la mejora en la función pulmonar (PEF) de la mañana del tiotropio respecto a la doble dosis de CI, y no ser inferior a salmeterol en la misma variable. El estudio tiene como limitación importante que no está diseñado para evidenciar mejoras en variables clínicas, como exacerbaciones, ingresos hospitalarios o mortalidad, el bajo número de participantes, y que en la rama de salmeterol no se presentan los datos de análisis por protocolo. Además, los ciclos de utilización del fármaco son de 16 semanas, por lo que no se permite conocer su perfil de seguridad a largo plazo. Finalmente, los criterios de inclusión y exclusión de los participantes en el estudio tan definidos impiden que las conclusiones sean fácilmente extrapolables a todos los pacientes asmáticos.
Mensaje para la práctica clínica. Cuando no se controla el asma con CI inhalados, se debe seguir el tratamiento escalonado añadiendo un BALD. El tratamiento con tiotropio se debería descartar a la espera de estudios con resultados clínicos y de información de seguridad a largo plazo en pacientes con asma.
Cumple 22 de los 25 criterios Consort.
Términos Mesh: asthma, inhaled anticolinergic, inhaled corticosteroid, long-acting β2-agonist.
Autores:
C. Barredaa, E.R. Alfarob y M.O. Caraballob
aServicio Madrileño de Salud. bServicio Andaluz de Salud.
Bibliografía
1. British Guideline on the Management of Asthma. A National Clinical Guideline. Revised edition June 2009. Edinburgh.
2. Global Initiative for Asthma. (GINA) Global Strategy for Asthma Management and Prevention 2009 (Update). Disponible en: http://www.ginasthma.org/
3. Grupo español para el Manejo del Asma. Gema 2009. Guía española para el manejo del asma. Madrid: Luzan 5; 2009.
4. Nelson HS, Weiss ST, Bleecker ER, Yancey SW, Dorinsky PM; SMART Study Group. The Salmeterol Multicenter Asthma Research Trial: a comparison of usual pharmacotherapy for asthma or usual pharmacotherapy plus salmeterol. Chest. 2006; 129:15-26.
5. Rodrigo GJ, Castro-Rodríguez JA, Nannini LJ, Plaza V, Schiavi EA. Tiotropium and risk for fatal and nonfatal cardiovascular events in patients with chronic obstructive pulmonary disease: Systematic review with meta-analysis. Respir Med. 2009;103: 1421-9.
Olmesartán no debe utilizarse para prevenir o retrasar la microalbuminuria: podría aumentar la mortalidad cardiovascular
Haller H, Ito S, Izzo JL, Januszewicz A, Katayama S, Menne J, et al. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes. N Engl J Med. 2011;364:907-17.
Pregunta de investigación. Un tratamiento con olmesartán, ¿previene/retrasa la microalbuminuria en pacientes con diabetes mellitus tipo 2 aún normoalbuminúricos?
Método
Diseño. Ensayo clínico aleatorizado y cruzado. Aleatorización. Listado generado por un programa que genera una secuencia aleatorizada de asignación 1:1.
Enmascaramiento. Doble ciego.
Seguimiento. Media de seguimiento de 3,2 años. Ámbito. Doscientos sesenta y dos centros de 19 países europeos.
Pacientes. Cuatro mil cuatrocientos cuarenta y nueve pacientes con diabetes mellitus tipo 2 sin microalbuminuria (18-75 años de edad). El 97,7% de los pacientes tiene al menos un factor de riesgo cardiovascular adicional a la diabetes mellitus.
La microalbuminuria se define como un ratio albúmina/ creatinina de más de 35 en mujeres o más de 25 en varones (midiendo la albúmina en mg y la creatinina en gramos).
Los pacientes sólo se incluyen si la hemoglobina glucosilada (HbA1C) ≥ 6,5%.
Se excluye a pacientes con enfermedad renal, ne frectomía, trasplante renal o diálisis. Otros criterios de exclusión fueron: infarto, ictus, accidente isquémico transitorio, revascularización o reperfusión miocárdica en los 6 meses anteriores al estudio; empleo de inhibidores de la enzima de conversión de la angiontensina (IECA) o antagonistas de los receptores de la angiotensina (ARA) II en los 6 meses previos al estudio, hipertensión arterial (HTA) si la presión arterial sistólica (PAS) > 200 mmHg y si la presión arterial diastólica (PAD) > 110 mmHg.
También se excluyó a los pacientes con insuficiencia cardíaca (NYHA III-IV), bradicardia (< 50 pulsaciones/minuto) o hiperlipidemia grave (> 400 mg/dl).
Intervenciones. Olmesartán 40 mg/día o placebo. Si la HTA supera 130/80 mmHg, se añaden antihipertensivos para su control (excluidos ARA-II o IECA).
Variables resultado principal. Tiempo hasta el comienzo de la microalbuminuria.
Variables secundarias. Episodios cardiovasculares y renales fatales o no fatales.
Sujetos analizados. Análisis por intención de tratar que incluye a 4.447 de los 4.449 a los que se aleatorizó.
Resultados
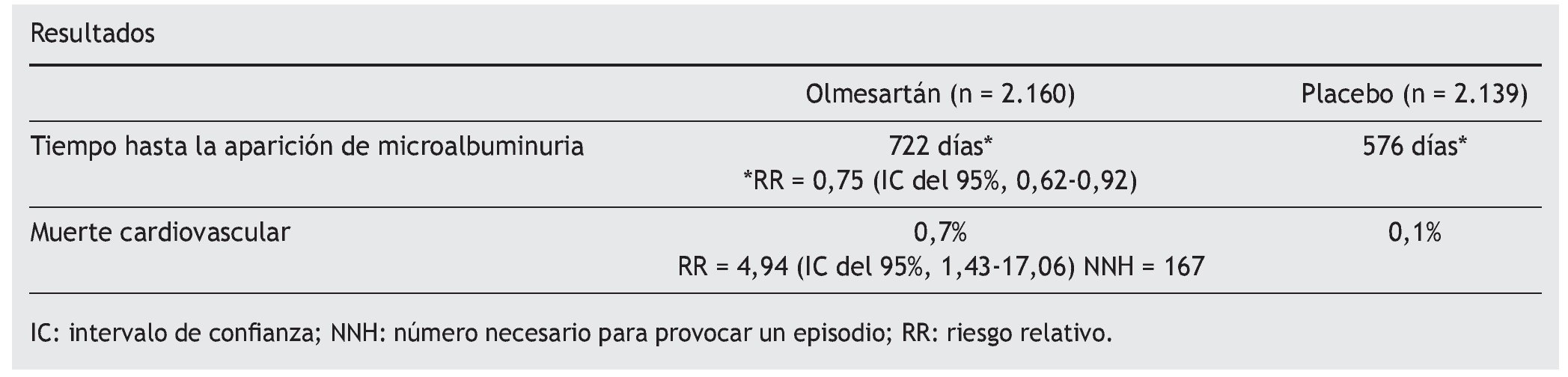
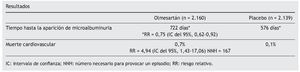
El estudio se finaliza a los 3,2 años, una vez alcanzado un preespecificado número de episodios de microalbuminuria (antes de los 5 años estimados para ello). La HTA durante el período de seguimiento fue de 125,7/74,3 mmHg en el grupo de olmesartán y de 128,7/76,2 mmHg en el grupo del placebo.
Aparecieron 178 (8,2%) casos de albuminuria con olmesartán y 210 (9,8%) con placebo (riesgo relativo = 0,77; intervalo de confianza del 95%, 0,63-0,94; número de pacientes necesario a tratar = 63).
El número de pacientes que duplicó las cifras de creatinina fue el mismo en cada grupo.
Efectos adversos. No hubo diferencias entre grupos.
Conclusión de los autores. Olmesartán retrasa la aparición de microalbuminuria en pacientes con diabetes mellitus tipo 2.
Fuente de financiación. Daiichi Sankyo Pharma.
Comentario
La nefropatía diabética es la causa más común de insuficiencia renal. El tratamiento antihipertensivo enlentece la progresión de la enfermedad. Los IECA y algunos ARA-II (losartán e irbesartán) han demostrado beneficios específicos en cuanto a protección renal en pacientes con diabetes mellitus (reducción de la microalbuminuria), independientemente de la reducción de las cifras de HTA1. En un metaanálisis se pone de manifiesto que, aparte de esto, los IECA reducen la mortalidad en los pacientes con nefropatía diabética, cosa que no hacen los ARA-II2.
El estudio que nos ocupa (ROADMAP) demuestra que olmesartán retrasa la aparición de microalbuminuria, pero no mejora la función renal: las cifras de creatinina se duplican tanto en el grupo de olmesartán como en el de placebo. También hay la limitación de que el grupo control sea placebo y que en él no se puedan utilizar los IECA para controlar la HTA.
En el estudio ROADMAP, olmesartán parece aumentar la mortalidad de origen cardiovascular. Aunque el estudio en sí no se diseñó para evaluar este fenómeno, conviene ser cautelosos. En otro estudio llevado a cabo en pacientes con nefropatía diabética (ORIENT)3, también se apuntaba hacia una mayor mortalidad de causa cardiovascular con olmesartán (10 frente a 3) (en este caso sin alcanzar significación estadística por el pequeño número de pacientes incluido). Estudios con otros ARA-II no se han asociado con este aumento de mortalidad.
A la luz de estos resultados, la Food and Drug Administration estadounidense ha emitido una alerta en la cual no recomienda olmesartán para el tratamiento o la prevención de microalbuminuria en pacientes con diabetes mellitus4, manteniendo un beneficio favorable para la HTA.
Mensaje para la práctica clínica. Olmesartán no debe emplearse para prevenir, retrasar o tratar la microalbuminuria en pacientes con diabetes mellitus. Los IECA continúan siendo el tratamiento de elección.
Cumple 20 de los 22 criterios CONSORT.
Términos Mesh:olmesartan, diabetic nephrophaty, microalbuminuria.
Autores:
J. Rodríguez Castillaa, C. Barreda Vázquezb y D. Palma Morgadoac
aServicio Andaluz de Salud. bServicio Madrileño de Salud.
Bibliografía
1. Chronic kidney disease: early identification and management in adults in primary and secondary care. NICE clinical guideline 73 (2008). Disponible en: www.nice.org.uk/CG073fullguideline
2. Strippoli GF, Craig M, Deeks JJ, Schena FP, Craig JC. Effects of angiotensin converting enzyme inhibitors and angiotensin II receptor antagonists on mortality and renal outcomes in diabetic nephropathy: systematic review. BMJ. 2004;329:828.
3. Imai E, Ito S, Handed M, Chan JC, Makino H. Olmesartan Reducing Incidence of Endstage Renal Disease in Diabetic Nephrophaty Trial (ORIENT). Hypertens Res. 2006;29:703-9.
4. Benicar (olmesartan): Ongoing Safety Review. FDA U.S. Disponible en: http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm215249.htm
Tratar intensivamente con estatinas en prevención secundaria tiene ventajas e inconvenientes
Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170.000 participants in 26 randomised trials. Cholesterol Treatment Trialist's Collaboration. Lancet. 2010;376:1670-81.
Pregunta de investigación. ¿Es seguro y eficaz el tratamiento intensivo con estatinas?
Método
Diseño. Metaanálisis de datos individuales de ensayos controlados y aleatorizados.
Fuentes de datos.Cholesterol Treatment Trialists' Collaboration.
Selección y valoración de artículos. Ensayos aleatorizados con al menos 1.000 participantes tratados al menos 2 años, que comparen tratamiento con estatinas a dosis estándares frente a placebo; y a dosis intensivas frente a estándares y que puedan aportar datos individuales, finalizados antes del 2009. No se valora la calidad de estos.
Variables resultado principales. Episodios vasculares mayores (EVM) (muerte coronaria, infarto de miocardio, revascularización coronaria e ictus isquémico). Nuevos casos de cáncer.
Resultados
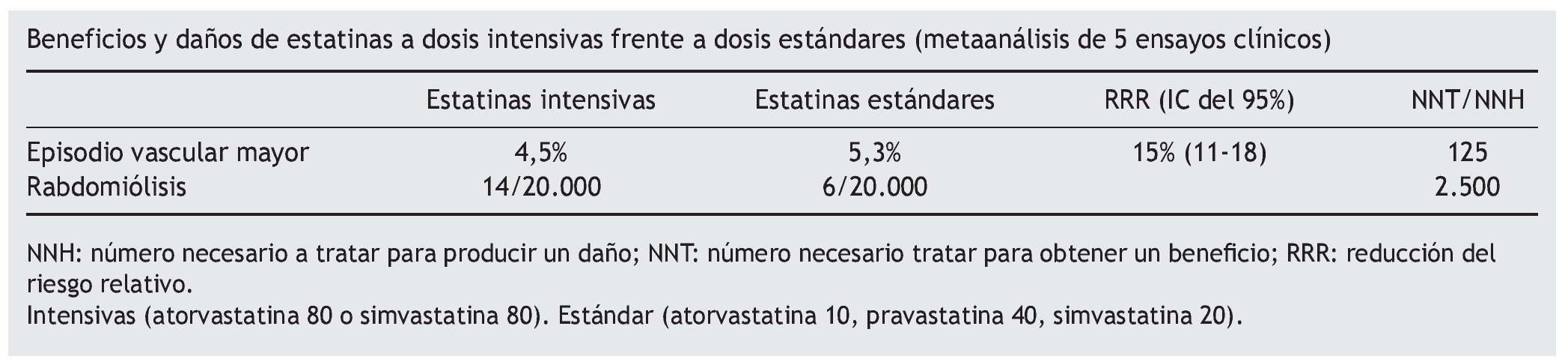
Se incluyeron 21 ensayos (n = 129.526, seguimiento medio 4,8 años) de dosis convencionales frente a placebo, y 5 ensayos (n = 39.612, seguimiento medio 5,1 años) de dosis intensivas frente a estándares.
El tratamiento a dosis estándar consigue una reducción media de EVM del 1,2%, con una reducción del colesterol unido a lipoproteínas de baja densidad (cLDL) en 1,07 mmol/l. Hay heterogeneidad entre estudios. El tratamiento con dosis intensivas frente a dosis estándar añade una reducción de EVM del 0,8% en la población ensayada (síndrome coronario agudo o enfermedad coronaria previa), con una reducción adicional en 0,51 mmol/l del cLDL. También hay heterogeneidad. Principalmente, se evitan procedimientos de revascularización (3,2% estándar y 2,6% intensiva, al año).
No se observa disminución significativa de la mortalidad por cualquier causa. Ni aumenta la incidencia de cáncer. El tratamiento intensivo frente a convencional se asocia a 4 casos adicionales de rabdomiólisis por 10.000.
Conclusión de los autores. Una reducción adicional de cLDL produce, de manera segura, una reducción adicional de la incidencia de ataques cardíacos, revascularizaciones e ictus isquémicos. Con cada mmol/l de reducción de cLDL se reduce la tasa anual de estos episodios en torno a un 20%. No se observa ningún límite dentro del rango estudiado de colesterol, lo que indica que reducciones de cLDL de 2-3 mmol/l reducirían el riesgo un 40-50%.
Fuente de financiación. UK Medical Research Council, British Heart Foundation, European Community Biomed Programme, Australian National Health and Medical Research Council, and National Heart Foundation.
Comentario
Las reducciones en cLDL parecen ser proporcionales a las reducciones relativas del riesgo de episodios vasculares, independientemente del valor de partida y sin que se observe un valor por debajo del cual mayores disminuciones fueran perjudiciales. La población estudiada con dosis intensivas es heterogénea (pacientes coronarios y/o con síndrome coronario agudo reciente), lo que supone una limitación del análisis. Además, las estatinas parecen ser eficaces sólo en el ámbito vascular, sin que haya resultados positivos (frente a placebo) en pacientes con insuficiencia cardíaca o renal1.
Esto implica que los beneficios sólo se manifiestan en pacientes de riesgo coronario basal muy alto.
Cuando se analizan independientemente las variables agregadas en EVM del metaanálisis de dosis intensivas frente a convencionales, se observa que la mayor parte de los beneficios son menos revascularizaciones (achacable a decisión médica en gran medida), pero no se observan ventajas claras en muerte coronaria, ni ictus hemorrágicos. Tampoco parece mejorar la mortalidad por cualquier causa.
Quizás la limitación más importante es no haber evaluado suficientemente los daños asociados al tratamiento, como la miopatía, la disfunción hepática o la incidencia de diabetes mellitus. Las tasas de abandono por mialgia se duplican con atorvastatina 80 frente a simvastatina 20 o 40 (el 2,2 frente al 1,1%), así como el global de abandonos por efectos adversos (el 9,6 frente al 4,2%)2.
Estas cifras hay que introducirlas en la ecuación riesgo/ beneficio, así como tener en cuenta la razón coste/beneficio. Dado que a día de hoy la diferencia de costes es alta y los beneficios en términos absolutos dependen del nivel de riesgo basal del paciente, parece razonable mantener las actuales recomendaciones sobre uso de estatinas a dosis intensivas, limitándolas a pacientes de riesgo muy alto en prevención secundaria3,4.
Mensaje para la práctica clínica. Pueden beneficiarse de estatinas a dosis intensivas los pacientes con síndrome coronario agudo reciente y pacientes coronarios de riesgo alto particular. Hay incertidumbre sobre algunos riesgos: diabetes mellitus, hemorragia cerebral, daño muscular y hepático.
Cumple 21 de los 27 criterios PRISMA.
Términos Mesh: vascular diseases, hydroxymethylglutaryl-CoA reductase inhibitors, secondary prevention.
Autores:
J.C. Domínguez Camachoa, O. Ortíz Rodríguezb y M.C. Montero Balosaac
aServicio Andaluz de Salud.
bServicio Extremeño de Salud.
Bibliografía
1. Cheung BM, lam KS. Is intensive LDL-cholesterol lowering beneficial and safe? Lancet. 2010;376:1622.
2. Pedersen TR, Faergeman O, Kastelein JJ, Olsson AG, Tikkanen MJ, Holme I, et al. High-dose atorvastatin vs usual-dose simvastatin for secundary prevention after miocardial infarction. JAMA. 2005;294:2437-45.
3. NICE. Lipid modification. Clinical Guideline 67. Marzo 2010.
4. Osakidetza. Guía de Práctica Clínica sobre el manejo de los lípidos como factor de riesgo vascular. 2008.
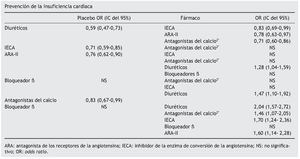
Los diuréticos son el tratamiento antihipertensivo más eficaz para la prevención de la insuficiencia cardíaca
Sciarretta S, Palano F, Tocci G, Baldini R, Volpe M. Antihypertensive treatment and development of heart failure in hypertension: a Bayesian network meta-analysis of studies in patients with hypertension and high cardiovascular risk. Arch Intern Med. 2011;171:384-94.
Pregunta de investigación. ¿En pacientes con hipertensión (HTA) o alto riesgo de riesgo cardiovascular (RCV) qué fármacos antihipertensivos son los más eficaces para prevenir la insuficiencia cardíaca (IC)?
Método
Diseño. Metaanálisis bayesiano de ensayos clínicos aleatorizados (ECA) y controlados.
Fuente de datos. PubMed y EMBASE.
Selección y valoración de artículos. ECA publicados entre 1997 y 2009 en revistas indexadas y revisadas por pares en bases de datos médicas, que incluyeran al menos 200 pacientes con HTA o RCV alto, y predominio de HTA (> 65%) e informaran de incidencia de IC y otros episodios cardiovasculares mayores. La búsqueda encontró 824 ECA pero sólo 26 ECA (233.313 pacientes) cumplieron criterios de inclusión.
Variable de resultado principal. Prevención de IC.
Resultados
Se realizaron dos análisis: a) uno comparando dos fármacos o un fármaco con placebo, y b) otro comparando todos los fármacos y placebo entre sí, mediante red bayesiana.
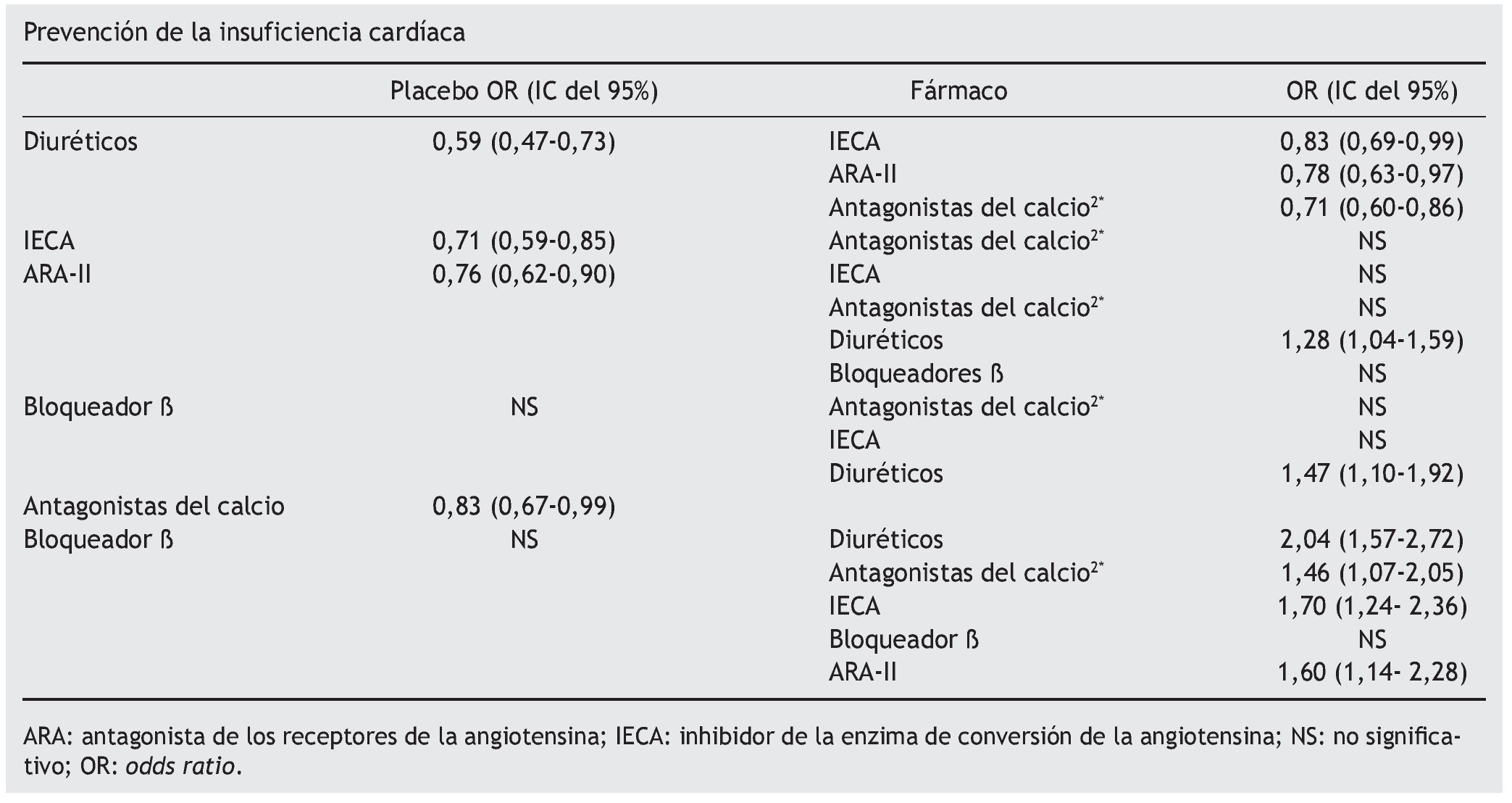
Al compararlos con placebo, todos los fármacos fueron más eficaces salvo los bloqueadores α. Los diuréticos se mostraron como la mejor opción terapéutica superior a IECA y ARA en prevención de IC, siendo estos tres grupos más eficaces que los antagonistas del calcio. Estos últimos, junto con los bloqueadores β y los bloqueadores α, fueron los fármacos con menor eficacia.
Se obtuvieron resultados similares en todos los análisis de subgrupos estratificados por sexo y edad.
Conclusión de los autores. Los diuréticos representan el tratamiento más eficaz para prevención de la IC, seguidos de los inhibidores del sistema renina-angiotensina. Los resultados apoyan su uso como tratamiento preventivo de primera línea en pacientes hipertensos con riesgo de desarrollar una IC. Antagonistas del calcio y bloqueadores β se han mostrado menos efectivos para la prevención de la IC.
Fuente de financiación. Ninguna publicada.
Comentario
El estudio PRICE muestra una prevalencia de IC del 6,8% en la población española de 45 o más años, que se eleva hasta el 16% cuando considera sólo a población mayor de 75 años1.
Estos resultados confirman el notable aumento de casos de IC en los últimos 20 años en países occidentales, que condiciona una necesidad cada vez mayor de atención sanitaria y elevado consumo de recursos.
Si bien los resultados de este metaanálisis son importantes, para su correcta interpretación debemos tener en cuenta que la prevención de la IC no es el único objetivo del tratamiento antihipertensivo y, por tanto, estos resultados no puede extrapolarse a otras variables cardiovasculares (mortalidad cardiovascular, infartos, ictus, etc.) que este metaanálisis no contempla. Así, por ejemplo, los antagonistas del calcio se han mostrado los más eficaces en la prevención de ictus y no en la prevención de la IC2.
Por otra parte, la elección del tratamiento antihipertensivo está condicionada por factores inherentes al paciente que este metaanálisis no diferencia. Así, no podemos extrapolar sus resultados a subgrupos de pacientes con diabetes mellitus, nefropatías, historia de infarto, etc. Los distintos grupos de pacientes condicionan la elección del tratamiento antihipertensivo, tal como recoge la recientemente publicada guía NICE de práctica clínica de hipertensión arterial3, que señala entre otros casos la utilidad de los bloqueadores β en pacientes con coronopatía.
Las limitaciones son propias del tipo de metaanálisis realizado como heterogenicidad de los ECA incluidos, diferentes dosis y diferentes tamaños muestrales de los tratamientos farmacológicos, así como la extrapolación de resultados desde evidencias indirectas.
Mensaje para la práctica clínica. La elección del tratamiento antihipertensivo más eficaz depende de múltiples factores, pero en pacientes hipertensos o con alto RCV y riesgo elevado de experimentar insuficiencia cardíaca, pueden considerarse como tratamiento preventivo de primera elección los diuréticos seguidos de IECA y ARA.
Cumple 25 de los 27 criterios PRISMA y 17 de los 18 criterios QUORUM.
Términos Mesh: antihypertensive, heart failure, meta-analysis.
Autores:
E. Candela Marroquína, A. Aránguez Ruiza y V. Olmo Quintanab
aServicio Extremeño de Salud.
bServicio Canario de Salud.
Bibliografía
1. Anguita Sánchez M, Crespo Leiro MG, De Teresa Galván E, Jiménez Navarro M, Alonso-Pulpón L, Muñiz García J; en representación de los investigadores del estudio PRICE. Prevalencia de la insuficiencia cardiaca en la población española mayor de 45 años. Estudio PRICE. Rev Esp Cardiol. 2008;61:1041-9.
2. Verdecchia P, Reboldi G, Angeli F, Gattobigio R, Bentivoglio M, Thijs L, et al. Angiotensinconverting enzyme inhibitors and calcium channel blockers for coronary heart disease and stroke prevention. Hypertension. 2005;46:386-92.
3. NICE. The clinical management of primary hipertensión in adults. Clinical Guideline. Methods, evidence and recomendations. February 2011. Disponible en: http://www.nice.org.uk/ nicemedia/live/12167/53228.pdf