Adaptar la ICU Mobility Scale (IMS) al ámbito de las unidades de cuidados intensivos (UCI) de España y evaluar las propiedades métricas de la IMS versión española (IMS-Es).
MétodoEstudio descriptivo de carácter métrico desarrollado en dos fases. Fase 1: adaptación al español de la IMS mediante equipo de enfermeras y fisioterapeutas (traducción, piloto, retrotraducción y acuerdo). Fase 2: análisis de propiedades métricas (validez convergente, divergente y predictiva, fiabilidad interobservador, sensibilidad y diferencia mínima importante) de la IMS-Es. Se registraron características de los pacientes (Barthel, Charlson, IMC, sexo), nivel de sedación/agitación (RASS), estancias en UCI y hospital, supervivencia, calidad de vida (SF-12), debilidad muscular (MRC-SS) y movilidad (IMS-Es) en los pacientes del estudio multicéntrico nacional MOviPre.
ResultadosTras obtener la IMS-Es, se implementó en 645 pacientes de 80UCI españolas entre abril y junio de 2017. Validez convergente: moderada correlación entre IMS-Es y MRC-SS (r=0,389; p<0,001) y comparación significativa entre grupos con y sin debilidad adquirida en la UCI (p<0,001). Validez divergente: no correlación entre IMS-Es e IMC (r [IC95%]: −0,112 [−0,232 a 0,011]), peso (r [IC95%]: −0,098 [−0,219 a 0,026]), Charlson (r [IC95%]: −0,122 [−0,242 a 0,001]) y Barthel (r [IC95%]: −0,037 [−0,160 a 0,087]) y sin diferencias entre sexos (p=0,587) ni categorías de IMC (p=0,412). Validez predictiva: moderadas y significativas correlaciones con estancia en hospital post-UCI (r [IC95%]: −0,442 [−0,502 a −0,377]) y componente físico del SF-12 (PCS) (r [IC95%]: 0,318 [0,063 a 0,534]); pacientes sin movilización activa en UCI mayor riesgo de mortalidad hospitalaria (OR [IC95%]: 3,769 [1,428 a 9,947]). Fiabilidad interobservador: muy buena concordancia entre enfermeras (CCI [IC95%]: 0,987 [0,983 a 0,990]) y entre enfermera-fisioterapeuta (CCI [IC95%]: 0,963 [0,948 a 0,974]). Sensibilidad al cambio: efecto pequeño al alta de UCI (d=0,273) y moderado a los 3meses del alta hospitalaria (d=0,709). Diferencia mínima importante: punto de corte de la diferencia de 2puntos, sensibilidad del 91,1% y especificidad del 100,0%.
ConclusionesLa IMS-Es es útil, válida y fiable para ser implementada por enfermeras de UCI y por fisioterapeutas al valorar la movilidad de los pacientes críticos.
To adapt the ICU Mobility Scale (IMS) to the area of intensive care units (ICU) in Spain and to evaluate the metric properties of the Spanish version of the IMS (IMS-Es).
MethodDescriptive metric study developed in two phases. Phase 1, adaptation to Spanish of the IMS by a team of nurses and physiotherapists (translation, pilot, backtranslation and agreement). Phase 2, analysis of metric properties (convergent, divergent and predictive validity, interobserver reliability, sensitivity and minimum important difference) of the IMS-Es. Patient characteristics (Barthel, Charlson, BMI, sex), sedation/agitation level (RASS), ICU and hospital stays, survival, quality of life (SF-12), muscle weakness (MRC-SS) and mobility (IMS-Es) were recorded in the patients of the MOviPre national multicentre study.
ResultsAfter obtaining the IMS-Es, it was implemented in 645 patients from 80 Spanish ICUs between April and June 2017. Convergent validity: moderate correlation between IMS-Es and MRC-SS (r=.389; P<.001) and significant comparison between groups with and without ICU-acquired weakness (P<.001). Divergent validity: no correlation between IMS-Es and BMI [r (95%CI): −.112 (−.232 to .011)], weight [r (95%CI): −.098 (−.219 to .026)], Charlson [r (95%CI): −.122 (−.242 to .001)] and Barthel [r(95%CI): −.037 (−.160 to .087)] and no differences between sexes (P=.587) or BMI categories (P=.412). Predictive validity: moderate and significant correlations with post-ICU hospital stay [r (95%CI): −.442 (−.502 to −.377)] and physical component of SF-12 (PCS) [r (95%CI): .318 (.063 to .534)]; patients without active mobilisation in ICU increased risk of hospital mortality [OR (95%CI): 3.769 (1.428 to 9.947)]. Interobserver reliability: very good concordance between nurses [CCI (95%CI): .987 (.983 to .990)] and nurse-physiotherapist [CCI (95%CI): .963 (.948 to .974)]. Sensitivity to change: small effect on discharge from ICU (d=.273) and moderate effect at 3months after hospital discharge (d=.709). Minimal important difference: 2-point difference cut-off point, 91.1% sensitivity and 100.0% specificity.
ConclusionsThe IMS-Es is useful, valid and reliable for implementation by ICU nurses and physiotherapists in assessing the mobility of critical patients.
Los avances en las intervenciones al paciente crítico en los últimos 20años han hecho posible el aumento de la supervivencia después del alta de la unidad de cuidados intensivos (UCI)1, por lo que en la actualidad el objetivo de los cuidados se centra en mejorar la calidad de vida de los pacientes después del ingreso en la UCI y el hospital2.
Sin embargo, el síndrome post-UCI es una secuela relativamente frecuente entre los pacientes que sobreviven a la UCI. Se define como la pérdida física, funcional y cognitiva de los pacientes que sobreviven a la UCI, siendo causa del 47% de los reingresos o fallecimientos al año después del alta o que, incluso en el mejor de los casos, afecte a las capacidades y habilidades de los pacientes para su reincorporación al trabajo3,4.
Uno de los aspectos más estudiados recientemente del síndrome post-UCI es la debilidad muscular adquirida en la UCI (DMA-UCI), conocida en la literatura como ICU-acquired muscle weakness (ICUAW), que puede diagnosticarse entre el 26 y el 65% de los pacientes tratados con ventilación mecánica (VM) entre 5 y 7días, respectivamente5,6. La DMA-UCI incluye manifestaciones clínicas de miopatía, polineuropatía y neuromiopatía, así como debilidad y pérdida de masa muscular relacionada con la patología crítica sin otra etiología explicativa.
En consecuencia, para evaluar la capacidad física y funcional del paciente crítico ingresado en la UCI y realizar un seguimiento de su evolución durante el ingreso y cuando retorna a la comunidad deben usarse instrumentos de medida validados en nuestro contexto cultural, con adecuadas propiedades psicométricas para la población de pacientes críticos7-9.
Dichos instrumentos se clasifican en los que miden la masa muscular (antropometría, bioimpedancia, ultrasonografía), la debilidad muscular (testado manual del músculo, con Medical Research Council [MRC-SS] o dinamómetro) y la función física, siendo esta dimensión la que tiene más instrumentos desarrollados pero pocos adecuadamente validados. Destacan como mejores por sus cualidades psicométricas la Chelsea critical care physiotherapy (CPAx), la Physical function in intensive care test (PFIT) y la ICU Mobility Scale (IMS)10.
Precisamente esta última, la IMS11,12, fue creada para sustituir el test de marcha a los 6minutos, no aplicable en el paciente crítico8,9 y la única con la finalidad de estandarizar el lenguaje de enfermeras y fisioterapeutas cuando describían la movilización del paciente durante la estancia en la UCI. Es una limitación de muchos estudios que han evaluado la efectividad de la movilización precoz en la UCI, no haber usado usado una escala de movilidad validada para definir los distintos grados de actividad que conseguían los pacientes13-16, dificultando este hecho la comparación entre los diferentes estudios que evalúan la eficacia de la movilidad para prevenir DMA-UCI, disminuir la estancia en la UCI y en el hospital o la mortalidad.
Dado que la IMS ha sido validada en el paciente crítico pero en la cultura anglosajona, el objetivo del presente estudio es realizar la adaptación transcultural de la escala ICU Mobility Scale al ámbito de los cuidados intensivos de España y evaluar las propiedades métricas de esta versión española.
MétodoEstudio descriptivo de carácter métrico que se desarrolla en dos fases: fase 1, adaptación al español de la ICU Mobility Scale; fase 2, análisis de las propiedades métricas de la escala versión española.
Fase 1. Adaptación transculturalEl objetivo de la adaptación al español es conseguir que el instrumento sea equivalente a nivel semántico, conceptual, de contenido técnico y de criterio en un idioma distinto al de la escala original17.
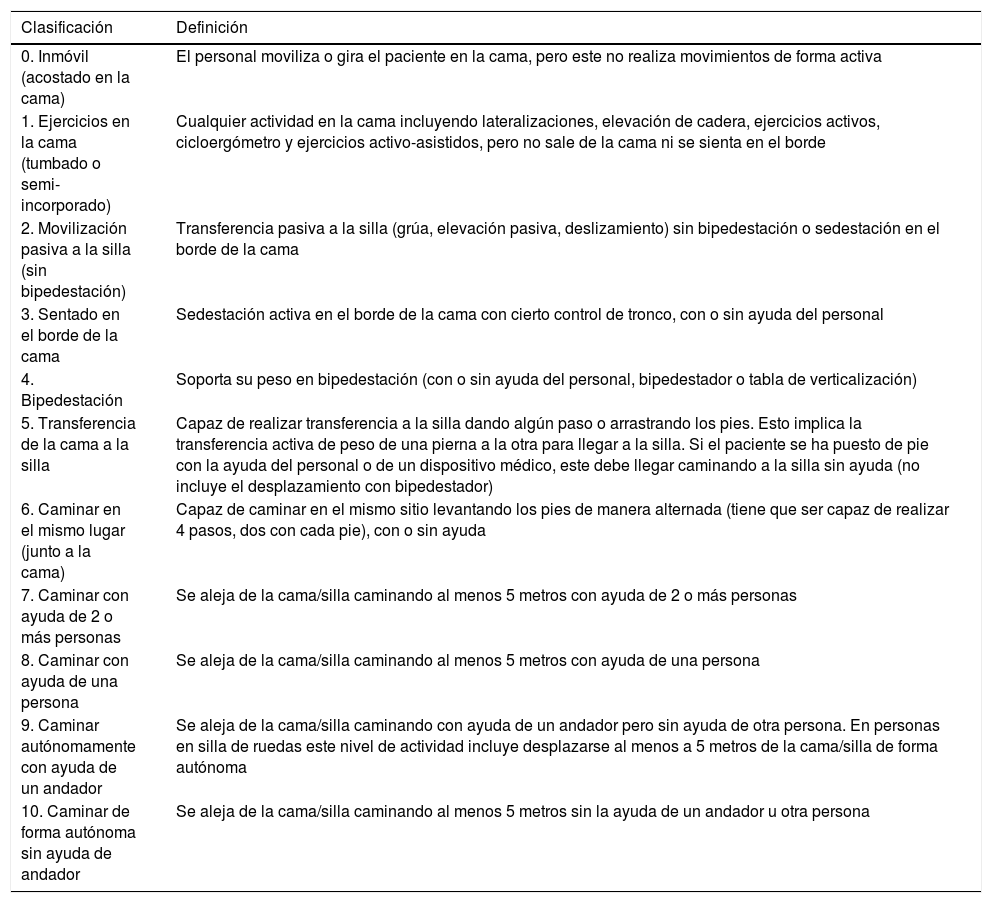
La ICU Mobility Scale (IMS) [Material suplementario] es una escala que contiene 10ítems que van del 0 (nada de movilidad) al 10 (camina sin ayuda), y que algunos autores18 la han categorizado de forma binaria (<4 movilización pasiva/activa en cama y ≥4 movilización activa fuera de la cama).
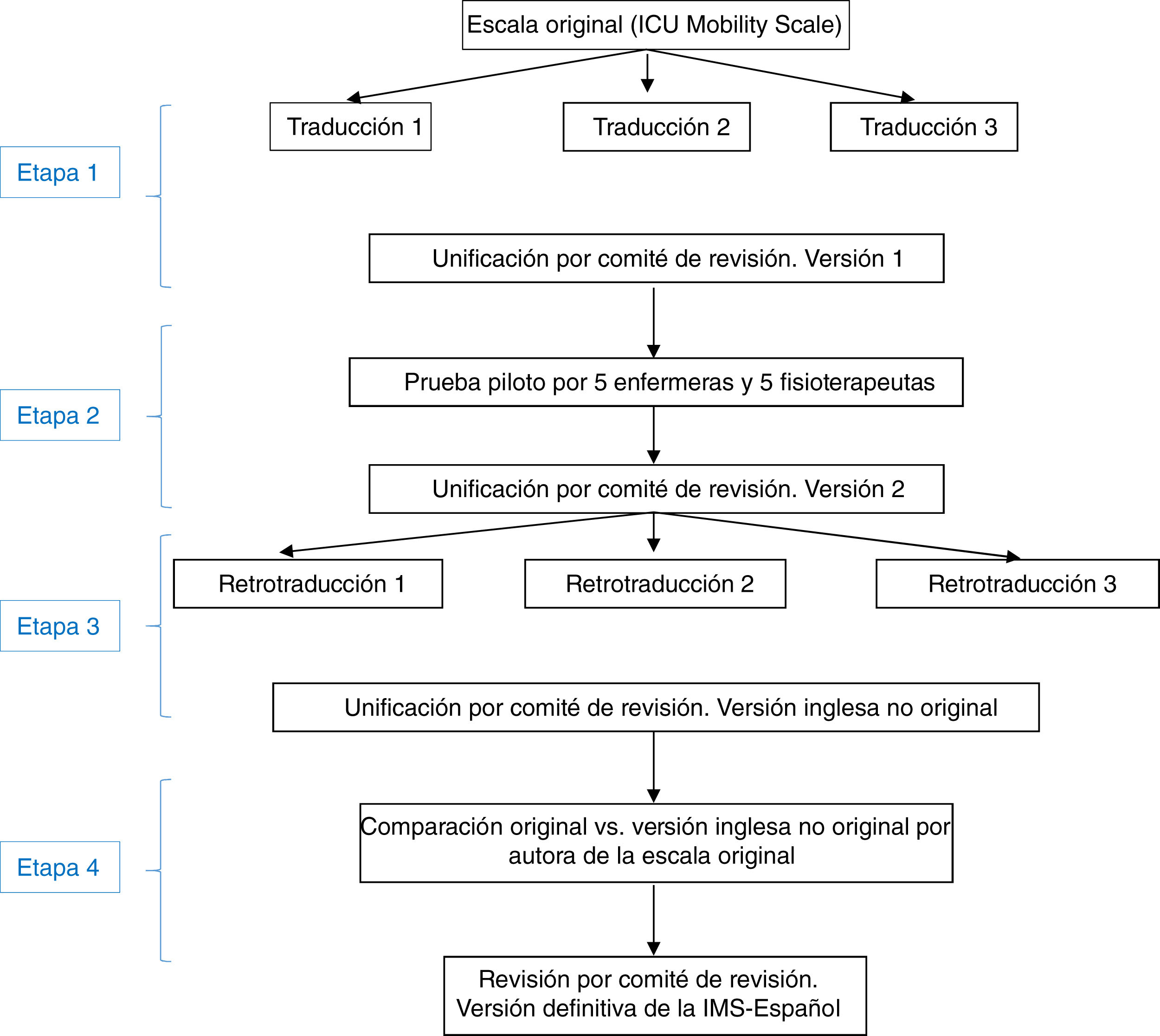
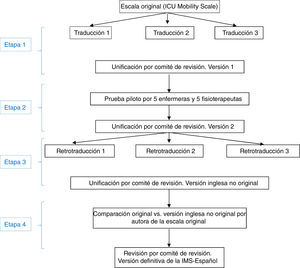
La adaptación al español de la IMS se realizó en cuatro etapas, siguiendo técnicas distintas en cada una de ellas (fig. 1):
Primera etapa: traducción de la IMS y unificación para obtener la primera versión de la escala en españolSe efectuó la traducción del inglés al español por tres traductores bilingües, del ámbito de la sanidad y que trabajaron de forma independiente, cuya lengua materna era el español. Se les entregó la versión original del instrumento, junto con una breve explicación de sus características y utilidades. Se obtuvieron tres traducciones al español del instrumento. Posteriormente se creó un comité de revisión, formado por dos enfermeras y un fisioterapeuta expertos en UCI (miembros del equipo investigador del estudio, con elevado nivel de inglés), para medir la equivalencia semántica de estas tres versiones de la escala traducida al español. En el comité de revisión se unificaron las traducciones y se creó una primera versión de la IMS-Española (IMS-Es-v1).
Segunda etapa: prueba pilotoLa pertinencia y la comprensibilidad de cada uno de los ítems de esta primera versión de la IMS-Es fueron evaluadas por 5 enfermeras y 5 fisioterapeutas con más de 5años de experiencia en cuidados intensivos. La pertinencia se determinó con una escala Likert en la que cada ítem fue puntuado entre 1 (nada relevante) y 4 (alta relevancia). Se recogieron también las valoraciones cualitativas de las enfermeras y fisioterapeutas sobre cada uno de los ítems. La comprensibilidad del texto se evaluó como mala, aceptable o buena.
Con esta prueba piloto también se estimó el tiempo de realización de la evaluación. Cada profesional midió el tiempo empleado en la aplicación de la escala.
Teniendo en cuenta todas las aportaciones, el comité de revisión elaboró la segunda versión de la IMS-Es (IMS-Es-v2).
Tercera etapa: retrotraducción de la IMS-EsSe realizó la retrotraducción o traducción inversa del español al inglés por tres traductores bilingües, independientes y del ámbito de la sanidad, cuya lengua materna era el inglés, conocedores del propósito de la escala IMS pero no de la versión original. La justificación de ocultar la versión original es asegurar una traducción no contaminada por lecturas previas de los ítems. Cada uno de ellos realizó una traducción independiente a partir de la segunda versión del IMS-Es. Posteriormente el comité de revisión, siguiendo el mismo procedimiento anterior, unificó las tres traducciones inversas, creando una nueva versión de la IMS en inglés.
Cuarta etapa: correlación de las escalas en inglésLa autora de la escala original evaluó la correspondencia ítem a ítem entre la versión original y la obtenida de las traducciones inversas. Valoró la equivalencia de contenido, sintáctica, técnica, de criterio y conceptual de los ítems como buena, apropiada o mala. Tras esta etapa se obtuvo la versión definitiva de la Escala de Movilidad de UCI en español (IMS-Es) (tabla 1).
ICU Mobility Scale versión española (IMS-Es)
| Clasificación | Definición |
|---|---|
| 0. Inmóvil (acostado en la cama) | El personal moviliza o gira el paciente en la cama, pero este no realiza movimientos de forma activa |
| 1. Ejercicios en la cama (tumbado o semi-incorporado) | Cualquier actividad en la cama incluyendo lateralizaciones, elevación de cadera, ejercicios activos, cicloergómetro y ejercicios activo-asistidos, pero no sale de la cama ni se sienta en el borde |
| 2. Movilización pasiva a la silla (sin bipedestación) | Transferencia pasiva a la silla (grúa, elevación pasiva, deslizamiento) sin bipedestación o sedestación en el borde de la cama |
| 3. Sentado en el borde de la cama | Sedestación activa en el borde de la cama con cierto control de tronco, con o sin ayuda del personal |
| 4. Bipedestación | Soporta su peso en bipedestación (con o sin ayuda del personal, bipedestador o tabla de verticalización) |
| 5. Transferencia de la cama a la silla | Capaz de realizar transferencia a la silla dando algún paso o arrastrando los pies. Esto implica la transferencia activa de peso de una pierna a la otra para llegar a la silla. Si el paciente se ha puesto de pie con la ayuda del personal o de un dispositivo médico, este debe llegar caminando a la silla sin ayuda (no incluye el desplazamiento con bipedestador) |
| 6. Caminar en el mismo lugar (junto a la cama) | Capaz de caminar en el mismo sitio levantando los pies de manera alternada (tiene que ser capaz de realizar 4 pasos, dos con cada pie), con o sin ayuda |
| 7. Caminar con ayuda de 2 o más personas | Se aleja de la cama/silla caminando al menos 5 metros con ayuda de 2 o más personas |
| 8. Caminar con ayuda de una persona | Se aleja de la cama/silla caminando al menos 5 metros con ayuda de una persona |
| 9. Caminar autónomamente con ayuda de un andador | Se aleja de la cama/silla caminando con ayuda de un andador pero sin ayuda de otra persona. En personas en silla de ruedas este nivel de actividad incluye desplazarse al menos a 5 metros de la cama/silla de forma autónoma |
| 10. Caminar de forma autónoma sin ayuda de andador | Se aleja de la cama/silla caminando al menos 5 metros sin la ayuda de un andador u otra persona |
Esta fase se desarrolló durante los meses de abril a junio de 2017 en las unidades participantes en el estudio multicéntrico nacional español de Movilización precoz (MOviPre)19.
Población de estudioSe incluyeron pacientes ingresados en las UCI a las 48h del inicio de la ventilación mecánica invasiva (VMI).
No se incluyeron pacientes con diagnóstico de ingreso principal o secundarios de patología neuromuscular (miastenia gravis, síndrome de Guillain-Barré, sarcopenia), incapacidad para andar antes del ingreso (si lo hacía con andador o bastón se incluyeron), ingreso por ictus o accidente vascular cerebral, mujeres embarazadas, grandes quemados, menores de edad, reingresos en UCI o traslados a UCI provenientes de otros hospitales. Tampoco se incluyeron pacientes a los que se preveía dificultad especial para la movilización (ausencia de extremidades de novo, portador de aparato de ortopedia) y aquellos con índice de masa corporal (IMC) superior a 35.
Fueron criterios de exclusión del estudio que constara en la historia clínica limitación terapéutica del soporte vital (LTSV) y los pacientes conscientes pero con incapacidad para seguir órdenes verbales simples. Se contemplaron como pérdidas los pacientes que no dieron el consentimiento o los que retiraron dicho consentimiento durante el período de estudio y los que fueron trasladados a otro centro intubados, por no poder continuar con su seguimiento. Se obtuvo la aprobación por parte de todos los Comités de Ética e Investigación Clínica de los centros participantes. Los datos recogidos por el investigador del centro fueron tramitados a través de una base de datos protegida con usuario y contraseña, codificando hospital y paciente, asegurándose así la confidencialidad de los pacientes incluidos en el estudio.
Tipo de muestreoMuestra de conveniencia durante la fase de reclutamiento del estudio MOvipre19 para incluir un mínimo de 192 pacientes, según validación original de la escala IMS11. El cálculo de la muestra (760pacientes) se basó en la incidencia de DMA-UCI, del 46% según la revisión sistemática de Stevens et al.20, con un error estándar estimado de 3 y pérdidas previstas del 10%.
Variables de estudioCaracterísticas de los pacientes: índice de Barthel previo al ingreso, índice de comorbilidad de Charlson, peso e índice de masa corporal, sexo. Nivel de agitación-sedación medido con Richmond Agitation Sedation Scale diariamente. Estancia en el hospital tras el alta de la UCI y supervivencia al alta del hospital. Puntuación de ICU Mobility Scale (IMS-Es) medida por turno de enfermería durante toda la estancia en la UCI y Medical Research Council Scalesum score (MRC-SS) medida cuando el paciente despierta por primera vez durante su estancia en la UCI y después consecutivamente cada 7días hasta el alta de la UCI y puntuación en la escala de calidad de vida (SF-12) de los componentes físico (PCS) y mental (MCS), previa al ingreso en la unidad (entrevista directa con el paciente) y a los a los 90días del alta hospitalaria (vía telefónica).
Instrumentos de medida- •
Índice de Barthel21. Instrumento de valoración de la función física. La puntuación máxima es de 100 puntos y se considera paciente dependiente (con diferentes grados de dependencia) si se obtienen puntuaciones iguales o inferiores a 60.
- •
Índice de comorbilidad de Charlson22. Sistema de evaluación de la esperanza de vida a los 10años, según las comorbilidades del paciente al ingreso y ajustado por la edad. La puntuación oscila entre 0 y 33, indicando las puntuaciones más elevadas más severidad en la enfermedad crónica.
- •
Índice de masa corporal (IMC), peso en kilogramos relacionado con el cuadrado de la altura en centímetros. Medido al ingreso en la unidad. Se consideró bajo peso (IMC<18,5), peso normal (IMC entre 18,5 y 24,99), sobrepeso (IMC entre 25 y 29,99) y obesidad (IMC≥30).
- •
Richmond Agitation Sedation Scale (RASS)23. Escala desarrollada y validada para evaluar la sedación y la agitación de paciente críticos. Consta de 10 puntos con 4 niveles de agitación (+4 combativo y +1 ansioso) y 5 niveles de sedación (−1 adormilado y −5 sedación muy profunda). El nivel 0 indica que el paciente está tranquilo y alerta.
- •
Short form 12-item health survey (SF-12)24. Cuestionario de calidad de vida relacionada con la salud. Compuesto por 12ítems. Evalúa el grado de bienestar y de capacidad funcional de las personas mayores de 14años, definiendo un estado positivo y negativo de la salud física (PCS) y mental (MCS), por medio de 8dimensiones.
- •
Medical Research Council Scale Sum score (MRC-SS) según el protocolo de evaluación descrito por Vanpee et al.25. Mide fuerza muscular, en la que cada grupo muscular se puntúa de 0 a 5. Son 12 paquetes musculares y los valores posibles van del 0 al 60. Se considera que el paciente presenta signos clínicos de DMA-UCI cuando la puntuación es inferior a 48.
La validez indica si la información que recogen las escalas es la que realmente se pretende medir26. Para ello se ha tenido en cuenta:
Validez concurrente o convergente. Se valora el grado de acuerdo entre constructos que están relacionados entre ellos. Se ha relacionado el instrumento a validar (IMS-Es) con el de referencia (MRC-SS), siendo ambos administrados por enfermeras y fisioterapeutas, respectivamente, el mismo día y una vez a la semana. Se categorizó la puntuación obtenida en la evaluación de la MRC-SS, según implicara diagnóstico de ICU-AW (MRC-SS<48) o lo descartara (MRC-SS≥48). Se calculó la correlación de Spearman (intensidad de correlación lineal) entre IMS-Es y MRC-SS, considerando correlación débil valores inferiores a 0,30; moderada entre 0,30 y 0,59, y fuerte valores superiores a 0,5927. Se compararon, mediante el test U de Mann-Whitney, las medianas y el rango intercuartílico [P25-P75] para la IMS-ES con relación con las dos categorías de la MRC-SS.
Validez divergente. Se valora el grado de no correlación entre variables que hipotéticamente no tendrían relación con lo que mide el nuevo instrumento. Se ha correlacionado la última valoración de IMS-Es simultánea a la valoración de MRC-SS, con el índice de masa corporal, el peso, el índice de Barthel y el índice de Charlson. Además se ha comparado con el sexo y el IMC categorizado. Se calculó la correlación de Spearman entre IMS-Es y el IMC, el peso, el índice de Barthel y el índice de comorbilidad de Charlson, y se compararon, mediante el test U de Mann-Whitney, las medianas y el rango intercuartílico [P25-P75] para la IMS-Es en relación con el sexo del paciente y el IMC categorizado.
Validez predictiva. Capacidad de un instrumento para predecir un evento. Se ha realizado un análisis de la IMS-Es con el cuestionario de calidad de vida SF-12, ajustada por edad, la duración de la estancia en el hospital post-UCI y la mortalidad oculta hospitalaria. La IMS-Es se ha estratificado según la mejor movilidad durante el ingreso en la UCI, como movilidad pasiva/activa en cama (IMS-Es<4) o movilidad activa fuera de la cama (IMS≥4), y el cuestionario de calidad de vida SF-12 se ha analizado con la puntuación obtenida en el cuestionario a los 90días del alta y con las diferencias de las puntuaciones entre los dos momentos del cuestionario (previo ingreso y al alta de la UCI). Se calculó la correlación de Spearman entre la mejor IMS-Es durante el ingreso en la UCI con la estancia hospitalaria post-UCI y con la diferencia de las puntuaciones entre el SF-12 antes del ingreso en el hospital y a los 90días del alta a su domicilio, tanto del componente físico (PCS) como del mental (MCS). Se calculó el riesgo de fallecer en el hospital entre los supervivientes de la UCI, según la mejor IMS-Es durante el ingreso en UCI (categorizada en movilización pasiva/activa en cama [IMS-Es<4] o activa fuera de la cama [IMS-Es≥4]), mediante la prueba de chi cuadrado. Así mismo, la IMS-Es categorizada se comparó, mediante el test U de Mann-Whitney con la diferencia de SF-12 antes del ingreso y a los 90días del alta.
FiabilidadFiabilidad interobservador26. Grado de concordancia entre dos o más observadores. Se han comparado las puntuaciones obtenidas de la IMS-Es entre enfermeras del equipo investigador y de estas con fisioterapeutas. Se evaluó el máximo nivel de movilidad mediante observación directa, en el mismo momento pero de forma independiente. Las valoraciones no fueron contrastadas entre los observadores. Tanto las enfermeras como las fisioterapeutas tenían más de 5años de experiencia en UCI. Para las comparaciones se utilizó el coeficiente de correlación intraclase (CCI), estableciendo un intervalo de confianza del 95%. Los valores del CCI aceptados se encuentran entre 0 y 1, teniendo en cuenta que valores por debajo de 0,31 indican una concordanza nula; entre 0,31 y 0,5, mediocre; entre 0,51 y 0,7, moderada; entre 0,71 y 0,9, buena, y por encima de 0,90, muy buena28. El total de concordancia se obtiene de la suma de los cuadros en los que coinciden las puntuaciones de los observadores, para cuya valoración se midió el índice kappa corregido, que considera concordancia pobre a valores inferiores a 0,20; débil concordancia de 0,21 a 0,40; moderada entre 0,41 y 0,60; buena concordancia entre 0,61 y 0,80, y muy buena concordancia los valores superiores a 0,81 y 129. Se midió la correlación de las observaciones mediante el coeficiente de Spearman.
Sensibilidad26Se evaluó la sensibilidad al cambio del IMS-Es en los pacientes dados de alta del hospital y con más de 2días de inclusión, analizando las puntuaciones de la escala en diferentes momentos a lo largo del ingreso, el tamaño del efecto y los porcentajes de pacientes sin cambio entre los diferentes momentos evaluados.
El cambio a lo largo del tiempo y el tamaño del efecto se evaluó mediante la significación del cambio en la IMS-Es con respecto a tres momentos, al incluirlos en el estudio al alta de la unidad y el día intermedio entre ellos; para los pacientes a los que se les evaluó calidad de vida a los 3meses del alta hospitalaria, los tres momentos evaluados fueron la inclusión en el estudio, el alta de la UCI y a los 3meses del alta hospitalaria. Se utilizó para ello la prueba de rangos con signo de Wilcoxon, comparando las diferencias de las medianas (rango intercuartílico [RIC]) del IMS-Es entre los dos primeros momentos y entre los segundos. El tamaño del efecto (d) se calculó mediante la fórmula d=Z/√n. Valores inferiores a 0,49 indican un efecto de pequeño tamaño; de 0,5 a 0,79, de magnitud moderada, y elevado igual o por encima de 0,830. Las comparaciones entre las proporciones de pacientes que no muestran cambio entre ambos momentos fueron evaluadas mediante la prueba de chi cuadrado.
Para evaluar el efecto de suelo y techo se determinó la proporción de pacientes con las mínimas puntuaciones (0puntos) y las máximas (10puntos) en la inclusión y al alta de la UCI. Los efectos de suelo y techo de menos del 15% son considerados como aceptables.
Diferencia mínima importanteEs la diferencia más pequeña que se consideraría clínicamente relevante para valorar un cambio en el manejo del paciente. Ha sido considerado como el mínimo cambio relevante, en el nivel de movilidad, para valorar un cambio en el programa de rehabilitación planteada por el fisioterapeuta para cada paciente. Se analizó mediante dos métodos: a)utilizando un indicador externo (anchor based method) que analiza las diferencias de pacientes agrupándolos según el cambio y muestra la magnitud de este cambio a lo largo del tiempo31, y b)basado en la distribución, que apoyándose en la estadística y en las propiedades métricas de las medidas, determinaría el cambio más pequeño que puede ser detectado por el instrumento. La diferencia mínima importante se calculó en los pacientes vivos al alta de la UCI.
Con la metodología de un indicador externo(anchor based method) al alta del paciente de la UCI, una enfermera del equipo investigador calificó mediante una escala de −7 a 7 (tabla 2) el cambio global en la movilización, a través de los registros de IMS-Es en la inclusión del estudio y al alta de la UCI32. Valoraciones de 0-1 fueron consideradas como sin cambios, 2-3 como pequeños cambios y 4-7 como cambios importantes33. Se comparó la mediana (RIC) del cambio en los tres grupos (sin cambios, pequeños cambios y cambios importantes) mediante el test de Kruskal-Wallis. Se calcularon la sensibilidad y la especificidad del cambio en la IMS-Es para discriminar entre los pacientes con cambio (pequeño o importante) y los pacientes sin cambio, obteniendo una curva receiver operating characteristic (curva ROC).
Escala de valoración del cambio global
| –7 | Pésimo rendimiento | Cambio sustancial |
| –6 | Mucho peor | |
| –5 | Peor rendimiento | |
| –4 | Moderadamente peor | |
| –3 | Algo peor | Pequeño cambio |
| –2 | Un poco peor | |
| –1 | Casi sin cambios, apenas un poco peor | No cambio |
| 0 | Sin cambios | |
| +1 | Casi sin cambios, apenas un poco mejor | |
| +2 | Un poco mejor | Pequeño cambio |
| +3 | Algo mejor | |
| +4 | Moderadamente mejor | Cambio sustancial |
| +5 | Mejor rendimiento | |
| +6 | Elevado rendimiento | |
| +7 | Máximo rendimiento |
Para estimar la diferencia mínima importante con el método basado en la distribución se utilizaron el error estándar de la media (EEM) y el tamaño del efecto (TE) de las valoraciones de IMS-Es en la inclusión y al alta. El EEM se calculó a partir de la desviación estándar (DE) de las medias de las mediciones y la rho de Spearman (r) calculada entre las valoraciones de las enfermeras (EEM=DE√(1-r)). El TE se cuantificó con la DE de la diferencia de las valoraciones en el momento de la inclusión en el estudio y al alta (TE=0,5*DE). El análisis de sensibilidad se completó excluyendo del análisis a los pacientes que, según la valoración global de movilidad, empeoraron.
Utilidad de la escala34Hace referencia a aspectos de coste económico y de tiempo en su implementación, la sencillez, la claridad y si es necesario un entrenamiento previo para su utilización. La estimación de utilidad derivará de las valoraciones realizadas por las enfermeras y fisioterapeutas durante la prueba piloto en la fase de adaptación transcultural.
Las variables se describen como mediana y rango intercuartílico (RIC) o media y desviación estándar (DE) para las variables cuantitativas (en función del comportamiento paramétrico de las mismas). Para las variables cualitativas se utilizan las frecuencias absolutas (n) y relativas (%). La normalidad de las variables se evaluó mediante la prueba de Kolmogorov-Smirnov. Para el análisis de los datos se utilizó el paquete estadístico SPSS Statistics para Windows (versión 23.0 IBM Corp; EE.UU.) y el programa Stata® (versión IC14, StataCorp LLC; EE.UU.).
ResultadosFase 1. Adaptación transculturalDesarrollada entre los meses de enero y febrero de 2017. En la etapa de la prueba piloto de la IMS-Es-v1 cada ítem fue puntuado entre 1 (nada relevante) y 4 (alta relevancia). El 66% de las valoraciones determinaron que los ítems tenían una relevancia 3 o 4. Encontramos diferencias entre las valoraciones de las enfermeras y las de los fisioterapeutas; fundamentalmente en la valoración más baja de relevancia (relevancia 1: 26% entre las enfermeras vs 0% entre los fisioterapeutas; p<0,001) y en la valoración más elevada (relevancia 4: 31% entre las enfermeras vs. 62% entre los fisioterapeutas; p=0,001). Los ítems valorados como menos relevantes por el 60% de las enfermeras fueron aquellos en los el paciente realiza movilización activa fuera de la cama (IMS-Es≥4), comparado con solo un 20% de las fisioterapeutas.
El tiempo que tardaron en aplicar la escala fue de 2’30” de mediana (RIC: 1’45”-4’15”), sin encontrar diferencias relevantes entre profesionales (enfermeras vs fisioterapeutas: 2’ [1’30”-4’30”) vs 3’ [1’30”-4’20”]).
El acuerdo ítem a ítem de la escala original con la resultante de la unificación de las retrotraducciones o traducciones inversas fue evaluado como bueno en todos sus ítems. Tras el proceso de adaptación (fig. 1) obtuvimos la escala IMS-España (MS-Es) (tabla 1).
Fase 2. Estudio métrico de validez y fiabilidadLa versión española de la IMS (tabla 1) fue implementada durante los meses de abril a junio de 2017 en 645 pacientes de las 80unidades de críticos españolas participantes en el estudio MOvipre19. Estos 645 pacientes aportan 10.133 registros diarios en la UCI. Las características de los pacientes y de las mediciones de IMS-Es y MRC-SS pueden verse en la tabla 3 y en tabla 4, respectivamente.
Características de los pacientes
| Todos los pacientesn=645 | Vivos al alta de UCIn=483 | Vivos al alta del hospitaln=450 | Vivos al alta del hospital e inclusión >2díasn=437 | |
|---|---|---|---|---|
| Edad, años, media (DE) | 63 (15) | 61 (16) | 60 (16) | 60 (16) |
| Sexo, mujeres, n (%) | 196 (30,4) | 151 (31,3) | 145 (32,2) | 142 (32,5) |
| IMC, kg/m2, media (DE) | 27 (4) | 27 (4) | 27 (4) | 27 (4) |
| Barthel, puntos, media (DE) | 95,5 (10,7) | 96,2 (9,6) | 96,6 (9,2) | 96,5 (9,3) |
| Charlson, puntos, mediana (RIC) | 4 (1-6) | 4 (0-6) | 4 (0-5) | 4 (0-5) |
| Apache II, puntos, media (DE) | 21 (8) | 20,5 (7,8) | 20,3 (7,8) | 20,3 (7,9) |
| Diagnóstico al ingreso, n (%) | ||||
| Sepsis | 126 (19,5) | 97 (20,1) | 91 (20,2) | 89 (20,4) |
| Trauma | 33 (5,1) | 29 (6) | 28 (6,2) | 28 (6,4) |
| Neurocirugía | 14 (2,2) | 10 (2,1) | 9 (2) | 9 (2,1) |
| Cirugía cardíaca | 57 (8,8) | 46 (9,5) | 45 (10) | 44 (10,1) |
| Otra cirugía | 116 (18) | 95 (19,7) | 94 (20,9) | 91 (20,8) |
| Sobredosis | 12 (1,9) | 11 (2,3) | 11 (2,4) | 11 (2,5) |
| Otros médicos | 287 (44,5) | 195 (40,4) | 172 (38,2) | 165 (37,8) |
| Procedencia, n (%) | ||||
| Domicilio | 49 (7,6) | 36 (7,5) | 35 (7,8) | 35 (8) |
| Planta de hospitalización | 289 (44,8) | 200 (41,4) | 184 (40,9) | 177 (40,5) |
| Urgencias | 255 (39,5) | 205 (42,4) | 192 (42,7) | 187 (42,8) |
| Otro centro | 52 (8,1) | 42 (8,7) | 39 (8,7) | 38 (8,7) |
| Estancia en UCI, días, mediana (RIC) | 14 (9-23) | 13 (8-22) | 13 (8-22) | 13 (8-23) |
| RASS inclusión, puntos, mediana (RIC) | –3 (–1 a –4) | –3 (–1 a –4) | –3 (–1 a –4) | –3 (–1 a –4) |
| RASS alta de UCI, puntos, mediana (RIC) | 0 (0 a –3) | 0 (0-0) | 0 (0-0) | 0 (0-0) |
| Pacientes que desarrollaron DMA-UCI, n (%) | 278 (43,1)+ | 247 (51,1)++ | 232 (51,6)+++ | 229 (52,4)++++ |
| Estancia en hospital tras alta de UCI, días, mediana (RIC) | 9 (0-19) | 13 (7-25) | 13 (7-25) | 14 (7-26) |
| Estancia en el hospital, días, mediana (RIC) | 29 (18-48) | 32 (20-52) | 32 (20-52) | 33 (2-53) |
| Destino al alta de UCI, n (%) | ||||
| Planta de hospitalización | 471 (73) | |||
| Otro centro | 12 (1,9) | |||
| Muerte | 162 (25,1) | |||
| Destino al alta del hospitala, n (%) | ||||
| Domicilio | 364 (75,4) | 364 (75,4) | 352 (80,5) | |
| Otro centro | 76 (15,7) | 76 (15,7) | 75 (17,2) | |
| Muerte | 33 (6,8) | – | – | |
| SF-12 previo ingreso, puntos, mediana (RIC)b | ||||
| Salud física (PCS) | 47,6 (35,9-54,33) | |||
| Salud mental (MCS) | 46,98 (35,99-54,39) | |||
| SF-12 a los 90 días del alta, puntos, mediana (RIC)b | ||||
| Salud física (PCS) | 42 (33,75-50,92) | |||
| Salud mental (MCS) | 50,07 (39,78-56,72) | |||
DE: desviación estándar; DMA-UCI: debilidad muscular adquirida en la UCI; IMC: índice de masa corporal; RASS: Richmond Agitation Sedation Scale; RIC: rango intercuartílico.
Valoraciones de movilidad y MRC-SS
| Movilidad (IMS-Es) | |
|---|---|
| Pacientes(n=645) | |
| Movilidad el día de la inclusión, puntos, mediana (RIC) | 0 (0-0) |
| Mejor movilidad durante el ingreso, puntos, mediana (RIC) | 2 (1-4) |
| Movilidad el día del último MRC-SSa, puntos, mediana (RIC) | 2 (2-5) |
| Movilidad al alta, puntos, mediana (RIC) | 2 (0-4) |
| Mediciones(n=10.133) | |
|---|---|
| Nivel de movilidad, n (%) | |
| < 4 | 9.232 (91) |
| ≥ 4 | 901 (9) |
| Debilidad (MRC-SS) | |
|---|---|
| Pacientes(n=475) | |
| Primera MRC-SS, puntos, mediana (RIC) | 44 (33-52) |
| Última MRC-SSa, puntos, mediana (RIC) | 49 (41-55) |
| Mediciones(n=929) | |
|---|---|
| MRC-SS, n (%) | |
| < 48 | 518 (55,8) |
| ≥ 48 | 411 (44,2) |
RIC: rango intercuartílico.
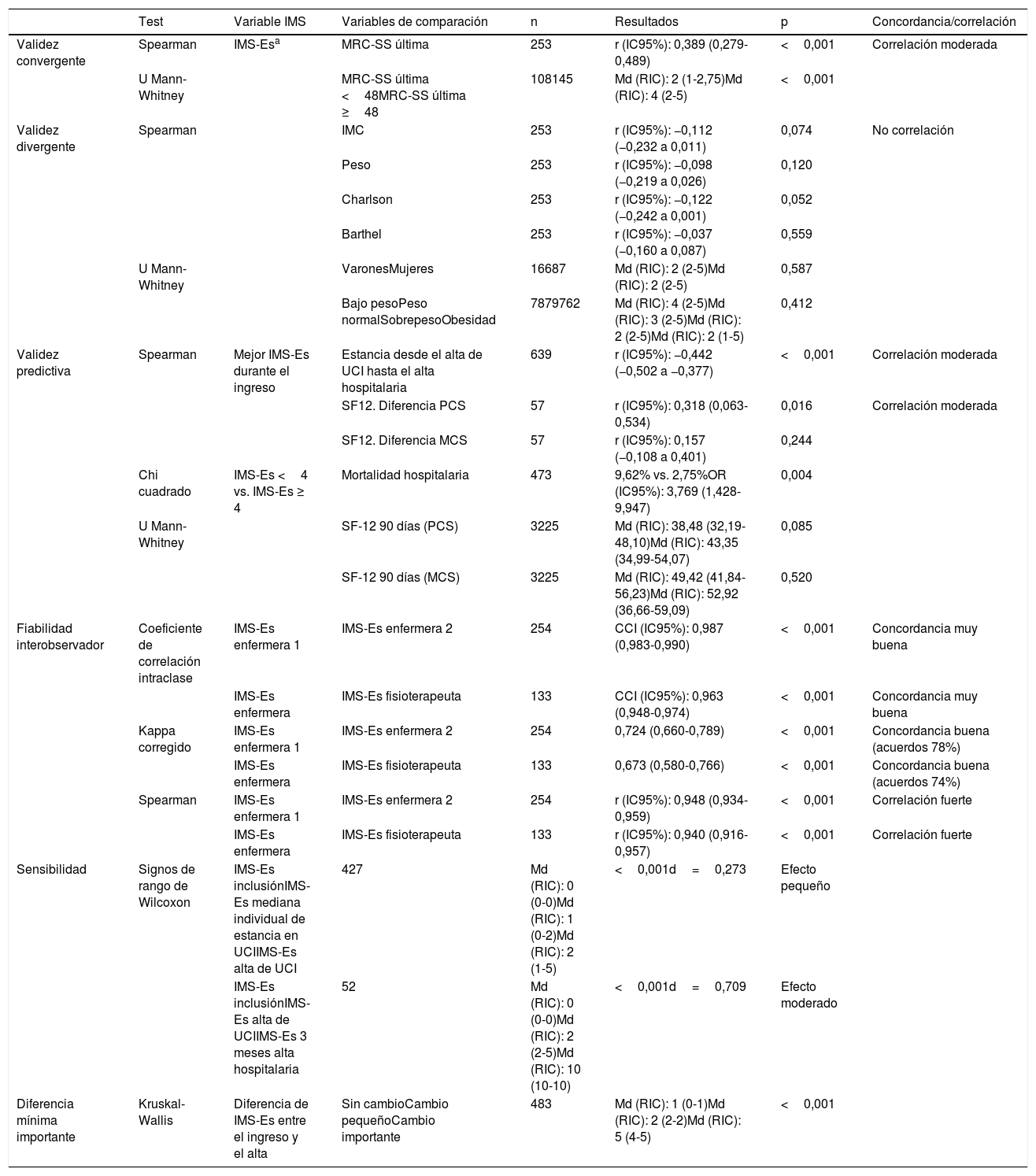
Validez convergente. De los 645 pacientes incluidos, solo se pudo evaluar la MRC-SS en 475; el resto de pacientes no llegaron a estar colaboradores. De estos, 253 pacientes fueron evaluados con MRC-SS en más de una ocasión. El coeficiente de correlación de Spearman, medido entre la última valoración de MRC-SS y la IMS-Es del mismo día, fue de 0,389 (p<0,001). Entre los pacientes que desarrollaron DMA-UCI durante el ingreso, el coeficiente de correlación de Spearman calculado fue de 0,475 (p<0,001). La comparación de las medianas (RIC) de las valoraciones de IMS-Es entre grupos según DMA-UCI (MRC-SS<48) o no DMA-UCI (MRC-SS≥48) en la última valoración del MRC-SS resulta estadísticamente significativa (p<0,001) (tabla 5).
Resultados del análisis de validación
| Test | Variable IMS | Variables de comparación | n | Resultados | p | Concordancia/correlación | |
|---|---|---|---|---|---|---|---|
| Validez convergente | Spearman | IMS-Esa | MRC-SS última | 253 | r (IC95%): 0,389 (0,279-0,489) | <0,001 | Correlación moderada |
| U Mann-Whitney | MRC-SS última <48MRC-SS última ≥48 | 108145 | Md (RIC): 2 (1-2,75)Md (RIC): 4 (2-5) | <0,001 | |||
| Validez divergente | Spearman | IMC | 253 | r (IC95%): −0,112 (−0,232 a 0,011) | 0,074 | No correlación | |
| Peso | 253 | r (IC95%): −0,098 (−0,219 a 0,026) | 0,120 | ||||
| Charlson | 253 | r (IC95%): −0,122 (−0,242 a 0,001) | 0,052 | ||||
| Barthel | 253 | r (IC95%): −0,037 (−0,160 a 0,087) | 0,559 | ||||
| U Mann-Whitney | VaronesMujeres | 16687 | Md (RIC): 2 (2-5)Md (RIC): 2 (2-5) | 0,587 | |||
| Bajo pesoPeso normalSobrepesoObesidad | 7879762 | Md (RIC): 4 (2-5)Md (RIC): 3 (2-5)Md (RIC): 2 (2-5)Md (RIC): 2 (1-5) | 0,412 | ||||
| Validez predictiva | Spearman | Mejor IMS-Es durante el ingreso | Estancia desde el alta de UCI hasta el alta hospitalaria | 639 | r (IC95%): −0,442 (−0,502 a −0,377) | <0,001 | Correlación moderada |
| SF12. Diferencia PCS | 57 | r (IC95%): 0,318 (0,063-0,534) | 0,016 | Correlación moderada | |||
| SF12. Diferencia MCS | 57 | r (IC95%): 0,157 (−0,108 a 0,401) | 0,244 | ||||
| Chi cuadrado | IMS-Es <4 vs. IMS-Es ≥ 4 | Mortalidad hospitalaria | 473 | 9,62% vs. 2,75%OR (IC95%): 3,769 (1,428-9,947) | 0,004 | ||
| U Mann-Whitney | SF-12 90 días (PCS) | 3225 | Md (RIC): 38,48 (32,19-48,10)Md (RIC): 43,35 (34,99-54,07) | 0,085 | |||
| SF-12 90 días (MCS) | 3225 | Md (RIC): 49,42 (41,84-56,23)Md (RIC): 52,92 (36,66-59,09) | 0,520 | ||||
| Fiabilidad interobservador | Coeficiente de correlación intraclase | IMS-Es enfermera 1 | IMS-Es enfermera 2 | 254 | CCI (IC95%): 0,987 (0,983-0,990) | <0,001 | Concordancia muy buena |
| IMS-Es enfermera | IMS-Es fisioterapeuta | 133 | CCI (IC95%): 0,963 (0,948-0,974) | <0,001 | Concordancia muy buena | ||
| Kappa corregido | IMS-Es enfermera 1 | IMS-Es enfermera 2 | 254 | 0,724 (0,660-0,789) | <0,001 | Concordancia buena (acuerdos 78%) | |
| IMS-Es enfermera | IMS-Es fisioterapeuta | 133 | 0,673 (0,580-0,766) | <0,001 | Concordancia buena (acuerdos 74%) | ||
| Spearman | IMS-Es enfermera 1 | IMS-Es enfermera 2 | 254 | r (IC95%): 0,948 (0,934-0,959) | <0,001 | Correlación fuerte | |
| IMS-Es enfermera | IMS-Es fisioterapeuta | 133 | r (IC95%): 0,940 (0,916-0,957) | <0,001 | Correlación fuerte | ||
| Sensibilidad | Signos de rango de Wilcoxon | IMS-Es inclusiónIMS-Es mediana individual de estancia en UCIIMS-Es alta de UCI | 427 | Md (RIC): 0 (0-0)Md (RIC): 1 (0-2)Md (RIC): 2 (1-5) | <0,001d=0,273 | Efecto pequeño | |
| IMS-Es inclusiónIMS-Es alta de UCIIMS-Es 3 meses alta hospitalaria | 52 | Md (RIC): 0 (0-0)Md (RIC): 2 (2-5)Md (RIC): 10 (10-10) | <0,001d=0,709 | Efecto moderado | |||
| Diferencia mínima importante | Kruskal-Wallis | Diferencia de IMS-Es entre el ingreso y el alta | Sin cambioCambio pequeñoCambio importante | 483 | Md (RIC): 1 (0-1)Md (RIC): 2 (2-2)Md (RIC): 5 (4-5) | <0,001 |
Validez divergente. Se observó una correlación débil y negativa entre IMS-Es y el peso (r=−0,098), el IMC (r=−0,112), el índice de Charlson (r=−0,122) y el índice de Barthel (r=−0,043). No hubo diferencias significativas entre las medianas (RIC) del IMS-Es de varones vs. mujeres (p=0,587), ni entre las medianas (RIC) del IMC categorizado (p=0,412) (tabla 5).
Validez predictiva. Se ha observado una correlación significativa y negativa entre la mejor IMS-Es obtenida durante el ingreso en la UCI y la estancia en el hospital post-UCI. También se ha observado una correlación significativa, en este caso positiva, entre la mejor IMS-Es y la diferencia en el componente físico del cuestionario SF-12, medidos antes del ingreso y 90días después; con el componente mental del SF-12 no hemos observado correlación. Se ha obtenido una diferencia significativa en el porcentaje de pacientes fallecidos en el hospital (al alta de la UCI), entre los que no llegaron a tener movilización activa fuera de la cama durante la estancia en la UCI (IMS-Es<4) vs. los que sí se movilizaron activamente (IMS≥4) (28/291 vs 5/182; OR [IC95%]: 3,769 [1,428-9,947]; p=0,004). Aunque no se han hallado diferencias significativas en la diferencia de los componentes físico y mental del SF-12 entre los pacientes con movilización pasiva/activa en cama vs. activa fuera de la cama, sí se ha observado que los pacientes con movilización activa fuera de la cama mejoraron en 5 y 3puntos, respectivamente, ambos componentes (tabla 5).
Fiabilidad interobservadorSe obtuvieron 254 pares de evaluaciones realizadas simultáneamente por dos enfermeras de UCI y 133 pares de evaluaciones realizadas simultáneamente por una enfermera de UCI y una fisioterapeuta. Se han obtenido concordancias muy buenas y fuertes correlaciones tanto en el par enfermera-enfermera como en el enfermera-fisioterapeuta (tabla 5).
SensibilidadEl tamaño del efecto en los cambios del IMS-Es entre el momento de la inclusión y el punto intermedio y entre este punto intermedio y el alta fue pequeño (d=0,273) (tabla 5). El 52,7% de los pacientes presentaron mejoría entre el día de la inclusión y el día intermedio; el 66,3% mejoraron desde el día intermedio hasta el alta de la unidad (p<0,001).
El tamaño del efecto observado en la comparación de las medianas de las diferencias entre los momentos de inclusión-alta UCI y el alta UCI-3meses de alta hospitalaria fue moderado (d=0,709) (tabla 5). El 90,4% de los pacientes mejoraron entre la inclusión y el alta de UCI y el 100% mejoraron desde el alta del hospital hasta los 3meses de esta (p=0,056).
En el momento de la inclusión de los pacientes el porcentaje de los mismos con un valor0 alcanzó el 76,8%, mientras que el porcentaje de pacientes con valor10 se situó en el 0,2%. Al alta de la UCI el IMS-Es presentó valores aceptables (<15%) tanto para el efecto suelo como para el efecto techo, con porcentajes del 6,8 y del 1,4%, respectivamente. En el momento de la inclusión el 60,5% de los pacientes tenían un nivel de sedación (medido con la Richmond Agitation Sedation Scale) de −3 o inferior (RASS, mediana [RIC]=−3 [−1 a −4]); al alta fueron el 0,9% los que tuvieron un RASS≤−3 (RASS, mediana [RIC]=0 [0 a 0]).
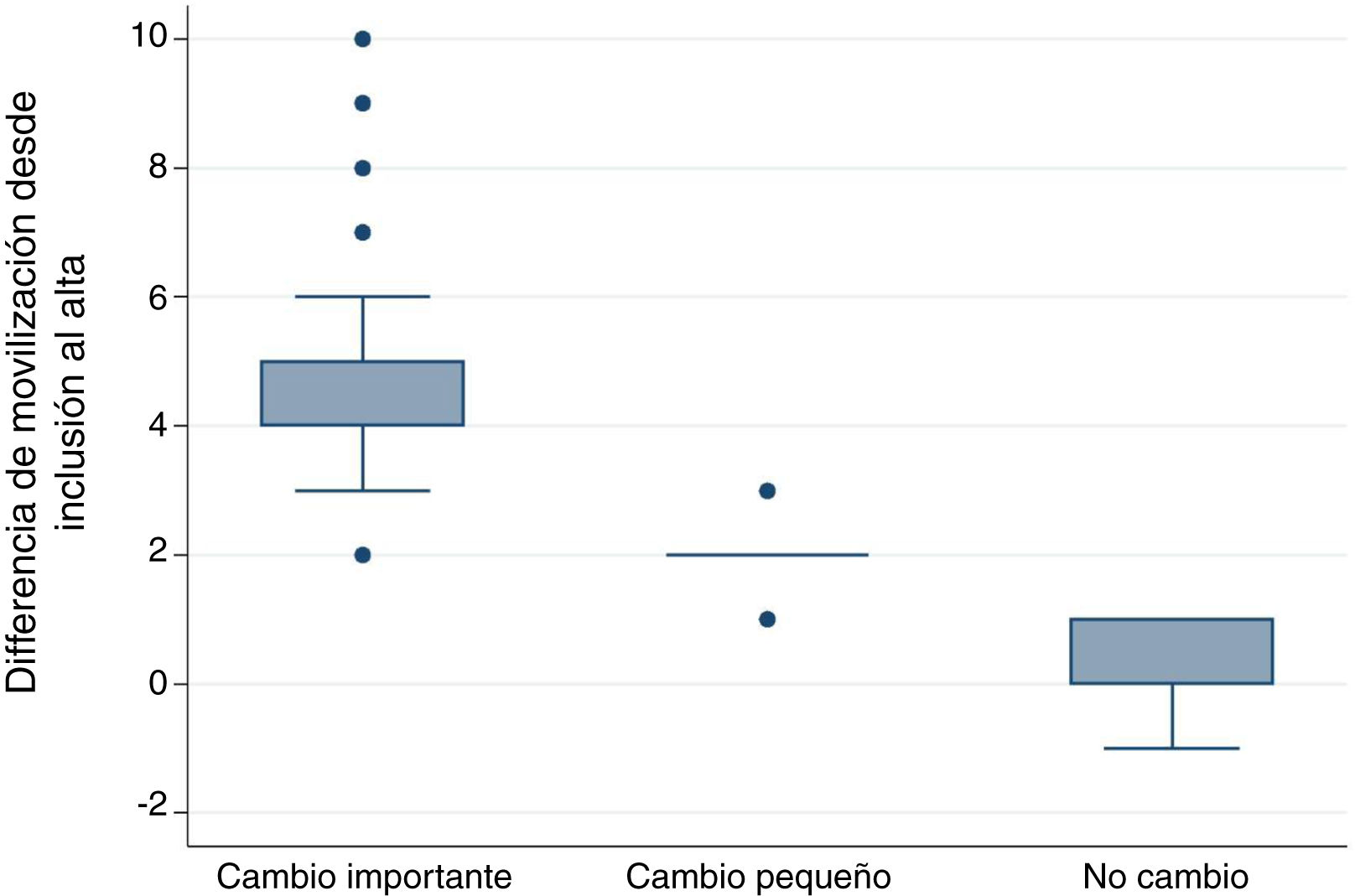
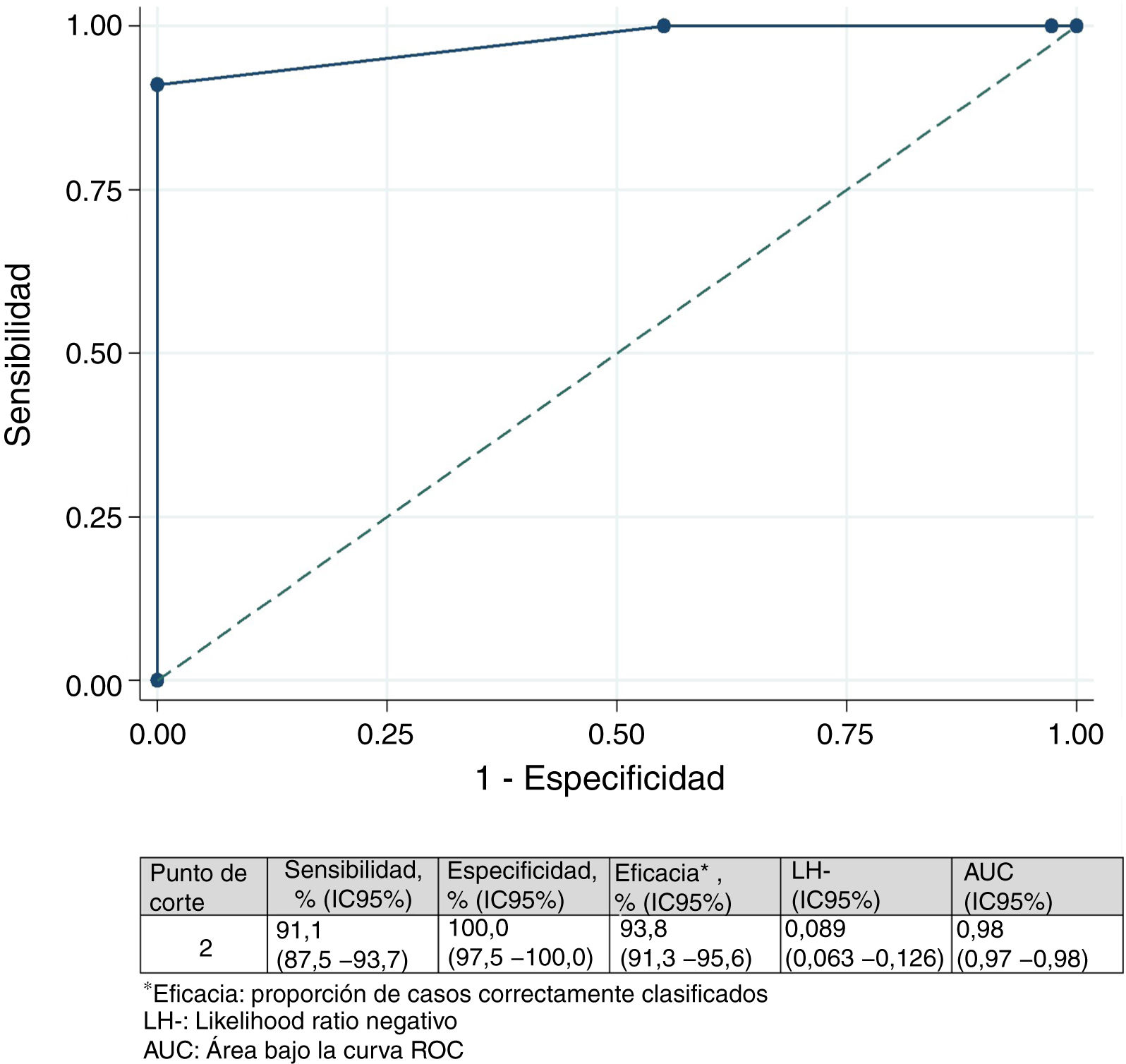
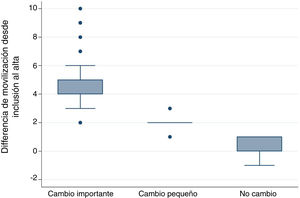
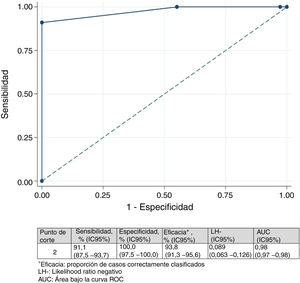
Diferencia mínima importanteDiferencia mínima importante según el «anchor based method». La mediana (RIC) del IMS-Es al ingreso, de los 483 pacientes que sobrevivieron a la UCI, fue de 0 (0-0) y de 2 (1-5) al alta; la mediana de la diferencia de movilidad entre el ingreso y el alta de la UCI fue de 2 (1-4). Según la escala de valoración del cambio global (tabla 2), en 147 pacientes (30,4%) no se observó cambio; el cambio fue pequeño en 167 (34,6%) y grande en 169 (35,0%). La comparación entre medianas (RIC) de la diferencia de movilidad entre el ingreso y el alta entre los tres grupos es significativa (fig. 2). El área bajo la curva ROC fue de 0,98 (IC95%: 0,97-0,98) (fig. 3). El análisis determina un punto de corte de2 en la escala IMS-Es como cambio clínicamente relevante, con una sensibilidad del 91,1% y una especificidad del 100,0%. En el análisis de sensibilidad, excluyendo a los 4 pacientes que empeoraron su movilidad entre la inclusión y el alta, los resultados obtenidos no se vieron modificados.
Diferencia mínima importante según la distribución. A partir de la desviación estándar (DE) del IMS-Es en el momento de la inclusión (0,779) y en el alta (2,079), el error estándar de la media (EEM) fue de 0,178 y de 0,474, respectivamente; el tamaño del efecto calculado, a partir de la DE de la diferencia (2,039), fue de 1,020. En el análisis de sensibilidad, excluyendo a los 4 pacientes que vieron deteriorado su nivel de movilidad, el EEM en el momento de la inclusión fue de 0,178 y al alta de 0,472, con un tamaño del efecto de 1,011.
Utilidad de la escalaEsta escala podría considerarse útil teniendo en cuenta el poco tiempo necesario para implementar la escala, su bajo coste y que las enfermeras y fisioterapeutas que participaron en la prueba piloto manifestaron que es una escala sencilla de aplicar.
DiscusiónEste trabajo ha permitido la adaptación de la escala IMS al contexto español y ha se ha obtenido un instrumento fácil de aplicar a la práctica clínica por enfermeras y fisioterapeutas, válido y fiable.
La diferencia observada en la adaptación transcultural de la escala original, en cuanto a la valoración de la pertinencia de los ítems entre enfermeras y fisioterapeutas, se basa en las diferentes competencias de cada profesión. Las enfermeras valoran como poco relevante las puntuaciones más elevadas, en las que el paciente camina, por considerar que son pocos los pacientes que llegan a desarrollar esta capacidad. Sin embargo, los fisioterapeutas ven estas puntuaciones como muy relevantes, y poco relevantes aquellas en las que los pacientes permanecen inmóviles en la cama, en concordancia con lo hallado en la literatura35-37.
Con respecto a la validez convergente, hemos obtenido una correlación moderada con la última MRC-SS (r [IC95%]: 0,389 [0,279-0,489]; p<0,001), resultados algo inferiores a los obtenidos en la escala original (r [IC95%]: 0,64 [0,49-0,75]; p<0,001)12. Del mismo modo, las diferencias de movilidad observadas entre el grupo que desarrolló DMA-UCI y el que no son igualmente significativas. Es posible que los pacientes incluidos en este estudio se movilizaran menos activamente aunque tuvieran capacidad para ello, debido a que solo el 14% de las unidades disponían de protocolos de movilización19, frente al 36,5% de las unidades en Australia, donde se validó la escala original12.
Además, otra justificación a la poca movilización podría ser la ratio enfermera:paciente, que en nuestro ámbito es de 1:2 solo en el 47,7% de las unidades, siendo de 1:3 en el 25,6% y hasta de 1:4 en el 3,5% de ellas19.
En el análisis de la validez divergente obtenemos resultados similares a los obtenidos en la escala original12, con ausencia de correlación significativa con el peso y sin diferencias entre sexos. La no comparación de la IMS con el IMC fue una de las limitaciones descritas en la validación de la versión original de la escala; en esta versión de IMS-Es sí evaluamos esta correlación, resultando no significativa tanto si se considera la variable como continua o como categórica.
En sentido contrario, la escala IMS-Es sí tiene capacidad predictiva en relación con la estancia y la mortalidad. Los pacientes que alcanzan mejores valores de IMS-Es durante el ingreso en la UCI tienen una estancia menor en el hospital tras el alta de la UCI, y además la no movilización activa fuera de la cama conlleva un elevado riesgo de fallecer en el hospital. Esta capacidad de la IMS-Es para predecir la mortalidad hospitalaria también fue observada por Tipping et al.38 en la escala original.
En cuanto a predecir la calidad de vida, la IMS38 no pudo demostrar esta validez, pero sí la IMS-Es. Ha demostrado tener validez en cuanto al componente físico de la calidad de vida a los 90días del alta hospitalaria.
El análisis de fiabilidad ofrece concordancias buenas y muy similares a las de la escala original11 (kappa 0,72 de enfermeras con fisioterapeutas senior y de 0,69 con fisioterapeutas junior) y correlaciones superiores (r=0,77-0,80)11. Wilches et al.39 obtuvieron similares correlaciones (CCI entre 0,94 y 1) y mejores concordancias (K entre 0,988 y 0,992), aunque en este estudio solo se han tenido en cuenta valoraciones de fisioterapeutas, al igual que Kawaguchi et al.40, que obtuvieron correlaciones elevadas entre fisioterapeutas (K [IC95%]: 0,99 [0,98-0,99]) en la validación de la versión del IMS en portugués. No ha sido evaluada en el presente estudio esta correlación entre fisioterapeutas, al considerar que la IMS fue creada para ser utilizada en el ámbito de las UCI y para estandarizar el lenguaje entre enfermeras y fisioterapeutas.
Los elevados valores del efecto suelo (76,8%) en el momento de la inclusión pueden ser explicados por el nivel de sedación, ya que el 60,5% de los pacientes tenía nivel de sedación profunda. Tipping et al.12, en la escala original, también obtuvieron elevado efecto suelo al ingreso (96%), con mediana de RASS de −4. El tamaño del efecto obtenido en el cambio de la IMS-Es entre la inclusión y el alta es pequeño (d=0,273) y muy inferior al obtenido en la escala original12 (d=0,8). Este pequeño efecto observado posiblemente sea ocasionado por la baja movilidad de los pacientes incluidos en el estudio y porque en la escala original se analizaron los momentos de inclusión, al alta y a los 6meses del alta hospitalaria, donde el nivel de movilidad de todos los pacientes era 10. En la validación de la IMS-Es hemos tenido en cuenta los momentos de inclusión, el alta y el día intermedio de ambos. Este hecho nos penaliza, puesto que al alta el nivel de movilidad que hemos observado no ha sido tan elevado. Sí hemos obtenido un tamaño del efecto moderado (d=0,709) en la cohorte de pacientes donde se evaluó la calidad de vida a los 3meses del alta hospitalaria.
La diferencia mínima importante obtenida se encuentra entre valores de 0,178 y de 2, valores inferiores a los obtenidos con la escala original con población de Australia y Nueva Zelanda12, donde obtuvieron valores entre 0,89 y 3. El motivo de estos datos más bajos, nuevamente, puede tener su origen en la menor movilidad de los pacientes del presente estudio. De esta forma, la relevancia clínica en el cambio se obtiene con valores más bajos.
Es necesario considerar como una limitación de la diferencia mínima importante, medida con un indicador externo (anchor based method), que este método la define como el cambio más pequeño en la evolución de los pacientes que estos consideran relevante. En el caso de pacientes críticos no es posible que el paciente manifieste su valoración del cambio, por lo que hemos considerado que lo más apropiado sería determinarlo por parte de una enfermera. Teniendo en cuenta que en el estudio MOviPre19 han participado 80UCI españolas, resultaba complicado establecer criterios similares para determinar la relevancia del cambio, por lo que la valoración ha sido realizada por una única enfermera, experta en UCI, en base a los registros de movilidad y teniendo en cuenta la edad, el Barthel previo al ingreso, el diagnóstico de ingreso, la gravedad y los días de ingreso en la UCI. Si bien es cierto que puede no reflejar la estimación de los pacientes, también puede ser considerado un método válido la valoración profesional basada en datos clínicos41.
ConclusionesLa escala obtenida es útil, válida y fiable para ser utilizada tanto por enfermeras de la UCI como por fisioterapeutas, para valorar la movilidad de los pacientes críticos y planificar programas de actividades individualizados, para prevenir la debilidad muscular adquirida en la UCI.
Para evaluar la función física del paciente de cuidados intensivos y seguir su evolución durante la estancia en la UCI se deben usar instrumentos validados para esta población y con propiedades métricas adecuadas. La ICU Mobility Scale (IMS) es una escala que valora la movilidad en pacientes críticos con buenas propiedades métricas. Con este trabajo se pretende realizar la adaptación al contexto español y validación de la IMS.
Implicaciones para la prácticaSe ha obtenido una escala válida y fiable que puede ser utilizada en la valoración de la movilidad de los pacientes críticos de España, tanto por enfermeras como por fisioterapeutas. De esta forma se estandariza el lenguaje entre ambas profesiones en la valoración del grado de actividad de los pacientes, permitiendo el desarrollo y la implementación de programas de actividad individualizados para prevenir el síndrome de debilidad adquirida en la UCI.
Este estudio no ha obtenido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Sociedad Española de Enfermería Intensiva y Unidades Coronarias (SEEIUC), promotora del estudio.
Natalia Cámara-Conde, Oscar Peñuelas-Rodríguez, Raquel Herrero-Hernández, M. Mar Sánchez-Sánchez, M. Pilar Fraile-Gamo (Hospital Universitario de Getafe, Madrid).
Candelas López-López, M. Jesús Frade-Mera, Noelia Regueiro-Díaz, Luis Fernando Carrasco Rodríguez-Rey, Ignacio Zaragoza-García, Francisco Javier Zarza-Bejarano, Virginia Toribio-Rubio, María Catalina Pérez-Muñoz (Hospital Universitario 12 de Octubre, Madrid).
María Acevedo Nuevo, Alejandro Barrios (Hospital Universitario Puerta de Hierro Majadahonda, Madrid).
Tamara R. Velasco-Sanz (Hospital Universitario Clínico San Carlos, Madrid).
Saúl García-González (Hospital Universitario de Móstoles, Madrid).
Emilia Romero de San Pío (Hospital Central de Asturias, Oviedo).
Joan-Daniel Martí-Romeu, Eva Blázquez-Martínez, Alicia San José-Arribas, Sandra Belmonte (Hospital Clínic de Barcelona, Barcelona).
Elisabeth Gallart (Hospital Vall d’Hebron, Barcelona).
Ricardo Rodrigues Gomes (Hospital Alvaro Cunqueiro, Vigo, Pontevedra).
Antonio Tomás Ríos Cortés (Hospital General Universitario Santa Lucía, Cartagena, Murcia).
Roberto Martínez Alejos (Centre Hospitalier Universitaire, Bordeaux, Francia).
Ana Rodríguez Merino (Royal Brompton and Harefield Hospital Trust, London, Reino Unido).
Elsa Afonso (Rosie Hospital, Cambridge, Reino Unido).
Andalucía. Coordinadora: María Esther Rodríguez Delgado. Autores: Antonia María Contreras Rodríguez; Ester Oreña Cimiano; Alvaro Ortega Guerrero; María del Carmen Martínez del Águila; Virginia Rodríguez Monsalve; Carlos Leonardo Cano Herrera; Juan Manuel Masegosa Pérez; de los hospitales Poniente, Virgen de Valme, Quirón, Santa Ana.
Aragón. Coordinadora: Delia María González de la Cuesta. Autores: María Inmaculada Pardo Artero; Marta Palacios Laseca; Ana Isabel Cabello Casao; María Belén Vicente de Vera Bellostas; Carmen Pérez Martínez; Sheila Escuder González; Amelia Lezcano Cisneros; Antonio Miguel Romeo; Isabel López Alegre; de los hospitales Clínico Universitario Lozano Blesa, Royo Villanova, Universitario Miguel Servet, Obispo Polanco.
Asturias. Coordinadora: Emilia Romero de San Pío. Autores: Helena Fernández Alonso; Lara María Rodríguez Villanueva; Roberto Riaño Suárez, Begoña Sánchez Cerviño, Sergio Carrasco Santos; de los hospitales Universitario Central de Asturias y San Agustín.
Canarias. Coordinadora: Alicia San José Arribas. Autores: Miriam González García; Antonio Linares Tavio; del Complejo Hospitalario Universitario de Canarias.
Cantabria. Coordinadora: Paz Álvarez García. Autores: Nuria Polo Hernández; Lourdes Gómez Cosío; Isabel Pérez Loza; Ángela Suárez Pérez; Sonia Crespo Rebollo; del Hospital Universitario Marqués de Valdecilla.
Castilla-La Mancha. Coordinador: Juan Carlos Muñoz Camargo. Autores: Julián García García; César Rojo Aguado; José Gómez López; Laura Sonseca Bartolomé; de los hospitales Universitario de Guadalajara y General de Albacete.
Castilla y León. Coordinadora: Alicia San José Arribas. Autores: Sonia del Olmo Nuñez; Patricia García Mazo; Eduardo Siguero Torre; Isabel Muñoz Díez; de los hospitales Universitario Río Ortega y Clínico de Valladolid.
Catalunya. Coordinadora: Pilar Delgado Hito. Autores: Mercedes Olalla Garrido Martín; Gemma Marín Vivó; Maria del Mar Eseverri Rovira; Montserrat Guillen Dobon; Montserrat Aran Esteve; Maribel Mirabete Rodríguez; Albert Mariné Méndez; Silvia Rodríguez Fernández; Joan Rosselló Sancho; Valeria Zafra Lamas; Inmaculada Carmona Delgado; Àngels Navarro Arilla; Gustau Zariquiey Esteva; Ángel Lucas Bueno Luna; Cristina Lerma Brianso; Rubén Gómez García; Bernat Planas Pascual; Marta Sabaté López; Ana Isabel Mayer Frutos; Roser Roca Escrihuela; Gemma Torrents Albà; Vanesa Garcia Flores; Joan Melis Galmés; Sandra Belmonte Moral; Montserrat Grau Pellicer; Aintzane Ruiz Eizmendi; Carme Garriga Moll; Esteve Bosch de Jaureguízar; de los hospitales Universitari Vall d’Hebron, Santa Creu i Sant Pau; Clínic de Barcelona; Consorci Sanitari de Terrassa; Universitari de Girona Dr. Josep Trueta; Universitari de Bellvitge.
Extremadura. Coordinador: Sergio Cordovilla Guardia, Fidel López Espuela. Autores: Lara Mateos Hinojal, María Isabel Redondo Cantos; del hospital Complejo Hospitalario de Cáceres.
Galicia. Coordinadora: M. del Rosario Villar Redondo. Autores: Jesús Vila Rey, Susana Sánchez Méndez; Yolanda García Fernández; María Cristina Benítez Canosa; Mauricio Díaz Álvarez; José Ramón Cordo Isorna; Ángeles Estébez Penín; Gloria Güeto Rial; Esther Bouzas López; de los hospitales Universitario Lucus Augusti, Complejo Hospitalario Universitario de Ourense, Complejo Universitario Santiago de Compostela y Complejo Hospitalario Universitario de Pontevedra.
Madrid. Coordinadoras: Susana Arias Rivera, María Jesús Frade Mera y María Jesús Luengo Alarcia. Autores: Noelia Regueiro Díaz; Luis Fernando Carrasco Rodríguez-Rey; María del Rosario Hernández García; Gema Sala Gómez; Javier Vecino Rubio; Saúl García González; María del Mar Sánchez Sánchez; Carmen Cruzado Franco; Beatriz Martín Rivera; Rocío González Blanco; Ana Belén Sánchez de la Ventana; Maria Luisa Bravo Arcas; Josefa Escobar Lavela; María del Pilar Domingo Moreno; Mercedes García Arias; Inmaculada Concepción Collado Saiz; María Acevedo Nuevo; Alejandro Barrios Suárez; Francisco Javier Zarza Bejarano; María Catalina Pérez Muñoz; Virginia Toribio Rubio; Patricia Martínez Chicharro; Alexandra Pascual Martínez; Sergio López Pozo; Laura Sánchez Infante; Verónica Ocaña García; Daniel Menes Medina; Ana Vadillo Cortázar; Gema Lendínez Burgos; Jesús Díaz Juntádez; María Teresa Godino Olivares; de los hospitales Universitario 12 de Octubre, Universitario de Móstoles, Universitario de Getafe, Universitario La Paz; Universitario Ramon y Cajal; Universitario Clínico San Carlos; Universitario del Sureste; Infanta Leonor, del Henares; Universitario Puerta de Hierro Majadahonda y Universitario Gregorio Marañón.
Murcia. Coordinador: Juan José Rodríguez Mondéjar. Autores: Francisco José Martínez Rojo; María Vanessa Ruiz Martínez; Daniel Linares Celdrán; Antonio Ros Molina; Javier Sáez Sánchez; José María Martínez Oliva; Ana Bernal Gilar; María Belén Hernández García; Antonio Tomás Ríos Cortés; Raquel Navarro Méndez; Sebastián Gil García; Juan Sánchez Garre; de los hospitales Universitario Morales Messeguer, Universitario Los Arcos del Mar Menor, Universitario Santa Lucía, Universitario Rafael Méndez, Clínico Universitario Virgen de la Arrixaca y Reina Sofía de Murcia.
Navarra. Coordinadora: Miriam del Barrio Linares. Autores: Rosana Goñi Viguria y Raquel Aguirre Santano; de la Clínica Universitaria de Navarra.
País Vasco. Coordinadora: M. Rosario García Díez. Autores: Laura Aparicio Cilla; Mónica Delicado Domingo; César Rodríguez Núñez; Ane Arrasate López; de los hospitales Universitario de Basurto y Universitario Araba (sede Txagorritxu).
Valencia. Coordinadora: Ángela Romero Morán. Autores: Rosa Paños Melgoso; Mónica Yañez Cerón; Amparo Mercado Martínez; Beatriz Martínez Llopis; María Josefa Vayá Albelda; Javier Inat Carbonell; M. Rosario Alcayne Senent; Fátima Giménez García; Eva Cristina Fernández Gonzaga; Laura Febrer Puchol; Senén Berenguer Ortuño; María Pastor Martínez; Dunia Valera Talavera; María José Segrera Rovira; Yolanda Langa Revert; Maricruz Espí Pozuelo; María Ángeles de Diego; Beatriz Garijo Aspas; María del Rosario Asensio García; José Ramón Sánchez Muñoz; Quirico Martínez Sánchez; Ramón López Mateu; de los hospitales Universitario Dr. Peset Aleixandre, General de Elda, Universitario de la Ribera, Lluís Alcanyís de Xàtiva, Clínico Universitario de Valencia, Provincial de Castellón, de Requena, Universitario San Juan, Universitario de la Plana, de Orihuela y Universitario de Elche.