Describir las características generales del paciente y del uso del dispositivo. Conocer presión del globo de retención (PGR) y factores relacionados. Identificar incidencia de fuga, recolocación y lesión perineal asociada al dispositivo (LAD) y factores relacionados.
Material y métodosEstudio observacional analítico longitudinal realizado en UCI polivalente, de junio a diciembre de 2010. La muestra incluyó portadores de Flexi-Seal®. Se valoraron: características de pacientes y de uso del dispositivo, PGR, fuga y cantidad, recolocación y motivo, LAD, sedoanalgesia en perfusión(SAP), relajación en perfusión, posición, tipo sonda, modalidad ventilatoria(MV), presión intraabdominal(PIA), presión media intratorácica(PMI), PEEP, Glasgow, color-aspecto, consistencia y volumen de heces. Significación p<0,05.
ResultadosSe incluyeron 21 pacientes, 52% varones, edad 54±17años con 30 episodios de inserción, Flexi-Seal-Signal® un 33%, permanencia 10±8días, principal indicacion «diarrea más lesión piel» en un 33%, retirada «intolerancia y/o expulsión espontánea» en un 30%. PGR mediana (Me)=40; RI (61-19) cmH2O. Factores asociados significativamente a mayor PGR: ausencia de SAP, decúbito prono, fuga, recolocación, Flexi-Seal® convencional, MV, menor PEEP y PMI, color-aspecto y mayor PIA. Densidad de incidencia de fuga, recolocación y LAD 43, 30 y 2 casos/100días de sonda, respectivamente. Factores de riesgo de fuga y recolocación: mayor PGR, Glasgow y volumen de heces, menor PIA, MV, modalidad asistida-espontánea OR 2,5; IC (1,6-3,8) y OR 1,7 (1,1-2,7), ausencia SAP OR 3,3 (2,2-5,1) y OR 2,4 (1,5-3,8), relajación en perfusión OR 2,4 (1,4-3,9) y OR 1,8 (1,1-3,1), Flexi-Seal®convencional OR 2,7 (1,7-4,1) y OR 2 (1,2-3,3), respectivamente. Factores de riesgo de fuga: color-aspecto, decúbito supino, menor PMI y PEEP.
ConclusionesMonitorizar la PGR puede alertar sobre la aparición de fuga y necesidad de recolocación. Conocer los factores asociados a la PGR, fuga y recolocación permitirá desarrollar estrategias para descender su elevada incidencia, como puede ser la disminución de la PGR reduciendo el volumen de hinchado.
To describe the general characteristics of the patient and device use. To know retention balloon pressure (RBP) and related factors. To identify rate of leakage incidence, relocation and perineal damage due to the device (PSD) and related risk factors.
Material and MethodsAn analytical observational, cross-sectional study conducted in a polyvalent ICU from June-December 2010 was performed. The sample included Flexi-Seal® carriers. Variables evaluated were patient and device use characteristics, RBP, leakage and quantity, relocation and reason, PSD, sedoanalgesia infusion, neuromuscular block, patient position, Flexi-Seal type catheter, ventilatory mode (VM), intra-abdominal pressure (IAP), mean intrathoracic pressure (MITP), PEEP, Glasgow, color-aspect, fecal consistency and volume. Significance P<.05.
ResultsTwenty-one patients were included, 52% male, aged 54±17 with 30 insertion episodes, Flexi-Seal-Signal® 33%, 10±8 days permanency, main indication 33% «diarrhea and injured skin»,” 30% device removal «intolerance and/or spontaneous expulsion». Median (Me) PGR =40; RI (61-19) cmH2O. Factors associated to higher PGR: SCI absence, prone-decubitus position, leakage, relocation, conventional Flexi-Seal®, MV, lower PEEP and IMP, Color-aspect, higher MITP. Leakage, relocation and PSD incidence density 43, 30 and 2 cases/100 days of catheter, respectively. Leakage and relocation risk factors: higher PGR, Glasgow and fecal volume, lower MITP, MV, assisted-spontaneous mode OR 2.5 CI (1.6-3.8) and OR 1.7(1.1-2.7), absence SCI OR 3.3 (2.2-5.1) and OR 2.4(1.5-3.8), absence neuromuscular block OR 2.4 (1.4-3.9) and OR 1.8 (1.1-3.1), Flexi-Seal® conventional OR 2.7(1.7-4.1) and OR 2 (1.2-3.3), respectively. Leakage risk factors: color-aspect, supine position, lower IMP and PEEP.
ConclusionsMonitoring RBP may alert us about leakage presence and relocation need. Knowing associated risk factors to RBP, leakage and relocation would help to develop strategies to reduce their high incidence rate such as decreasing RBP by reducing inflated volume.
La diarrea e incontinencia fecal transitoria constituyen un problema común que puede agravar patologías preexistentes, dificultar su tratamiento y empeorar el pronóstico de los pacientes1. Existen diversas definiciones de diarrea, pero una de las más aceptadas en el entorno del paciente crítico es la definición de diarrea asociada a nutrición enteral propuesta en el estudio COMGINE2,3. Según esta definición se considera que el paciente presenta diarrea si el número de deposiciones es igual o superior a 5 en un periodo de 24h o si el paciente presenta 2 deposiciones de un volumen estimado superior a 1.000ml/deposición en el mismo periodo.
El paciente crítico presenta una mayor susceptibilidad a padecer episodios de diarrea e incontinencia fecal aguda1,4, que suelen tener un origen desconocido o multifactorial debido a la alteración de la flora y de la motilidad gastrointestinal normal, al reposo intestinal prolongado, a la administración de nutrición enteral y a tratamientos farmacológicos, como son los antibióticos, que no siempre pueden interrumpirse. Su prevalencia en las UCI españolas se encuentra en torno al 6-4%5.
El primer paso para tratar de controlar la incontinencia fecal es identificar su origen6. Las 2 causas más frecuentes de incontinencia fecal aguda son la infección por Clostridium difficile7 y las complicaciones secundarias a la alimentación enteral8.
La incontinencia fecal es un factor de riesgo establecido para la aparición de úlceras por presión9–13,que aumentan la morbimortalidad, la duración de los tratamientos, la estancia hospitalaria y los costes14. Como tal se incluye en las herramientas existentes para identificar a los pacientes de riesgo de padecerlas15–17. Además también constituye un riesgo para la transmisión de infecciones nosocomiales, debido a la transmisión cruzada de Clostridium difficile18–22. Las úlceras por presión y las infecciones nosocomiales asociadas a la incontinencia fecal suponen un incremento de los costes indirectos, que se suman a los costes directos que ocasiona el consumo de recursos materiales y humanos23,24.
La incontinencia fecal y la diarrea provocan heces frecuentes y acuosas que sobrehidratan la piel, haciéndola más permeable. Este exceso de sobrehidratación conduce a un aumento del coeficiente de fricción25. El amoniaco liberado por las heces alcaliniza el manto ácido de la piel, lo que reactiva las enzimas digestivas presentes en las heces causantes de una mayor irritación26, apareciendo una piel tensa, dolorosa y eritematosa, clasificada como dermatitis por incontinencia27, que presenta un mayor riesgo de infección6,28. Además, los agentes tensoactivos de los jabones pueden actuar como irritantes ocasionando lesiones adicionales29 y la mayoría de los jabones de barra tienen un pH alcalino que puede exacerbar la dermatitis30. Todas estas alteraciones de la barrera protectora de la piel aumentan su fragilidad, maceración, excoriación y lesión, favoreciendo la aparición de las denominadas úlceras por humedad, que constituyen un gran desafío para el personal de enfermería debido a la dificultad de su diagnóstico frente a las úlceras por presión31.
En otras ocasiones el paciente puede presentar lesiones en la piel (úlceras por presión, heridas quirúrgicas, heridas traumáticas abiertas y quemaduras), ante las cuales se hace difícil su protección si el paciente tiene diarrea. La higiene del paciente y su movilización asociada también supone un problema y una posible fuente de importantes efectos adversos en el paciente crítico, especialmente en aquellos con inestabilidad hemodinámica, respiratoria y/o neurológica.
Por todas estas razones, el tratamiento de la incontinencia fecal debe constituir una prioridad en las UCI32. A pesar de ello, durante muchos años ha sido algo problemático debido a la elevada carga asistencial que supone mantener la comodidad del paciente, su dignidad y asegurar un óptimo cuidado de la piel, mediante la higiene y los cambios frecuentes de la ropa de cama. Como alternativa surge la posibilidad de realizar un sondaje rectal, con el fin de desviar el contenido fecal de forma efectiva. Para ello se han empleado dispositivos improvisados creados a partir de sistemas destinados a otros usos, con una seguridad poco definida33–35. Desde el año 2004 en España se comenzó a utilizar un novedoso sistema para el control de la eliminación fecal en pacientes con heces líquidas o semilíquidas, comercializado como sonda Flexi-Seal®. Este dispositivo consiste en un catéter de silicona blando, de aproximadamente 1m de largo, que insertado en el recto y fijado mediante un globo de retención de baja presión en su extremo distal se destina a contener y desviar el débito fecal a una bolsa colectora en su extremo proximal36,37. Tras 6 años en contacto con el dispositivo se ha adquirido experiencia en su manejo y difundido evidencia científica que muestra su eficacia38–46, y actualmente se trata de un cuidado estándar para el paciente crítico. Además recientemente se ha mejorado el diseño de esta sonda, con la incorporación de un testigo de hinchado óptimo del globo de retención, con el fin de solventar las dificultades que se han planteado durante estos años de su manejo, como son: la fuga de heces perisonda, la necesidad de recolocación y la existencia de lesiones asociadas al dispositivo. Estas situaciones implican un incremento del número de movilizaciones del paciente y disminuyen la eficacia del dispositivo.
La presión intraabdominal (PIA) se define como el estado de presión que hay en la cavidad abdominal, determinada por el índice de masa corporal, la posición, la actividad muscular de la pared y la respiración47. Debido a que el abdomen se comporta como un solo compartimento, la medición de la PIA puede ser determinada en cualquier parte de él: intraperitoneal, vesical, por útero, vena cava inferior, recto o estómago48. Actualmente se sabe que la medición de la PIA puede obtenerse de diferentes formas. Por medición directa, mediante la inserción de una cánula o aguja intraperitoneal conectada a un manómetro o transductor de presión; método que se emplea en procedimientos laparoscópicos47,48. Por medición indirecta de la presión en vena cava, mediante la inserción de una línea venosa central cuya punta esté a nivel de la vena cava inferior o por canulación de la vena femoral48,49. Por medición indirecta transvesical, mediante la inserción de una sonda vesical, o por medición indirecta transgástrica mediante la inserción de un catéter intragástrico con balón de aire47,50–55. El método gold estándar que se ha determinado para medir la PIA es la medición transvesical56–64, y aunque existen numerosos estudios que tratan de validar la medición de la PIA indirecta por diferentes métodos48–55, no existe evidencia de la medición de la PIA transrectal. Teniendo en cuenta que el dispositivo para control de la eliminación fecal se encuentra alojado en la ampolla rectal, dentro de la cavidad abdominal, nos planteamos la posibilidad de medir la PIA a través del dispositivo.
La importancia que tiene el control de la diarrea e incontinencia fecal en el paciente crítico, la utilidad que parece presentar la sonda Flexi-Seal® para su control, el interés por mejorar la eficacia del dispositivo y la curiosidad por explotar otros usos del mismo nos hicieron plantearnos los siguientes objetivos:
Describir las características generales de los pacientes portadores del dispositivo y las de su uso. Conocer la presión del globo de retención (PGR) y los factores que influyen sobre esta. Identificar la incidencia de fuga de heces perisonda, necesidad de recolocación y lesión perineal asociada al dispositivo (LAD) y los factores de riesgo de presentar cualquiera de estas situaciones. Evaluar las mejoras aportada por el testigo de llenado óptimo del dispositivo (Flexi-Seal-Signal®). Conocer la tolerancia del paciente consciente al dispositivo. Analizar la posibilidad de estimar la PIA a partir de la PGR del dispositivo Fexi-Seal®.
Se realizó un estudio observacional analítico longitudinal de junio a diciembre de 2010. El ámbito de estudio fue la UCI Polivalente de adultos del Hospital Universitario 12 de Octubre, que cuenta con 14 camas. La población objeto de estudio fueron todos los pacientes ingresados en la UCI durante los 7 meses del estudio en los que se insertó el dispositivo para control de la eliminación fecal, porque cumplían alguno de los siguientes criterios: pacientes con heces líquidas o semilíquidas en alguna de las siguientes situaciones; pacientes con 2 o más episodios de diarrea según la definición de diarrea asociada a nutrición enteral (más de 5 deposiciones en 24h o 2 deposiciones de 1.000cc cada una durante 24h); pacientes con diarrea secundaria a infección por Clostridium difficile; pacientes con lesiones secundarias a gangrena de Fournier; pacientes con lesiones en la piel, heridas quirúrgicas, úlceras por presión, quemaduras u otras lesiones en la zona de alcance de la incontinencia fecal; pacientes en decúbito prono y pacientes en los que las movilizaciones estén contraindicadas o conlleven un riesgo para su patología (inestabilidad hemodinámica, grave compromiso respiratorio y/o neurológico). Se utilizaron 2 tipos de dispositivos para el control de la eliminación fecal debido a la sustitución de la sonda Flexi-Seal® convencional por la Flexi-Seal-Signal® (modelo que incluye testigo de hinchado óptimo del globo de retención) en su comercialización. Durante los 3 primeros meses de estudio se utilizó Flexi-Seal® convencional, en el cuarto mes coexistió el uso de ambos tipos de sonda y durante los últimos 3 meses se empleó Flexi-Seal-Signal®. Se realizó un cuestionario de tolerancia del dispositivo a los portadores del mismo durante más de 24h que presentaban un Glasgow de 14-15. La medición de la PIA se efectuó en aquellos pacientes en los que el médico consideró necesaria su monitorización. Se excluyeron aquellos pacientes que no dieron su consentimiento para el uso confidencial de los datos de su historia clínica relacionados con el dispositivo.
VariablesLas variables estudiadas fueron: edad, sexo, peso, talla e índice de masa corporal, motivo de ingreso en UCI (patología respiratoria, neurológica, infecciosa, gastrointestinal, renal, intoxicaciones y cardíaca), tipo de sonda (Flexi-Seal® convencional, Flexi-Seal-Signal®), motivo de inserción del dispositivo, volumen de primer hinchado del globo de retención, días de permanencia del dispositivo, motivo de cambio del dispositivo, motivo de retirada del dispositivo, grado de integridad de la piel ante la retirada del dispositivo (según la clasificación por estadios de las úlceras por presión), tolerancia del paciente al dispositivo, volumen diario, consistencia y color-aspecto de heces recogidas por el dispositivo, PGR del dispositivo, valor absoluto de PIA transvesical, presión media intratorácica (PMI) y presión positiva al final de la espiración (PEEP) durante conexión a ventilación mecánica, Glasgow Coma Score, presencia de sedoanalgesia (SAP) y/o relajación en perfusión (RP) (categorizada su presencia como 1 y su ausencia como 2), modalidad ventilatoria, ventilación controlada o asistida-espontánea, posición del paciente (categorizada como 1 decúbito supino y como 2 decúbito prono), densidad de incidencia de fuga perisonda, recolocación y LAD, presencia de fuga perisonda, número de fugas perisonda, días transcurridos hasta primera fuga, cantidad de fuga (categorizada en escasa o <25cc, moderada o de 25-100cc y abundante >100cc), necesidad de recolocación, número de recolocaciones, días transcurridos hasta primera recolocación, motivo de recolocación, presión y volumen del globo de retención pre y posrecolocación, días transcurridos hasta aparición de LAD, grado de LAD (según la clasificación por estadios de las ulceras por presión) y localización de LAD.
InstrumentosMonitorización de la PGR mediante su medición a través del testigo de hinchado del globo de retención con manómetro de baja presión Portex®. Monitorización de la PIA con sistema de columna líquida Kit Abdo- Pressure®. Monitorización de PMI y PEEP a través de la ventilación mecánica. Entrevista con el paciente o la familia para la obtención de su peso y talla habitual. Historia clínica del paciente para obtención de las variables estudiadas. Observación directa para la medición del volumen diario, color y aspecto de las heces recogidos por el dispositivo. Registros de elaboración propia para recoger características de uso del dispositivo y variables de estudio. Cuestionario de tolerancia del paciente al dispositivo de elaboración propia ad hoc, que incluía: la escala verbal numérica para valorar el dolor en la región anal y 3 preguntas con 3 opciones de respuesta (mucha, poca o ninguna) para valorar la presión en la región anal, el tenesmo y el bienestar ocasionado por el dispositivo.
ProcedimientoDurante el diseño del estudio se actualizó el protocolo de cuidados del paciente con dispositivo para control de la eliminación fecal existente en la unidad. Se incluyó la monitorización y registro en gráfica de la PGR; la identificación y registro en gráfica de la presencia de fuga de heces perisonda (definiendo 3 categorías en función del volumen estimado, escasa o <25cc, moderada o entre 25 y 100cc y abundante o >100cc), de la necesidad de recolocación (estableciendo como criterios de recolocación: fuga moderada o abundante, expulsión espontánea, movilización-tracción de la sonda, cambio o retirada transitoria del dispositivo) y de la existencia de LAD (registrando fecha de aparición, estadio, localización y dimensiones). Para asegurar la difusión del protocolo entre la totalidad del personal de enfermería se realizaron 10 sesiones formativas de 20min de duración cada una, durante la jornada laboral.
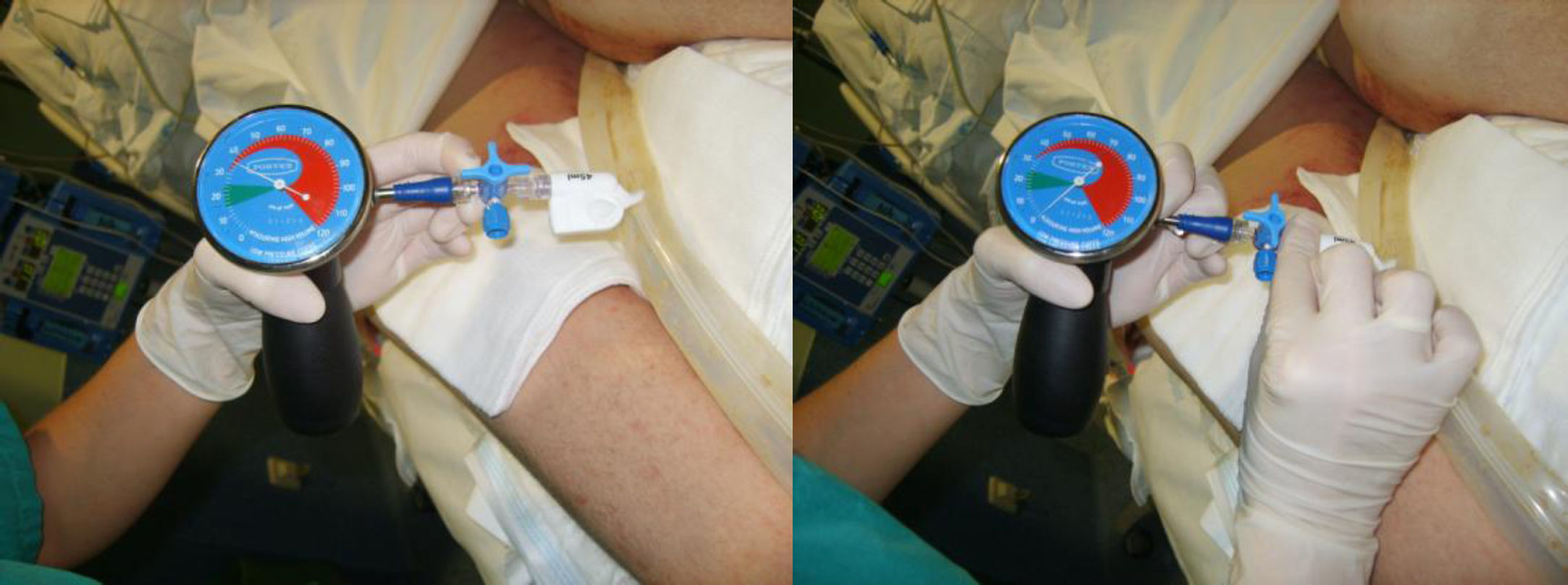
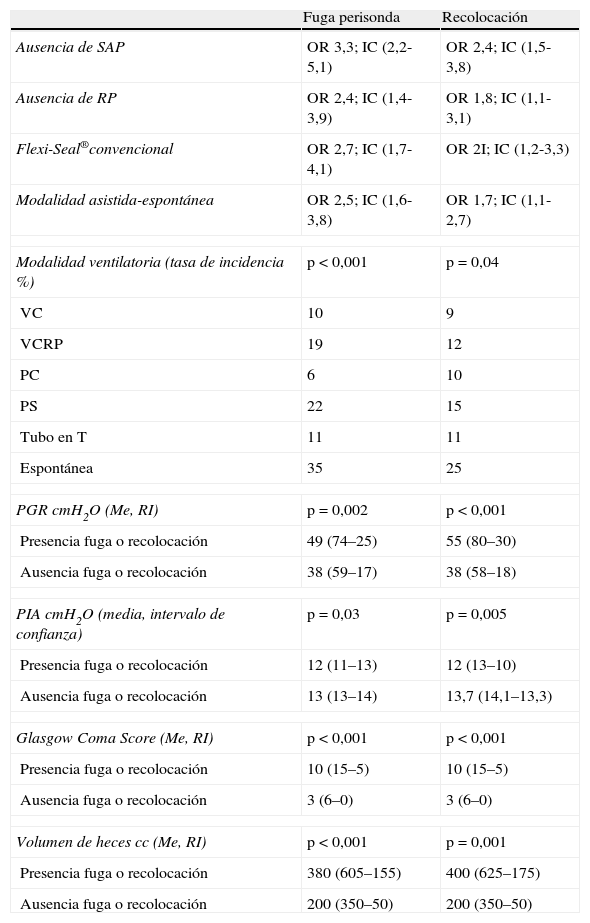
Para monitorizar la PGR del dispositivo se dejaba una llave de 3 pasos con un bioconector (tapón con válvula) purgada con agua destilada, conectada al testigo de hinchado del globo. Dicha llave se mantenía cerrada al testigo de hinchado del globo. La medición de la presión se realizaba conectando un manómetro de baja presión al bioconector de la llave, se abría la llave conectando el testigo de hinchado del globo con el manómetro y se obtenía el valor de PGR mínimo mantenido visualizado (fig. 1). Antes de desconectar el manómetro se cerraba la llave y luego se retiraba suavemente en posición vertical (llave abajo y manómetro arriba) para evitar la pérdida del agua del globo de retención. La medición de la PIA se obtenía a través de un sistema de columna líquida. Apertura del dispositivo de medición de PIA: se pinzaba para evitar que la orina mojara el filtro que incluye, se conectaba a la sonda vesical y con la diuresis del paciente el sistema se purgaba. Si el paciente estaba en anuria o con la vejiga muy deplecionada se introducían 25cc de solución salina al 0,9%. Se nivelaba el cero de la columna líquida a la altura de la sínfisis púbica línea media axilar y se abría la pinza que pone la columna en contacto con el aire. Cuando la columna se quedaba mantenida en un valor determinado con ligera fluctuación, se obtenía el valor de la PIA, valor mínimo visualizado de forma mantenida. Durante las mediciones de la PGR y la PIA la cama se colocaba a 0° respecto al eje, salvo que existiera grave compromiso respiratorio que lo impidiera.
El cuestionario de tolerancia del paciente al dispositivo se elaboró por consenso entre los miembros del equipo investigador.
Al incluir al paciente en el estudio, tras obtener el consentimiento informado, se abría un registro con: datos demográficos, datos relacionados con el ingreso, características generales del uso del dispositivo y cuestionario de tolerancia del paciente consciente al dispositivo, que se terminaba de completar cuando se retiraba el dispositivo. Diariamente se rellenaba un registro de valoración, en el que la variable volumen diario de heces recogidas por el dispositivo se registraba una vez al día, cuando se cerraba el balance, y el resto de las variables se cumplimentaban 3 veces al día. Cuando se producía un episodio de fuga, recolocación y/o LAD se rellenaba un registro de incidencias. El seguimiento del paciente y la recogida de datos se realizaban hasta que se retiraba el dispositivo; no se dio el alta a ningún paciente con el mismo. El tiempo máximo de permanencia del mismo dispositivo fue de 29 días, siguiendo las recomendaciones del fabricante. Las variables del estudio eran recogidas por los enfermeros responsables de los pacientes portadores del dispositivo en la gráfica de enfermería, según las indicaciones del protocolo y transcritos por el equipo investigador a los 3 registros, previamente definidos creados para el estudio, salvo el cuestionario de tolerancia, que era realizado por alguno de los enfermeros del equipo investigador. Los 3 registros se incluyeron en una base de datos en SPSS v15.0.
Consideraciones éticasSe obtuvo la aprobación del Comité Ético de Investigación Clínica del Hospital para la realización del estudio. Asimismo se obtuvo el consentimiento informado de los pacientes o familiares para su inclusión en el estudio. Los datos recogidos fueron tratados de forma anónima y completamente confidencial. Para ello, los datos fueron identificados mediante un código y solo los investigadores del estudio podían relacionar dichos datos con el paciente y con su historia clínica.
Análisis estadísticoLas variables cualitativas se describieron mediante su distribución de frecuencias, tanto de forma global como en los grupos considerados de interés. Las variables cuantitativas se resumieron mediante sus medidas de tendencia central (media o mediana), acompañadas de una medida de dispersión (desviación estándar o rango intercuartílico). Se exploró y comprobó la normalidad de las muestras de las variables estudiadas mediante el test de Kolmogorov-Smirnov. Para valorar los distintos factores relacionados con la PGR, fuga perisonda, recolocación, LAD y evaluar las mejoras aportadas por el testigo de llenado óptimo se utilizó el contraste t- Student cuando la variable cuantitativa asumía normalidad; en caso contrario se emplearon los contrastes no paramétricos de Mann-Whitney o Kruskal-Wallis según correspondieron. Cuando las variables eran cuantitativas se utilizó el coeficiente de correlación-Spearman y cuando las 2 variables eran cualitativas se empleó el test de χ2. Para analizar la posibilidad de estimar la PIA a partir de la PGR se estudiaron como posibles variables predictoras: SAP, RP, posición, tipo de sonda, modalidad ventilatoria, PGR, PMI, PEEP, Glasgow, color-aspecto, consistencia y volumen de heces. Las variables que resultaron significativas en el análisis bivariante, utilizando los contrastes anteriormente citados, se incluyeron en un modelo de regresión lineal final, eliminando aquellas variables que daban problemas de multicolinealidad en el modelo. Se consideraron estadísticamente significativas aquellas p<0,05. Los cálculos estadísticos se realizaron con el programa SPSS v15.0.
ResultadosSe incluyeron 21 pacientes, 52% (11) varones, con una edad media de 54±17 años. De los pacientes incluidos 15 presentaron un episodio de inserción, 4 presentaron 2, uno presentó 3 y otro 4, analizándose un total de 30 episodios de inserción. El motivo de ingreso de los pacientes incluidos en el estudio fue: patología respiratoria 7 casos (33%), patología neurológica 4 casos (19%), patología infecciosa 6 casos (28%), patología gastrointestinal 2 casos (10%), patología cardiaca un caso (5%) e intoxicación un caso (5%). Las características antropométricas de los pacientes incluidos fueron: peso 77±17 kg, talla 166±11cm e índice de masa corporal 27±5 kg/m2. En las tablas 1 y 2 se reflejan las características generales del uso del dispositivo, la fuga de heces perisonda, necesidad de recolocación y LAD, durante los 30 episodios de inserción. Durante la inserción del dispositivo 3 pacientes presentaron rectorragia, se retiró la sonda para realizar una colonoscopia, que en ninguno de los casos evidenció la presencia de lesión en la mucosa rectal responsable del sangrado. En un casó la colonoscopia objetivó sangrado en colon descendente con presencia de colitis isquémica y en los otros 2 no se identificó foco de sangrado activo; la rectorragia cedió al corregir la coagulopatía y trombocitopenia que los pacientes presentaban.
Características del uso del dispositivo durante los 30 episodios de inserción
| Tipo de sonda (frecuencia absoluta, relativa) | |
| Flexi-Seal® convencional | 20 (70%) |
| Flexi-Seal-Signal® | 10 (30%) |
| Motivo de inserción (frecuencia absoluta, relativa) | |
| Diarrea | 3 (10%) |
| Diarrea por Clostridium difficile | 2 (7%) |
| Diarrea más inestabilidad | 2 (7%) |
| Diarrea más lesión de la piel | 10 (33%) |
| Heces líquidas o semilíquidas e inestabilidad | 6 (20%) |
| Heces líquidas o semilíquidas y decúbito prono | 6 (20%) |
| Heces líquidas o semilíquidas y lesión de la piel | 1 (3%) |
| Volumen primer hinchado globo retención (mediana, rango intercuartílico) | 40 (45-35) |
| Días de permanencia (media±desviación típica) | 10±8 |
| Motivo de cambio (frecuencia absoluta, relativa) | |
| Permanencia de 29 días | 1 (25%) |
| Rotura testigo hinchado globo | 2 (50%) |
| Rotura testigo de irrigación | 1 (25%) |
| Motivo de retirada (frecuencia absoluta, relativa) | |
| Remisión de diarrea | 4 (13%) |
| Remisión diarrea y cicatrización de lesiones | 1 (3%) |
| Remisión de inestabilidad y de diarrea | 3 (10%) |
| Rotura de sonda | 1 (3%) |
| Rotura de sonda y remisión de inestabilidad | 1 (3%) |
| Intolerancia, molestia o expulsión espontánea | 9 (30%) |
| Exitus | 8 (27%) |
| Procedimientos diagnósticos | 3 (10%) |
| Grado integridad piel ante retirada (frecuencia absoluta, relativa) | |
| Piel íntegra | 16 (55%) |
| Grado I | 6 (21%) |
| Grado II | 5 (17%) |
| Grado III | 2 (7%) |
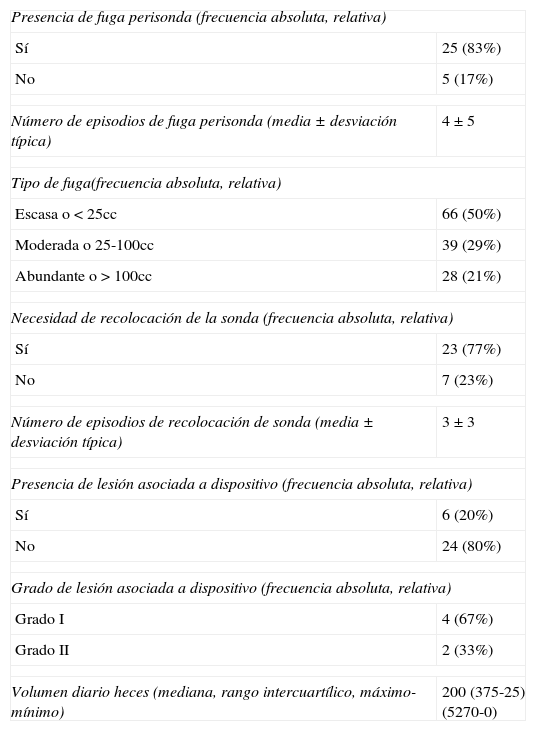
Fuga de heces perisonda, necesidad de recolocación y LAD durante los 30 episodios de inserción
| Presencia de fuga perisonda (frecuencia absoluta, relativa) | |
| Sí | 25 (83%) |
| No | 5 (17%) |
| Número de episodios de fuga perisonda (media±desviación típica) | 4±5 |
| Tipo de fuga(frecuencia absoluta, relativa) | |
| Escasa o <25cc | 66 (50%) |
| Moderada o 25-100cc | 39 (29%) |
| Abundante o >100cc | 28 (21%) |
| Necesidad de recolocación de la sonda (frecuencia absoluta, relativa) | |
| Sí | 23 (77%) |
| No | 7 (23%) |
| Número de episodios de recolocación de sonda (media±desviación típica) | 3±3 |
| Presencia de lesión asociada a dispositivo (frecuencia absoluta, relativa) | |
| Sí | 6 (20%) |
| No | 24 (80%) |
| Grado de lesión asociada a dispositivo (frecuencia absoluta, relativa) | |
| Grado I | 4 (67%) |
| Grado II | 2 (33%) |
| Volumen diario heces (mediana, rango intercuartílico, máximo-mínimo) | 200 (375-25) (5270-0) |
La integridad de la piel y la lesión asociada a dispositivo se categoriza según la clasificación por estadios de las úlceras por presión (grado i, grado ii, grado iii y grado iv.
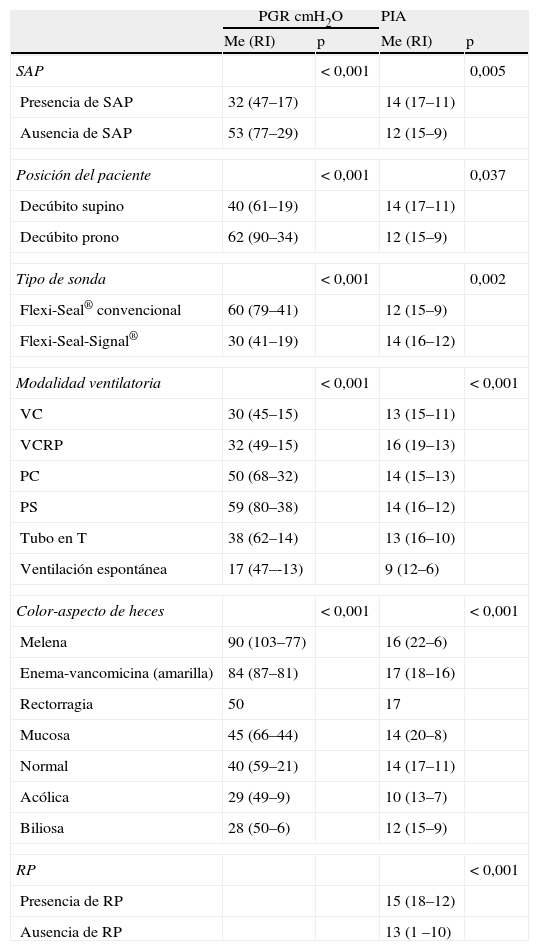
En el registro de valoración diaria, utilizado para conocer los factores asociados a la PGR, fuga perisonda y recolocación, se obtuvieron 625 mediciones de cada variable estudiada, correspondiendo el 48% a registros de la sonda Flexi-Seal-Signal®. La PGR presentó una mediana (Me) de 40cmH2O con un rango intercuartílico (RI) de (61-19) cmH2O. Los factores que influyeron significativamente sobre la PGR se reflejan en la tabla 3. La administración de relajantes neuromusculares en perfusión continua (RP), la ventilación controlada frente a la asistida-espontánea, la consistencia y el volumen de las heces recogidas por el dispositivo y el Glasgow del paciente no influyeron significativamente sobre la PGR.
Factores con influencia significativa sobre PGR y PIA
| PGR cmH2O | PIA | |||
| Me (RI) | p | Me (RI) | p | |
| SAP | <0,001 | 0,005 | ||
| Presencia de SAP | 32 (47–17) | 14 (17–11) | ||
| Ausencia de SAP | 53 (77–29) | 12 (15–9) | ||
| Posición del paciente | <0,001 | 0,037 | ||
| Decúbito supino | 40 (61–19) | 14 (17–11) | ||
| Decúbito prono | 62 (90–34) | 12 (15–9) | ||
| Tipo de sonda | <0,001 | 0,002 | ||
| Flexi-Seal® convencional | 60 (79–41) | 12 (15–9) | ||
| Flexi-Seal-Signal® | 30 (41–19) | 14 (16–12) | ||
| Modalidad ventilatoria | <0,001 | <0,001 | ||
| VC | 30 (45–15) | 13 (15–11) | ||
| VCRP | 32 (49–15) | 16 (19–13) | ||
| PC | 50 (68–32) | 14 (15–13) | ||
| PS | 59 (80–38) | 14 (16–12) | ||
| Tubo en T | 38 (62–14) | 13 (16–10) | ||
| Ventilación espontánea | 17 (47–-13) | 9 (12–6) | ||
| Color-aspecto de heces | <0,001 | <0,001 | ||
| Melena | 90 (103–77) | 16 (22–6) | ||
| Enema-vancomicina (amarilla) | 84 (87–81) | 17 (18–16) | ||
| Rectorragia | 50 | 17 | ||
| Mucosa | 45 (66–44) | 14 (20–8) | ||
| Normal | 40 (59–21) | 14 (17–11) | ||
| Acólica | 29 (49–9) | 10 (13–7) | ||
| Biliosa | 28 (50–6) | 12 (15–9) | ||
| RP | <0,001 | |||
| Presencia de RP | 15 (18–12) | |||
| Ausencia de RP | 13 (1 –10) | |||
| Rho | p | Rho | p | |
| PIA | 0,175 | 0,002 | ||
| PMI | -0,137 | 0,01 | 0,263 | <0,001 |
| PEEP | -0,238 | <0,001 | ||
| Glasgow | -0,328 | <0,001 |
Me: mediana; PC: presión control; PEEP: presión positiva al final de la espiración; PGR: presión del globo de retención; PIA: presión intraabdominal; PMI: presión media intratorácica; PS: presión soporte; RI: rango intercuartílico; RP: relajantes neuromusculares en perfusión; SAP: sedoanalgesia en perfusión continua; VC: volumen control; VCRP: volumen control regulado por presión.
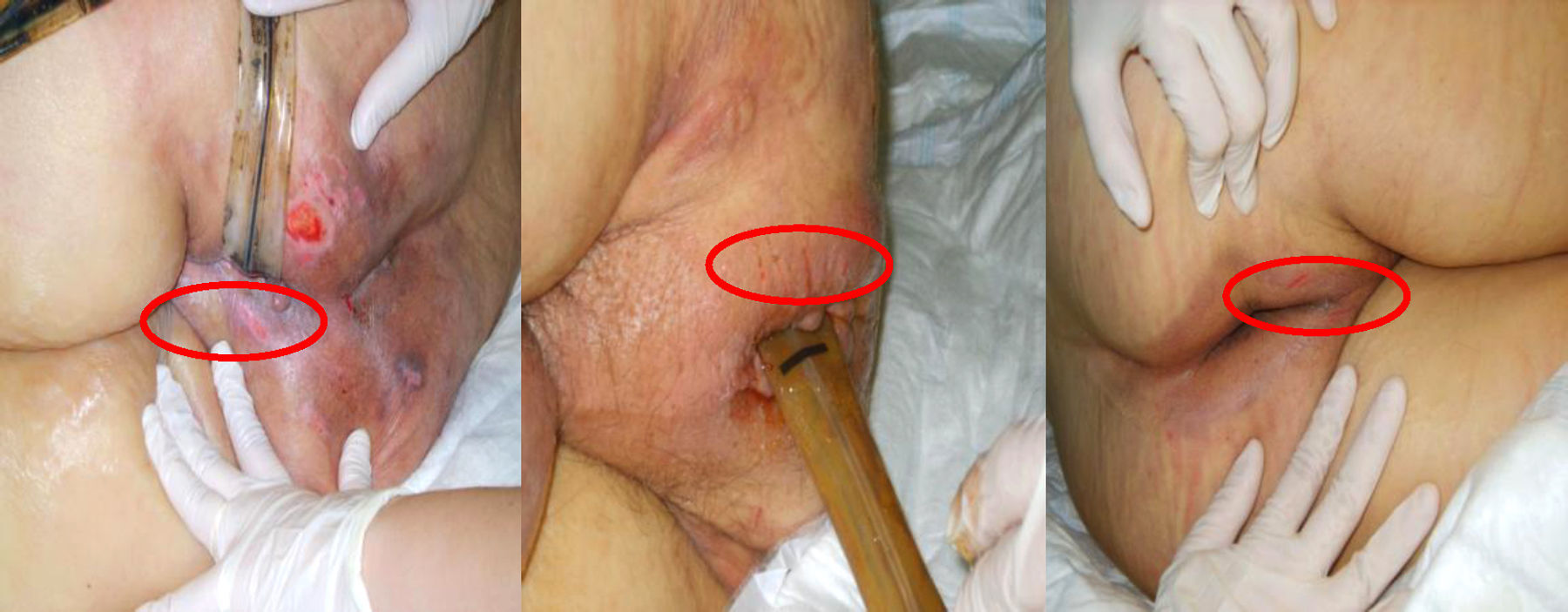
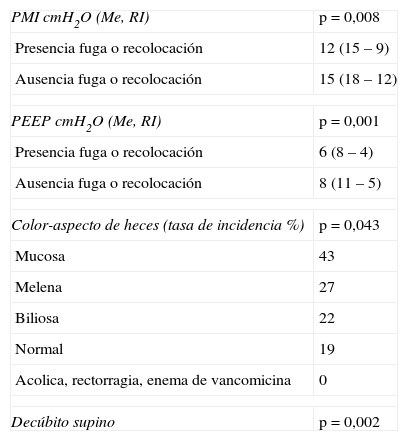
La densidad de incidencia de fuga, recolocación y LAD fue 43, 30 y 2 casos/100días, respectivamente. Los días transcurridos hasta la aparición de fuga perisonda y recolocación fueron 3±5 días y hasta la aparición de LAD 9±5 días. La localización de las lesiones perineales asociadas al dispositivo fue perpendicular al ano en 2 (33%) ocasiones, paralelas al ano en otras 2 (33%) y en continuidad con el ano, entre este y los genitales en otras 2 (33%) ocasiones (fig. 2). No se identificó significación estadística entre la presencia de fuga de heces perisonda, necesidad de recolocación, LAD y las siguientes variables: edad, sexo, peso, talla e índice de masa corporal. Los factores asociados significativamente a la presencia de fuga de heces perisonda y recolocación se reflejan en las tablas 4 y 5. Ningún paciente en decúbito prono presentó fuga de heces perisonda, por lo que parece que esta posición constituye un factor de protección frente a la fuga de heces perisonda. Los motivos de recolocación de la sonda fueron: expulsión espontánea 28 (30%), fuga perisonda 55 (60%), cambio de la sonda 2 (2%), movilización-tracción de la sonda 3 (3%), presencia de fuga más expulsión 3 (3%) y retirada transitoria del dispositivo 2 (2%). Cuando se produjo la expulsión espontánea del dispositivo, el volumen retirado del globo de retención fue de Me=30, RI (22-39)cc y la última PGR antes de la expulsión fue de Me=40, RI (39-49) cmH2O. La PGR prerrecolocación presentó una Me=42, RI (63-21) cmH2O; posrecolocación Me=58, RI (79-37) cmH2O, sin diferencia significativa (p=0,13); mientras que el volumen prerrecolocación presentó una Me=37, RI (52-22) cc y posrecolocación Me=39, RI (54-18) cc, con diferencia significativa p<0,001.
Factores asociados significativamente a la presencia de fuga de heces perisonda y recolocación del dispositivo
| Fuga perisonda | Recolocación | |
| Ausencia de SAP | OR 3,3; IC (2,2-5,1) | OR 2,4; IC (1,5-3,8) |
| Ausencia de RP | OR 2,4; IC (1,4-3,9) | OR 1,8; IC (1,1-3,1) |
| Flexi-Seal®convencional | OR 2,7; IC (1,7-4,1) | OR 2I; IC (1,2-3,3) |
| Modalidad asistida-espontánea | OR 2,5; IC (1,6-3,8) | OR 1,7; IC (1,1-2,7) |
| Modalidad ventilatoria (tasa de incidencia %) | p<0,001 | p=0,04 |
| VC | 10 | 9 |
| VCRP | 19 | 12 |
| PC | 6 | 10 |
| PS | 22 | 15 |
| Tubo en T | 11 | 11 |
| Espontánea | 35 | 25 |
| PGR cmH2O (Me, RI) | p=0,002 | p<0,001 |
| Presencia fuga o recolocación | 49 (74–25) | 55 (80–30) |
| Ausencia fuga o recolocación | 38 (59–17) | 38 (58–18) |
| PIA cmH2O (media, intervalo de confianza) | p=0,03 | p=0,005 |
| Presencia fuga o recolocación | 12 (11–13) | 12 (13–10) |
| Ausencia fuga o recolocación | 13 (13–14) | 13,7 (14,1–13,3) |
| Glasgow Coma Score (Me, RI) | p<0,001 | p<0,001 |
| Presencia fuga o recolocación | 10 (15–5) | 10 (15–5) |
| Ausencia fuga o recolocación | 3 (6–0) | 3 (6–0) |
| Volumen de heces cc (Me, RI) | p<0,001 | p=0,001 |
| Presencia fuga o recolocación | 380 (605–155) | 400 (625–175) |
| Ausencia fuga o recolocación | 200 (350–50) | 200 (350–50) |
IC: intervalo de confianza; Me: mediana; OR: odd ratio; PC: presión control; PGR: presión del globo de retención; PIA: presión intraabdominal; PS: presión soporte; RI: rango intercuartílico; RP: relajación neuromuscular en perfusión; SAP: sedoanalgesia en perfusión continua; VC: volumen control; VCRP: volumen control regulado por presión.
Factores asociados significativamente a la presencia de fuga de heces perisonda
| PMI cmH2O (Me, RI) | p=0,008 |
| Presencia fuga o recolocación | 12 (15 – 9) |
| Ausencia fuga o recolocación | 15 (18 – 12) |
| PEEP cmH2O (Me, RI) | p=0,001 |
| Presencia fuga o recolocación | 6 (8 – 4) |
| Ausencia fuga o recolocación | 8 (11 – 5) |
| Color-aspecto de heces (tasa de incidencia %) | p=0,043 |
| Mucosa | 43 |
| Melena | 27 |
| Biliosa | 22 |
| Normal | 19 |
| Acolica, rectorragia, enema de vancomicina | 0 |
| Decúbito supino | p=0,002 |
Me: mediana; PEEP: presión positiva al final de la espiración; PMI: presión media intratorácica; RI: rango intercuartílico.
El cuestionario de tolerancia del dispositivo se realizó a los 7 pacientes que alcanzaron un Glasgow mayor o igual a 14 mientras lo portaron, durante 9 episodios de inserción. En el 50% (4) de los episodios de inserción valorados se reflejó el dolor ocasionado por el dispositivo con puntuación 1 y en el 12,5% (1) se reflejó una puntuación de 2, 3, 7 y 8. La sensación de presión anal se contestó como ninguna durante el 33,3% (3) de los episodios de inserción valorados, poca presión en el 33,3% (3) y mucha presión en el 33,3% (3). El tenesmo rectal se manifestó como ninguno en un 11% (1), poco en un 67% (6) y mucho en un 22% (2). El dispositivo se consideró cómodo en el 56% (5) de los episodios de inserción valorados, poco incomodo en el 22% (2) y muy incómodo en el 22%(2).
La monitorización de la PIA se efectuó bajo indicación médica en 16 pacientes durante 20 episodios de inserción. Los factores que influyeron significativamente sobre la PIA se reflejan en la tabla 3. La variable modalidad ventilatoria dicotomizada en modalidad controlada y asistida-espontánea influyó significativamente sobre la PIA con una p<0,001, presentando los pacientes en modalidad controlada una PIA Me14:RI (17-11) versus asistida-espontánea PIA Me11:RI (14-8). Las variables predictoras de la PIA que resultaron significativas fueron: la PGR con una p=0,004, la SAP con p=0,002, la PMI y la posición del paciente con una p<0,001. El modelo de regresión lineal obtenido para estimar la PIA a partir de la PGR y del resto de variables predictoras fue el siguiente: PIA=9,62+0,03×PGR-0,38×PMI+4,75×posición - 2,13×SAP. Para el cálculo de esta ecuación, a la posición del paciente le correspondería un valor 1 cuando el paciente estuviera en decúbito supino y 2 en decúbito prono, y a la variable SAP un valor 1 cuando estuviera presente y 2 cuando no, tal cual se categorizaron ambas variables.
DiscusiónEl dispositivo para control de la eliminación fecal es relativamente novedoso y su conocimiento se encuentra en fase de caracterización fenomenológica, aunque fue comercializado en España en 2004. Existen escasas publicaciones sobre el dispositivo que incluyan amplias series de casos38; la mayoría de la evidencia refleja la experiencia de manejo con el dispositivo en casos aislados39–46 y no hay ningún artículo publicado que se haya planteado objetivos similares a los de este estudio. Tras la experiencia en el manejo del dispositivo durante estos años comienzan a identificarse las dificultades que se pueden plantear durante su uso y el conocimiento en profundidad de las mismas nos puede ayudar a elaborar estrategias de mejora y prevención para tratar de evitarlas.
El globo de retención del dispositivo Flexi-Seal® está diseñado para minimizar el daño en la mucosa rectal38. Se trata de un globo muy elástico volumétrico, que se recomienda hinchar con 40 cc de H2O, con un volumen de hinchado máximo que no debe superar 45 cc de H2O36. Al monitorizar la PGR nuestros resultados constatan este hecho, dado que la PGR obtenida presenta una mediana de 40cmH2O. Probablemente esta presión se mantendrá cuando el paciente esté relajado y no exista ningún factor que favorezca la modificación de la presión que las paredes de la ampolla rectal ejercen sobre el globo de retención, factores como los identificados en este estudio. La percepción que el paciente comienza a tener del dispositivo cuando desaparece el efecto de la sedoanalgesia en perfusión puede favorecer la contracción de la musculatura abdominopélvica como mecanismo de defensa para su expulsión y aumentar la PGR. Además este momento coincide con el destete de la VM, que se suele acompañar de la aparición de episodios frecuentes de tos, que aumentan la PIA, y de la existencia de presiones pulmonares más bajas, todos ellos factores asociados significativamente al aumento de la PGR en este estudio. Parece lógico que la presencia de problemas gastrointestinales que cursen con la emisión de heces patológicas también aumenten la PGR. Algo llamativo es la identificación de menor PGR en decúbito supino, posición en la que la región dorsal y sacra se ve sometida a mayor presión, frente al decúbito prono donde esta área queda libre, lo que puede hacernos pensar que la PGR se ve influida por la PIA, dado que en esta posición el abdomen se encuentra más comprimido y por tanto la PGR debería ser mayor. No obstante, teniendo en cuenta que una presión externa que sobrepase la presión capilar media (16-33mmHg) es suficiente para dañar un tejido si se mantiene de forma prolongada65–68 y que la presión recomendada para el hinchado del neumotaponamiento de los tubos orotraqueales o cánulas de traqueostomía, dispositivos invasivos que se puede asemejar a la sonda Flexi-Seal®, es de 20 a 30cmH2O69, consideramos elevada una PGR de 40cmH2O. Aunque en el estudio de Padmanabhan et al.38, se evidenciara la ausencia de lesión en la mucosa rectal antes y después de la inserción del dispositivo en 8 pacientes y en nuestra serie de casos la presencia de rectorragia no se haya relacionado con lesiones a este nivel, ya se han descrito casos aislados en los que el dispositivo lesionó la mucosa rectal, manifestándose con rectorragia70–72. En el estudio de Marchetti et al.73. el examen endoscópico, tras la retirada en pacientes sanos, de 3 tipos distintos de dispositivos para control de la eliminación fecal objetivó la presencia de anormalidades en la mucosa, con aparición de rotura capilar y hematomas. Por tanto, creemos necesaria la realización de estudios más amplios que permitan conocer la incidencia de estas lesiones y sus factores relacionados, como puede ser la existencia de una PGR elevada. La PGR también se ha medido en el estudio de Marchetti73 et al., observándose su comportamiento con diferentes volúmenes de hinchado del globo de retención, en distintas posiciones y en 3 tipos de dispositivos para control de la eliminación fecal. En este estudio, la PGR del dispositivo, hinchando el globo de retención con 15 cc de H2O, alcanzó cifras entorno a 75±8,2 cmH2O, una PGR más elevada que las obtenidas en nuestro estudio. Pero se trataba de voluntarios sanos que estaban conscientes durante toda la inserción del dispositivo. Por tanto percibían el dispositivo plenamente y podían tener más tendencia a su expulsión y a la utilización de la prensa abdominal para ello, situaciones ambas que aumentarían la PGR.
Durante el manejo del paciente portador del dispositivo Flexi-Seal® pueden surgir eventualidades, entre las que hemos identificado y nos gustaría destacar la presencia de fuga de heces perisonda, la necesidad de recolocación de la sonda y la LAD, puesto que incrementa las movilizaciones, siendo estas una fuente de efectos adversos y del malestar del paciente. A diferencia de la baja incidencia de fuga que se identificó en el estudio de Padmanabhan et al.38, en nuestro estudio llama la atención la elevada incidencia de fuga de heces perisonda, necesidad de recolocación del dispositivo y la existencia de numerosos factores de riesgo similares para ambas situaciones, puesto que el principal motivo de recolocación en nuestra serie de casos fue la fuga perisonda moderada o abundante. El conocimiento de estos factores nos permite identificar el perfil del paciente con mayor riesgo de presentar estas eventualidades, como es el paciente que no recibe SAP, ni RP, que tiene un mayor nivel de conciencia, que se encuentra en fase de destete de la ventilación mecánica, presenta una menor PIA, mayor volumen de heces evacuadas y mayor PGR. Los resultados que muestra este estudio indican que la ausencia de fuga perisonda y recolocación se produjo cuando la PGR presentaba una mediana inferior a 40 cmH2O. Probablemente esta sería una cifra que deberíamos evitar sobrepasar para prevenir la aparición de fuga y recolocación. Aunque esta afirmación no se puede dar de forma concluyente, debido a nuestro reducido tamaño muestral, sí podemos afirmar que la monitorización de la PGR y el conocimiento de los factores asociados a la misma, a la fuga de heces perisonda y a la recolocación del dispositivo nos pueden alertar frente a la presencia de estas 2 últimas. Aunque la presencia de fuga y la necesidad de recolocación se asocia a mayor PGR, hemos observado que cuando se recoloca la sonda en la práctica clínica se aumenta el volumen de hinchado del globo de retención y por tanto la PGR, lo que favorece aún más la presencia de fuga de heces perisonda y necesidad de recolocación. Por tanto, recomendamos como estrategia de mejora para tratar de disminuir la incidencia de fuga perisonda y de recolocación el descenso del volumen de hinchado del globo y de la PGR, cuando esta sea elevada (>40cmH2O), existan factores de riesgo para su presencia y más aún cuando se tenga que recolocar el dispositivo en estas situaciones. Además sería interesante la realización de estudios multicéntricos, con mayor tamaño muestral, que permitieran identificar el valor de la PGR óptima.
En nuestra serie de casos no se han identificado lesiones en la mucosa rectal asociadas al dispositivo al igual que en estudio de Padmanabhan et al.38, pero sí se han identificado lesiones por decúbito del dispositivo en la región perineal, con una incidencia de aparición a tener en cuenta, no descritas previamente en ninguna publicación salvo en la presentación de un caso durante el I Seminario Inter-hospitalario: manejo de la diarrea en el paciente crítico46. No hemos conseguido reconocer cuáles son sus factores de riesgo, pero tras este estudio se ha determinado como medida de prevención e incluido en el protocolo de manejo del dispositivo, la aplicación de ácidos grasos hiperoxigenados en la región perineal en los pacientes portadores del dispositivo.
Los resultados obtenidos en nuestro estudio nos sugieren que las mejoras aportadas por Flexi-Seal-Signal®, fundamentalmente la incorporación de un testigo de hinchado óptimo del globo de retención, parecen reducir la PGR, el riesgo de fuga de heces perisonda y de recolocación. Este testigo permite variar el volumen de hinchado del globo en función de las circunstancias del paciente o de la existencia de factores de riesgo para la fuga, recolocación y aumento de la PGR, ya que tenemos una orientación de la presión que existe en el globo de retención, aunque desconozcamos el volumen de agua que hay en su interior. Sin embargo, hemos observado que el manejo inicial de este testigo lleva implícito un aprendizaje, para saber identificar cuándo está normodistendido o cuándo se encuentra infradistendido o sobredistendido, situaciones estas 2 últimas que hay que tratar de evitar. Una de las limitaciones de este estudio es el desconocimiento, y por tanto el control, sobre la variable volumen de hinchado del globo de retención, puesto que esta variable solo se medía cuando se insertaba y recolocaba el dispositivo. Pero su control implicaría grandes dificultades para realizar un manejo confortable del dispositivo. Otra limitación de este estudio sería la ausencia de aleatorización de la inserción de la sonda Flexi- Seal® convencional o Flexi-Seal-Signal®. Aunque la sonda convencional se insertó en más pacientes que la Flexi-Seal-Signal®, los episodios de uso de esta última fueron más largos y por tanto se recogió un número similar de mediciones de las variables estudiadas de ambos modelos del dispositivo.
La buena tolerancia que el paciente consciente tiene del dispositivo ya ha sido documentada previamente38,73. Aunque en nuestra serie de casos se ha identificado mayor aparición de tenesmo rectal y molestias que en el estudio de Padmanabhan et al38, en general nuestros resultados también reflejan que el dispositivo Flexi-Seal®® es poco doloroso, provoca poco tenesmo rectal y no es muy incómodo para la mayoría de los pacientes conscientes que lo precisan.
En estudios previos se ha identificado el incremento de la PIA en pacientes con modalidades ventilatorias controladas y PEEP elevadas74 y el descenso de la misma cuando se administra sedoanalgesia y relajación a los pacientes75. Sin embargo, en este estudio se puede observar cómo la PIA es mayor en aquellos pacientes ventilados con modalidades controladas, con PMI más elevadas, que reciben SAP y RP, comportándose la PIA de forma antagónica con respecto a la PGR. Este hecho nos puede orientar sobre la importancia que tiene la percepción del paciente de la presencia del dispositivo en el aumento de la PGR, puesto que justo en estas situaciones, cuando el paciente está más sedado y comprometido, la PGR disminuye. Resulta extraño que en decúbito prono nuestros resultados muestren una PIA menor, debido a la compresión del abdomen en esta posición, pero hay que tener en cuenta que la medición transvesical de la misma se debe hacer en decúbito supino56–64 y en estos casos no fue posible. Además, la evidencia existente al respecto es bastante controvertida; hay estudios que refieren su aumento76 y otros que, sin embargo, demuestran su descenso en esta posición77–79. A pesar del comportamiento antagónico que la PIA tiene frente a la PGR ante la presencia de diversos factores, en nuestra serie de casos la PIA se pudo estimar a partir del valor de la PGR creando un modelo de regresión lineal. El incremento de la PIA se asocia a un aumento importante de la morbimortalidad80–82, por ello en estos últimos años se ha tratado de estandarizar la técnica para la medición de la PIA y de consensuar la definición de hipertensión intrabdominal y síndrome compartimental abdominal83, creándose con este propósito la Sociedad Mundial de Síndrome Compartimental Abdominal75,84. Pero la medición de la PGR en aquellos pacientes portadores del dispositivo para control de la eliminación fecal permitiría estimar la PIA sin necesidad de utilizar otro dispositivo específico para ello. No obstante, es cierto que se necesitan estudios más amplios, con mayor tamaño muestral, para confirmar la posibilidad de estimar la PIA a partir del la PGR y validar este nuevo método de medición de la PIA.
ConclusionesEl principal motivo de inserción del dispositivo fue la coexistencia de diarrea más lesión de la piel. Se trata de un dispositivo que no se suele mantener muchos días. Al indicarse en pacientes en los que las movilizaciones conllevan un riesgo para su patología o están contraindicadas, es decir pacientes muy inestables y graves, el motivo de retirada con frecuencia se debe al fallecimiento del paciente.
Consideramos que la PGR obtenida es elevada y se debería estudiar más en profundidad su repercusión sobre la mucosa rectal. El conocimiento de los factores que influyen en la PGR (como son: la presencia o ausencia de SAP, la posición del paciente, el tipo de sonda, la modalidad ventilatoria, el color-aspecto de las heces, la PIA, la PMI y la PEEP) y la monitorización de estos nos pueden alertar sobre la aparición de fuga y necesidad de recolocación.
La incidencia de fuga y recolocación es elevada y sus factores de riesgos similares. El conocimiento de los factores que aumentan la PGR y los factores de riesgo de fuga de heces perisonda y recolocación permitirá desarrollar estrategias para descender su elevada incidencia, como puede ser la disminución de la PGR reduciendo el volumen de hinchado.
Las mejoras aportadas por Flexi-Seal-Signal® reducen la PGR, la incidencia de fuga de heces perisonda y de recolocación.
La tolerancia del dispositivo Flexi-Seal® es difícil de valorar en el paciente crítico, porque pocos pacientes conscientes lo portan. Se trata de un dispositivo poco doloroso, que provoca poco tenesmo rectal y no es muy incómodo para la mayoría de los pacientes conscientes que lo precisan.
En nuestra serie de casos, el valor absoluto de la PGR no es un indicador directo de la PIA, pero a partir del modelo de regresión lineal creado se puede estimar su valor. Se necesitan más estudios para confirmar la posibilidad de estimar la PIA a partir del la PGR y validar este nuevo método de medición de la PIA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la colaboración desinteresada de Mercedes Catalán González (médico adjunto del Servicio de Medicina Intensiva UCI Polivalente), del Instituto de Investigación del Hospital Universitario 12 de Octubre, especialmente de Eva María Andrés (Bioestadística) y a todo el equipo asistencial (enfermeros, médicos, auxiliares de enfermería y celadores) de la UCI-Polivalente del Hospital Universitario Doce de Octubre por la ayuda prestada.