La transferencia de microbiota fecal (TMF) es un tratamiento eficaz y seguro para tratar la infección recurrente por Clostridioides difficile. Es esencial extremar esfuerzos para que la TMF se realice con rigor y en base a los conocimientos científicos. La selección del donante de microbiota fecal es un punto clave del proceso para garantizar la seguridad del receptor. Es necesario disponer de protocolos de actuación que permitan a los clínicos actuar con las máximas garantías y minimizar los riesgos del procedimiento. Por este motivo, en Cataluña se ha constituido un grupo de trabajo multidisciplinario con el objetivo de establecer unas recomendaciones para la selección del donante de microbiota fecal.
Fecal microbiota transplantation (FMT) is an effective and safe treatment to treat recurrent Clostridioides difficile infection. It is essential to make every effort to perform FMT rigorously and based on scientific knowledge. Selection of the fecal microbiota donor is a key point of the process to ensure recipient safety. It is necessary to have protocols of action that allow clinicians to act with the maximum guarantees and to minimize the risks of the procedure. For this reason, a multidisciplinary working group has been set up in Cataluña with the aim of establishing recommendations for the selection of the fecal microbiota donor.
En los últimos años la transferencia de microbiota fecal (TMF) ha emergido como el tratamiento de elección para tratar la infección recurrente por Clostridioides difficile (C. difficile), con tasas de curación global de entre el 85-90%1. Su eficacia ha quedado ampliamente demostrada en múltiples estudios no controlados y en varios ensayos clínicos2. Por ello, las principales guías de práctica clínica y sociedades médicas recomiendan la TMF como primera opción terapéutica en la infección por C. difficile recurrente3–7.
Los continuos avances en el conocimiento del microbioma intestinal humano han demostrado que existe una asociación entre la alteración de la microbiota intestinal y un amplio espectro de trastornos y/o enfermedades. Estos datos han suscitado un creciente interés en la comunidad científica para establecer el papel de la TMF en otras entidades distintas a la infección recurrente por C. difficile, como la enfermedad inflamatoria intestinal, el síndrome metabólico, la colonización intestinal por microorganismos multirresistentes, el síndrome de intestino irritable, etc.
La TMF se considera un procedimiento seguro, bien tolerado y prácticamente sin efectos adversos a corto plazo si se realiza de forma correcta. Sin embargo, la evidencia disponible en cuanto a seguridad a largo plazo es limitada. Por este motivo, es esencial establecer protocolos de actuación que permitan a los clínicos actuar con las máximas garantías y minimizar los riesgos del procedimiento.
La pandemia causada por el virus SARS-CoV-2 causante de la COVID-19 obliga a los profesionales a tomar medidas adicionales para la selección del donante de microbiota fecal. Varios estudios han documentado la presencia de ARN del virus SARS-CoV-2 en heces8,9, hecho que implica un potencial riesgo de transmisión del virus vía fecal-oral. En el presente documento de posicionamiento se establecen una serie de recomendaciones para minimizar el riesgo de contagio de la COVID-19 mediante TMF, que se irán perfeccionando a medida que avancen los conocimientos científicos en este campo.
Con este objetivo, se ha constituido un grupo de trabajo multidisciplinar formado por especialistas en digestología, enfermedades infecciosas, microbiología y endocrinología, con el objetivo de establecer unas recomendaciones que sirvan para la práctica rigurosa de esta modalidad terapéutica y, al mismo tiempo, ofrecer una guía sobre la metodología a seguir.
Selección del donanteLa selección del donante debe ser rigurosa para garantizar la seguridad del procedimiento. El cribado del donante es vital para prevenir la transmisión de enfermedades infecciosas. Existe además el riesgo teórico de que la TMF module la susceptibilidad del receptor a presentar condiciones o enfermedades vinculadas con la microbiota intestinal. Con el objetivo de minimizar estos riesgos, previo a la donación, cada candidato potencial será sometido a una entrevista personal y a un análisis clínico que incluirá un estudio de sangre y de heces, entre otros.
Hoja informativa para el donanteTodas las personas que entren en el proceso de selección de donantes serán informadas del funcionamiento del proceso y de la finalidad de su aportación. Para ello, se les entregará un documento informativo que garantiza la confidencialidad y la protección de los datos personales. Posteriormente se les pedirá que firmen un consentimiento informado. En el anexo 1 (ver material adicional) se adjunta un ejemplo de la hoja informativa para el donante.
Entrevista personal y exploración físicaLa seguridad del receptor es la principal preocupación, por ello, el donante será descartado si en la entrevista personal y/o en la exploración física del voluntario se detectan antecedentes médicos relevantes, comportamientos que se asocien un aumento del riesgo de contraer enfermedades transmisibles o signos que sugieran una enfermedad activa. En la entrevista personal se debe facilitar a todos los donantes los datos de contacto de los responsables del programa de TMF para que puedan notificar de forma inmediata cualquier cambio en los síntomas u otros cambios relevantes que puedan presentar durante el período de selección y donación. En el anexo 2 (ver material adicional) se adjunta un ejemplo del cuestionario a realizar en la entrevista personal.
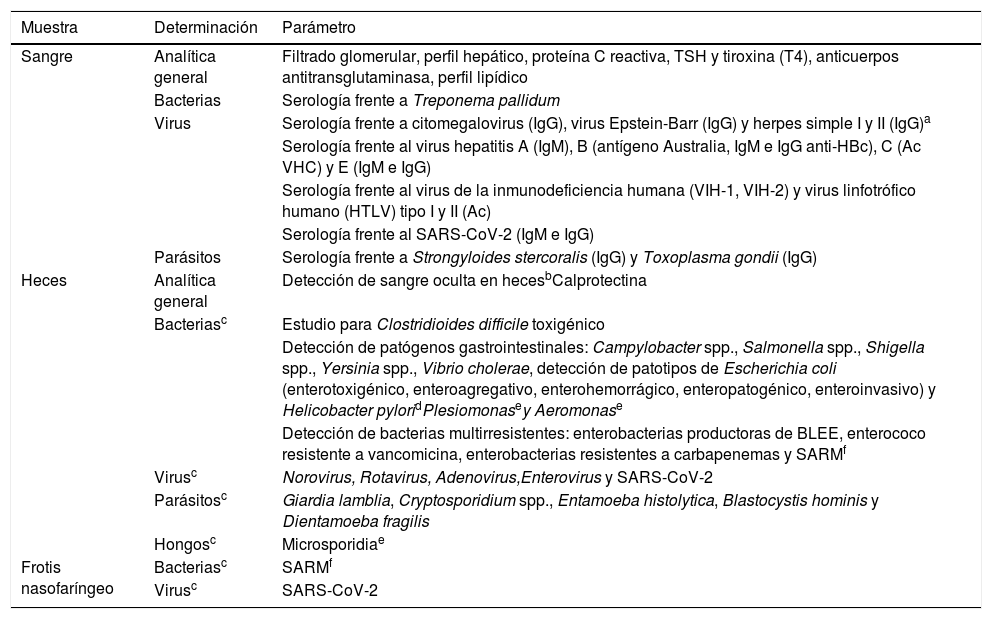
Determinaciones analíticasTras realizar la entrevista personal debe realizarse un estudio analítico de cribado. En la tabla 1 se detallan las determinaciones que se consideran imprescindibles. Según el contexto clínico del receptor (pacientes con inmunosupresión), pueden evaluarse microorganismos que, a pesar de ser altamente infrecuentes, pueden ser potencialmente patógenos. El estudio de donantes de otras nacionalidades debe adaptarse a la epidemiología del país de origen (p. ej., frente a Trypanosoma cruzi o Schistosoma). El número de entidades incluidas en la lista podrá actualizarse en función del conocimiento y la experiencia que se vaya adquiriendo con la TMF.
Analítica de cribado a realizar en todos los potenciales donantes de heces
| Muestra | Determinación | Parámetro |
|---|---|---|
| Sangre | Analítica general | Filtrado glomerular, perfil hepático, proteína C reactiva, TSH y tiroxina (T4), anticuerpos antitransglutaminasa, perfil lipídico |
| Bacterias | Serología frente a Treponema pallidum | |
| Virus | Serología frente a citomegalovirus (IgG), virus Epstein-Barr (IgG) y herpes simple I y II (IgG)a | |
| Serología frente al virus hepatitis A (IgM), B (antígeno Australia, IgM e IgG anti-HBc), C (Ac VHC) y E (IgM e IgG) | ||
| Serología frente al virus de la inmunodeficiencia humana (VIH-1, VIH-2) y virus linfotrófico humano (HTLV) tipo I y II (Ac) | ||
| Serología frente al SARS-CoV-2 (IgM e IgG) | ||
| Parásitos | Serología frente a Strongyloides stercoralis (IgG) y Toxoplasma gondii (IgG) | |
| Heces | Analítica general | Detección de sangre oculta en hecesbCalprotectina |
| Bacteriasc | Estudio para Clostridioides difficile toxigénico | |
| Detección de patógenos gastrointestinales: Campylobacter spp., Salmonella spp., Shigella spp., Yersinia spp., Vibrio cholerae, detección de patotipos de Escherichia coli (enterotoxigénico, enteroagregativo, enterohemorrágico, enteropatogénico, enteroinvasivo) y Helicobacter pyloridPlesiomonasey Aeromonase | ||
| Detección de bacterias multirresistentes: enterobacterias productoras de BLEE, enterococo resistente a vancomicina, enterobacterias resistentes a carbapenemas y SARMf | ||
| Virusc | Norovirus, Rotavirus, Adenovirus,Enterovirus y SARS-CoV-2 | |
| Parásitosc | Giardia lamblia, Cryptosporidium spp., Entamoeba histolytica, Blastocystis hominis y Dientamoeba fragilis | |
| Hongosc | Microsporidiae | |
| Frotis nasofaríngeo | Bacteriasc | SARMf |
| Virusc | SARS-CoV-2 |
BLEE: beta-lactamasas de espectro extendido; SARM: Staphylococcus aureus resistente a meticilina; SARS-CoV-2: severe acute respiratory syndrome coronavirus 2; TSH: prueba de la tirotropina.
El donante será un candidato elegible si las respuestas al cuestionario indican que no tiene ningún riesgo, la detección de patógenos es negativa y los estudios adicionales no indican ninguna enfermedad relevante. Es imprescindible formar a los donantes durante la entrevista inicial para que informen al equipo médico sobre cualquier cambio en su estado de salud durante el período de la donación.
Una vez superado el proceso de selección, el donante podrá aportar todas las donaciones (deposiciones) que desee durante un periodo de 2 semanas. En caso de que el voluntario desee proseguir con las donaciones, será preciso repetir la analítica de cribado en heces cada 2 semanas y la analítica de sangre y frotis nasofaríngeo cada 2 meses, de acuerdo con lo establecido en la tabla 1.
Para garantizar la seguridad de los receptores, como medida adicional se recomienda mantener la donación en cuarentena durante un periodo de entre 2 y 8 semanas para confirmar que el voluntario no ha presentado ningún cambio de salud relevante en las semanas posteriores a la última donación9. Esta medida pretende detectar aquellas infecciones que se encuentran en un período ventana o que no se hubieran detectado en el estudio inicial.
Criterios de exclusión del donanteLos donantes serán descartados si se detectan factores de riesgo de transmisión de agentes infecciosos u otras características que puedan repercutir en la salud del receptor.
A día de hoy se desconoce cuál es la composición ideal de la microbiota intestinal del donante para que la TMF sea eficaz, de manera que los donantes son seleccionados por un principio de exclusión más que de inclusión. Debe tenerse en cuenta, que si el cribado se realiza correctamente, solo una minoría podrán finalmente ejercer como donantes10.
Criterios de exclusión del donante- •
Edad inferior a 18 años o mayor de 50 años.
- •
Haber tomado antimicrobianos (antibióticos, antivirales, antifúngicos) o probióticos en los 6 meses previos a la donación.
- •
Resultado positivo de cualquier patógeno determinado en el estudio microbiológico de sangre y heces durante el período de cribado (tabla 1).
- •
Hábito tabáquico (>10 cigarrillos/día).
- •
Presentar fiebre o síntomas digestivos (diarrea, náuseas, vómitos, estreñimiento, dolor abdominal, etc.).
- •
Presentar antecedentes médicos relevantes (neoplasia, enfermedades transmisibles) y, en concreto, historia de enfermedades gastrointestinales, incluyendo enfermedad inflamatoria intestinal, enfermedad celíaca, síndrome del intestino irritable, estreñimiento crónico, diarrea crónica, historia previa de infección por C. difficile y/o hemorragia digestiva.
- •
Historia de enfermedades autoinmunes (ejemplo: esclerosis múltiple, enfermedades del tejido conectivo, diabetes mellitus tipo 1), de enfermedades relacionadas con la atopia, asma, otros tipos de diabetes mellitus, tratamiento actual con agentes inmunomoduladores, historia de síndromes de dolor crónico (ejemplo: fibromialgia, fatiga crónica), de trastornos neurológicos o del desarrollo neurológico, trastornos psiquiátricos, síndrome metabólico (NCEP ATP III criteria), obesidad (índice de masa corporal >30kg/m2), o malnutrición (índice de masa corporal <18,5kg/m2).
- •
Historia familiar de: cáncer colorrectal, síndrome de poliposis, enfermedad inflamatoria intestinal, enfermedad celíaca o enfermedades autoinmunes.
- •
Consumo de drogas ilícitas.
- •
Tomar medicación que pueda ser excretada por las heces, que pueda significar un riesgo para el receptor o que pueda provocar cambios en la microbiota intestinal o disbiosis (inhibidores de la bomba de protones).
- •
Presentar comportamientos asociados a un aumento del riesgo de contraer enfermedades transmisibles:
- –
Comportamiento sexual de riesgo: relaciones sexuales en los últimos 6 meses con: parejas anónimas, con múltiples parejas, con portadores del VIH, personas que se hayan administrado drogas por vía intravenosa, personas que ejerzan o hayan ejercido la prostitución.
- –
Tatuaje, piercing y/o acupuntura en los últimos 6 meses.
- –
Historia actual o previa de encarcelamiento.
- –
Viaje reciente (6 meses) a países tropicales, países con enfermedades diarreicas endémicas o de alto riesgo de diarrea del viajero (África, Sudeste asiático, México, Centroamérica, Sudamérica, Caribe).
- –
Accidente reciente por pinchazo de aguja.
- –
Haber recibido derivados sanguíneos en los últimos 6 meses.
- –
Haber recibido vacunas atenuadas y/o vivas en los últimos 6 meses.
- –
Individuos que trabajen con animales (disminuir riesgo de trasmisión de zoonosis).
- •
Presentar factores de riesgo de colonización por microorganismos multirresistentes:
- –
Trabajadores sanitarios.
- –
Personas en contacto con el sistema sanitario definido como: hospitalización reciente, ingreso reciente en centros de larga estancia, asistencia regular a hospitales de día y/o cirugía ambulatoria.
- •
Cirugía mayor gastrointestinal.
- •
Cirugía mayor no gastrointestinal en los últimos 4 meses (neumonectomía, intervención cardíaca o cirugía torácica, fractura grave (fémur, pelvis, etc.), prótesis articular (cadera, rodilla, etc.).
- •
Presentar factores de riesgo de la enfermedad de Creutzfeldt-Jakob (encefalopatía espongiforme).
- •
Presentar una infección confirmada (PCR) o sospecha clínica (fiebre, fatiga, tos seca, mialgias, disnea y/o cefalea) de infección por SARS-CoV-2.
- •
Contacto con un paciente infectado por SARS-CoV-2 o con sospecha clínica de infección en las últimas 4 semanas.
Varios estudios han documentado la presencia de ARN del virus SARS-CoV-2 en heces y su detección puede mantenerse incluso tras la negativización de las muestras respiratorias8,9. Este hecho implica un potencial riesgo de transmisión del SARS-CoV-2 por vía fecal-oral. Para minimizar el riesgo de trasmitir la COVID-19 con el TMF, además de las pruebas específicas establecidas en la tabla 1, se recomiendan las siguientes medidas:
- A.
Una persona que haya presentado la COVID-19 (confirmada microbiológicamente o con sospecha clínica) no podrá ser valorado como posible donante hasta pasadas 12 semanas de la resolución de la infección.
- B.
Una persona que haya estado en contacto con un caso de COVID-19 (confirmado microbiológicamente o con sospecha clínica) no podrá ser valorado como posible donante hasta pasadas 4 semanas del contacto.
- C.
La presencia de síntomas o cualquier resultado microbiológico positivo descarta al candidato, así como a todas las muestras que haya podido entregar en las últimas 4 semanas previas al diagnóstico clínico y/o microbiológico.
- D.
Los voluntarios asintomáticos con IgG positiva y el resto de pruebas negativas, serán considerados candidatos aptos para la donación de heces.
Los autores declaran no tener ningún conflicto de intereses.
Xavi Aldeguer. Servicio de Aparato Digestivo. Hospital Universitario de Girona Doctor Josep Trueta.
Francesc Balaguer. Servicio de Aparato Digestivo. Hospital Clínic de Barcelona.
Xavier Bessa i Caserras. Servicio de Aparato Digestivo. Hospital del Mar.
Natalia Borruel Sáinz. Servicio de Aparato Digestivo. Hospital Universitario Vall d’Hebrón.
Xavier Calvet Calvo. Servicio de Aparato Digestivo. Hospital Universitario Parc Taulí.
Antoni Castells. Servicio de Aparato Digestivo. Hospital Clínic de Barcelona. Presidente de la Sociedad Catalana de Digestología.
Guillermo Cuervo. Servicio de Enfermedades Infecciosas. Hospital Universitario de Bellvitge.
Maria Esteve Comas. Servicio de Aparato Digestivo. Hospital Universitario Mútua Terrassa.
Francisco Guarner Aguilar. Servicio de Aparato Digestivo. Hospital Universitario Vall Hebrón.
Jose Manuel Hernández Real. Servicio de Endocrinología. Hospital Universitario de Girona Doctor Josep Trueta.
Juan P Horcajada. Servicio de Enfermedades Infecciosas. Hospital del Mar.
Joaquin Lopez-Contreras González. Servicio de Enfermedades Infecciosas. Hospital de la Santa Creu i Sant Pau.
Marc Llirós Dupré. Institut de Investigación Biomédica de Girona (IdIBGi).
Míriam Mañosa i Ciria. Servicio de Aparato Digestivo. Hospital Universitario Germans Trias i Pujol.
Lurdes Matas Andreu. Servicio de Microbiología Clínica. Hospital Universitario Germans Trias i Pujol.
Ferran Navarro Risueño. Servicio de Microbiología Clínica. Hospital de la Santa Creu i Sant Pau.
Roger Paredes. Servicio de Enfermedades Infecciosas. Hospital Universitario Germans Trias i Pujol.
Virginia Rodríguez-Garrido. Servicio de Microbiología Clínica. Hospital Universitario Vall d’Hebrón.
José R. Santos. Servicio de Enfermedades Infecciosas. Hospital Universitario Germans Trias i Pujol.
Nieves Sopena Galindo. Servicio de Enfermedades Infecciosas. Hospital Universitario Germans Trias i Pujol.
German Soriano Pastor. Servicio de Aparato Digestivo. Hospital de la Santa Creu i Sant Pau.
Judith Villar-Garcia. Servicio de Enfermedades Infecciosas. Hospital del Mar.