Existe un creciente aumento de las infecciones de prótesis articular (IPA) por bacterias resistentes a las cefalosporinas utilizadas en la profilaxis quirúrgica. La sustitución de estas por glucopéptidos no ha demostrado mejorar los resultados pero sí su asociación.
MétodosEstudio comparativo de la asociación de teicoplanina y cefazolina antes de la cirugía de artroplastia frente a cefazolina sola de un grupo control previo.
ResultadosEn el periodo control hubo 16 IPA de 585 cirugías, mientras que en el grupo de intervención fueron 6 de 579 (incidencia 2,7% vs. 1,03%; RR 0,4, p=0,04). En el grupo control, 11 de las infecciones fueron causadas por bacterias grampositivas frente a 4 en el de intervención (1,8% vs. 0,7%, p=0,08).
ConclusionesLa adición de teicoplanina a cefazolina en la profilaxis de la cirugía de artroplastia se asoció a una reducción de la incidencia de IPA, a expensas de un descenso de las causadas por grampositivos.
There is a growing increase in prosthetic joint infection (PJI) incidence due to cephalosporin-resistant bacteria, used in surgical prophylaxis. The replacement of these with glycopeptides has not been shown to improve the results, but they have been shown to improve with their combination.
MethodsComparative study of combination of teicoplanin and cefazolin before arthroplasty surgery against cefazolin alone from a previous control group.
ResultsDuring the control period, there were 16 PJIs from 585 surgeries, while in the intervention group there were 6 from 579 (incidence 2.7% vs. 1.03%, RR 0.4, P=.04). In control group, 11 of the infections were caused by Gram-positive bacteria versus 4 in the intervention group (1.8% vs. 0.7%, P=.08).
ConclusionsThe addition of teicoplanin to cefazolin in the prophylaxis of arthroplasty surgery was associated with a reduction in the incidence of PJI, thanks to a decrease in infections caused by Gram-positive bacteria.
La profilaxis antibiótica preoperatoria con cefalosporinas ha demostrado su eficacia en la prevención de la infección de prótesis articular (IPA) y su utilización se recomienda en todas las guías de profilaxis quirúrgica1. A pesar de ello el número de IPA ha ido en aumento, por el cada vez mayor número de procedimientos que se realizan, en población cada vez más añosa y con mayor comorbilidad, y cada vez más por bacterias resistentes a estos antibióticos, fundamentalmente Staphylococcus spp., tanto Staphylococcus aureus (S. aureus) como coagulasa negativos2,3. Debido a esta razón, se ha evaluado la posibilidad de utilizar como profilaxis glucopéptidos en lugar de cefalosporinas, lo cual no ha demostrado ser efectivo, pues el beneficio de conseguir un descenso de las infecciones por grampositivos es compensado por una mayor tasa de infecciones por gramnegativos4.
En nuestro centro, la profilaxis preoperatoria se realizaba con una dosis única de cefazolina. Sin embargo, el 47% de las IPA eran provocadas por bacterias resistentes a esta. Diversos estudios que han evaluado la asociación de cefalosporina con glucopéptido como profilaxis en la cirugía de artroplastia han mostrado una reducción de las tasas de IPA, a expensas fundamentalmente de las provocadas por grampositivos5,6, por lo que desde el 1 de junio del 2015 se modificó el protocolo de profilaxis quirúrgica en la cirugía de artroplastia electiva añadiendo una dosis preoperatoria de teicoplanina a la cefazolina.
El objetivo de este estudio es evaluar la eficacia y la seguridad de este cambio de profilaxis antibiótica en la cirugía de artroplastia primaria electiva de rodilla y cadera.
MétodoEstudio comparativo de intervención antes-después. Se analizó a los pacientes a los que, desde el 1 de junio del 2015 hasta el 31 de mayo del 2017, se les administró una dosis de 800mg de teicoplanina y 2 g de cefazolina antes de la cirugía de artroplastia primaria electiva de cadera y rodilla. Se utilizó como grupo control a los pacientes intervenidos en los 2 años anteriores, en los que solo se utilizaba una dosis única de cefazolina. La intervención fue aprobada por la Comisión de Enfermedades Infecciosas y Política Antibiótica del hospital.
En ambos periodos los pacientes siguieron un protocolo de descontaminación selectiva de S. aureus antes de la cirugía, implementado en nuestro centro desde 20117, además de las medidas habituales de prevención de la herida quirúrgica.
Se excluyó a los pacientes alérgicos a betalactámicos y glucopéptidos, y también las cirugías de recambio de prótesis y las no electivas por fractura de cadera.
Se registraron las variables demográficas de los pacientes, los principales factores de riesgo de IPA, la aparición de eventos adversos tras la infusión de los antibióticos y el desarrollo de complicaciones postoperatorias como daño renal agudo o infección por Clostridium difficile (C. difficile). Definimos el daño renal agudo como un incremento de 0,3mg/dl en los niveles de creatinina o 1,5 veces el valor basal, según los criterios de la Acute Kidney Injury Network8. Se definió la IPA según los últimos criterios publicados9 y se contabilizaron como casos de la misma aquellos que se manifestaron en los primeros 12 meses después de la implantación de la prótesis.
Análisis estadísticoLa descripción de las variables cuantitativas se realizó con la media y su intervalo de confianza (IC) del 95%. Las variables categóricas las describimos con su número, porcentaje e IC del 95%. Las diferencias de medias las analizamos mediante la prueba de la t de Student y el análisis de las variables categóricas mediante el cálculo del riesgo relativo (RR). La significación estadística se estableció en p<0,05. Todos los cálculos se realizaron con el paquete estadístico SPSS 15.0 (Chicago, EE. UU.).
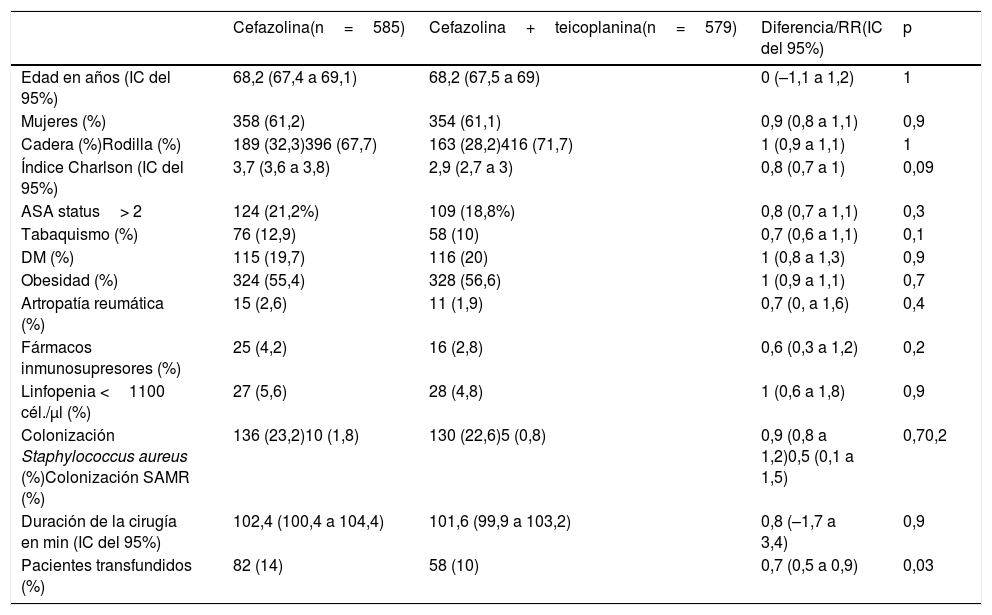
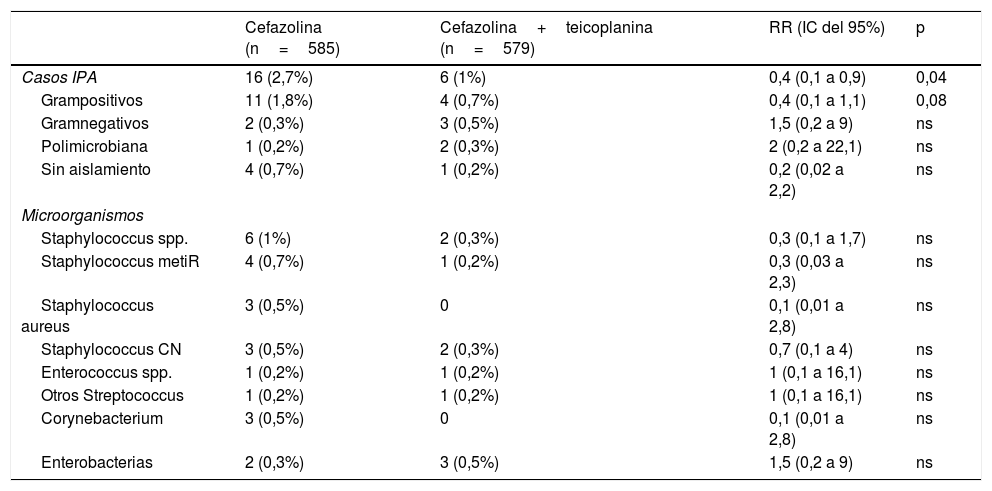
ResultadosEn el periodo control se realizaron 585 cirugías, de las que 16 (2,7%) desarrollaron IPA, mientras que en el grupo de intervención se incluyeron 579 pacientes con la pauta teicoplanina-cefazolina, de los cuales 6 (1%) se complicaron con IPA (RR 0,4, IC del 95%, 0,1 a 0,9, p=0,04). En la tabla 1 se muestran los datos demográficos y los principales factores de riesgo para IPA de ambos grupos. En la tabla 2 se muestran los agentes etiológicos de IPA de cada grupo.
Comparativa de pacientes en grupo control (cefazolina) e intervención (cefazolina+teicoplanina)
| Cefazolina(n=585) | Cefazolina+teicoplanina(n=579) | Diferencia/RR(IC del 95%) | p | |
|---|---|---|---|---|
| Edad en años (IC del 95%) | 68,2 (67,4 a 69,1) | 68,2 (67,5 a 69) | 0 (–1,1 a 1,2) | 1 |
| Mujeres (%) | 358 (61,2) | 354 (61,1) | 0,9 (0,8 a 1,1) | 0,9 |
| Cadera (%)Rodilla (%) | 189 (32,3)396 (67,7) | 163 (28,2)416 (71,7) | 1 (0,9 a 1,1) | 1 |
| Índice Charlson (IC del 95%) | 3,7 (3,6 a 3,8) | 2,9 (2,7 a 3) | 0,8 (0,7 a 1) | 0,09 |
| ASA status> 2 | 124 (21,2%) | 109 (18,8%) | 0,8 (0,7 a 1,1) | 0,3 |
| Tabaquismo (%) | 76 (12,9) | 58 (10) | 0,7 (0,6 a 1,1) | 0,1 |
| DM (%) | 115 (19,7) | 116 (20) | 1 (0,8 a 1,3) | 0,9 |
| Obesidad (%) | 324 (55,4) | 328 (56,6) | 1 (0,9 a 1,1) | 0,7 |
| Artropatía reumática (%) | 15 (2,6) | 11 (1,9) | 0,7 (0, a 1,6) | 0,4 |
| Fármacos inmunosupresores (%) | 25 (4,2) | 16 (2,8) | 0,6 (0,3 a 1,2) | 0,2 |
| Linfopenia <1100 cél./μl (%) | 27 (5,6) | 28 (4,8) | 1 (0,6 a 1,8) | 0,9 |
| Colonización Staphylococcus aureus (%)Colonización SAMR (%) | 136 (23,2)10 (1,8) | 130 (22,6)5 (0,8) | 0,9 (0,8 a 1,2)0,5 (0,1 a 1,5) | 0,70,2 |
| Duración de la cirugía en min (IC del 95%) | 102,4 (100,4 a 104,4) | 101,6 (99,9 a 103,2) | 0,8 (–1,7 a 3,4) | 0,9 |
| Pacientes transfundidos (%) | 82 (14) | 58 (10) | 0,7 (0,5 a 0,9) | 0,03 |
ASA: American Society of Anesthesiologists; DM: diabetes mellitus; IC: intervalo de confianza; RR: riesgo relativo; SARM: Staphylococcus aureus resistente a meticilina.
Comparativa de la etiología de IPA en grupo control (cefazolina) e intervención (cefazolina+teicoplanina)
| Cefazolina (n=585) | Cefazolina+teicoplanina (n=579) | RR (IC del 95%) | p | |
|---|---|---|---|---|
| Casos IPA | 16 (2,7%) | 6 (1%) | 0,4 (0,1 a 0,9) | 0,04 |
| Grampositivos | 11 (1,8%) | 4 (0,7%) | 0,4 (0,1 a 1,1) | 0,08 |
| Gramnegativos | 2 (0,3%) | 3 (0,5%) | 1,5 (0,2 a 9) | ns |
| Polimicrobiana | 1 (0,2%) | 2 (0,3%) | 2 (0,2 a 22,1) | ns |
| Sin aislamiento | 4 (0,7%) | 1 (0,2%) | 0,2 (0,02 a 2,2) | ns |
| Microorganismos | ||||
| Staphylococcus spp. | 6 (1%) | 2 (0,3%) | 0,3 (0,1 a 1,7) | ns |
| Staphylococcus metiR | 4 (0,7%) | 1 (0,2%) | 0,3 (0,03 a 2,3) | ns |
| Staphylococcus aureus | 3 (0,5%) | 0 | 0,1 (0,01 a 2,8) | ns |
| Staphylococcus CN | 3 (0,5%) | 2 (0,3%) | 0,7 (0,1 a 4) | ns |
| Enterococcus spp. | 1 (0,2%) | 1 (0,2%) | 1 (0,1 a 16,1) | ns |
| Otros Streptococcus | 1 (0,2%) | 1 (0,2%) | 1 (0,1 a 16,1) | ns |
| Corynebacterium | 3 (0,5%) | 0 | 0,1 (0,01 a 2,8) | ns |
| Enterobacterias | 2 (0,3%) | 3 (0,5%) | 1,5 (0,2 a 9) | ns |
CN: coagulasa negativos; IC: intervalo de confianza; IPA: infección de prótesis articular; metiR: resistente a meticilina; ns: no significativo; RR: riesgo relativo.
Hubo un paciente en cada grupo que desarrolló exantema cutáneo inmediatamente después de la infusión de los antibióticos, sin angioedema ni anafilaxia, que remitieron con antihistamínicos y no obligaron a suspender la intervención. No hubo casos de infección por C. difficile en ninguno de los grupos durante el ingreso hospitalario. En el grupo de intervención hubo 15 casos (2,6%) de lesión renal aguda, todos ellos leves y reversibles, mientras que en el grupo control fueron 12 (2,1%, RR 1,2, IC del 95%, 0,6 a 2,7, p no significativa). No se han producido casos de infección osteoarticular por Enterococcus faecium resistente a glucopéptidos en el periodo de estudio.
DiscusiónEn nuestro estudio, la adición de una dosis preoperatoria de teicoplanina a la habitual de cefazolina se asoció a una reducción estadísticamente significativa del 60% de la tasa de IPA, a expensas de un descenso de los casos provocados por grampositivos, particularmente Staphylococcus spp., sin modificarse las infecciones causadas por gramnegativos ni aumento de los efectos adversos.
El creciente número de infecciones por bacterias multirresistentes supone, entre otras consecuencias, una grave amenaza para los éxitos logrados con diferentes procedimientos quirúrgicos o la implantación de dispositivos (marcapasos, válvulas, etc.)10. La mayoría de los estudios de profilaxis antibiótica son de los años 70 y 80, en donde los principales agentes causales de infección posquirúrgica o postimplante eran sensibles11,12.
En el caso particular de las IPA, como en otras infecciones asociadas a biodispositivos, en las últimas décadas se ha descrito un notable incremento de los casos causados por Staphylococcus resistentes a meticilina y el resto de betalactámicos, lo que unido a las infecciones enterocócicas y otras supone que actualmente buena parte de las IPA son producidas por bacterias resistentes a los antibióticos más habitualmente empleados en su prevención, las cefalosporinas2,3. En consecuencia, parece necesario un cambio en las estrategias en la prevención de estas infecciones13. La descolonización de pacientes portadores de S. aureus, implementada en nuestro centro desde hace varios años con buenos resultados, es una opción eficaz para disminuir las infecciones por este7, pero no actúa sobre los Staphylococcus coagulasa negativos, cuya tasa, además, de resistencia a meticilina, y por extensión, cefalosporinas, es mayor. En ese sentido, se ha evaluado la opción de sustituir la profilaxis antibiótica preoperatoria con cefalosporinas por glucopéptidos. Sin embargo, los resultados no han ofrecido beneficios, pues el descenso conseguido de infecciones por grampositivos se compensa por una mayor tasa de infecciones por gramnegativos, incluso también más infecciones por Staphylococcus sensible a meticilina4.
Por tanto, el siguiente planteamiento sería si la combinación de cefalosporinas con glucopéptidos podría ser de utilidad. Los estudios realizados con vancomicina, sola o en asociación, han demostrado un éxito moderado en disminuir la incidencia de IPA, pero con un exceso de nefrotoxicidad6,14,15. La teicoplanina tiene un perfil más favorable de efectos secundarios que la vancomicina, es menos nefrotóxica y se puede administrar en menor tiempo, lo cual es importante en la logística de funcionamiento de la actividad de quirófano16. En ese sentido, una experiencia publicada con la asociación de teicoplanina-cefuroxima ha demostrado mejorar los resultados en prevención de la IPA5.
En nuestro centro, como en otros, casi la mitad de las IPA eran provocadas por bacterias resistentes a las cefalosporinas, por lo que se cambió el protocolo de profilaxis quirúrgica asociando cefazolina y teicoplanina, tras lo cual se produjo un descenso global de la tasa de IPA, a expensas de las causadas por grampositivos, con una disminución de la incidencia de casos de Staphylococcus en general, y de los resistentes a meticilina en particular. Podría atribuirse el beneficio de esta nueva pauta a la mayor vida media de la teicoplanina respecto de la cefazolina, que extendería su efecto varias horas después de realizada la cirugía, y no a la ampliación del espectro antibiótico. Sin embargo, se ha demostrado que el uso de dosis sucesivas de cefalosporinas después de la cirugía no añade beneficio al de una única dosis preoperatoria17, por lo que puede descartarse este hecho.
Este procedimiento fue asimismo seguro, sin producirse un exceso de lesión renal aguda (y además todos los casos fueron reversibles), reacciones anafilácticas ni sobreinfecciones por C. difficile, respecto al grupo control. Además, hasta la fecha, el mayor uso de teicoplanina no ha repercutido en la aparición de casos de infecciones por Enterococcus resistentes a glucopéptidos, de prótesis ni de otras localizaciones.
Una de las limitaciones de este trabajo es que es unicéntrico y los resultados podrían no ser aplicables en hospitales con alta incidencia de casos de Staphylococcus resistentes a teicoplanina, que en nuestro centro, de momento, no hay. Otra limitación es que los pacientes no están aleatorizados, siendo el grupo control una cohorte histórica, es decir, no es un ensayo clínico, sino un estudio cuasiexperimental. Los pacientes del grupo control tienen características similares de los del grupo de intervención, aunque es cierto que más pacientes del grupo control recibieron transfusiones, lo cual es un factor de riesgo bien conocido de IPA y esto puede ser un sesgo. Sin embargo, al analizar solo a los pacientes que fueron transfundidos, se mantuvo la reducción de los casos (6,1% vs. 1,7%). Además, nuestro estudio muestra resultados similares a los publicados y es coherente en que solo se redujeron las infecciones por grampositivos, siendo similar la tasa de IPA por gramnegativos, pues la teicoplanina no tiene actividad sobre estos, lo cual sugiere fuertemente la causalidad de la intervención y parece descartar que sea un efecto casual.
Finalmente, el periodo de seguimiento elegido, 12 meses, podría ser también un sesgo, pues podría haber casos de infección por Staphylococcus coagulasa negativo que se manifestaran más tardíamente de ese periodo. De hecho, ha habido casos de IPA después de esos 12 meses en el grupo de intervención, pero también (y en mayor número) en el control, por lo que los resultados no se ven afectados.
En conclusión, la asociación de teicoplanina a cefalosporina parece ser efectiva en la prevención de la IPA electiva y bien tolerada.
FinanciaciónEste trabajo no ha recibido financiación.
Conflicto de interesesJosé María Barbero declara haber recibido honorarios por conferencias del laboratorio Angelini. Jose Sanz Moreno declara haber recibido honorarios por colaboraciones docentes y de asesoramiento de los laboratorios Gilead, Viid y Janssen. El resto de los autores declaran no tener ningún conflicto de intereses.