Saksenaea vasiformis es un hongo filamentoso del orden de los Mucorales, ocasionalmente causante de infecciones con una gran morbimortalidad, sobre todo en áreas tropicales o subtropicales. El objetivo es describir las características clínicas de los casos publicados en España.
MétodosAdemás de presentar un caso de infección por Saksenaea vasiformis (S. vasiformis) atendido en el Hospital Universitario Cruces en 2023, se realizó una búsqueda sistemática de la literatura hasta el 17/04/2024, analizando un total de 11 casos. Se obtuvieron datos epidemiológicos y clínicos, y se realizó un análisis descriptivo.
ResultadosLa media de edad fue de 64,9 años, la mayoría varones (72,7%) inmunocompetentes. La adquisición se relacionó con traumatismos graves (45,5%) o picaduras de insectos (36,4%). El 90,1% sufrió una infección de piel y partes blandas. El proceso diagnóstico fue complejo, siendo de utilidad la tinción directa (36,4%), el cultivo en medios específicos (27,3%) las técnicas moleculares (54,5%) y los hallazgos histopatológicos (90,9%). Se determinó la CMI de los antifúngicos en 3 casos, obteniendo valores bajos para anfotericina-B liposomal (AMB-L) y posaconazol, y variables para voriconazol. AMB-L fue el antifúngico más empleado, asociado en todos los casos a un amplio desbridamiento quirúrgico. La mortalidad fue del 45,5%.
ConclusiónLa infección por S. vasiformis es infrecuente en nuestro medio, pero de gran importancia clínica debido a su gravedad y dificultad diagnóstica. El reconocimiento rápido, junto con un precoz y agresivo desbridamiento y el tratamiento antifúngico adecuado son fundamentales.
Saksenaea vasiformis(S. vasiformis) is a filamentous fungus from the Mucorales order, responsible for isolated infections with high morbidity and mortality, especially in tropical or subtropical areas. The objective is to describe the clinical characteristics of the cases reported in Spain.
MethodsIn addition to presenting a case of S. vasiformis infection treated at Hospital Universitario Cruces in 2023, a systematic literature review was conducted on 17/04/2024, analyzing a total of 11 cases. Epidemiological and clinical data were obtained, and a descriptive analysis was performed.
ResultsThe average age was 64.9 years, with most being male (72.7%) and immunocompetent. Acquisition was related to severe trauma (45.5%) or insect bites (36.4%). 90.1% suffered from skin and soft tissue infections. The diagnostic process was complex, with the following being useful: direct staining (36.4%), culture in specific media (27.3%), molecular techniques (54.5%), and histopathological findings (90.9%). MICs of antifungals was determined in 3 cases, with low MICs for liposomal amphotericin B (L-AMB) and posaconazole, and variable MICs for voriconazole. L-AMB was the most commonly used antifungal, combined in all cases with extensive surgical debridement. Mortality was 45.5%.
ConclusionInfection by S. vasiformis is rare in our environment but clinically significant due to its severity and difficult diagnosis. Rapid recognition, along with early and aggressive debridement and appropriate antifungal treatment, are essential.
Saksenaea vasiformis(S. vasiformis) es un hongo filamentoso del orden de los Mucorales, aislado por primera vez en 19531. Hoy en día S. vasiformis se considera un complejo de especies diferenciables fenotípica y molecularmente2. Se encuentra ampliamente en el suelo, materia orgánica en descomposición, madera y excrementos de animales3.
La mucormicosis por Saksenaea spp. representa aproximadamente el 3% de las infecciones por Mucorales4. La primera infección por S. vasiformis en humanos fue descrita por Ajello et al. en 19765, y desde entonces se han publicado casos aislados en la literatura, la mayoría de ellos en zonas de climas tropicales y subtropicales (sobre todo en India y Australia)6. De entre los casos publicados en Europa, España es uno de los países que concentra la mayor parte7.
A diferencia de otras mucormicosis, afecta predominantemente a individuos inmunocompetentes3,6. Clínicamente, afecta principalmente a la piel y partes blandas, produciendo lesiones ulcerativas y necróticas rápidamente progresivas3,6,7. Se relaciona con una alta tasa de morbilidad y una mortalidad cercana al 40%6.
El objetivo principal del presente estudio es describir las características de los casos de S. vasiformis publicados en España.
Material y métodosSe presenta un caso clínico atendido en el Hospital Universitario Cruces, en septiembre de 2023.
Además, se describen los casos de S. vasiformis publicados en España desde la publicación del primer caso en nuestro país hasta el 17 de abril de 2024, fecha en la que se realizó una búsqueda sistemática de la literatura en Medline (Pubmed) y Embase, empleando el término «Saksenaea vasiformis» en los buscadores (figura 1S del material suplementario). Una vez descartados los duplicados, se realizó una selección vía título, afiliación de autores y abstract. Se descartaron los artículos que no correspondían a casos clínicos en humanos (estudios de laboratorio, casos clínicos en animales, etc.) y tras un segundo cribado, se descartaron los casos clínicos no publicados en España. Se realizó una revisión de las referencias bibliográficas de los artículos seleccionados, de cara a buscar artículos que podían no haberse detectado en la búsqueda sistemática. Además del caso atendido por nuestro grupo, se incluyó un caso «en prensa». Se consideraron artículos publicados en inglés y español.
Se obtuvieron datos epidemiológicos y clínicos: edad, procedencia, estado inmunológico del paciente, mecanismo de infección, manifestaciones clínicas, proceso diagnóstico, tratamiento y resolución del caso. Se elaboró una tabla con los datos más relevantes y se realizó un análisis descriptivo.
ResultadosDescripción del caso clínicoVarón de 56 años, sin antecedentes médico-quirúrgicos de interés, herido por asta de toro en un festejo taurino en un pueblo de la provincia de Cáceres en agosto de 2023.
Recibió en total tres cornadas, dos superficiales en pierna izquierda (pretibial y cara posterior del muslo) y una más profunda y con varios trayectos en pared lumbar izquierda, sin afectación muscular inicial. El mismo día del suceso, se realizó exploración y limpieza quirúrgica en el hospital referente de dicha área y se instauró tratamiento antibiótico con piperacilina-tazobactam. Una semana después, el paciente fue trasladado a otro centro, correspondiente a su lugar de residencia habitual. A su llegada presentaba una importante área de necrosis y celulitis, por lo que requirió hasta 3 nuevas intervenciones quirúrgicas para drenaje de colecciones en flanco.
En los cultivos tomados secuencialmente en superficie se aislaban diferentes especies de microorganismos (Candida lusitaniae, Candida tropicalis (C. tropicalis), Nocardia cyriacigeorgica, Mycobacterium fortuitum complex y Mycobacterium farcinogenes). Se instauraron diferentes esquemas de tratamiento antimicrobiano, con antibióticos (piperacilina-tazobactam, imipenem, daptomicina, ciprofloxacino, doxiciclina, cotrimoxazol) y antifúngicos (fluconazol) pero el paciente presentó empeoramiento clínico progresivo, por lo que fue derivado a nuestro centro.
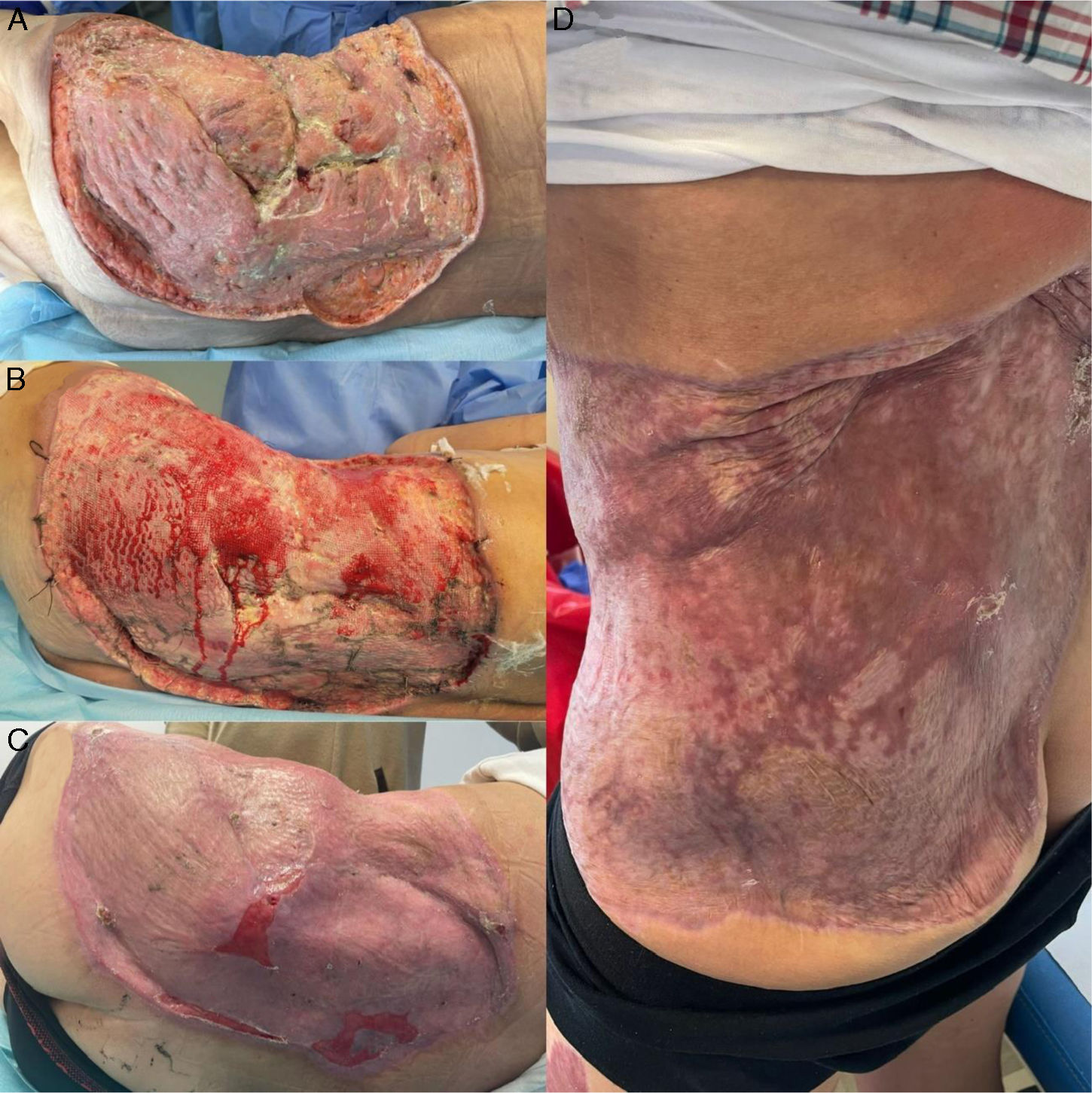
A su llegada a nuestro hospital, tres semanas después de la herida por asta de toro, el paciente presentaba regular estado general, con gran elevación de marcadores analíticos inflamatorio-infecciosos (PCR 250mg/L, 25.000 leucocitos/mm3, con predominio de neutrófilos). A la exploración, presentaba extensa placa necrótica con celulitis perilesional en flanco izquierdo con extensión a glúteo (fig. 1A). Se pautó cobertura antimicrobiana de amplio espectro (linezolid, amikacina, piperacilina-tazobactam y fluconazol) y se programó una nueva limpieza quirúrgica en las primeras 12 horas desde la llegada (fig. 1B), realizando desbridamiento amplio de tejidos desvitalizados, con envío de muestra a Microbiología y Anatomía Patológica. En el frotis rápido (tinción de Gram) no se observaron microorganismos, y en los cultivos rutinarios únicamente se aislaban Staphylococcus epidermidis(S. epidermidis) y C. tropicalis, que se consideraron probables contaminantes. Se desconfiaba de la patogenicidad de dichos microorganismos en superficie, y por ello se esperaba el resultado de los cultivos específicos de microorganismos de crecimiento lento aislados previamente (Nocardia spp. y micobacterias) y los resultados de la histología, que pudieran descartar o confirmar, entre otros, la presencia de granulomas.
La evolución inicial fue desfavorable; la necrosis en flanco continuó progresando, y el paciente presentó shock séptico que requirió la administración de vasoactivos y ventilación mecánica invasiva. Una tomografía computarizada (TC) mostró signos de miositis grave afectando a musculatura en flanco y glúteo izquierdo.
A los 10 días desde el ingreso, se recibió notificación desde el Servicio de Anatomía Patológica de la presencia de hifas de hongos filamentosos con datos de angioinvasión en la muestra histológica del tejido subcutáneo de la cirugía inicial (fig. 2). Simultáneamente, y a lo largo de los días posteriores, el laboratorio de Microbiología informó del crecimiento de un hongo filamentoso lanoso, grisáceo y voluminoso en medios de agar sangre, agar chocolate, caldo tioglicolato y en agar Sabouraud en todas las muestras obtenidas tras la primera cirugía (fig. 3A). En el examen directo con blanco de calcoflúor de las muestras enviadas posteriormente, se objetivaron hifas no tabicadas ramificadas en ángulo recto, por lo que se sospechó un zigomiceto como patógeno implicado (fig. 3B). La identificación no pudo realizarse por examen microscópico de la cepa por falta de esporulación, y tampoco se obtuvo ninguna identificación por espectrometría de masas (MALDITOF).
Se modificó el tratamiento antimicrobiano añadiendo anfotericina B liposomal (AMB-L) a dosis de 4mg/kg/24 h e isavuconazol iv. (dosis de carga de 600mg durante 48 horas, y posteriormente 200mg/día); y se realizó una nueva cirugía urgente de desbridamiento amplio (fig. 1C). El defecto cutáneo y subcutáneo era de tal magnitud, que se exponía parcialmente el hueso de la pala iliaca izquierda, por lo que se añadieron fomentos tópicos diarios de AMB-L (dilución de 50mg/L) durante 15 días.
El hongo fue posteriormente identificado en el día+32 de ingreso como S. vasiformis mediante PCR y secuenciación de la región ITS. Una muestra desparafinada remitida desde el laboratorio de Anatomía Patológica fue enviada al Centro Nacional de Microbiología del Instituto de Salud Carlos III donde se confirmó también por secuenciación la presencia de S. vasiformis. Cinco días más tarde se obtuvo el antifungigrama con metodología EUCAST, que mostraba mayor susceptibilidad a anfotericina B y posaconazol, con las siguientes CMI (mg/L): anfotericina B y posaconazol 0,5; isavuconazol 2; anidulafungina> 4; voriconazol e itraconazol 8; caspofungina y terbinafina> 16.
Tras la identificación definitiva del hongo y el resultado del antifungigrama, se cambió isavuconazol por posaconazol iv. (dosis de carga de 300mg/12h el primer día, con dosis posteriores de 300mg/día).
Desde el primer momento del inicio del tratamiento antifúngico con anfotericina y los sucesivos desbridamientos, se produjo una evolución progresivamente favorable, tanto a nivel clínico (retirada de las aminas vasoactivas y la ventilación mecánica), como a nivel analítico, evidenciándose un claro descenso de los reactantes de fase aguda.
Los exámenes directos con blanco de calcoflúor de las muestras enviadas posteriormente y los cultivos seriados de muestras profundas obtenidas en los desbridamientos posteriores continuaron siendo positivos hasta el día+28 de ingreso (17 días tras inicio del doble tratamiento antifúngico), por lo que se intentó aumentar la dosis de AMB-L a 10mg/Kg/24h, pero no fue posible debido al desarrollo de hipopotasemia severa. Se prolongó el tratamiento con AMB-L a dosis de 5mg/kg/24h iv. junto con posaconazol durante 4 semanas y posteriormente se dejó posaconazol en monoterapia.
Como intercurrencias destacables durante el ingreso, el paciente presentó sobreinfecciónes superficiales por Enterococcus faecium (manifestada como esfacelos y exudación) que se controló con vancomicina, y por Pseudomonas aeruginosa (P. aeruginosa) multirresistente (que se presentó como fiebre, esfacelos y zonas hipergranuladas en dermis) que se trató con ceftolozano-tazobactam y tobramicina.
Después de un mes de ingreso y tras conseguirse la negativización de los cultivos, se inició la cobertura del defecto con injertos de piel autóloga parcial mallados, de manera exitosa (fig. 4). En total se realizaron 6 cirugías de desbridamiento y 2 de cobertura por parte de Cirugía Plástica. Tras 50 días de estancia en la Unidad de Cuidados Intensivos, el paciente pudo trasladarse a planta de hospitalización convencional. Tras la estabilización de la zona cutánea y subcutánea, se observó persistencia de colecciones subyacentes a pala iliaca izquierda, que se comportaban por TC como abscesos (fig. 5). Fue imposible su drenaje ecoguiado dada la situación desepitelizada de la zona, que contraindicaba el acceso percutáneo. Las pruebas de imagen resultaron contradictorias: una gammagrafía con leucocitos marcados no sugería infección activa, pero una resonancia magnética (RM) resultó compatible con abscesos de partes blandas en músculo cuadrado lumbar, ligamento ilio-lumbar y músculo iliaco izquierdos, con datos de osteomielitis en sacro y hueso iliaco. Por ello, se decidió realizar pauta prolongada de posaconazol oral (300mg/día). En el día 66 de ingreso, el paciente fue dado de alta. El tratamiento con posaconazol se prolongó 6 meses, sin presentar efectos adversos. Pasado ese tiempo se realizó nueva RM, evidenciándose marcada mejoría radiológica, con disminución de las colecciones de la musculatura adyacente la articulación sacroiliaca izquierda y sin datos concluyentes de osteomielitis, por lo que se decidió suspender el tratamiento. Tres meses después de la suspensión del posaconazol, el paciente se encuentra asintomático, con el defecto de cobertura cutánea solucionado y sin signos de recidiva de la infección (fig. 4).
A) Defecto de cobertura en flanco y glúteo izquierdo, previo a comenzar con injertos tras un mes de ingreso; B) a la semana del inicio de la siembra de injertos con epitelización incipiente; C) a los 4 meses desde el ingreso, 2 meses tras el alta, y D) a los 6 meses tras el alta, aproximadamente 1 mes después del fin del posaconazol.
La tabla 1 recoge las principales características de los 11 casos analizados, donde se incluye el caso descrito.
Características de los casos clínicos de S. vasiformis publicados en España
| Ref. | Provincia de adquisición | Edad/Sexo | Inmuno-depresión | Etiología /mecanismo | Presentación clínica | Diagnóstico | Antifúngico | Desbridamiento quirúrgico | Éxitus | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tinción directa | Cultivo | AP | PCR | AMB-L | Otros | ||||||||
| Cefai, 1987 | SD | 55/M | SD | Politraumatismo tras caída desde altura | Celulitis gangrenosa | - | + | + | SD | Sí | No | Amputación de extremidad | No |
| Gómez-Merino, 2003 | Albacete | 66/V | No | TCE tras accidente de tráfico | Celulitis necrosante | SD | + | + | SD | Sí | No | Agresivo | No |
| García-Martínez, 2008 | Madrid | 71/V | Sí (diabetes, neoplasia) | Posible inhalación de esporas (jardinero) | Forma rinoorbitocerebral invasiva | + | + | + | SD | Sí | No | Parcial | Sí |
| Domínguez, 2012 | Sevilla | 82/M | No | Desconocido. Posible picadura | Infección diseminada/celulitis | - | + | + | + | No | No | Parcial | Sí |
| Mayayo, 2013 | Tarragona | 46/M | No | Accidente de tráfico | Fascitis necrosante | SD | + | + | + | Sí | No | Agresivo. Amputación extremidad. | Sí |
| Gómez-Camarasa, 2014 | Granada | 58/V | Sí (diabetes) | Accidente con tractor en granja | Celulitis/infección diseminada | + | + | SD | + | Sí | No | Parcial | Sí |
| Coronel-Pérez, 2015 | Sevilla | 76/V | No | Picadura de agente desconocido | Celulitis necrosante | SD | + | + | SD | Sí | No | Tejido desvitalizado | No |
| Guinea, 2017 | Madrid | 76/V | SD | Picadura | Cutánea | + | + | + | + | Sí | PSZ | Sí (SD) | No |
| Fernández-Tormos, 2019 | Cáceres | 71/V | Sí (diabetes, neoplasia) | Picadura de araña | Celulitis/fasctitis necrosante/Infección diseminada | SD | + | + | SD | Sí | AMB nebulizada+PSZ | Amputación extremidad | No |
| Uribarri García, 2024 | Navarra | 58/V | Sí (cirrosis, neoplasia) | Picadura de arácnido | Celulitis/fascitis necrosante facial | SD | + | + | + | Sí | IVZ | Parcial | Sí |
| Caso actual | Cáceres | 55/V | No | Herida por asta de toro | Celulitis/miositis necrosante | + | + | + | + | Sí | AMB cutánea+IVZ+PSZ | Agresivo | No |
AMB-L: anfotericina B liposomal; AP: anatomía patológica; IVZ: isavuconazol; M: mujer; PSZ: posaconazol; SD: sin datos; TCE: traumatismo craneoencefálico; V: varón.
La media de edad fue de 64,9 años. El 72,7% de los casos eran varones, y la mayoría inmunocompetentes (55,5%). Dentro de los pacientes inmunodeprimidos (4 en total), destacaban como principal factor la diabetes y las enfermedades neoplásicas, reportadas cada una de ellas en 3 pacientes, y siendo ambas coexistentes en 2 de los casos.
En cuanto al lugar geográfico donde se adquirió la infección, la mayoría de los casos fueron en áreas rurales o suburbanas del centro-sur de la Península Ibérica, destacando las provincias de Cáceres, Madrid y Sevilla, con 2 casos reportados en cada una. En cuanto al mecanismo de infección, se relacionaron con un antecedente traumático importante (45,5%) o con picaduras de insectos (36,4%).
En la gran mayoría de los casos (90,1%), los pacientes sufrieron una infección de piel y partes blandas. En 3 de los casos, esta afectación se asoció a una infección diseminada. Domínguez et al. reportaron afectación renopulmonar con afectación de 3 zonas cutáneas, que se consideraron probablemente secundarias a la diseminación hematógena11; Gómez-Camarasa et al. reportaron afectación rinoorbitocerebral y afectación cutánea diseminada a distancia13; y Fernández-Tormos et al. reportaron lesiones pulmonares cavitadas sugestivas de embolismo fúngico16.
El proceso diagnóstico fue complejo en la mayoría de los casos, y en 1 caso se realizó posmortem. El examen directo empleando KOH o blanco de calcoflúor (positiva en el 36,4% de los casos) y/o los hallazgos histopatológicos con diferentes tinciones como hematoxilina-eosina (positiva en el 90,9% de los casos), fueron los que permitieron establecer una primera orientación etiológica hacia un hongo filamentoso.
El cultivo del hongo fue finalmente posible en todos los casos, empleando diferentes medios de cultivo. En todos los casos en los que consta el empleo del agar Sabouraud, se logró el crecimiento del hongo, pero en ninguno fue posible lograr la esporulación del hongo que permitiera su identificación microbiológica. La identificación de la especie se logró a través del cultivo en medios específicos como el agar Czapek-Dox (Difco) en 2 de los casos (18,2%), el agar-agua en 1 caso, o a través de técnicas moleculares (6 casos, 54,5%). En 5 casos (45,5%) consta el envío de la muestra a un centro de referencia, como al Centro Nacional de Microbiología del Instituto de Salud Carlos III de Madrid. La CMI de los antifúngicos se reportó solamente en 3 casos; en todos ellos consta una buena sensibilidad a posaconazol y a anfotericina B. El nuestro es el único artículo donde se reporta la sensibilidad al isavuconazol. Los resultados de las CMI para el resto de antifúngicos fueron variables.
La mayoría de los pacientes requirieron ingresos prolongados (semanas o meses) con ingreso en unidades de cuidados intensivos. En 9 de los 11 casos consta el empleo de antibioterapia empírica de amplio espectro; si bien solo en 3 casos se reportó la presencia de coinfección bacteriana, destacando los enterococos y P. aeruginosa, citados en 2 ocasiones.
Solamente en 2 casos se inició el tratamiento antifúngico apropiado de manera empírica; en el resto, se inició solo tras la identificación de elementos fúngicos en la tinción rápida, histopatología o el cultivo, demorándose días o semanas. En todos los casos (salvo en el caso diagnosticado posmortem), se empleó la AMB-L; la mayoría (54,5%) en monoterapia, y en el resto asociada a derivados azólicos (posaconazol o isavuconazol). En un caso se empleó AMB nebulizada. En nuestro caso la AMB tópica cutánea no mostró efectos adversos y se acompañó de una evolución local favorable.
En todos los casos se realizó desbridamiento quirúrgico de la zona afectada. En 4 casos, debido a la situación clínica del paciente y la localización anatómica de la infección, solamente se pudo realizar un desbridamiento parcial. Todos estos casos tuvieron un desenlace fatal. En los demás, el desbridamiento fue agresivo, retirando todo el tejido desvitalizado, y precisando procedimientos complejos como fasciotomía, desbridamiento osteomuscular, mastectomía y/o amputación del miembro afecto (esto último en el 27,3%).
La mortalidad total atribuible a la infección fue del 45,5%, en todos los casos por fracaso multiorgánico en contexto de shock séptico. Cabe destacar la alta mortalidad en los pacientes inmunodeprimidos (75%) y en los casos en los que se reportó sobreinfección bacteriana (mortalidad del 66,7%). Ninguno de los 3 pacientes en los que se empleó el tratamiento combinado con AMB-L y posaconazol fallecieron.
DiscusiónEl caso presentado se trata del primer caso publicado en la literatura de infección por S. vasiformis en relación a una herida por asta de toro. Habitualmente, en las series de casos publicadas de infección por asta de toro se han reportado infecciones polimicrobianas con predominio de enterobacterias, sin constar aislamientos de hongos filamentosos18,19.
S. vasiformis es un patógeno emergente en España. El cuadro clínico habitual es una infección necrosante grave de piel y partes blandas, en un varón de mediana edad, generalmente inmunocompetente, a diferencia de las infecciones de partes blandas producidas por otros mucormicetos, que se presentan habitualmente como infecciones oportunistas en pacientes inmunodeprimidos, con mayor frecuencia de formas diseminadas y rinoorbitocerebrales. No obstante, se han descrito cuadros de infección crónica de tejidos blandos, con afectación de estructuras adyacentes y evolución lenta, así como formas diseminadas graves con muy alta mortalidad3.
Habitualmente se adquiere tras una herida cutánea producida por diferentes mecanismos (traumatismos, picadura…), principalmente en un área rural con clima mediterráneo. Estas características son similares a las publicadas en la literatura a nivel mundial; si bien llama la atención la diferencia de sexo hallada, con claro predominio en varones, y un mayor número de pacientes inmunodeprimidos en nuestra serie respecto a las series de casos globales publicadas6.
En cuanto al cultivo, en línea con lo reportado en la literatura, es posible el cultivo del hongo en medios micológicos habituales como Sabouraud, pero es muy difícil lograr la esporulación del hongo que permita la identificación de la especie. Para ello se requieren estudios moleculares y el empleo de medios específicos, lo que a menudo requiere remitir las muestras a Centros de Referencia de Microbiología2,3.
Debido a la alta agresividad del cuadro y a las dificultades para el diagnóstico microbiológico precoz, es importante, ante un alto índice de sospecha, la realización de tinciones para observación directa de elementos fúngicos (KOH, blanco de calcoflúor) y el envío de muestras para estudio anatomopatológico, ya que pueden detectar más precozmente la presencia de una infección fúngica invasiva7,20.
No se han publicado guías de práctica clínica específicas, por lo que se deben seguir las guías generales de manejo de mucormicosis21. El tratamiento se basa en dos pilares: el desbridamiento quirúrgico y el tratamiento antifúngico, dentro del cual la AMB-L y el posaconazol son los antimicrobianos de elección21,22. Es fundamental el inicio precoz y debe considerarse la terapia combinada hasta el control de la infección23. El posaconazol ha demostrado mejores resultados en estudios de sensibilidad in vitro y en pequeñas series, incluso en monoterapia, especialmente como terapia de rescate2,3,6,24. Además, en casos de afectación cutánea/subcutánea (sobre todo en heridas extensas y con necrosis, con menor llegada del antifúngico sistémico), se puede considerar el uso de anfotericina B tópica25–27. No está establecida una clara correlación clínico-microbiológica en el tratamiento de estas infecciones y no están definidos los puntos de corte clínicos en el estudio de sensibilidad a los antifúngicos.
Al igual que con otras causas de mucormicosis, la infección por S. vasiformis se caracteriza por angioinvasión y necrosis tisular 3, por lo que el desbridamiento quirúrgico debe ser lo más precoz y agresivo posible, realizando el número de intervenciones necesarias para eliminar todo el tejido desvitalizado. Se debe individualizar el momento de comenzar la cobertura del defecto con injertos o colgajos, habitualmente tras un periodo seguro de terapia antifúngica y con cultivos ya negativos7.
La mortalidad de nuestra serie ha sido ligeramente superior a la reportada en series globales, quizá por el mayor número de pacientes inmunodeprimidos, a pesar de que no está claramente definido que estos tengan un peor pronóstico6. Las sobreinfecciones bacterianas se han relacionado con una mayor mortalidad7. Al contrario, el inicio precoz del tratamiento (sobre todo una cirugía precoz y agresiva) y el empleo de posaconazol se asocian a un mejor pronóstico6.
En resumen, la infección cutánea por S. vasiformis es una entidad escasamente descrita en la literatura, asociada a traumatismos o heridas incisas, que se manifiesta habitualmente con necrosis progresiva local en pacientes inmunocompetentes. Se trata de una infección emergente, todavía infrecuente en nuestro medio, pero de gran importancia clínica debido a su gravedad y dificultad diagnóstica. El reconocimiento rápido, seguido de un tratamiento precoz y agresivo, puede conllevar un mejor pronóstico, que de por sí es grave.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos agradecer a la Unidad de Micología del Centro Nacional de Microbiología del Instituto de Salud Carlos III (Majadahonda, Madrid) su apoyo en la identificación del hongo y estudio de sensibilidad a los antifúngicos. Agradecer también a la Dra. María Rivero y a la Dra. Estela Moreno, del Hospital Universitario de Navarra, su amabilidad al ampliar los datos clínicos de su caso para la revisión global.