Los test de detección in vitro de Interferón-γ frente a Mycobacterium tuberculosis (MTB) podrían ser una herramienta útil en el diagnóstico de enfermedad tuberculosa activa.
MétodosSe realiza el test QuantiFERON-TB-Gold test in Tube (QFG-IT) en la sangre de 118 pacientes con tuberculosis pulmonar activa y se compara el resultado con la prueba de tuberculina.
ResultadosEl estudio de QFG-IT fue positivo en 94 casos (79,7%), negativo en 17 (14,4%) e indeterminado en 7 (5,9%). QFG-IT negativo o indeterminado fue más frecuente en pacientes más ancianos (p=0,017) y en los casos de baciloscopia negativa (p=0,041). La concordancia kappa entre la prueba de la tuberculina y el QFG-IT fue de 74,5% con un valor kappa de 0,45 (SE:0,136). Trece de los enfermos estudiados estaban infectados por el VIH, la prueba de la tuebrculina fue positiva en 5 de los 12 casos (38,5%) en que se realizó,y el estudio de QFG-IT fue positivo en 9/13 (69,2%).
ConclusionesQFG-IT puede ser una herramienta útil complementaria a la prueba de la tuberculina en el diagnóstico de enfermedad tuberculosa.
The Interferon-γ in vitro detection tests could be a useful tool in the diagnosis of active tuberculosis compared to Mycobacterium tuberculosis (MTB).
MethodsThe QuantiFERON-TB-Gold in Tube (QFG-IT) test was performed on the blood of 118 patients with active tuberculosis and the results compared with the tuberculin test.
ResultsThe QFG-IT test was positive in 94 cases (79.7%), negative in 17 (14.4%) and indeterminate in 7 (5.9%). A negative or indeterminate QFG-IT test was more common in older patients (P=0.017) and in cases with negative smear tests (P=0.041). The kappa agreement between the tuberculin and QFG-IT tests was 74.5% with a kappa value of 0.45 (SE:0.136). Thirteen of the patients studied were infected with HIV and the tuberculin was positive in 5 of the 12 cases (38.5%) in whom it was performed, with the QFG-IT being positive in 9/13 (69.2%).
ConclusionsThe QFG-IT test may be a useful complimentary tool to the tuberculin test in the diagnosis of tuberculosis.
En la última década se han introducido nuevos test que podrían mejorar el diagnóstico de la infección tuberculosa. Estos test, que detectan la producción in vitro de IFN-γ frente a Mycobacterium tuberculosis (MTB), podrían mejorar la especifidad de la prueba de la tuberculina (PT) y probablemente también su sensibilidad en inmunodeprimidos1. Existen en la actualidad 3 test IGRAs (del inglés Interferon-gamma Relaease Assays) comercializados: QuantiFERON-TB-Gold Test in Tube® y su predecesor QuantiFERON-TB-Gold Test® (Cellestis Ltd; Carnegie, VIC, Australia), que miden mediante un test de ELISA la producción antígeno específica de interferón-gamma (IFN-γ) por las células T circulantes en sangre completa y T-SPOT.TB® (Oxford Immunotec, Oxford, UK), que utiliza la técnica de Elispot para medir las células T productoras de IFN-γ. T-SPOT.TB® podría tener una mayor sensibilidad que QuantiFERON-TB-Gold Test® (QFG) en sujetos inmunodeprimidos2,3. QuantiFERON-TB-Gold Test in Tube® (QFG-IT) mejora la sensibilidad de QFG y también la sencillez de la técnica, al incluir los antígenos de MTB en el tubo de la extracción. Estos tres tests utilizan antígenos específicos de MTB localizados en la región RD1 de su genoma (ESAT-6, CFP10 y en el caso de QFG-IT también TB7.7 localizado en la región RD11), que no están presentes en la mayoría de las micobacterias ambientales. Sus ventajas frente a la PT serían por tanto una mayor especifidad para la infección tuberculosa, evitando falsos positivos en relación a la vacunación con BCG; también podrían tener una mayor sensibilidad en inmunodeprimidos y además permiten distinguir los resultados negativos de la anergia.
Su uso ya ha sido aprobado en diferentes países, fundamentalmente para el diagnóstico de infección tuberculosa latente complementario o en sustitución a la PT4,5. En las últimas guías recientemente publicadas en nuestro país ya se propone un algoritmo para su utilización en combinación con la PT para el diagnóstico de infección tuberculosa latente6.
Estos test también podrían tener un papel en el diagnóstico de enfermedad tuberculosa, sobre todo en los casos en que las tinciones de Ziehl o auramina y las técnicas de amplificación de ADN no permiten un diagnóstico rápido. Existen algunos trabajos ya publicados que sugieren que los test de IFN-γ pueden ser una prueba rápida, más sensible que la PT o complementaria a ésta, útil en los casos en que el diagnóstico de tuberculosis se demora varias semanas en espera del cultivo de micobacterias, que permitiría apoyar o excluir el diagnóstico de tuberculosis. Además el conocer la sensibilidad del QFG-IT en la enfermedad tuberculosa y en comparación con la PT nos permitiría también estimar su sensibilidad en la infección tuberculosa latente.
El objetivo de este trabajo es evaluar el papel del test de ELISA Quantiferon-TB-Gold Test In Tube® (QFG-IT) en el diagnóstico de la enfermedad tuberculosa activa y la concordancia con la PT en los enfermos de tuberculosis activa.
MétodosEl estudio se diseñó como un ensayo observacional prospectivo. Se llevó a cabo entre el 1 de enero del 2007 y el 15 de febrero de 2009 en los Hospitales Son Llàtzer y Son Dureta de Palma de de Mallorca. Fue aprobado por el Comité Ético de las Islas Baleares, y se obtuvo el consentimiento informado de los pacientes incluidos.
Se evaluaron 123 pacientes, de los cuales 118 cumplieron los criterios de inclusión, ser mayor de 14 años y tener un diagnóstico de tuberculosis activa definido como: 1) aislamiento de M. tuberculosis en cultivo de una muestra clínica; 2) presencia de granulomas caseificantes en anatomía patológica de una biopsia de una muestra de tejidos y 3) presencia de exudado linfocitario con ADA elevado o PCR positiva para MTB en líquido cefalorraquídeo o pleural, siempre acompañado de un cuadro clínico compatible, previa exclusión de otros diagnósticos y con respuesta adecuada al tratamiento de la tuberculosis.
Para cada caso se recogieron las siguientes variables: datos demográficos (edad, sexo, origen) y datos clínicos: hábitos tóxicos, enfermedades asociadas, presencia y tipo de inmunosupresión, infección por el VIH y en la mayoría de los pacientes se realizó la prueba de la tuberculina además de QFG-IT.
Se determinó la producción de IFN-γ mediante Quantiferon-TB-GoldTest In Tube® (QFG-IT) (Cellestis Ltd)) en la sangre de los pacientes diagnosticados de tuberculosis activa. Todas las extracciones se realizaron antes o en las primeras 24h de inicio del tratamiento de la tuberculosis. El test consiste en la incubación de la sangre del paciente durante 16–24h en un tubo con los péptidos sintéticos de las proteínas ESAT-6 CFP-10 y TB7.7, en otro tubo con un mitógeno (control positivo) y con tercer tubo sin péptidos ni mitógenos (control negativo). Se mide posteriormente mediante ELISA la producción de IFN-γ en plasma obtenido tras centrifugación. El test se considera positivo para infección tuberculosa si existe una respuesta de IFN-γ frente a los antígenos de MTB que es significativamente superior al valor obtenido con el control negativo, es decir un valor ≥0,35IU/ml (tras restar el valor del control negativo) Un resultado indeterminado se considera cuando no se produce respuesta tras el estímulo de un mitógeno y tampoco de los antígenos específicos de MTB es decir un valor de IFN-γ<0,5UI/ml7.
La Prueba d ela tuberculina (PT) se realizó siguiendo la técnica de Mantoux: la inyección intradérmica en el antebrazo de 0,1ml (2UT) del derivado proteico purificado RT23 (Statens serum Institute, Copenhagen, Denmark). La PT es leída a las 72h y se considera positiva si el diámetro transversal de la induración es superior a 5mm, siguiendo las Guías Clínicas Españolas6.
El análisis y recogida de datos se realizó con el paquete estadístico SPSS versión 11 (SPSS Inc. Chicago, IL). Se realizó un análisis descriptivo y se compararon las características de los pacientes con estudio de QFG-IT positivo y negativo; se analizó mediante el cálculo del índice kappa la concordancia entre la respuesta a la PT y el test de QFG-IT (excelente concordancia si valor kappa > de 0,75, moderada de 0,4–0,75 y pobre o escasa si<0,4). Se estimó también la sensibilidad del test de QFG y de la PT en nuestro estudio.
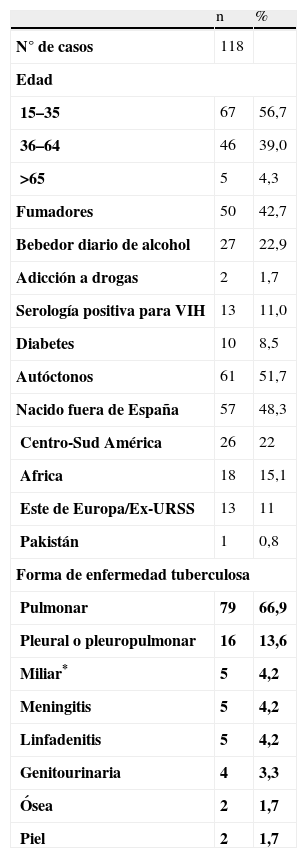
ResultadosSe analizaron finalmente 118 pacientes, 85 diagnosticados en el hospital Son Llátzer y 33 en el Hospital Son Dureta, cuyas características clínicas y demográficas se exponen en la tabla 1. La enfermedad tuberculosa fue mayoritariamente pulmonar. La muestra que permitió el diagnóstico de tuberculosis fue el esputo en 67 casos (56,8%), exudado pleural en 15 (12,7%), lavado o aspirado broncoalveolar en 11 (9,3%), exudado pleural y esputo simultáneamente en 10 (8,4%), biopsias de tejidos en 8 (6,8%), líquido cefalorraquídeo (LCR) en 4 (3,4%) y orina en 2 casos (1,7%). La tinciones de Ziehl o de Auramina de esputo fueron positivas en 66 casos (55,9%), el cultivo fue positivo en 90 (78,8%), la PCR de M. tuberculosis fue positiva en LCR en un caso (0,8%), la histología mostró granulomas caseificantes en 8 casos (6,9%), y en los casos restantes el diagnóstico se hizo al obtener una ADA elevado en líquido pleural o LCR con un cuado clínico compatible con enfermedad tuberculosa pleural o meníngea y buena respuesta a tuberculostáticos La RX tórax mostró alteraciones en 102 de los 118 casos, observándose lesiones cavitadas en 40 casos.
Caracteristicas basales de los 118 pacientes diagnosticados de tuberculosis activa
| n | % | |
| N° de casos | 118 | |
| Edad | ||
| 15–35 | 67 | 56,7 |
| 36–64 | 46 | 39,0 |
| >65 | 5 | 4,3 |
| Fumadores | 50 | 42,7 |
| Bebedor diario de alcohol | 27 | 22,9 |
| Adicción a drogas | 2 | 1,7 |
| Serología positiva para VIH | 13 | 11,0 |
| Diabetes | 10 | 8,5 |
| Autóctonos | 61 | 51,7 |
| Nacido fuera de España | 57 | 48,3 |
| Centro-Sud América | 26 | 22 |
| Africa | 18 | 15,1 |
| Este de Europa/Ex-URSS | 13 | 11 |
| Pakistán | 1 | 0,8 |
| Forma de enfermedad tuberculosa | ||
| Pulmonar | 79 | 66,9 |
| Pleural o pleuropulmonar | 16 | 13,6 |
| Miliar* | 5 | 4,2 |
| Meningitis | 5 | 4,2 |
| Linfadenitis | 5 | 4,2 |
| Genitourinaria | 4 | 3,3 |
| Ósea | 2 | 1,7 |
| Piel | 2 | 1,7 |
* Miliar: afectación pulmonar con o sin patrón miliar y al menos de otro órgano.
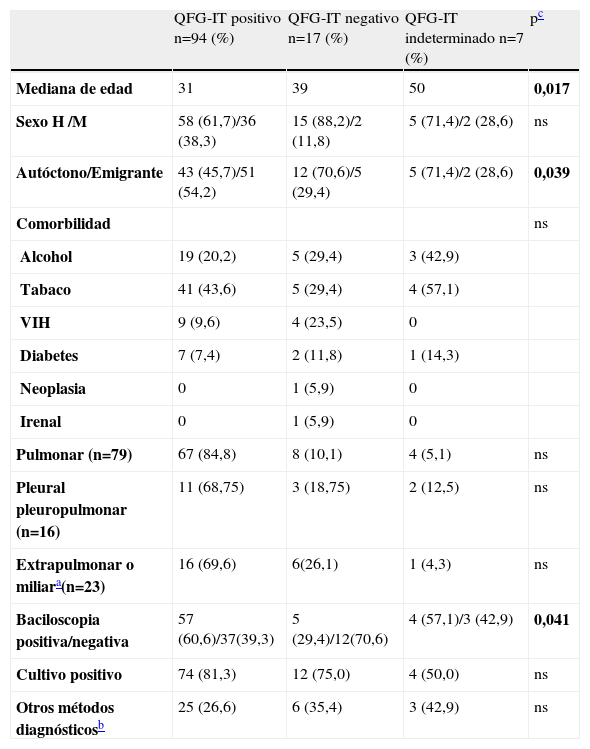
El estudio de QFG-IT fue positivo en 94 casos (79,7%; IC95% 72,4–86,9), negativo en 17 (14,4%; IC95% 8,1–20,7) e indeterminado en 7 (5,9%; IC95% 1,7–10,2). En la tabla 3 se exponen las características de los pacientes en función del resultado del estudio de QFG-IT. El valor medio de QFG-IT en caso de positividad fue de 8,67UI/ml (DE: 8,62), con una mediana de 5,21 (P25−75 1,72–13,32, rango: 0,38–39,07).
Para poder estudiar la significación estadística de las diferencias entre los 3 grupos, dado el pequeño número de pacientes, se comparó el grupo con resultado de QFG-IT positivo con el resto de los pacientes. Los pacientes que presentaron un test de QFG-IT negativo e indeterminado se unificaron en un grupo, asumiendo que el QFG-IT indeterminado está relacionado con anergia y a pesar de que una diferencia clara en la patogenia de la negatividad y la anergia del test.
El grupo de enfermos de tuberculosis con el estudio de QFG-IT negativo o indeterminado tenía una edad más avanzada que los que tuvieron el estudio de QFG-IT positivo (p=0,017). Se observó también una mayor frecuencia de resultados negativos o indeterminados de QFG-IT en la población autóctona respecto a la población emigrante de otros países (p=0,039), y se observó también una edad media más avanzada de los enfermos autóctonos con tuberculosis [mediana edad autóctonos 39,0; P25−75 29,0–55,8; mediana edad otros países 30,0; P25−75 25,0–36,3 (p=0,002)] (tabla 3).
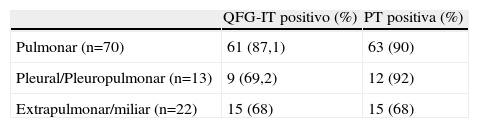
El resultado de QFG-IT fue positivo en 57/66 (86,3%) de los casos que tuvieron la baciloscopia positiva y en 37/52 (71,1%) casos que tuvieron la baciloscopia negativa, así QFG-IT fue más frecuente en los casos en que la baciloscopia fue positiva (p=0,041) y se observó también una tendencia que no alcanzó la significación estadística a una mayor frecuencia de resultados positivos en las formas pulmonares de tuberculosis respecto a las formas extrapulmonares y pleurales (tabla 2).
Características de los pacientes con estudio de QFG-IT positivo, negativo o indeterminado
| QFG-IT positivo n=94 (%) | QFG-IT negativo n=17 (%) | QFG-IT indeterminado n=7 (%) | pc | |
| Mediana de edad | 31 | 39 | 50 | 0,017 |
| Sexo H /M | 58 (61,7)/36 (38,3) | 15 (88,2)/2 (11,8) | 5 (71,4)/2 (28,6) | ns |
| Autóctono/Emigrante | 43 (45,7)/51 (54,2) | 12 (70,6)/5 (29,4) | 5 (71,4)/2 (28,6) | 0,039 |
| Comorbilidad | ns | |||
| Alcohol | 19 (20,2) | 5 (29,4) | 3 (42,9) | |
| Tabaco | 41 (43,6) | 5 (29,4) | 4 (57,1) | |
| VIH | 9 (9,6) | 4 (23,5) | 0 | |
| Diabetes | 7 (7,4) | 2 (11,8) | 1 (14,3) | |
| Neoplasia | 0 | 1 (5,9) | 0 | |
| Irenal | 0 | 1 (5,9) | 0 | |
| Pulmonar (n=79) | 67 (84,8) | 8 (10,1) | 4 (5,1) | ns |
| Pleural pleuropulmonar (n=16) | 11 (68,75) | 3 (18,75) | 2 (12,5) | ns |
| Extrapulmonar o miliara(n=23) | 16 (69,6) | 6(26,1) | 1 (4,3) | ns |
| Baciloscopia positiva/negativa | 57 (60,6)/37(39,3) | 5 (29,4)/12(70,6) | 4 (57,1)/3 (42,9) | 0,041 |
| Cultivo positivo | 74 (81,3) | 12 (75,0) | 4 (50,0) | ns |
| Otros métodos diagnósticosb | 25 (26,6) | 6 (35,4) | 3 (42,9) | ns |
Se observó también en los pacientes con determinadas comorbilidades como infección por el VIH, presencia de alguna neoplasia, diabetes mellitus o insuficiencia renal una tendencia a presentar con mayor frecuencia un test de QFG-IT negativo (tabla 2).
El valor medio de QFG-IT en los casos de positividad fue más elevado en las formas pulmonares y las extrapulmonares que en las formas pleuropulmonares/pleurales, sin que las diferencias alcanzasen la significación estadística.
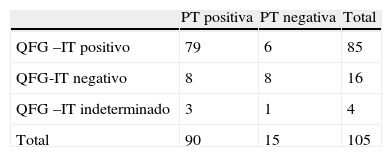
Comparación del test de QFG-IT frente al la prueba de la tuberculinaLa PT pudo hacerse en 105 de los 118 pacientes con un resultado positivo en 90 casos (84,7%) y negativo en 15 (14,3%). La mediana del valor de la PT en los casos de positividad fue de 18mm (P25−75 16–20). Los resultados de la PT y de QFG-IT se exponen en la tabla 3, y en la tabla 4 se exponen los resultados positivos de ambos test en función de la localización de la tuberculosis.
Sin tener en cuenta los resultados indeterminados, la concordancia kappa global entre ambos test fue de 74,5% con un valor kappa de 0,45 (SE: 0,136). De los 105 pacientes, 9 tuvieron una PT y un estudio de QFG negativo o indeterminado, por lo que se estima la sensibilidad combinada de ambos test de 91,5%.
Trece de los enfermos estudiados estaban infectados por el VIH, 6 de estos tenían CD4 <200cel/mm3, 6 tenían formas pulmonares y 7 miliares o extrapulmonares de tuberculosis; La PT fue positiva en 5 de los 12 casos (38,5%) en que se realizó,y el estudio de QFG-IT fue positivo en 9 (69,2%) y negativo en 4 casos, y en 3 de estos muy cerca del punto de corte: 0,26, 0,30 y 0,31U/ml. La mediana de CD4 en los 4 casos en con resultado negativo de QFG-IT fue de 170cel/mm3 (DS: 116,8), en 2 casos se trataba de TB pumonar y en 2 casos de formas extrapulmonares (ganglionar y diseminada); en los 5 casos con resultado positivo la mediana de CD4 fue de 307cel/mm3 (DS: 205,9). En los 6 pacientes que tenían menos de 200 cél CD4/mm3, la PT fue negativa en todos los casos, y el QFG-IT fue positivo en 3/6 casos.
Tres pacientes del estudio tenían una inmunosupresión profunda, por infección por el VIH con un valor de CD4< 50cel/mm3en 2 casos (6 y 36 CD4/mm3), y por una leucemia aguda en tratamiento con quimioterapia en el tercer caso. Estos 3 pacientes tenían la PT negativa en los tres casos, y también QFG-IT negativo en 2/3 casos, solo fue positivo en uno de los dos pacientes con infección por el VIH y CD4 de 36/mm3.
En 5 pacientes de 70 años o más con TB activa (2 pulmonar, 1 pleural, 1 piel, una genitourinaria) se observó una PT positiva en 4 casos, negativa en 1, y QFG-IT positivo en dos casos, negativo en 2 e indeterminado en un caso. El único paciente anciano con PT negativa tenía también QFG-IT negativo.
DiscusiónEn nuestro trabajo la sensibilidad global del QFG-IT en enfermos de tuberculosis fue del 79,7%, similar e incluso superior a la de otros estudios ya publicados3,8,9. La sensibilidad del test fue menor en los pacientes ancianos, en las formas de tuberculosis con afectación pleural y en los casos de baciloscopia negativa. La sensibilidad combinada de la PT y del QFG-IT fue mejor que la de cualquiera de los 2 test separados, alcanzando el 91,5%.
La concordancia sólo moderada entre la PT y el test de QFG-IT podría justificarse porque no miden exactamente el mismo fenómeno: los test de IFN-γ estudian principalmente la respuesta rápida efectora de las células T frente a antígenos micobacterianos, mientras que la PT mide tanto la respuesta efectora de las células T como la respuesta de las células T de memoria, al ser una reacción de hipersensibilidad retardada y además utiliza como antígeno un extracto de diferentes antígenos micobacterianos, no sólo de MTB.
Existe un número limitado de estudios al respecto de la validez de los test de IGRAs en el diagnóstico de enfermedad tuberculosa, con resultados discordantes. Una serie norteamericana de 45 enfermos de tuberculosis demostró que únicamente un 55% tenían el test de QFG positivo8. Otro trabajo realizado en Sudáfrica obtuvo resultados mejores con una sensibilidad del test global de 76% y una sensibilidad combinada PT/QFG más elevada que la individual llegando a ser de hasta 96%, en la misma línea que nuestra hallazgos; sin embargo los autores concluyen que el test de QFG, por su incapacidad de distinguir enfermedad activa de infección latente, tendría poca utilidad para el diagnóstico de enfermedad en los paises de alta prevalencia de infección latente9. Un estudio reciente realizado en un país de baja prevalencia de tuberculosis como Suecia10, tampoco consiguió demostrar su utilidad en ese medio para el diagnóstico de tuberculosis activa, ya que solo 41/70 enfermos con tuberculosis activa tuvieron un test positivo, siendo el valor predictivo positivo del test estimado en este estudio de 71,9% y el valor predictivo negativo de 67,6%. Sin embargo, en otro estudio previo realizado en Dinamarca en pacientes con sospecha de tuberculosis, los resultados obtenidos demostraron una mejor sensibilidad de 85% con una especifidad también baja de 65% concluyendo los autores a favor de su utilidad como herramienta de apoyo en el diagnóstico de tuberculosis activa11. El uso combinado de ambos test podría tener un papel en la práctica clínica en nuestro entorno para apoyar el diagnostico de TBC, pero su negatividad no nos permite excluir enfermedad dado que el 8,5% de nuestros pacientes con tuberculosis tuvieron los 2 test negativos. Sin embargo, un estudio multicéntrico europeo publicado hace unos meses describe una sensibilidad combinada del PPD y QFG-IT de 97,7%, y concluye que el uso combinado de ambos test puede permitir una rápida exclusión del diagnóstico de tuberculosis12. Este estudio, al igual que el nuestro, está limitado por el número de pacientes que tienen realizados ambos test y probablemente son todavía necesarios más estudios para valorar el papel de la combinación de las técnicas en el diagnóstico de exclusión de tuberculosis. El hecho de que existan pacientes con enfermedad tuberculosa y un test de QFG-IT negativo puede ser explicado porque QFG-IT y cualquier IGRA son técnicas para el diagnóstico de infección tuberculosa y no de enfermedad tuberculosa. En la infección tuberculosa latente está bien demostrada la producción de IFN-γ frente a antígenos de MTB en pacientes sanos sensibilizados, pero no así en la enfermedad tuberculosa, donde el control inmunológico de la enfermedad ha fallado se producen en sangre periférica citocinas antiinflamatorias que pueden afectar la producción de IFN-γ13,14.
No disponemos todavía de datos suficientes para establecer el valor del QFG-IT y de los otros IGRAs como apoyo para el diagnóstico de tuberculosis en un país como el nuestro con prevalencia media de la enfermedad. Un trabajo reciente realizado por un grupo catalán3 que estudió el valor de QFG-IT y de T-SPOT.TB en un grupo de pacientes en diferentes fases de la enfermedad tuberculosa describió una positividad de QFG-IT sólo en 69,4% de los pacientes antes de iniciar el tratamiento de la tuberculosis frente a 83,3% de positividad del T-SPOT.TB, y aunque el número de pacientes de este estudio era reducido, también se observó un mayor número de negativos en los pacientes con baciloscopia negativa. Nuestro trabajo también sugiere que existen falsos negativos del test, y que algunos factores podrían estar implicados en la negatividad, como la edad, la existencia de comorbilidades o inmunosupresión de base y también la localización extrapulmonar de la tuberculosis.
No hemos observado superioridad de QFG-IT frente a la PT en el pequeño número de pacientes ancianos que hemos podido estudiar a diferencia de un trabajo realizado en pacientes de más de 80 años publicado recientemente, en el que se observó una sensibilidad de QFG de 77% frente a 27% de la PT15. Se observó también en nuestro estudio una mayor frecuencia de resultados negativos o indeterminados de QFG-IT en la población autóctona respecto a la población emigrante de otros países, pero esta diferencia podría también estar relacionada con la edad media más avanzada de los enfermos autóctonos con tuberculosis.
La tendencia observada a presentar, entre los pacientes con comorbilidades o inmunosupresión con mayor frecuencia un test de QFG-IT negativo ha sido también comentada en otros estudios16,17. Mención aparte merecen los pacientes con infección por VIH, ya que a pesar del reducido tamaño de la muestra, los resultados obtenidos en este estudio sugieren una mayor sensibilidad del test de QFG-IT frente a la PT en pacientes con infección por el VIH. Diferentes publicaciones sugieren que los IGRAS son una herramienta prometedora para el diagnóstico de tuberculosis, sobre todo en pacientes sin inmunosupresión grave, con una buena sensibilidad de hasta 65% en la enfermedad tuberculosa17 e incluso se ha descrito un potencial papel predictor de desarrollo de tuberculosis18,19.
El mayor porcentaje de resultados negativos para QFG-IT lo hemos obtenido en la tuberculosis pleural. La tuberculosis con afectación pleural se describe clásicamente como una forma en que predomina el patrón «Th1», con compartimentalización de la respuesta inmune y por tanto mayor producción de IFN-γ en el lugar de la infección, y menor en sangre periférica lo que podría justificar que el estudio de QFG-IT en sangre periférica fuese con mayor frecuencia negativo en estas formas de tuberculosis13. Nuestro estudio difiere de otro trabajo que describió una positividad de hasta 93% para QFG en las formas pleurales de tuberculosis20. En cuanto a la TB extrapulmonar, varios estudios refieren una buen sensibilidad del test, incluso mejor que en formas pulmonares de la enfermedad11,12,20,21 y sobre todo en las formas ganglionares22. Sin embargo, otros autores tampoco consiguen buenos resultados en la TB extrapulmonar8.
Nuestro estudio tiene limitaciones importantes: a pesar de ser un estudio prospectivo, no disponemos de un grupo control significativo para poder estimar el valor predictivo negativo y positivo del test. Por otro lado, no hemos obtenido la significación estadística en algunos de los parámetros analizados como la presencia de imunosupresión o la negatividad de la baciloscopia como factores predictores de un resultado negativo de QFG-IT probablemente por el pequeño tamaño de la muestra.
En conclusión, en los enfermos con tuberculosis activa, los IGRAs como QFG-IT pueden ser una herramienta más para apoyar una sospecha diagnóstica, probablemente complementaria a la PT y no en sustitución de la misma, en espera de la obtención de cultivos micobacterianos. Sin embargo, un test de QFG-IT negativo probablemente no se debe utilizar como única prueba para el diagnóstico de exclusión de tuberculosis. Son necesarios estudios más amplios en diferentes grupos para conocer mejor el verdadero papel de este test en el diagnóstico de la tuberculosis. Es probable que en los próximos años asistamos a un importante desarrollo de estas técnicas prometedoras que nos permitirán optimizar el diagnóstico de la tuberculosis incluyendo en nuestra práctica clínica no sólo el análisis de IFN-γ específico para MTB en la sangre periférica, sino midiendo también otras citocinas como la IL223, y estudiando también sus niveles en el lugar de la infección24.
FinanciaciónEste trabajo ha sido financiado por el Fondo de Investigaciones Sanitarias-Instituto de Salud Carlos III (PI FIS 06/801).
Conflicto de interesesLos autores declaran no tener conflicto de intereses.