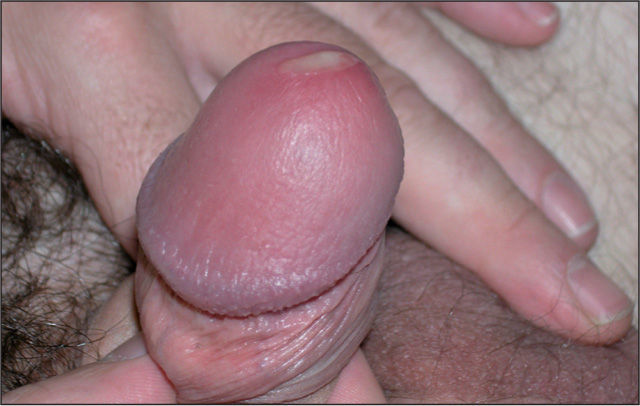
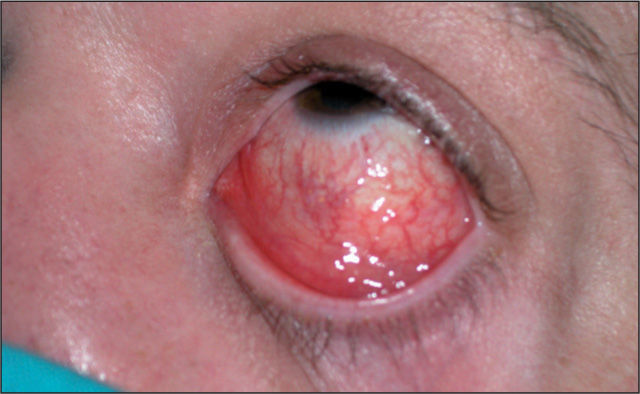
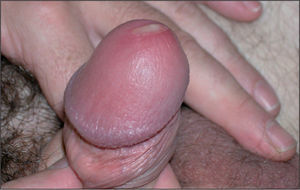
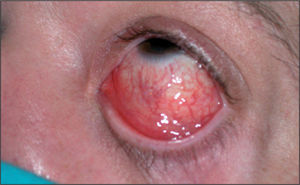
Varón de 41 años que consulta por conjuntivitis desde hace 48 h que se acompaña de un cuadro de disuria y secreción uretral de 4 días de evolución. Durante la anamnesis reconoció la posibilidad de haberse inoculado la secreción uretral a nivel ocular. No refería dolor testicular o perineal, artralgias ni sensación febril o escalofríos. Se definía heterosexual y casado, y reconocía haber mantenido relaciones con una prostituta, de tipo genital-oral y sin preservativo, 2 días antes del inicio de la disuria. En la exploración se evidenció secreción uretral amarillenta (fig. 1) y una adenopatía inguinal derecha dolorosa, elástica y rodadera. Además, presentaba hiperemia conjuntival con exudado purulento, reacción folicular tarsal, blefaritis y edema de predominio en párpados inferiores (fig. 2). No se observaron ulceraciones corneales en el examen con fluoresceína ni afectación de la cámara anterior ocular. Se tomaron muestras de la secreción uretral para cultivo en medios agar chocolate, Thayer-Martin, agar dextrosa Sabouraud con cloranfenicol y cicloheximida, y medio Roiron para Trichomonas vaginalis. También se recogieron una muestra uretral profunda con una torunda de alginato con medio de transporte específico para Chlamydia trachomatis y Mycoplasma spp. hasta la siembra en medios de cultivo, muestra de chorro medio de micción para urocultivo y extracciones sanguíneas para serologías a virus de la inmunodeficiencia humana (VIH), virus de la hepatitis B y C, y sífilis. Se procedió al cultivo del exudado conjuntival en medios agar sangre, agar chocolate, Thayer-Martin y medio para C. trachomatis y Mycoplasma spp.
EvoluciónLa tinción de Gram de las muestras conjuntivales mostró abundantes leucocitos. Se encontraron más de 5 leucocitos polimorfonucleares neutrófilos por campo de 1.000 aumentos en la muestra uretral. Ante la posibilidad de una conjuntivitis por Neisseria gonorrhoeae se decidió tratar con ceftriaxona 250 mg i.m. en monodosis, asociando doxiciclina 100 mg/12 h v.o. durante 7 días. Trascurridas 24 h de la inoculación en agar chocolate, crecieron colonias grisáceas de 1 a 2 mm de diámetro, a partir de las muestras uretral y conjuntival. Estas colonias presentaban un olor característico a hipoclorito sódico; la oxidasa y la catalasa eran positivas y, por tanto, identificadas como Haemophilus spp. Para determinar la especie se inoculó el aislado uretral y el conjuntival en sendas placas de Müller-Hinton con un disco de factor X (hemina), otro con factor V (NAD) y un último con ambos factores, incubando 24 h a 37 °C en atmósfera enriquecida con CO2. El hallazgo de colonias alrededor del disco con factor V y del disco que contenía factor V y hemina demostraba que se trataba de H. parainfluenzae. No se aislaron otros patógenos uretrales a partir de las muestras de procedencia uretral y conjuntival. El aislado clínico era sensible a ampicilina, cefotaxima, cefuroxima, amoxicilina-ácido clavulánico, ciprofloxacino, tetraciclina, fosfomicina y rifampicina; y resistente a cloranfenicol y trimetoprima-sulfametoxazol. El urocultivo y las serologías fueron negativos. Al mostrar sensibilidad a la ampicilina, no se determinó la producción de betalactamasas. En la revisión del paciente a la semana comprobamos que las clínicas ocular y urológica se habían resuelto.
DiscusiónLos principales patógenos responsables de uretritis (N. gonorrhoeae, C. trachomatis, T. vaginalis, Mycoplasma genitalium y Ureaplasma urealyticum) están bien caracterizados y su hallazgo en las muestras microbiológicas es diagnóstico. Aunque la terapia empírica siempre debe cubrir a N. gonorrhoeae y C. trachomatis, hay países occidentales donde más del 50% de los casos de uretritis con filiación microbiológica se deben a otros agentes infecciosos (uretritis no gonocócicas ni clamidiales)1. Con frecuencia olvidamos otros patógenos oportunistas como Haemophilus spp., Streptococcus spp. y Neisseria meningitidis, que forman parte de la flora orofaríngea2 y tienen capacidad para infectar el epitelio uretral, transmitiéndose a través de relaciones orogenitales3,4. Como nuestro paciente presentaba uretritis asociada a la aparición posterior de conjuntivitis con el antecedente de una relación orogenital de riesgo, nuestro diagnóstico diferencial se planteó entre microorganismos responsables de infecciones de transmisión sexual (ITS). C. trachomatis y N. gonorrhoeae son bacterias con capacidad para producir uretritis y conjuntivitis (por autoinoculación o contacto directo con secreciones genitales), y la primera es causa importante de ceguera en países subdesarrollados5,6. N. gonorrohoeae puede producir un cuadro agudo de queratitis, úlceras corneales, celulitis palpebral y diseminación sistémica, por lo que la sospecha de una conjuntivitis por este germen requiere tratamiento antibiótico urgente con ceftriaxona (monodosis de 125 o 250 mg, i.m.)6,7. El diagnóstico diferencial de un síndrome de uretritis infecciosa con conjuntivitis asociada debe incluir otros patógenos uretrales como Mycoplasma genitalium, U. urealyticum y otros, menos frecuentes, pero con transmisión orogenital probada como N. meningitidis, Streptococcus spp., Haemophilus spp., virus del herpes simple I y II, adenovirus (8 y 37)8,9 y enterobacterias, como Escherichia coli. El síndrome de Reiter, a veces relacionado con contactos sexuales de riesgo, también debe considerarse.
H. parainfluenzae es un bacilo gramnegativo habitual dentro de la flora orofaríngea2,10. Como patógeno, es el segundo en importancia dentro del género Haemophilus spp., y se ha descrito como agente causal de otitis, conjuntivitis, absceso dental, endocarditis, artritis, osteomielitis, infección hepatobiliar, meningitis, absceso cerebral, prostatitis, uretritis10–12, endocarditis13, empiema y neumonía14. Desde principios de la década de 1980 se ha estudiado el papel de H. parainfluenzae en las infecciones genitourinarias10–12,15, y se ha concluido que su aislado a partir de muestras genitales es poco frecuente y que sólo tiene valor clínico en ausencia de otros patógenos10–12. El biotipo II es el que se aísla con más frecuencia, especialmente en la uretra masculina11,12,15, y se ha identificado como único patógeno en casos de uretritis y abscesos de la glándula de Bartholino12. Se considera que la colonización-infección genitourinaria por esta especie se produce a partir de la flora orofaríngea o digestiva15.
La identificación del género Haemophilus spp. se basa en demostrar la dependencia de los factores de crecimiento X (hemina) y V (NAD) con discos impregnados con estas sustancias, por lo que se las conoce como "bacterias exigentes". H. parainfluenzae presenta la peculiaridad de no mostrar dependencia del factor X al ser capaz de sintetizarlo.16Actinobacillus y Pasteurella spp. también pueden presentar esta dependencia, de modo que el diagnóstico microbiológico se establece determinando actividades enzimáticas y la fermentación de azúcares. Por otra parte, H. parainfluenzae, como H. influenzae, puede presentar resistencia sólo a ampicilina o asociada a otros antibióticos como cotrimoxazol, cloranfenicol, tetraciclinas y aminoglucósidos. El mecanismo habitual de resistencia a ampicilina es mediante la producción de una betalactamasa plasmídica tipo TEM-1 y, con menor frecuencia, del tipo ROB-1. Ambas se inhiben por el ácido clavulánico, por lo que estas cepas son sensibles a amoxicilina-ácido clavulánico y a las cefalosporinas de tercera generación17–19. Debemos recordar que en un porcentaje inferior al 5%, la resistencia se debe a la pérdida de afinidad de las proteínas fijadoras de penicilina tipo 3 (PBP-3), lo que significa la pérdida de sensibilidad tanto para amoxicilina-ácido clavulánico como para las cefalosporinas. En los últimos años se han descrito casos producidos por este tipo cepas en Francia y Japón20.
Presentamos un caso de uretritis por H. parainfluenzae sensible a ampicilina asociada a conjuntivitis tras una relación orogenital, que respondió satisfactoriamente al tratamiento empírico con una monodosis de ceftriaxona 250 mg i.m. Ante cuadros de uretritis asociada a conjuntivitis, una anamnesis cuidadosa permite orientar la posibilidad de una ITS y los microorganismos probables, iniciando precozmente un tratamiento empírico y unas medidas preventivas adecuadas.