Streptococcus pneumoniae es la causa principal de otitis media aguda (OMA), y sólo en un 20% de los casos se resuelve espontáneamente1. El objetivo de este estudio es conocer, en nuestro medio, la frecuencia con que se aísla S. pneumoniae en la OMA bacteriana infantil con relación a otras bacterias, cuáles son los serotipos más frecuentes y cuáles son sus patrones de sensibilidad. El interés principal de la determinación de los serotipos es valorar la efectividad potencial de la vacuna neumocócica heptavalente (4, 6B, 9V, 14, 18C, 19F y 23F).
Se presenta un estudio prospectivo realizado durante los años 2005 y 2006, en 25 niños de 1 a 5 años con OMA producida por S. pneumoniae. Este grupo se formó a partir de un total de 45 niños con diagnóstico clínico y microbiológico de OMA bacteriana. Se excluyeron los que habían recibido tratamiento antibiótico los 7 días previos y ninguno estaba vacunado frente a neumococo. El 80% de los niños presentaba otorrea espontánea y, en estos casos, las muestras de exudado se recogieron con un hisopo estéril, conservado en medio de Amies. En el 20% restante se realizó una timpanocentesis, tanto con fines diagnósticos como terapéuticos; la secrección ótica obtenida se mantuvo en la misma jeringa empleada en su recolección hasta el momento de su siembra. El tiempo de envío al laboratorio osciló entre 1 y 5h. Las muestras se sembraron en agar sangre, agar chocolate, agar MacConkey, agar sabouraud, agar Brucella y caldo de cerebro-corazón2. Todas las muestras se tiñeron mediante la técnica de Gram. En 25 niños se aisló S. pneumoniae y fue identificado en el laboratorio por la morfología de las colonias, la solubilidad en bilis y la sensibilidad a la optoquina. La sensibilidad antibiótica de las cepas neumocócicas se determinó mediante E-test (E-test, AB Biodisks). El serotipado se realizó en el laboratorio de referencia de neumococos (Centro Nacional de Microbiología del Instituto de Salud Carlos III, Majadahonda, Madrid).
En la tinción de Gram se observaron leucocitos polimorfonucleares en todos los pacientes, y en el 80% de los casos también se observaban las bacterias causantes de la otitis. Los microoganismos aislados del total de las 45 otitis fueron S. pneumoniae (n=25; 56%), seguido de Haemophilus influenzae no serotipo B (n=11; 24%), Staphylococcus aureus (n=4; 8,8%) y Streptococcus pyogenes (n=5; 11%).
Los serotipos neumocócicos fueron: 19A (n=4), 19F (n=2), 3 (n=5), 14 (n=3), 6B (n=2), 9V, 23F, 15A, 35F, 18C, 11, 20 y 24. Una cepa fue no tipable. El 40% de estos serotipos estaba incluido en la vacuna heptavalente: 6B, 9V, 14, 18C, 19F y 23F. Sin embargo, el serotipo 19A y el 3, que fueron los aislados con mayor frecuencia, no eran vacunales.
Diez aislamientos (40%) eran resistentes a penicilina, el 80% de estos era también resistente a macrólidos y 5 cepas (20%) presentaban sensibilidad intermedia o resistencia a cefotaxima (tabla 1). El 32% (n=9) de los neumococos aislados era resistente a tetraciclinas, mostrando CMI ⩾8μg/ml, la mayoría (n=6) era también resistente a penicilina. Solamente 1 cepa, perteneciente al serogrupo 23F, fue resistente a cloranfenicol. La resistencia a macrólidos sobre el total de las 25 cepas de S. pneumoniae fue del 52% (n=13), el fenotipo de resistencia MLSB fue el más común, 69,2% (n=9), y se asoció a las CMI más elevadas a eritromocina (CMI=128μg/ml), este hallazgo coincide con el patrón de resistencia del resto del país3,4. El fenotipo M se observó en 5 aislados. Todas las cepas fueron sensibles a vancomicina con CMI ⩽0,5μg/ml y a levofloxacino con CMI=1μg/ml.
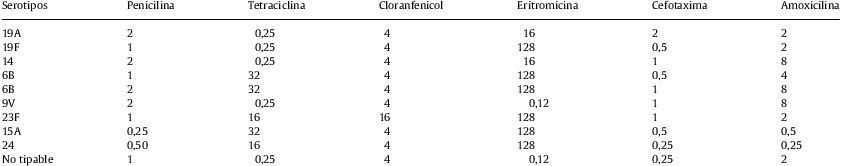
Serotipos de Streptococcus pneumoniae resistentes a penicilina. Sensibilidad a antimicrobianos expresada en CMI (μg/ml)
| Serotipos | Penicilina | Tetraciclina | Cloranfenicol | Eritromicina | Cefotaxima | Amoxicilina |
| 19A | 2 | 0,25 | 4 | 16 | 2 | 2 |
| 19F | 1 | 0,25 | 4 | 128 | 0,5 | 2 |
| 14 | 2 | 0,25 | 4 | 16 | 1 | 8 |
| 6B | 1 | 32 | 4 | 128 | 0,5 | 4 |
| 6B | 2 | 32 | 4 | 128 | 1 | 8 |
| 9V | 2 | 0,25 | 4 | 0,12 | 1 | 8 |
| 23F | 1 | 16 | 16 | 128 | 1 | 2 |
| 15A | 0,25 | 32 | 4 | 128 | 0,5 | 0,5 |
| 24 | 0,50 | 16 | 4 | 128 | 0,25 | 0,25 |
| No tipable | 1 | 0,25 | 4 | 0,12 | 0,25 | 2 |
El 40% de nuestros pacientes presentaba otitis producida por serotipos neumocócicos incluídos en la vacuna conjugada heptavalente: 6B, 9V, 14, 18C, 19F y 23F, por lo que teóricamente podrían haberse evitado y hubiera sido especialmente ventajoso en los niños afectados por cepas con algún grado de resistencia a la penicilina (6B, 14, 19F, 23F)5,6. Sin embargo, el 60% de los serotipos neumocócicos aislados en la serie no estaba incluído en la vacuna heptavalente, entre ellos hay que destacar los serotipos con mayor frecuencia de presentación, el serotipo 19 A y el 3. Estos serotipos aparecen también como causas muy frecuentes en la enfermedad invasiva7,8. Los estudios de los efectos de la vacuna en la enfermedad neumocócica infantil española no son definitivos, ya que los esquemas de vigilancia y vacunación son diferentes en las distintas comunidades autónomas9, no obstante, se puede apuntar la necesidad de ampliar el número de serotipos que hay que incluir en la composición de una futura vacuna conjugada.
AgradecimientosNuestro agradecimiento especial a la Dra. Asunción Fenoll, del Laboratorio de referencia de neumococos, Centro Nacional de Microbiología del Instituto de Salud Carlos III, Majadahonda, Madrid.
Financiación
Este trabajo ha sido financiado por la Fundación Canaria de Investigación y salud con los proyectos PI:19/04 y PI:22/04