La infección por citomegalovirus (CMV) es la infección congénita más frecuente en los países industrializados. Se estima una prevalencia mundial del 0,67%1, aunque estos valores varían dependiendo de los países, siendo del 0,48% en España2.
El CMV congénito produce una gran morbimortalidad; un 20% de recién nacidos sintomáticos desarrollan sordera neurosensorial y retraso psicomotor, y un 4% fallecen. Además, un 13% de los recién nacidos asintomáticos desarrollan secuelas a largo plazo3.
A pesar de que en España no se recomienda el cribado serológico durante el embarazo, en los últimos años se han producido novedades diagnósticas y terapéuticas que han reabierto este debate4,5.
La prevalencia de CMV a nivel mundial en mujeres en edad fértil se encuentra en torno a un 86% y aumenta con la edad6,7, siendo estas cifras superiores a las de la sífilis, la infección por virus de la inmunodeficiencia humana o el virus de la hepatitis B. En España no hay datos actuales sobre la prevalencia de CMV en embarazadas, por lo que planteamos este estudio con el fin de conocer la seroprevalencia en gestantes en nuestra área de salud en Madrid.
Se ha llevado a cabo un estudio observacional retrospectivo entre 2018 y 2019 en el que se ha incluido a las gestantes con serología frente a CMV en el primer trimestre. En aquellas con IgG e IgM positivas se realizó un estudio de avidez de IgG y a las que presentaron baja avidez (< 50%) se les propuso la realización de amniocentesis diagnóstica.
Se utilizaron reactivos de Architect (Abbott) CMIA (Enzimoinmunoanálisis de micropartículas quimioluminiscente) para la realización de CMV IgG, CMV IgM y la avidez. La PCR cuantitativa de CMV se realizó en STARlet (Werfen) con el reactivo de Altona Real Start CMV PCR Kit 1.0.
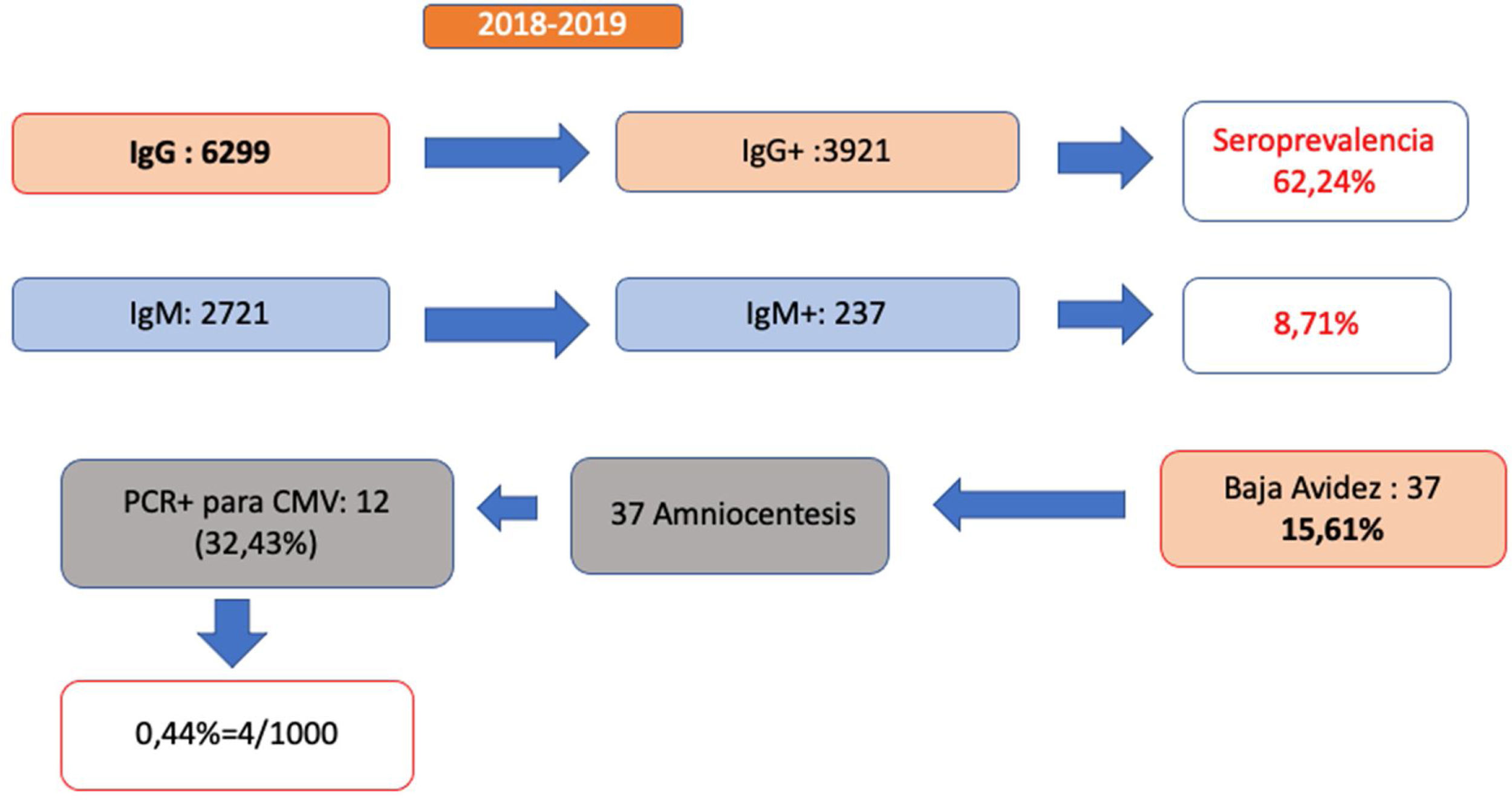
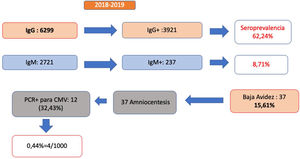
De las 1.0431 gestantes atendidas durante ese periodo, se realizó determinación de anticuerpos IgG a 6299 (60,39%), de las que 3.921 fueron positivas, lo que supone un 62,2% de seroprevalencia. Se realizó determinación simultánea de IgM en 2.721 gestantes, siendo 237 (8,71%) positivas (fig. 1).
De las gestantes con anticuerpos IgM positivos, 37 (15,6%) tenían baja avidez de la IgG, lo que sugiere una infección en los 3-6 meses previos. Esto indica que el 1,35% de las mujeres cribadas con anticuerpos IgM e IgG tuvieron riesgo de infección gestacional en el primer trimestre. De las 37 amniocentesis realizadas, 12 (32,43%) tuvieron PCR positiva para CMV en líquido amniótico, indicativo de infección fetal y confirmado con PCR en orina al nacimiento.
Por tanto, podemos concluir que entre las gestantes a las que se ha realizado cribado serológico mediante IgM e IgG, la tasa de CMV congénito en nuestra área es del 0,44%. Si solo consideramos las gestantes con anticuerpos IgG e IgM positivos, el porcentaje asciende al 5%, siendo del 32% en caso de baja avidez de los anticuerpos IgG.
Este estudio analiza la seroprevalencia de CMV en gestantes en nuestro país, con datos que podrían ser extrapolables a otras poblaciones de características similares.
En nuestro medio un 62% de las gestantes son seropositivas, con lo que más de un tercio son susceptibles de padecer una infección primaria durante el embarazo.
El 1,3% de las mujeres con IgM e IgG positivas tuvieron un resultado indicativo de infección en los 3-6 meses previos y un 32% de las mismas desarrolló una infección congénita. El peso global de la infección congénita en nuestro medio es seguramente más alto, ya que no se han considerado las infecciones producidas después del primer trimestre ni las reinfecciones/reactivaciones en mujeres inmunes.
Actualmente se están ensayando nuevas opciones terapéuticas en la gestante para prevenir la infección fetal8. Así, un ensayo clínico aleatorizado y controlado con placebo muestra una disminución significativa en las tasas de infección fetal en aquellas gestantes infectadas en el primer trimestre que recibieron tratamiento con valaciclovir (11% vs. 48%; p=0,020)5. Además, diferentes grupos han estudiado el papel de la gammaglobulina hiperinmune y, aunque hay dudas sobre su eficacia, existe un estudio que evidencia un beneficio en la transmisión de la infección al feto empleando dosis altas quincenales (7,5% vs. 35,2% en el grupo de control histórico)9.
Sin embargo, cabe destacar que el conocimiento del estatus serológico solamente aporta información útil para detectar y tratar primoinfecciones por CMV en la gestante. Por este motivo resulta esencial invertir esfuerzo en mejorar las técnicas serológicas para el diagnóstico de las reinfecciones/reactivaciones, ya que estas pueden causar también enfermedad grave en el feto2.
Además, el cribado serológico en el primer trimestre nos permitiría recordar las recomendaciones de prevención primaria, que deben trasmitirse a todas las gestantes en la primera consulta, independientemente de su status serológico, dada la posibilidad de primoinfecciones y reinfecciones. Por último, permitiría detectar las infecciones congénitas con riesgo de secuelas a largo plazo10, garantizando un adecuado seguimiento de los niños infectados.